후무렌
Humulene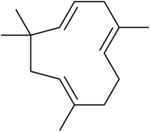 | |
 | |
| 이름 | |
|---|---|
| 우선 IUPAC 이름 (1E,4E,8E)-2,6,9-테트라메틸시클라운데카-1,4-8-트리엔 | |
| 기타 이름 α-카리오필렌; 3,7,10-후무라트리엔 | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 첸블 | |
| 켐스파이더 | |
| ECHA 정보 카드 | 100.027.106 |
PubChem CID | |
| 유니 | |
CompTox 대시보드 (EPA ) | |
| |
| |
| 속성[1] | |
| C15H24 | |
| 몰 질량 | 204.357 g/120−1 |
| 외모 | 옅은 황록색의 투명한 액체 |
| 밀도 | 0.886 g/cm3 |
| 녹는점 | 25 °C 미만 (77 °F, 298 K) |
| 비등점 | 5 mmHg에서 106 ~ 107 °C (223 ~ 225 °F, 379 ~ 380 K) |
| 위험 요소 | |
| 치사량 또는 농도(LD, LC): | |
LD50(중간선량) | 48 mg/kg 이상 |
| 안전 데이터 시트(SDS) | MSDS |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
α-후뮬렌 또는 α-카릴렌으로도 알려진 후뮬렌은 자연적으로 발생하는 단환식 세스키테펜(CH)으로1524, 11원환을 포함하고, 3개의 비결합 C=C 이중결합을 포함한 3개의 이소프렌 단위(이 중 2개는 3중 치환, 1개는 이중 치환)로 구성된다.그것은 처음에 후물루스 루푸루스의 에센셜 오일에서 발견되었고,[2] 그 이름에서 유래했습니다.휴뮬렌은 β-카리오필렌의 이성질체이며, 이 둘은 종종 많은 방향족 식물에서 혼합물로 함께 발견된다.
발생.
휴뮬렌은 홉 식물의 꽃 원뿔인 휴물루스 루풀루스에서 추출된 에센셜 오일의 성분 중 하나이며, 그 이름에서 유래했습니다.후뮬렌 농도는 식물에 따라 다르지만 에센셜 [3]오일의 최대 40%에 이를 수 있습니다.맥주를 양조하는 과정에서 후뮬렌과 그 반응물은 많은 맥주의 "홉피" 향을 줍니다.노블 홉 품종은 휴뮬렌 함량이 높은 반면, 다른 비터 홉 품종은 낮은 [4][unreliable source?]함량을 가지고 있는 것으로 밝혀졌다.양조공정에서는 후뮬렌의 여러 에폭시드를 제조한다.가스 크로마토그래피-질량분석 샘플과 훈련된 감각패널에 관한 과학적 연구에서 후뮬렌 에폭시드 II의 가수분해 생성물이 [5][6]맥주에서 특히 "홉피" 향을 발생시키는 것으로 밝혀졌다.
α-휴뮬렌은 모든 대륙의 많은 방향족 식물에서 발견되었으며, 종종 이성질체 β-카리오필렌과 함께 발견되었다.대기 중에 입증되어야 함 α-humulene 기여하고 있소나무 trees,[7]오렌지 orchards,[8]습지 elders,[9]tobacco,[10]과 해바라기 밭.[11]α-Humulene Salvia officinalis 같은 향기로운 식물의 에센셜 오일에(일반적인 현자, 요리 세이지)[12]생강 나무 속 strychnifolia Uyaku 또는 산 속에서는 생강 나무, 인삼은 에센셜 오일은 29.9%까지 species,[13]포함되어 있다.Mentha 중 spicata,[14]는 생강과 Litsea mushaensis는 중국의 월계수의 잎 오일의 10%(생강과)[15]tree,[16]Cordia verbenacea, 해안의 열대 남 아메리카(erva baleeira)에 덤불의 잎 추출물의 4%는 25%trans-Caryophyllene[17]은 향신료의 맛에 기여하는 화학적 화합물의. 여뀌 속 냄새ata 또는 베트남 고수, 그리고 [18]대마초의 특징적인 향기.
준비 및 합성
후뮬렌은 파르네실 이인산염(FPP)에서 파생된 많은 세스키테르페노이드 중 하나이다.FPP로부터 후뮬렌의 형성은 세스퀴테르펜 합성 [19]효소에 의해 촉매된다.
이 생합성은 코리 합성이라고 불리는 파르네솔로부터 알릴 스타넨을 준비함으로써 실험실에서 모방할 수 있다.실험실에서 후뮬렌을 합성하는 방법은 다양하며, 매크로사이클에서 C-C 결합의 다른 폐쇄를 포함한다.맥머리 합성은 티타늄 촉매 카르보닐 결합 반응을 사용하고, 다카하시 합성은 보호된 시아노히드린 음이온에 의한 할로겐화 알릴 분자 내 알킬화를 사용하며, 스기놈 합성은 게라닐 단편을 사용하며, 드 그루트 합성은 유칼립투스 오일의 [20]원류 증류액에서 후뮬렌을 합성한다.후뮬렌은 또한 4성분 조립과 팔라듐 매개 환화의 조합을 사용하여 합성될 수 있다.이 합성은 C-C 결합 구성 및 환화 단계의 단순성에 주목할 만하며, 이는 관련된 폴리에스테르페노이드의 [21]합성에 유리함을 증명할 것으로 믿어진다.
휴뮬렌의 위치선택성을 이해하기 위해, 두 개의 3중 치환된 CcC 이중 결합 중 하나가 유의하게 더 반응적이라는 사실을 이해하기 위해, 그 구성 공간을 계산적으로 탐색하고 4개의 다른 배열을 [22]식별했다.
조사.
실험실 연구에서 휴뮬렌은 잠재적인 항염증 효과를 [23][24]위해 연구되고 있다.
2015년 브라질 연구원들은 α-휴뮬렌이 특히 "황열 모기"인 이집트 [25][26]에데스 에 대항하는 진충성 렙토플레오스 잎 기름의 방충 특성에 대한 적극적인 기여자라는 것을 확인했습니다.
대기 화학
α-Humulene은 대기 중 2차 유기 에어로졸 생성 가능성이 비교적 높은 수많은 식물(발생 참조)에서 방출되는 생체 휘발성 유기 화합물이다.그것은 햇빛에 있는 오존과 빠르게 반응하여 산소가 들어간 생성물을 형성합니다.α-휴뮬렌은 대부분의 모노텔펜에 비해 매우 높은 반응속도 계수(1.17 × 10cm−143−1 분자−1 s)를 가진다.3개의 이중 결합을 포함하고 있기 때문에 각각 응축하여 2차 유기 에어로졸을 형성할 수 있는 1세대, 2세대, 3세대 제품이 가능하다.전형적인 대류권 오존 혼합비 30ppb에서 α-후뮬렌의 수명은 약 2분이며, 1세대와 2세대 제품의 평균 수명은 각각 [27]1시간과 12.5시간이다.
레퍼런스
- ^ Merck Index, 제12판, 4789호
- ^ 글렌 틴세스, "홉 아로마 앤 플레이버", 1993년 1~2월, Brewing Technics.<http://realbeer.com/hops/aroma.html> 2010년 7월 21일 접속
- ^ Katsiotis, S. T.; Langezaal, C. R.; Scheffe, J. J. C. (1989). "Analysis of the Volatile Compounds from Cones of Ten Humulus lupulus Cultivars". Planta Med. 55 (7): 634. doi:10.1055/s-2006-962205.
- ^ "Archived copy". Archived from the original on 2015-09-24. Retrieved 2011-04-17.
{{cite web}}: CS1 maint: 제목으로 아카이브된 복사(링크) - ^ Yange, Xiaogen; Lederer, Cindy; McDaniel, Mina; Deinzer, Max. (1993). "Evaluation of hydrolysis products of humulene epoxides II and III". Journal of Agricultural and Food Chemistry. 41 (8): 1300–1304. doi:10.1021/jf00032a026.
- ^ Peackock, Val; Deinzer, Max (1981). "Chemistry of hop aroma in beer". Journal of the American Society of Brewing Chemists. 39. Archived from the original on 2013-12-30.
- ^ D. Helmig; J. Ortega; T. Duhl; D. Tanner; A. Guenther; P. Harley; C. Wiedinmyer; J. Milford; T. Sakulyanontvittaya (2007). "Sesquiterpene emissions from pine trees--identifications, emission rates and flux estimates for the contiguous United States". Environ. Sci. Technol. 41 (5): 1545–1553. Bibcode:2007EnST...41.1545H. doi:10.1021/es0618907. PMID 17396639.
- ^ P. Ciccioli; E. Brancaleoni; M. Frattoni; V. Di Palo; R. Valentini; G. Tirone; G. Seufert; N. Bertin; U. Hansen; O. Csiky; R. Lenz; M. Sharma (1999). "Emission of reactive terpene compounds from orange orchards and their removal by within-canopy processes". J. Geophys. Res. 104 (D7): 8077–8094. Bibcode:1999JGR...104.8077C. doi:10.1029/1998JD100026.
- ^ D. Degenhardt; D. Lincoln, J. (2006). "Volatile Emissions from an Odorous Plant in Response to Herbivory and Methyl Jasmonate Exposure". Chem. Ecol. 32 (4): 725–743. doi:10.1007/s10886-006-9030-2. PMID 16718568. S2CID 6017606.
- ^ C. De Moraes; M. Mescher; J. Tumlinson (2001). "Caterpillar-induced nocturnal plant volatiles repel conspecific females". Nature. 410 (6828): 577–580. Bibcode:2001Natur.410..577D. doi:10.1038/35069058. PMID 11279494. S2CID 4408480.
- ^ G. Schuh; A. Heiden; T. Hoffmann; J. Kahl; P. Rockel; J. Rudolph; J. Wildt (1997). "Emissions of Volatile Organic Compounds from Sunflower and Beech: Dependence on Temperature and Light Intensity". J. Atmos. Chem. 27 (3): 291–318. Bibcode:1997JAtC...27..291S. doi:10.1023/A:1005850710257. S2CID 94314856.
- ^ Bouajaj, S; Benyamna, A; Bouamama, H; Romane, A; Falconieri, D; Piras, A; Marongiu, B (2013). "Antibacterial, allelopathic and antioxidant activities of essential oil of Salvia officinalis L. growing wild in the Atlas Mountains of Morocco". Nat Prod Res. 27 (18): 1673–6. doi:10.1080/14786419.2012.751600. PMID 23240623. S2CID 29522122.
- ^ Cho, IH; Lee, HJ; Kim, YS (Aug 2012). "Differences in the volatile compositions of ginseng species (Panax sp.)". J Agric Food Chem. 60 (31): 7616–22. doi:10.1021/jf301835v. PMID 22804575.
- ^ Chauhan, SS; Prakash, O; Padalia, RC; Vivekanand, Pant AK; Mathela, CS (2011). "Chemical diversity in Mentha spicata: antioxidant and potato sprout inhibition activity of its essential oils". Nat Prod Commun. 6 (9): 1373–8. PMID 21941918.
- ^ Suthisut, D; Fields, PG; Chandrapatya, A (2011). "Contact toxicity, feeding reduction, and repellency of essential oils from three plants from the ginger family (Zingiberaceae) and their major components against Sitophilus zeamais and Tribolium castaneum". J Econ Entomol. 104 (4): 1445–54. doi:10.1603/ec11050. PMID 21882715. S2CID 45872520.
- ^ Ho, CL; Wang, EI; Tseng, YH; Liao, PC; Lin, CN; Chou, JC; Su, YC (2010). "Composition and antimicrobial activity of the leaf and twig oils of Litsea mushaensis and L. linii from Taiwan". Nat Prod Commun. 5 (11): 1823–8. PMID 21213991.
- ^ de Carvalho, Jr.; Rodrigues, R.F.; Sawaya, A.C.; Marques, M.O.; Shimizu, M.T. (2004). "Chemical composition and antimicrobial activity of the essential oil of Cordia verbenacea D.C". Journal of Ethnopharmacology. 95 (2–3): 297–301. doi:10.1016/j.jep.2004.07.028. PMID 15507352.
- ^ Hillig, Karl W (October 2004). "A chemotaxonomic analysis of terpenoid variation in Cannabis". Biochemical Systematics and Ecology. 32 (10): 875–891. doi:10.1016/j.bse.2004.04.004. ISSN 0305-1978.
- ^ 이끼, G.P. "휴뮬렌이 세스키테르페노이드 생합성 유도"국제생화학분자생물학효소명칭연맹(International Union of Phiology and Molecular Biology Englature Nomenclature.2011년 4월 10일에 액세스.http://www.enzyme-database.org/reaction/terp/humul.html
- ^ 골드미스, 데이비드"천연물의 종합 합성"캐나다: John Wiley & Sons. 1997 페이지 129-133
- ^ Hu, Tao & Corey, E.J. (2002). "Short Syntheses of (±)-δ-Araneosene and Humulene Utilizing a Combination of Four-Component Assembly and Palladium-Mediated Cyclization". Organic Letters. 4 (14): 2441–2443. doi:10.1021/ol026205p. PMID 12098267.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Neuenschwander, U; et al. (2012). "Origin of Regioselectivity in α-Humulene Functionalization". J. Org. Chem. 77 (6): 2865–2869. doi:10.1021/jo3000942. PMID 22332847.
- ^ Passosa, G.F.; Fernandesa, ES.; et al. (2007). "Anti-inflammatory and anti-allergic properties of the essential oil and active compounds from Cordia verbenacea". Journal of Ethnopharmacology. 110 (2): 323–333. doi:10.1016/j.jep.2006.09.032. PMID 17084568.
- ^ Fernandes E.S.; Passos G.F.; Medeiros R.; da Cunha F.M.; Ferreira J.; Campos M.M.; Pianowski L.F.; Calixto J.B. (2007). "Anti-inflammatory effects of compounds alpha-humulene and (−)-trans-caryophyllene isolated from the essential oil of Cordia verbenacea". European Journal of Pharmacology. 569 (3): 228–236. doi:10.1016/j.ejphar.2007.04.059. PMID 17559833.
- ^ Janelle Lassalle (2020-09-19). "Humulene". The Cannigma. Retrieved 2021-01-27.
- ^ Santos da Silva, R.C.; Milet-Pinheiro, P.; Bezerra da Silva, P.C.; Gomes da Silva, A.; Vanusa da Silva, M.; Amaral Ferraz Navarro, D.M.; da Silva, N.H.; et al. (2015-12-19). Boudko, Dmitri (ed.). "(E)-Caryophyllene and α-Humulene: Aedes aegypti Oviposition Deterrents Elucidated by Gas Chromatography-Electrophysiological Assay of Commiphora leptophloeos Leaf Oil". PLOS ONE. 10 (12): e0144586. Bibcode:2015PLoSO..1044586D. doi:10.1371/journal.pone.0144586. PMC 4674132. PMID 26650757.
- ^ Beck, M.; Winterhalter, R.; Herrmanna, F.; Moortgat, G. K. (2011). "The gas-phase ozonolysis of α-humulene". Phys. Chem. Chem. Phys. 13 (23): 10970–11001. Bibcode:2011PCCP...1310970B. doi:10.1039/c0cp02379e. PMID 21461420.




