화학
Chemistry| 시리즈의 일부 |
| 화학 |
|---|
 |
화학은 [1]물질의 특성과 성질에 대한 과학적인 연구이다.그것은 원자, 분자, 이온으로 이루어진 화합물, 즉 그들의 구성, 구조, 특성, 행동 그리고 다른 [2][3][4][5]물질들과 반응하는 동안 그들이 겪는 변화들을 다루는 자연 과학이다.
그 과목의 범위에서 화학은 물리학과 [6]생물학의 중간 위치를 차지한다.그것은 기초적이고 응용적인 과학 분야를 기초적인 [7]수준에서 이해하기 위한 기초를 제공하기 때문에 때때로 중앙과학이라고 불린다.예를 들어, 화학은 식물의 성장(식물학), 화성암의 형성(지질학), 대기 중의 오존이 어떻게 형성되고 환경 오염 물질이 어떻게 분해되는지(생태학), 달에 있는 토양의 특성(우주 화학), 의약품의 작용(약리학), 범죄 현장에서 DNA 증거를 수집하는 방법(생태학)을 설명한다.s)
화학은 원자와 분자가 화학 결합을 통해 어떻게 상호작용하여 새로운 화학 화합물을 형성하는지와 같은 주제를 다룬다.화학 결합에는 두 가지 유형이 있습니다.
- 원자가 하나 이상의 전자를 공유하는 1차 화학 결합, 원자가 하나 이상의 전자를 다른 원자에 기증하여 이온( 양이온 및 음이온)을 생성하는 이온 결합, 금속 결합
- 수소 결합, 반데르발스 힘 결합, 이온 이온 상호작용, 이온 다이폴 상호작용 등의 2차 화학 결합
어원학
화학이라는 단어는 화학, 야금, 철학, 점성술, 천문학, 신비주의 그리고 의학의 요소들을 아우르는 초기 일련의 관행을 언급했던 연금술이라는 단어의 르네상스 기간 동안 변형된 것에서 유래했다.연금술사들은 또한 [8]현대 화학의 많은 질문에 관심을 가졌지만 연금술은 종종 납이나 다른 비금속을 금으로 바꾸려는 탐구와 관련이 있는 것으로 보인다.
연금술이라는 현대어는 아랍어 al-kmmā (에서 유래했다.알-키-미냐가 고대 그리스어 μμα에서 유래했기 때문에 이것은 이집트 기원이 될 수 있다. 이는 이집트어로 [9]이집트의 고대 이름인 케메트에서 차례로 유래되었다.또는 al-kīmāa는 [10]δμεα '함께 주조'에서 유래할 수 있다.
현대 원리
현재 원자 구조의 모델은 양자 역학 [11]모델이다.전통적인 화학은 소립자, 원자, 분자,[12] 물질, 금속, 결정, 그리고 물질의 다른 집합체에 대한 연구로 시작한다.물질은 고체, 액체, 기체 및 플라즈마 상태, 분리 또는 조합으로 연구할 수 있다.화학에서 연구되는 상호작용, 반응 그리고 변환은 보통 원자들 사이의 상호작용의 결과이며, 원자들을 함께 고정시키는 화학적 결합의 재배열로 이어집니다.그러한 행동은 화학 실험실에서 연구된다.
화학 실험실은 전형적으로 다양한 형태의 실험용 유리기구를 사용한다.그러나 유리제품은 화학의 중심은 아니며, 많은 실험적인 화학(응용/산업적인 화학)도 유리제품 없이 이루어집니다.
화학반응은 어떤 물질들이 하나 이상의 [13]다른 물질로 변하는 것이다.이러한 화학적 변환의 기초는 원자 사이의 화학적 결합에서 전자의 재배열이다.그것은 보통 원자를 대상으로 하는 화학 방정식을 통해 상징적으로 묘사될 수 있다.화학 변환 방정식의 왼쪽과 오른쪽의 원자의 수는 같다.(양쪽 원자의 수가 같지 않은 경우, 변환은 핵반응 또는 방사성 붕괴라고 불립니다.)물질이 겪을 수 있는 화학 반응의 종류와 그에 수반되는 에너지 변화는 화학 법칙으로 알려진 특정한 기본 규칙에 의해 제한된다.
에너지와 엔트로피를 고려하는 것은 거의 모든 화학 연구에서 변함없이 중요하다.화학물질은 그 구조, 위상 및 화학조성에 따라 분류된다.스펙트럼 분석 및 크로마토그래피와 같은 화학 분석 도구를 사용하여 분석할 수 있습니다.화학 연구에 종사하는 과학자들은 [14]화학자로 알려져 있다.대부분의 화학자들은 하나 이상의 하위 분야를 전문으로 한다.화학 연구에 필수적인 몇 가지 개념은 다음과 같습니다.[15]
문제
화학에서 물질은 정지 질량과 부피를 가지고 있고 입자로 구성되어 있는 모든 것으로 정의된다.물질을 구성하는 입자들도 정지 질량을 가지고 있다 – 모든 입자들이 광자와 같은 정지 질량을 가지고 있는 것은 아니다.물질은 순수한 화학 물질일 수도 있고 물질의 [16]혼합물일 수도 있다.
아톰

원자는 화학의 기본 단위이다.그것은 원자핵이라고 불리는 고밀도 핵으로 구성되어 있으며, 전자 구름에 의해 점유된 공간에 둘러싸여 있다.핵은 양전하를 띤 양성자와 무전하를 띤 중성자로 구성되어 있는 반면, 전자 구름은 음전하를 띤 전자들로 구성되어 있습니다.중성 원자에서, 음전하를 띤 전자는 양성자의 양전하를 균형 있게 합니다.핵은 밀도가 높다; 핵자의 질량은 전자의 약 1,836배이지만, 원자의 반지름은 [17][18]핵의 약 10,000배이다.
원자는 또한 전기 음성도, 이온화 전위, 선호 산화 상태, 배위수 및 형성할 선호 결합 유형(예: 금속, 이온, 공유가)과 같은 원소의 화학적 특성을 유지할 것으로 예상할 수 있는 가장 작은 실체이다.
요소
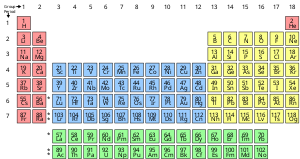
화학 원소는 단일 유형의 원자로 구성된 순수한 물질로, 원자핵에 있는 특정 수의 양성자로 특징지어지며, 원자번호로 알려져 있고 기호 Z로 표현된다.질량수는 핵에 있는 양성자와 중성자 수의 합이다.비록 한 원소에 속하는 모든 원자의 핵이 같은 원자 번호를 가질지라도, 그들은 반드시 같은 질량 번호를 가질 필요는 없다; 다른 질량 번호를 가진 원소의 원자는 동위원소라고 알려져 있다.예를 들어, 핵에 6개의 양성자를 가진 모든 원자는 화학 원소 탄소 원자이지만 탄소 원자는 12 또는 [18]13의 질량수를 가질 수 있다.
화학 원소의 표준 표시는 원자 번호별로 원소를 정렬하는 주기율표에 있다.주기율표는 그룹, 열, 마침표 또는 행으로 배열됩니다.주기율표는 주기적인 [19]경향을 식별하는 데 유용하다.
컴파운드

화합물은 둘 이상의 원소로 구성된 순수한 화학 물질이다.화합물의 특성은 그 [20]원소의 특성과 거의 유사하지 않다.화합물의 표준 명명법은 국제순수응용화학연합(IUPAC)이 정한다.유기화합물은 유기명칭법에 [21]따라 명명된다.무기화합물의 명칭은 무기명법에 따라 작성된다.화합물이 둘 이상의 성분을 가지고 있는 경우, 전기음성 성분과 전기음성 [22]성분이라는 두 가지 클래스로 나뉩니다.또한 Chemical Abstracts Service는 화학 물질을 색인화하는 방법을 고안했습니다.이 계획에서 각 화학 물질은 CAS 등록번호로 알려진 번호로 식별할 수 있다.
분자

분자는 순수한 화학 물질에서 분리할 수 없는 가장 작은 부분이며, 독특한 화학적 특성, 즉 다른 물질과 화학 반응을 일으킬 수 있는 잠재력을 가지고 있습니다.그러나 이 정의는 분자로 구성된 물질에만 잘 적용되며, 많은 물질에는 해당되지 않습니다(아래 참조).분자는 전형적으로 공유 결합에 의해 결합된 원자의 집합으로 구조가 전기적으로 중립이고 모든 원자가 전자는 결합 또는 단독 쌍으로 다른 전자와 쌍을 이룬다.
따라서 분자는 이온과 달리 전기적으로 중성적인 단위로 존재한다.이 규칙이 깨지면, "분자"에게 전하를 주면, 그 결과는 종종 분자 이온 또는 다원자 이온이라고 불립니다.그러나 분자 개념의 개별적이고 분리된 성질은 일반적으로 분자 이온이 질량 분석계의 진공에 있는 방향 빔과 같이 잘 분리된 형태로만 존재해야 합니다.고체(예: 일반적인 황산염 또는 질산 이온)에 존재하는 하전 다원자 집합은 일반적으로 화학에서 "분자"로 간주되지 않습니다.어떤 분자는 하나 이상의 짝이 없는 전자를 포함하고 라디칼을 생성한다.대부분의 라디칼은 비교적 반응성이 높지만 산화질소(NO)와 같은 일부 라디칼은 안정적일 수 있습니다.
"inert" 또는 귀한 가스 원소(헬륨, 네온, 아르곤, 크립톤, 제논, 라돈)는 가장 작은 이산 단위로서 단일 원자로 구성되지만, 다른 분리된 화학 원소들은 어떤 방식으로든 서로 결합하는 분자 또는 원자의 네트워크로 구성됩니다.식별 가능한 분자는 물, 공기와 같은 친숙한 물질과 알코올, 설탕, 가솔린, 그리고 다양한 의약품과 같은 많은 유기 화합물을 구성합니다.
하지만, 모든 물질이나 화학 화합물이 분리된 분자로 구성된 것은 아니며, 실제로 지구의 고체 지각, 맨틀, 그리고 핵을 구성하는 대부분의 고체 물질은 분자가 없는 화학 화합물이다.이온 화합물 및 네트워크 고체 등의 다른 유형의 물질은 식별 가능한 분자 자체가 존재하지 않도록 구성되어 있다.대신, 이러한 물질들은 물질 내에서 가장 작은 반복 구조로서 공식 단위 또는 단위 셀의 관점에서 논의된다.이러한 물질의 예로는 광물염(식탁염 등), 탄소나 다이아몬드 같은 고체, 금속, 그리고 친숙한 실리카와 규산염 광물(예: 석영이나 화강암)이 있다.
분자의 주요 특징 중 하나는 종종 구조라고 불리는 기하학이다.2원자, 3원자 또는 4원자 분자의 구조는 사소한 것일 수 있지만, (선형, 각추형 등) 6개 이상의 원자로 구성된 다원자 분자의 구조는 화학적 성질을 위해 결정적일 수 있다.
물질 및 혼합물
  | |
  | |
  | |
| 순수 화학물질의 예.왼쪽에서 오른쪽으로 주석(Sn)과 황(S), 다이아몬드(탄소 동소체), 수크로스(순당), 염화나트륨(소금), 중탄산나트륨(소다) 등 이온 화합물이다. |
화학 물질은 일정한 성분과 [23]성질을 가진 물질의 일종이다.물질의 집합은 혼합물이라고 불린다.혼합물의 예로는 공기와 [24]합금이 있습니다.
물질 몰 및 양
몰은 물질의 양(화학량이라고도 함)을 나타내는 측정 단위입니다.한 몰은 정확히 6.02214076×1023 입자(atoms, 분자, 이온 또는 전자)를 포함하도록 정의되며, 여기서 몰당 입자 수는 아보가드로 [25]상수로 알려져 있다.몰 농도는 용액의 부피당 특정 물질의 양으로 일반적으로 몰/dm3 [26]단위로 보고된다.
단계
서로 다른 화학 분류를 구별하는 특정 화학 특성 외에도 화학 물질은 여러 단계로 존재할 수 있습니다.대부분의 경우 화학 분류는 이러한 벌크 위상 분류와는 무관하지만, 일부 이상 단계는 특정 화학 특성과 호환되지 않는다.상은 압력이나 온도와 같은 다양한 조건에 걸쳐 유사한 벌크 구조 특성을 가진 화학 시스템의 상태 집합입니다.
밀도 및 굴절률 등의 물리적 특성은 위상 특성 값 안에 들어가는 경향이 있습니다.물질의 상은 상전이에 의해 정의됩니다.상전이는 시스템에 투입되거나 시스템에서 배출되는 에너지가 벌크 조건을 변경하는 것이 아니라 시스템의 구조를 재배치하는 것입니다.
이 경우 물질이 초임계 상태에 있는 것으로 간주되는 경우, 상 사이의 구별은 이산 경계'를 갖는 대신 연속적일 수 있다.세 개의 상태가 조건에 근거해 만나면, 삼중점이라고 불리고, 이것은 불변하기 때문에, 일련의 조건을 정의하는 편리한 방법입니다.
가장 친숙한 상은 고체, 액체 및 기체입니다.많은 물질은 여러 고체상을 보인다.예를 들어 온도와 압력에 따라 달라지는 고체 철의 세 가지 상(알파, 감마 및 델타)이 있습니다.고체상의 주된 차이는 원자의 결정 구조 또는 배열입니다.화학 연구에서 흔히 볼 수 있는 또 다른 단계는 수용액(즉, 물)에 용해된 물질의 상태입니다.
덜 친숙한 단계에는 플라스마, 보스-아인슈타인 응축물 및 페르미온 응축물, 그리고 자성 물질의 상사성 및 강자성 위상이 포함된다.대부분의 익숙한 단계는 3차원 시스템을 다루지만, 2차원 시스템에서 아날로그를 정의할 수도 있습니다. 이는 생물학에서 시스템과의 관련성으로 주목을 받아 왔습니다.
본딩
분자 또는 결정에서 함께 붙어있는 원자는 서로 결합되어 있다고 한다.화학결합은 핵의 정극전하와 [27]핵의 주위를 진동하는 부극전하 사이의 다극균형으로서 시각화할 수 있다.단순한 흡인력과 반발 이상의 에너지와 분포는 전자가 다른 원자에 결합할 수 있는 가능성을 특징으로 합니다.
화학 결합은 공유 결합, 이온 결합, 수소 결합일 수도 있고 반데르발스 힘 때문일 수도 있습니다.이런 종류의 결합은 각각 어떤 잠재력에 기인한다.이러한 전위는 분자 또는 결정에서 원자를 함께 고정시키는 상호작용을 만듭니다.많은 단순한 화합물에서, 원자가 결합 이론, 원자가 셸 전자 쌍 반발 모델(VSEPR), 산화수의 개념은 분자 구조와 조성을 설명하기 위해 사용될 수 있다.
이온 결합은 금속이 하나 이상의 전자를 잃어 양전하가 된 양이온이 되고, 그 후 전자는 비금속 원자에 의해 얻어져 음전하가 된 음이온이 되었을 때 형성된다.반대 방향으로 대전된 두 이온은 서로를 끌어당기고 이온 결합은 그들 사이의 정전기적인 끌어당기는 힘입니다.예를 들어 금속인 나트륨(Na)은 1개의 전자를 잃어 Na+ 양이온이 되고, 비금속인 염소(Cl)는 이 전자를 얻어 Cl이 된다−.이온은 정전기 흡인력에 의해 결합되어 화합물 염화나트륨(NaCl) 또는 일반적인 식탁용 소금이 형성된다.

공유 결합에서, 하나 이상의 원자가 전자 쌍은 두 개의 원자에 의해 공유됩니다. 즉, 결합된 원자의 전기적으로 중성적인 그룹을 분자라고 합니다.원자는 각 원자에 대해 고귀한 기체 전자 구성(가장 바깥쪽 껍질에 있는 8개의 전자)을 만드는 방식으로 원자가 전자를 공유합니다.각각의 원자가 껍데기에 8개의 전자를 가지도록 결합하는 경향이 있는 원자는 옥텟 법칙을 따른다고 한다.하지만, 수소와 리튬과 같은 일부 원소들은 가장 바깥쪽에 있는 두 개의 전자만을 필요로 한다; 이 원자들은 이중 법칙을 따르는 것으로 알려져 있고, 이러한 방식으로 그들은 바깥쪽에 두 개의 전자를 가진 귀가스 헬륨의 전자 구성에 도달하고 있다.
마찬가지로, 고전 물리학의 이론들은 많은 이온 구조를 예측하는데 사용될 수 있다.금속 착체와 같은 더 복잡한 화합물의 경우, 원자가 결합 이론은 덜 적용되며 일반적으로 분자 궤도 이론과 같은 대체 접근법이 사용됩니다.전자 궤도 다이어그램을 참조하십시오.
에너지
화학의 맥락에서 에너지는 물질의 원자, 분자 또는 골재 구조의 결과로서 물질의 속성이다.화학적 변환은 이러한 종류의 구조 중 하나 또는 그 이상의 변화를 수반하기 때문에, 항상 관련된 물질의 에너지의 증감을 수반한다.일부 에너지는 열이나 빛의 형태로 주변과 반응물 사이에 전달된다. 따라서 반응물의 생성물은 반응물보다 많거나 적은 에너지를 가질 수 있다.
에너지 스케일에서 최종 상태가 초기 상태보다 낮으면 발열성 반응이라고 하며, 엔더곤성 반응의 경우에는 그 반대이다.반응이 주위에 열을 방출하면 발열이라고 하며, 흡열 반응의 경우 주변으로부터 열을 흡수한다.
화학반응은 반응물질이 활성화 에너지로 알려진 에너지 장벽을 극복하지 않는 한 항상 가능하지 않다.화학 반응 속도(특정 온도 T)는 활성화 에너지 E와 관련이 있으며, 볼츠만의 모집단 -E / T e)에 의해 결정됩니다. – 주어진 온도 T에서 분자가 E 이상의 에너지를 가질 확률입니다.온도에 대한 반응 속도의 기하급수적 의존성을 아레니우스 방정식이라고 합니다.화학 반응이 일어나는 데 필요한 활성화 에너지는 [28]열, 빛, 전기 또는 초음파 형태로 기계적 힘의 형태로 나타날 수 있습니다.
또한 엔트로피 고려사항을 포함하는 관련 개념 자유 에너지는 화학 열역학에서 반응의 가능성을 예측하고 화학 반응의 평형 상태를 결정하는 데 매우 유용한 수단이다.Gibbs 자유 에너지의 총 변화량이 음의 Gif 0 \ \ G 0 ,}일 경우에만 반응이 가능하며, 0과 같으면 화학 반응은 평형 상태라고 한다.
전자, 원자, 분자에 대해 제한된 에너지 상태만 존재합니다.이것들은 양자역학 법칙에 의해 결정되는데, 양자역학 법칙은 결합 시스템의 에너지를 양자화해야 한다.높은 에너지 상태의 원자/분자는 들뜬 상태라고 합니다.들뜬 에너지 상태에 있는 물질의 분자/원자(atom)는 종종 훨씬 더 반응적이다. 즉, 화학 반응에 더 잘 적응한다.
물질의 위상은 항상 그 에너지와 주변의 에너지에 의해 결정된다.물질의 분자간 힘이 주변 에너지가 그것들을 극복하기에 충분하지 않을 때, 그것은 물과 마찬가지로2 액체나 고체처럼 보다 질서 있는 단계에서 발생합니다; 그 분자가 수소 [29]결합에 의해 결합되기 때문에 상온에서 액체입니다.반면 황화수소(HS)는2 상온과 표준 압력의 기체인데, 황화수소의 분자가 더 약한 쌍극자-쌍극자 상호작용에 의해 결합되기 때문이다.
한 화학 물질에서 다른 화학 물질로의 에너지 전달은 한 물질에서 방출되는 에너지 양자의 크기에 따라 달라집니다.하지만, 열 에너지는 종종 거의 모든 물질에서 다른 물질로 더 쉽게 전달되는데, 왜냐하면 물질에서 진동 및 회전 에너지 수준을 담당하는 포논이 전자 에너지 전달을 위해 호출된 광자보다 훨씬 적은 에너지를 가지고 있기 때문입니다.따라서 진동 및 회전 에너지 수준은 전자 에너지 수준보다 더 가깝게 떨어져 있기 때문에 빛 또는 다른 형태의 전자 에너지와 관련된 물질 간에 열이 더 쉽게 전달됩니다.예를 들어, 자외선 전자 복사는 열이나 전기 에너지만큼 한 물질에서 다른 물질로 전달되지 않습니다.
다른 화학 물질에 대한 특성 에너지 수준의 존재는 스펙트럼 라인의 분석에 의한 화학 물질의 식별에 유용하다.화학 스펙트럼 분석에는 IR, 마이크로파, NMR, ESR 등 다양한 종류의 스펙트럼이 사용된다.분광학은 또한 방사선 스펙트럼을 분석하여 별이나 먼 은하와 같은 먼 곳의 물체의 구성을 확인하는 데 사용된다.

화학 에너지라는 용어는 화학 물질이 화학 반응을 통해 변환될 가능성을 나타내거나 다른 화학 물질을 변환하는 데 종종 사용됩니다.
반응
화학물질이 다른 물질 또는 에너지와의 상호작용에 의해 변형되면 화학반응이 일어난 것으로 간주된다.따라서 화학반응은 물질이 다른 물질과 밀접하게 접촉할 때 일어나는 반응과 관련된 개념이다. 혼합물이든 용액이든, 어떤 형태의 에너지에 대한 노출이든, 또는 둘 다이다.이는 반응 성분과 시스템 환경 간의 에너지 교환을 야기합니다. 시스템 환경은 설계된 용기(종종 실험실 유리 제품)일 수 있습니다.
화학반응은 분자의 형성이나 해리를 야기할 수 있다. 즉, 분자가 둘 이상의 분자를 형성하기 위해 분열되거나 분자 내 또는 분자 간에 원자의 재배열을 야기할 수 있다.화학반응은 보통 화학결합의 생성과 파괴를 수반한다.산화, 환원, 해리, 산염기 중화 및 분자 재배열은 일반적으로 사용되는 화학 반응의 일부입니다.
화학반응은 화학방정식을 통해 상징적으로 묘사될 수 있다.비핵화학반응에서는 방정식의 양쪽에 있는 원자의 수와 종류가 동일하지만, 핵반응에서는 핵입자만 해당된다.양성자와 중성자.[30]
화학반응의 과정에서 화학결합의 재조직이 일어나는 일련의 단계를 그 메커니즘이라고 한다.화학반응은 여러 단계에서 일어날 것으로 예상할 수 있으며, 각 단계마다 속도가 다를 수 있습니다.따라서 반응 과정에서 가변 안정성을 갖는 많은 반응 중간체를 예상할 수 있다.반응 메커니즘은 반응의 역학과 상대적 생성물 혼합을 설명하기 위해 제안된다.많은 물리 화학자들이 다양한 화학 반응의 메커니즘을 연구하고 제안하는 것을 전문으로 한다.우드워드-호프만 규칙과 같은 몇 가지 경험적 규칙은 종종 화학 반응을 위한 메커니즘을 제안할 때 유용하다.
IUPAC 골드북에 따르면 화학반응은 "화학종의 [31]상호변환을 일으키는 과정"이다.따라서 화학반응은 소반응일 수도 있고 단계반응일 수도 있다.이 정의에는 컨포머의 상호변환이 실험적으로 관찰 가능한 경우가 포함된다는 추가 경고가 있다.그러한 검출 가능한 화학 반응은 일반적으로 이 정의에 의해 나타나는 분자 실체의 집합을 포함하지만, 종종 개념적으로 단일 분자 실체와 관련된 변화(즉, '현미경 화학 사건')에도 이 용어를 사용하는 것이 편리하다.
이온 및 소금

이온은 하나 이상의 전자를 잃거나 얻은 하전된 종, 원자 또는 분자입니다.원자가 전자를 잃고 전자보다 양성자가 많을 때, 원자는 양전하를 띤 이온 또는 양이온이다.원자가 전자를 얻어서 양성자보다 더 많은 전자를 가질 때, 원자는 음전하를 띤 이온 또는 음이온이다.양이온과 음이온은 염화나트륨 또는 NaCl을+ 형성하는 Na 및 Cl− 이온과 같은 중성염의 결정 격자를 형성할 수 있다.산-염기 반응 중에 분해되지 않는 다원자 이온의 예로는 수산화물(OH−)과 인산염(PO43−)이 있다.
플라즈마는 보통 고온을 통해 완전히 이온화된 기체 물질로 구성되어 있습니다.
산도와 염기성
물질은 종종 산이나 염기로 분류될 수 있다.산염기 거동을 설명하는 몇 가지 다른 이론이 있다.가장 간단한 것은 아레니우스 이론으로 산은 물에 녹으면 하이드로늄 이온을 생성하는 물질이고 염기는 물에 녹으면 수산화 이온을 생성하는 물질이다.Brönsted에 따르면-저산염기이론, 산은 화학반응에서 다른 물질에 양의 수소이온을 공급하는 물질이다. 더 나아가 염기는 수소이온을 받는 물질이다.
세 번째 공통 이론은 루이스 산염기 이론으로, 새로운 화학 결합의 형성에 기초한다.루이스 이론은 산은 결합 형성 과정에서 다른 물질로부터 한 쌍의 전자를 받아들일 수 있는 물질이고, 염기는 새로운 결합을 형성하기 위해 한 쌍의 전자를 제공할 수 있는 물질이라고 설명한다.이 이론에 따르면 교환되는 중요한 것은 요금이다.[32][unreliable source?]이 [33]개념의 역사에서 분명히 알 수 있듯이 물질이 산 또는 염기로 분류되는 다른 몇 가지 방법이 있다.
산 강도는 일반적으로 두 가지 방법으로 측정됩니다.아레니우스 산도의 정의에 기초한 측정치 중 하나는 pH로, 음의 로그 척도로 표현되는 용액 중의 하이드로늄 이온 농도의 측정치이다.따라서 pH가 낮은 용액은 높은 하이드로늄 이온 농도를 가지며 산성도가 높다고 할 수 있다.Brönsted에 기초한 다른 측정값:로우리 정의는 산 해리 상수(K)로a, Brönsted에서 산 역할을 하는 물질의 상대적 능력을 측정한다.산의 낮은 정의.즉, K 값이 높은 물질은a K 값이 낮은a 물질보다 화학 반응에서 수소 이온을 공여할 가능성이 높다.
레독스
레독스(redox-oxidation) 반응은 원자가 전자를 얻거나(reducation) 전자를 잃음으로써 산화 상태가 변하는 모든 화학 반응을 포함한다.다른 물질을 산화시키는 능력을 가진 물질은 산화제, 산화제 또는 산화제로 알려져 있다.산화제는 다른 물질에서 전자를 제거한다.마찬가지로, 다른 물질을 감소시키는 능력이 있는 물질은 환원제, 환원제 또는 환원제로 알려져 있습니다.
환원제는 다른 물질에 전자를 전달하여 스스로 산화한다.그리고 그것이 전자를 "기증"하기 때문에 그것은 전자 기증자라고도 불립니다.산화 및 환원은 산화수의 변화를 의미하며, 실제 전자의 전달은 절대 일어나지 않을 수 있습니다.따라서 산화수는 산화수의 증가, 환원량은 산화수의 감소로 정의된다.
평형
평형 개념은 과학 전반에 걸쳐 널리 사용되고 있지만, 화학의 맥락에서, 화학 조성의 여러 다른 상태들이 가능할 때마다, 예를 들어, 서로 반응할 수 있는 여러 화학 화합물들의 혼합에서, 또는 물질이 한 가지 이상의 상으로 존재할 때 발생합니다.
평형 상태에 있는 화학물질의 시스템은, 비록 변하지 않는 구성을 가지고 있더라도, 대부분의 경우 정적이 아니다; 물질의 분자들은 계속해서 서로 반응하여 동적 평형을 일으킨다.따라서 이 개념은 화학 성분과 같은 매개변수가 시간이 지남에 따라 변경되지 않는 상태를 기술한다.
화학법칙
화학반응은 화학의 기본 개념이 된 특정한 법칙에 의해 지배된다.그 중 몇 가지는 다음과 같습니다.
- 아보가드로의 법칙
- 맥주-람버트의 법칙
- 보일의 법칙(1662년, 압력과 체적을 관련짓는 것)
- 찰스의 법칙(1787년, 부피와 온도 관련)
- 픽의 확산 법칙
- 게이-루삭의 법칙(1809년, 압력과 온도 관련)
- 르 샤틀리에의 원리
- 헨리의 법칙
- 헤스의 법칙
- 에너지 보존의 법칙은 평형, 열역학, 그리고 운동학의 중요한 개념으로 이어진다.
- 질량 보존의 법칙은 현대 물리학에서도 고립된 시스템에서 계속 보존되고 있습니다.그러나 특수 상대성 이론은 질량-에너지 등가성으로 인해 비물질 "에너지"(열, 빛, 운동 에너지)가 비고립 시스템에서 제거될 때마다 질량이 손실된다는 것을 보여준다.높은 에너지 손실은 핵화학에서 중요한 주제인 측정 가능한 질량의 손실을 초래한다.
- 명확한 구성의 법칙, 비록 많은 시스템(특히 생체 고분자와 광물)에서 그 비율은 많은 수를 필요로 하는 경향이 있고, 종종 분수로 표현된다.
- 배수비례의 법칙
- 라울의 법칙
역사
화학의 역사는 아주 옛날부터 현재까지의 기간에 걸쳐 있다.기원전 수천 년 이후, 문명들은 결국 화학의 다양한 분과의 기초를 이루는 기술을 사용하고 있었다.예를 들어 광석에서 금속을 추출하고, 도자기와 유약을 만들고, 맥주와 와인을 발효시키고, 약과 향수를 위해 식물에서 화학물질을 추출하고, 지방을 비누로 만들고, 유리를 만들고, 청동과 같은 합금을 만드는 것이 포함된다.화학은 물질의 성분과 그 상호작용을 이해하기 위한 직관적이지만 비과학적인 접근인 원시과학 연금술이 선행되었다.물질의 본질과 그 변화를 설명하는 데는 실패했지만, 실험을 수행하고 결과를 기록함으로써 연금술사들은 현대 화학의 발판을 마련했다.연금술과 구별되는 지식의 집합체로서의 화학은 로버트 보일에 의해 그의 작품인 회의적인 키미스트에서 그것들 사이에 분명한 차별화가 만들어졌을 때 나타나기 시작했다.연금술과 화학 둘 다 물질과 물질의 변형과 관련이 있는 반면, 결정적인 차이는 화학자들이 그들의 연구에 사용한 과학적 방법에 의해 주어졌다.화학은 화학 현상의 신중한 측정과 정량적 관찰을 요구하는 질량 보존의 법칙을 개발한 앙투안 라부아지에의 연구로 확립된 과학으로 여겨진다.화학의 역사는 열역학의 역사와 얽혀 있으며, 특히 윌러드 [34]깁스의 연구를 통해 더욱 그렇다.
정의.
새로운 발견과 이론이 과학의 기능을 추가함에 따라 화학의 정의는 시간이 지남에 따라 바뀌었다.1661년 저명한 과학자 로버트 보일의 관점에서 "기질학"이라는 용어는 혼합 [35]물체의 물질 원리의 주제를 의미했다.1663년, 화학자 크리스토퍼 글레이저는 "기질학"을 과학 예술로 묘사했습니다. 이를 통해 우리는 몸을 녹이고, 그것들로부터 다른 물질들을 끌어내고, 그것들을 다시 결합시키고, 더 높은 [36]완성도로 높이는 방법을 배울 수 있습니다.
게오르크 에른스트 스탈이 사용한 "화학"이라는 단어의 1730년 정의는 혼합, 복합 또는 집합체를 그들의 원리로 분해하는 예술과 그러한 [37]원리에서 그러한 신체를 구성하는 예술을 의미했다.1837년, Jean-Baptiste Duma는 "화학"이라는 단어를 분자 [38]힘의 법칙과 효과에 관련된 과학을 지칭하는 것으로 여겼다.이 정의는 1947년에 물질의 과학, 즉 구조, 특성, 그리고 그것들을 다른 물질로 바꾸는 반응을 의미하게 될 때까지 더욱 진화했습니다. 이는 라이너스 [39]폴링에 의해 받아들여졌습니다.보다 최근인 1998년, 레이먼드 장 교수는 "화학"의 정의를 물질과 그것이 [40]겪는 변화에 대한 연구로 확장했다.
규율
이집트 바빌로니아와 인디언과[41][42] 같은 초기 문명은 야금, 도자기, 염료 예술에 관한 실용적인 지식을 축적했지만 체계적인 이론을 발전시키지는 못했다.
아리스토텔레스가 불, 공기, 흙, 물이 모든 것이 결합으로 형성되는 기본 요소라고 말한 네 가지 원소에 대한 이론과 함께 고전 그리스에서 기본적인 화학 가설이 처음 등장했다.그리스의 원자론은 데모크리투스와 에피쿠로스 같은 철학자들의 작품에서 생겨난 기원전 440년으로 거슬러 올라간다.기원전 50년에, 로마 철학자 루크레티우스는 그의 책 De rerum natura (사물의 [43][44]본질에 대하여)에서 이론을 확장했습니다.현대 과학의 개념과 달리, 그리스의 원자론은 경험적 관찰에 대한 관심이 거의 없고 화학 [45]실험에 대한 관심이 없는 순수하게 철학적이었다.
질량 보존 사상의 초기 형태는 고대 그리스 철학에서 "무에서 나오는 것은 없다"는 개념인데, 이는 엠페도클레스에서 찾을 수 있다.기원전 4세기) : "어떤 것도 존재하지 않는 것으로부터 나오는 것은 불가능하기 때문에, 그리고 그것이 완전히 [46]파괴되어야 한다는 것을 가져오거나 들을 수 없다." 그리고 우주의 본질을 묘사하면서, "사물의 전체는 항상 현재와 같았고,[47] 앞으로도 그럴 것이다."라고 쓴 에피쿠로스(기원전 3세기)가 있다.
헬레니즘 세계에서는 처음으로 연금술의 예술이 확산되어 자연물질의 연구에 마법과 신비주의를 혼합하여 원소를 금으로 바꾸고 [48]영생의 영약을 발견하는 궁극적인 목표를 세웠다.작업, 특히 증류의 개발은 초기 비잔틴 시대에 계속되었고, 가장 유명한 실천가는 파노폴리스의 [49]4세기 그리스-이집트 조시모스이다.알케미는 이슬람 [50]정복 이후 아랍 세계 전역에서 계속 발전하고 실행되었으며, 그곳에서부터, 그리고 비잔틴의 [51]잔재로부터 라틴어 번역을 통해 중세 및 르네상스 유럽으로 확산되었다.
자비르 이븐 헤이얀의 아랍어 작품에서는 화학 물질의 계통적인 분류를 도입하여 유기 물질(식물, 혈액, 머리카락 등)에서 무기 화합물(염화 암모니아 또는 염화 암모늄)을 [52]화학적 방법으로 유도하는 방법을 설명하였다.아랍어 자비르의 작품들 (예: "자비의 서"와 "일흔의 서")은 나중에 라틴어 "게버"[53]로 번역되었고, 13세기 유럽에서는 보통 사이비 게버라고 불리는 익명의 작가가 이 [54]이름으로 연금술과 야금술을 만들기 시작했다.아부 알-레이한 알-브룬과[55] 아비센나와[56] 같은 후에 영향력 있는 이슬람 철학자들은 연금술, 특히 금속의 변환 이론에 대해 논쟁을 벌였다.
프란시스 베이컨 경과 다른 사람들에 의해 제안된 새로운 경험적 방법의 영향으로, 옥스퍼드 대학의 화학자들, 로버트 보일, 로버트 후크 그리고 존 메요우는 오래된 연금술 전통을 과학 분야로 재편하기 시작했다.보일은 특히 연금술의 주장과 새로운 [57]화학의 경험적 과학적 발견을 구별하는 그의 가장 중요한 작품인 고전 화학 교재 The Sceptical Kymist로 인해 화학의 창시자로 여겨진다.그는 보일의 법칙을 공식화했고, 고전적인 "4원소"를 거부했으며 엄격한 [58]실험의 대상이 될 수 있는 원자와 화학 반응에 대한 기계적 대안을 제안했다.
프롤기스톤(모든 연소의 근원에 있는 물질) 이론은 18세기 초 독일인 게오르크 에른스트 스탈에 의해 제안되었고, 물리학의 뉴턴의 화학적 유사체인 프랑스 화학자 앙투안 라부아지에에 의해서만 뒤집혔습니다; 그는 적절한 이론에 대한 새로운 과학을 확립하기 위해 다른 어떤 것보다도 더 많은 일을 했습니다.질량 보존의 원리를 설명하고 [60]오늘날까지 사용되는 새로운 화학 명명 체계를 개발함으로써 기술적 기초.
그러나 그의 연구 이전에, 특히 많은 다른 기체로 구성된 '공기'의 본질과 관련하여 많은 중요한 발견들이 이루어졌다.스코틀랜드의 화학자 조셉 블랙과 플랑드르 얀 침례 반 헬몬트는 1754년에 블랙이 '고정 공기'라고 부르는 이산화탄소, 즉 수소를 발견했고 헨리 카벤디쉬는 수소와 조셉 프리스틀리와 독립적으로 칼 빌헬름 쉴레에게 그 성질을 설명했다.
영국의 과학자 John Dalton은 모든 물질은 물질의 분리할 수 없는 '아톰'으로 구성되어 있고 다른 원자들은 다양한 원자량을 가지고 있다는 현대 원자의 이론을 제안했다.
화학 조합의 전기 화학 이론의 개발은 19세기 초에 두 과학자, 특히 옌스 야콥 베르젤리우스와 험프리 데이비의 연구 결과로 일어났는데, 알레산드로 볼타의 볼타 발명에 의해 가능해졌다.데이비는 산화물에서 전류를 [61]흘려 알칼리 금속을 포함한 9개의 새로운 원소를 발견했다.
영국 윌리엄 프라우트는 모든 원자가 수소 원자량의 정확한 배인 무게를 가지고 있기 때문에 원자량에 따라 모든 원소를 정렬할 것을 처음 제안했다.J.A.R. Newlands는 초기 원소표를 고안했고, 그 후 1860년대에 드미트리 멘델레예프에 의해 그리고 줄리어스 로타르 [65][66]마이어를 포함한 몇몇 다른 과학자들에 의해 독립적으로 발전되었다[64].나중에 귀한 가스라고 불리는 불활성 가스는 세기 말에 윌리엄 램지 경과 협력하여 발견되었고, 따라서 표의 기본 구조를 채웠다.
20세기 초에 화학의 이론적 토대는 원자의 내부 구조의 본질을 조사하고 발견하는 데 성공한 일련의 놀라운 발견으로 인해 마침내 이해되었습니다.1897년 캠브리지 대학의 J.J. 톰슨이 전자를 발견했고 곧이어 프랑스 과학자 베크렐과 피에르 퀴리 부부가 방사능 현상을 조사했다.맨체스터 대학의 일련의 선구적인 산란 실험에서, 어니스트 러더포드는 원자의 내부 구조와 양성자의 존재를 발견했고, 다양한 유형의 방사능을 분류하고 설명했으며 질소를 알파 입자로 폭격함으로써 첫 번째 원소를 성공적으로 변환했다.
원자 구조에 대한 그의 연구는 그의 학생들인 덴마크 물리학자 닐스 보어, 헨리 모즐리, 그리고 오토 한에 의해 향상되었고, 그들은 신흥 핵 화학을 주도했다.화학 결합과 분자 궤도의 전자 이론은 미국인 과학자 라이너스 폴링과 길버트 N에 의해 개발되었다. 루이스.
유엔은 2011년을 국제 화학의 [67]해로 선포했다.그것은 국제 순수·응용 화학 연합과 유엔 교육·과학·문화 기구의 이니셔티브였으며 전 세계 화학 협회, 학계 및 기관이 참여했으며 지역 및 지역 활동을 조직하기 위해 개별 이니셔티브에 의존했다.
유기화학은 프리드리히 뵐러의 [68]요소 합성 이후 유스투스 폰 리비그와 다른 사람들에 의해 개발되었다.19세기의 다른 중요한 발전은 원자가 결합에 대한 이해와 화학에 대한 열역학 응용이었다.
연습
하위 분야
이 기사는 대부분 또는 전체적으로 단일 출처에 의존하고 있습니다.: · · · · (2014년 9월) |
화학은 일반적으로 몇 가지 주요 하위 분야로 나뉩니다.또한 [69]화학에는 여러 주요 분야와 전문 분야가 있습니다.
- 분석 화학은 화학 성분과 구조를 이해하기 위해 재료 샘플을 분석하는 것입니다.분석 화학은 화학에서 표준화된 실험 방법을 통합합니다.이 방법들은 순수하게 이론적인 화학을 제외한 화학의 모든 하위 분야에서 사용될 수 있다.
- 생화학은 살아있는 유기체에서 일어나는 화학, 화학 반응, 화학 상호작용에 대한 연구이다.생화학 및 유기화학은 약화학 또는 신경화학에서와 같이 밀접하게 관련되어 있습니다.생화학은 또한 분자생물학과 유전학과 관련이 있다.
- 무기화학은 무기화합물의 특성과 반응에 대한 연구이다.유기물 화학과 무기물 화학의 구분은 절대적이지 않고 많은 중복이 있으며, 가장 중요한 것은 유기금속 화학의 하위 분야이다.
- 재료 화학은 유용한 기능을 가진 물질의 준비, 특성화 및 이해입니다.이 분야는 대학원 과정에서의 새로운 연구 범위로, 재료 고유의 근본적인 문제에 초점을 맞추어 화학의 모든 고전 영역의 요소들을 통합합니다.주요 연구 시스템은 응축된 상(액체, 액체, 중합체)의 화학과 상 간의 계면을 포함한다.
- 신경화학은 전달체, 펩타이드, 단백질, 지질, 당, 핵산을 포함한 신경화학에 대한 연구입니다.그들의 상호작용과 신경계를 형성, 유지, 수정하는 데 있어 그들이 하는 역할입니다.
- 핵화학은 아원자 입자들이 어떻게 모여서 핵을 만드는지에 대한 연구이다.현대 변환은 핵화학에서 큰 구성요소이며 핵종 표는 이 분야에서 중요한 결과이자 도구입니다.
- 유기화학은 유기화합물의 구조, 특성, 구성, 메커니즘 및 반응에 대한 연구이다.유기화합물은 탄소골격에 기초한 화합물로 정의된다.
- 물리화학은 화학 시스템과 프로세스의 물리적이고 근본적인 기초에 대한 연구입니다.특히, 그러한 시스템과 프로세스의 에너지와 역학은 물리 화학자들의 관심사다.중요한 연구 분야는 화학 열역학, 화학 동력학, 전기화학, 통계역학, 분광학,[70] 그리고 최근에는 우주화학이다.물리화학은 분자물리학과 많이 겹친다.물리화학은 방정식을 도출할 때 미적분을 사용하는 것을 포함한다.그것은 보통 양자 화학과 이론 화학과 관련이 있다.물리화학은 화학물리학과는 별개의 학문이지만, 다시 말하지만, 매우 강한 중복이 있다.
- 이론 화학은 기본적인 이론적 추론을 통해 화학을 연구하는 학문이다.특히 양자역학을 화학에 적용하는 것을 양자화학이라고 한다.제2차 세계대전이 끝난 이후 컴퓨터의 발달은 화학 문제를 해결하기 위한 컴퓨터 프로그램을 개발하고 적용하는 기술인 컴퓨터 화학의 체계적인 발전을 가능하게 했다.이론 화학은 (이론적이고 실험적인) 응집 물질 물리학 및 분자 물리학과 크게 겹친다.
화학 내의 다른 분야들은 전통적으로 연구되는 물질의 유형이나 연구 종류에 따라 분류된다.이것들은 무기 화학, 무기 물질의 연구; 유기 화학, 유기 (탄소 기반) 물질의 연구; 생화학, 생물 유기 생물에서 발견된 물질의 연구; 물리 화학, 열역학 및 양자 역학과 같은 물리적 개념을 사용하는 화학적 과정의 연구; 그리고 분석 화학, 그리고 분석 화학을 포함합니다.재료 샘플의 화학적 성분과 구조를 이해하기 위한 분석.최근 몇 년 동안 신경계에 대한 화학 연구인 신경 화학과 같은 더 많은 전문 분야가 등장했습니다(하위 분야 참조).
다른 것들로는 전기화학, 펨토케미스트리, 향미화학, 흐름화학, 조직화학, 화학의 역사, 수소화화학, 수학화학, 분자역학, 천연물화학, 유기금속화학, 석유화학, 광화학, 물리유기화학, 고분자화학, 방사화학, 음향화학 등이 있다.ry, 초분자 화학, 합성 화학, 그리고 다른 많은 것.
학제간
학제간 분야에는 농업화학, 우주화학(및 우주화학), 대기화학, 화학공학, 화학생물학, 화학정보학, 환경화학, 지구화학, 녹색화학, 면역화학, 해양화학, 재료과학, 기계화학, 의약화학, 분자생물학, 나노테크놀로지,장학, 약리학, 식물화학, 고체화학, 표면과학, 열화학, 그리고 많은 다른 것.
산업
화학 산업은 세계적으로 중요한 경제 활동을 대표한다.2013년 세계 50대 화학 생산국의 매출은 9,805억 달러, 이익률은 10.3%[71]였습니다.
프로 사회
「 」를 참조해 주세요.
레퍼런스
- ^ Brown, Theodore L.; LeMay, Jr., H. Eugene; Bursten, Bruce E.; Murphey, Catherine J.; Woodward, Patrick M.; Stoltzfus, Matthew W.; Lufaso, Michael W. (2018). "Introduction: Matter, energy, and measurement". Chemistry: The Central Science (14th ed.). New York: Pearson. pp. 46–85. ISBN 9780134414232.
- ^ "What is Chemistry?". Chemweb.ucc.ie. Archived from the original on 3 October 2018. Retrieved 12 June 2011.
- ^ "Definition of CHEMISTRY". www.merriam-webster.com. Archived from the original on 7 August 2020. Retrieved 24 August 2020.
- ^ "Definition of chemistry Dictionary.com". www.dictionary.com. Archived from the original on 5 March 2016. Retrieved 24 August 2020.
- ^ "Chemistry Is Everywhere". American Chemical Society. Archived from the original on 29 November 2020. Retrieved 1 December 2020.
- ^ 카스텐 라인하르트.20세기의 화학 과학: 경계를 잇는 것.Wiley-VCH, 2001.ISBN 3-527-30271-9. 페이지 1-2.
- ^ 시어도어 L. 브라운, H. 유진 레메이, 브루스 에드워드 버스턴, H. 레메이화학: 센트럴 사이언스지.프렌티스 홀, 8판(1999년).ISBN 0-13-010310-1. 페이지 3-4.
- ^ "History of Alchemy". Alchemy Lab. Archived from the original on 8 June 2011. Retrieved 12 June 2011.
- ^ "연금술", 옥스포드 영어 사전, J.A. 심슨, E.S.C.에 수록되어 있다.와이너, 제1권, 제2판, 1989년, ISBN 0-19-861213-3.
- ^ 위클리, 어니스트(1967).현대 영어 어원 사전뉴욕: 도버 출판사.ISBN 0-486-21873-2
- ^ "chemical bonding". Britannica. Encyclopædia Britannica. Archived from the original on 26 April 2012. Retrieved 1 November 2012.
- ^ 내용: Anthony Carpi 박사, Wayback Machine에서 2007년 2월 28일 데모크리투스에서 달튼까지의 원자.
- ^ IUPAC 골드북 정의 2007년 3월 4일 Wayback Machine 아카이브 완료
- ^ "California Occupational Guide Number 22: Chemists". Calmis.ca.gov. 29 October 1999. Archived from the original on 10 June 2011. Retrieved 12 June 2011.
- ^ "General Chemistry Online – Companion Notes: Matter". Antoine.frostburg.edu. Archived from the original on 24 June 2011. Retrieved 12 June 2011.
- ^ Armstrong, James (2012). General, Organic, and Biochemistry: An Applied Approach. Brooks/Cole. p. 48. ISBN 978-0-534-49349-3.
- ^ Burrows et al. 2008, 페이지 13. 오류::
- ^ a b Housecroft & Sharpe 2008, 페이지 2
- ^ 버로우즈 외 2009년, 페이지 110
- ^ Burrows et al. 2008, 페이지 12. 오류::
- ^ "IUPAC Nomenclature of Organic Chemistry". Acdlabs.com. Archived from the original on 8 June 2011. Retrieved 12 June 2011.
- ^ Connelly, Neil G.; Damhus, Ture; Hartshom, Richard M.; Hutton, Alan T. (2005). Nomenclature of Inorganic Chemistry IUPAC Recommendations 2005. Cambridge, United Kingdom: Royal Society of Chemistry Publishing / IUPAC. ISBN 0854044388. Retrieved 13 June 2022.
- ^ Hill, J.W.; Petrucci, R.H.; McCreary, T.W.; Perry, S.S. (2005). General Chemistry (4th ed.). Upper Saddle River, New Jersey: Pearson Prentice Hall. p. 37.
- ^ M.M. Avedesian; Hugh Baker. Magnesium and Magnesium Alloys. ASM International. p. 59.
- ^ Burrows et al. 2008, 페이지 16. 오류::
- ^ 앳킨스 & 드 폴라 2009, 9페이지
- ^ Visionlearning. "Chemical Bonding by Anthony Carpi, Ph". visionlearning. Archived from the original on 17 July 2011. Retrieved 12 June 2011.
- ^ 라일리, 마이클(2007).기계적 힘이 화학 반응을 유도함 2014년 8월 14일 Wayback Machine, NewScientist.com 뉴스 서비스, Reilly에서 보관
- ^ Changing of Matter 2007년 4월 28일 Wayback Machine에서 아카이브– Chemforkids.com
- ^ 2007년 10월 12일 Wayback Machine에서의 화학반응식 아카이브– IUPAC Goldbook
- ^ Gold Book Chemical Reaction 2007년 3월 4일 Wayback Machine IUPAC Goldbook에 보관
- ^ "The Lewis Acid–Base Concept". Apsidium. 19 May 2003. Archived from the original on 27 May 2008. Retrieved 31 July 2010.
- ^ "History of Acidity". Bbc.co.uk. 27 May 2004. Archived from the original on 27 February 2009. Retrieved 12 June 2011.
- ^ "Selected Classic Papers from the History of Chemistry". Archived from the original on 17 September 2018. Retrieved 8 October 2017.
- ^ Boyle, Robert (1661). The Sceptical Chymist. New York: Dover Publications, Inc. (reprint). ISBN 978-0-486-42825-3.
- ^ Glaser, Christopher (1663). Traite de la chymie. Paris. 다음 항목에 있습니다.
- ^ Stahl, George, E. (1730). Philosophical Principles of Universal Chemistry. London.
- ^ 듀마, J.B. (1837년)Affinite(강연주), vii, p 4. Statique chimique, 파리: Academie des Sciences
- ^ Pauling, Linus (1947). General Chemistry. Dover Publications, Inc. ISBN 978-0-486-65622-9.
- ^ Chang, Raymond (1998). Chemistry, 6th Ed. New York: McGraw Hill. ISBN 978-0-07-115221-1.
- ^ 최초 화학자 Wayback Machine에서 2015년 1월 8일 아카이브, 1999년 2월 13일 New Scientist
- ^ Barnes, Ruth (2004). Textiles in Indian Ocean Societies. Routledge. p. 1. ISBN 9780415297660.
- ^ Lucretius. "de Rerum Natura (On the Nature of Things)". The Internet Classics Archive. Massachusetts Institute of Technology. Archived from the original on 29 June 2011. Retrieved 9 January 2007.
- ^ Simpson, David (29 June 2005). "Lucretius (c. 99–55 BCE)". The Internet History of Philosophy. Archived from the original on 28 May 2010. Retrieved 10 November 2020.
- ^ Strodach, George K. (2012). The Art of Happiness. New York: Penguin Classics. pp. 7–8. ISBN 978-0-14-310721-7.
- ^ 제12장; 페이지 291–2 참조
- ^ Long, A. A.; D. N. Sedley (1987). "Epicureanism: The principals of conservation". The Hellenistic Philosophers. Vol 1: Translations of the principal sources with philosophical commentary. Cambridge: Cambridge University Press. pp. 25–26. ISBN 978-0-521-27556-9.
- ^ "International Year of Chemistry – The History of Chemistry". G.I.T. Laboratory Journal Europe. 25 February 2011. Archived from the original on 15 June 2013. Retrieved 12 March 2013.
- ^ Bryan H. Bunch & Alexander Hellemans (2004). The History of Science and Technology. Houghton Mifflin Harcourt. p. 88. ISBN 978-0-618-22123-3.
- ^ Morris Kline(1985) 비수학자용 수학 2015년 9월 5일 웨이백 머신에 보관.Courier Dover 출판물, 페이지 284ISBN 0-486-24823-2
- ^ 마르셀랭 베르텔로, 앙시앵 알키미스테스 컬렉션 (3권, 파리, 1887–1888, 페이지 161); F.셔우드 테일러, "그리스 연금술의 기원", 앰빅스 1(1937), 40.
- ^ Stapleton, Henry E.와 Azo, R. F.와 Hidayat Husain, M. 1927.10세기 이라크와 페르시아의 화학."D" in: 아시아 벵골 협회 회고록, vol.VII, No. 6, 페이지 317-418, 페이지 338-340; 크라우스, 파울 1942-1943.이븐 헤이옌: 이슬람의 역사과학자들에 대한 공헌. I. Le corpus des écrits jébiriens. II. Jabir et la science greque.카이로: 프랑스 오르세올로지 오리엔탈 연구소, vol.II, 페이지 41~42.
- ^ 다름슈타터, 에른스트"Liber Misericordiae Geber: Eine lateinische übersetzung des gröβeren Kitb l-ra"ma", Archiv für Geschichte der Medizin, 181-197페이지, 마르셀린."Archéologie et Histoire des sciences", 프랑스 아카데미 des sciences de l'Institut de France, 49, 1906, 페이지 308–363; Forster, Regula도 참조하십시오."자비르 b. 2021년 4월 18일 Wayback Machine, 백과사전, 3에 보관.
- ^ Newman, William R. "New Light on the Identity of Geber", Sudhoffs Archiv, 1985, 69, 페이지 76-90, Newman, William R.Pseudo-Geber의 Summa perfectionis: 비평판, 번역 및 연구, Leiden: Bril, 1991, 페이지 57–103.그것은 아마드 Y에 의해 주장되어 왔다.사이비 게버의 저작물은 실제로 아랍어에서 라틴어로 번역되었다(알 하산, 아마드 Y 참조). "수마와 게버의 라틴 저작물의 아랍어 기원: 아랍어 출처에 근거한 베르텔로트, 루스카, 뉴먼의 반박"알-하산알 키미야어 연구: 라틴어와 아랍어의 연금술과 화학에 대한 비판적 문제.힐데스하임:Georg Olms Verlag, 2009년, 53–104페이지, 온라인 아카이브 2021년 2월 25일 웨이백 머신에서도 이용 가능).
- ^ Marmura, Michael E.; Nasr, Seyyed Hossein (1965). "An Introduction to Islamic Cosmological Doctrines. Conceptions of Nature and Methods Used for Its Study by the Ikhwan Al-Safa'an, Al-Biruni, and Ibn Sina by Seyyed Hossein Nasr". Speculum. 40 (4): 744–746. doi:10.2307/2851429. JSTOR 2851429.
- ^ 로버트 브리폴트(1938).'인류의 창조', 196-197페이지
- ^ "로버트 보일, 현대 화학의 창시자" 해리 수틴 (2011)
- ^ "History – Robert Boyle (1627–1691)". BBC. Archived from the original on 9 January 2011. Retrieved 12 June 2011.
- ^ Eagle, Cassandra T.; Jennifer Sloan (1998). "Marie Anne Paulze Lavoisier: The Mother of Modern Chemistry". The Chemical Educator. 3 (5): 1–18. doi:10.1007/s00897980249a. S2CID 97557390.
- ^ Mi Gyung Kim (2003). Affinity, that Elusive Dream: A Genealogy of the Chemical Revolution. MIT Press. p. 440. ISBN 978-0-262-11273-4.
- ^ Davy, Humphry (1808). "On some new Phenomena of Chemical Changes produced by Electricity, particularly the Decomposition of the fixed Alkalies, and the Exhibition of the new Substances, which constitute their Bases". Philosophical Transactions of the Royal Society. 98: 1–45. doi:10.1098/rstl.1808.0001. Archived from the original on 18 April 2021. Retrieved 30 November 2020.
- ^ Chemistry 412 course notes. "A Brief History of the Development of Periodic Table". Western Oregon University. Archived from the original on 9 February 2020. Retrieved 20 July 2015.
- ^ 2015년 9월 24일 Wayback Machine에 보관된 메모: "...Mendeleev가 살아본 적이 없다면 주기율표를 사용할 것입니다."
- ^ Winter, Mark. "WebElements: the periodic table on the web". The University of Sheffield. Archived from the original on 4 January 2014. Retrieved 27 January 2014.
- ^ "Julius Lothar Meyer and Dmitri Ivanovich Mendeleev". Science History Institute. June 2016. Archived from the original on 21 March 2018. Retrieved 20 March 2018.
- ^ 무엇이 이러한 가족의 모습을 자연 속에서 닮게 하는가?1860년대에는 모두가 그것에 대해 머리를 긁적거리고 있었고, 몇몇 과학자들은 다소 비슷한 답을 찾기 위해 움직였다.가장 의기양양하게 문제를 해결한 사람은 드미트리 이바노비치 멘델레예프라는 러시아 청년으로 1859년 벨리치카에 있는 소금 광산을 방문했습니다.
- ^ "Chemistry". Chemistry2011.org. Archived from the original on 8 October 2011. Retrieved 10 March 2012.
- ^ Ihde, Aaron John (1984). The Development of Modern Chemistry. Courier Dover Publications. p. 164. ISBN 978-0-486-64235-2.
- ^ W.G. Laidlaw; D.E. Ryan; Gary Horlick; H.C. Clark; Josef Takats; Martin Cowie; R.U. Lemieux (10 December 1986). "Chemistry Subdisciplines". The Canadian Encyclopedia. Archived from the original on 12 March 2012. Retrieved 12 June 2011.
- ^ Herbst, Eric (12 May 2005). "Chemistry of Star-Forming Regions". Journal of Physical Chemistry A. 109 (18): 4017–4029. Bibcode:2005JPCA..109.4017H. doi:10.1021/jp050461c. PMID 16833724.
- ^ Tullo, Alexander H. (28 July 2014). "C&EN's Global Top 50 Chemical Firms For 2014". Chemical & Engineering News. American Chemical Society. Archived from the original on 26 August 2014. Retrieved 22 August 2014.
참고 문헌
- Atkins, Peter; de Paula, Julio (2009) [1992]. Elements of Physical Chemistry (5th ed.). New York: Oxford University Press. ISBN 978-0-19-922672-6.
- Burrows, Andrew; Holman, John; Parsons, Andrew; Pilling, Gwen; Price, Gareth (2009). Chemistry3. Italy: Oxford University Press. ISBN 978-0-19-927789-6.
- Housecroft, Catherine E.; Sharpe, Alan G. (2008) [2001]. Inorganic Chemistry (3rd ed.). Harlow, Essex: Pearson Education. ISBN 978-0-13-175553-6.
추가 정보
통속적인 독서
- 앳킨스, P.W. 갈릴레오의 손가락 (Oxford University Press) ISBN 0-19-860941-8
- 앳킨스, P.W. 앳킨스의 분자 (Cambridge University Press) ISBN 0-521-82397-8
- 킨, 샘사라진 스푼 – 주기율표(블랙스완) 런던, 2010 ISBN 978-0-552-77750-6
- Levi, Primo The Periodic Table (Penguin Books) [1975] 이탈리아어 번역: Raymond Rosental (1984) ISBN 978-0-14-13944-7
- Stwertka, A. 요소 가이드 (Oxford University Press) ISBN 0-19-515027-9
- "Dictionary of the History of Ideas". Archived from the original on 10 March 2008.
- . Encyclopædia Britannica. Vol. 6 (11th ed.). 1911. pp. 33–76.
학부 입문 교재
- 앳킨스, P.W., 오버튼, T., 루크, J., 웰러, M. 및 암스트롱.슈라이버와 앳킨스 무기화학 (제4판) 2006년 (옥스포드 대학 출판부) ISBN 0-19-926463-5
- 장, 레이먼드화학 6학번보스턴: 제임스 M.스미스, 1998년ISBN 0-07-115221-0.
- Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (1st ed.). Oxford University Press. ISBN 978-0-19-850346-0.
- Voet과 Voet.생화학(와일리) ISBN 0-471-58651-X
고급 학부용 또는 대학원용 교재
- 앳킨스, P. W. 물리화학 (Oxford University Press) ISBN 0-19-879285-9
- 앳킨스, P. W. 등분자 양자역학 (Oxford University Press)
- McWeeny, R. Coulson's Valence (Oxford 과학 출판물) ISBN 0-19-855144-4
- 폴링, L.화학결합의 성질 (코넬대학교 출판부) ISBN 0-8014-0333-2
- 폴링, L., 윌슨, E.B.화학에 응용하는 양자역학(도버 출판물) ISBN 0-486-64871-0
- 스마트와 무어솔리드 스테이트 화학: 개요(채프만 및 홀) ISBN 0-412-40040-5
- Stephenson, G. 과학 학생을 위한 수학적 방법(롱맨) ISBN 0-582-44416-0

















