마르코프니코프의 법칙
Markovnikov's rule유기화학에서는 마르코브니코프의 법칙이나 마르코니코프의 법칙이 어떤 부가반응의 결과를 기술하고 있다.이 규칙은 1870년 러시아의 화학자 블라디미르 마르코브니코프에 의해 공식화되었다.[1][2][3]
설명
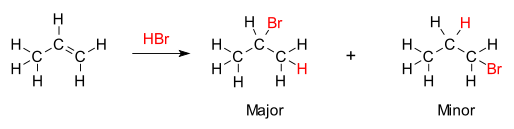
이 규칙은 비대칭 알켄에 프로틴산 HX나 다른 극성 시약을 첨가하면 산 수소(H)나 전기성 부분이 더 많은 수소 대체물로 탄소에 부착되고, 할로겐화(X)군이나 전기화 부분이 알킬 대체물로 탄소에 부착된다는 것이다.이는 마르코브니코프의 원래 정의와는 대조적인 것으로, 수소 원자가 가장 적은 탄소에는 X 성분을 첨가하고, 수소 원자는 가장 많은 수소 원자를 가진 탄소에는 첨가한다는 규칙이 명시되어 있다.[4]
알켄이 물과 반응하여 탄화수소의 형성을 수반하는 알코올을 형성할 때도 마찬가지다.히드록실 그룹(OH)은 탄소-탄소 결합 수가 많은 탄소에 결합하는 반면, 수소 결합은 탄소-수소 결합이 더 많은 이중 결합의 다른 쪽 끝에 있는 탄소에 결합한다.
마르코브니코프 규칙의 화학적 근거는 첨가 과정 중에 가장 안정적인 탄수화물 형성이다.알켄의 한 탄소 원자에 수소 이온을 첨가하면 다른 탄소 원자에 양전하를 생성하여 탄수화물 중간을 형성한다.탄수화물은 대체량이 많을수록 유도 및 초융합으로 안정성이 높다.첨가 반응의 주요 산물은 보다 안정된 중간에서 형성된 것이다.따라서 알켄에 HX(X가 H보다 어떤 원자가 더 전기적임)를 첨가한 주요 생산물은 수소 원자가 덜 대체된 위치에 있고 X는 더 대체된 위치에 있다.그러나 다른 하나는 대체되지 않고 안정성이 떨어지는 탄수화물은 어느 정도의 농도에서 여전히 형성될 것이며, 그 반대인 X의 결합 부착을 가진 경제품으로 진행될 것이다.
반 마르코브니코프 반응
탄수화물 중간을 포함하지 않는 메커니즘은 마르코브니코프의 규칙에 의해 지시되지 않은 다른 섭생성을 가진 다른 메커니즘을 통해 반응할 수 있다.할로겐은 마코브니코프 반응과는 정반대로, 할로겐은 덜 대체된 탄소에 더하기 때문에 이러한 반응은 반 마르코브니코프라고 한다.
마코브니코프 방지 규칙은 과산화 벤조일 또는 과산화수소가 존재하는 상태에서 이소부틸렌에 브롬화수소를 첨가하여 설명할 수 있다.대체된 연골에 대한 HBr의 반응은 자유방사선 첨가 연구에서 원형이었다.초기 화학자들은 마르코브니코프 반응 제품에 대한 마르코브니코프 반응 제품의 비율이 변동하는 이유는 과산화물과 같은 자유 급진적 이온화 물질의 예상치 못한 존재 때문이라는 것을 발견했다.과산화물 내 O-O 결합이 상대적으로 약하다는 설명이다.빛, 열, 때로는 스스로 작용하는 것만으로 O-O 결합은 분열되어 2개의 급진파를 형성할 수 있다.그런 다음 급진적인 집단은 HBr과 상호 작용하여 Br actical을 만들 수 있고, 그 다음 이중 결합과 반응한다.브로민 원자는 상대적으로 크기 때문에, 이 상호작용은 탄소와 브로민 급진간의 정적인 상호작용을 덜 만들기 때문에 가장 적게 대체된 탄소와 마주하고 반응할 가능성이 더 높다.나아가 양전하 종과 비슷하게, 비장애 전자가 더 대체적인 위치에 있을 때 급진적인 종은 가장 안정적이다.급진적 중간은 초점화에 의해 안정된다.보다 대체적인 위치에서는 더 많은 탄소-수소 결합이 급진파의 부족한 분자 궤도(traval arbit arbit arbit arbit)에 맞춰져 있다.이는 초점화 효과가 더 크기 때문에 그 위치가 더 유리하다는 것을 의미한다.[5]이 경우 단자 탄소는 2차 첨가 제품 대신 1차 첨가 제품을 생산하는 반응 물질이다.
해밀턴과 니스위츠가 저에너지 다이오드의 방향성 분자와 빛 에너지를 활용해 알켄을 양이온 급진으로 바꾸는 새로운 안티 마코브니코프 첨가 방법을 설명한 것이다.[6][7]
마코브니코프 반대 행동은 연금술에 대한 추가보다 더 많은 화학 반응으로 확장된다.안티 마르코브니코프 작용은 아세트토페논을 제공하는 오릭 촉매에 의한 페닐아세틸렌 수화에서 관찰된다. 특별한 루테늄 촉매로[8] 다른 레지오이소머 2-페닐아세트알데히드를 제공한다.[9]
반 마르코브니코프 행동도 특정 재배열 반응에서 나타날 수 있다.티타늄으로 ()IV) chloride-catalyzed formal nucleophilic substitution at enantiopure 1 in the scheme below, two products are formed – 2a and 2b Due to the two chiral centers in the target molecule, the carbon carrying chlorine and the carbon carrying the methyl and acetoxyethyl group, four different compounds are to be formed: 1R,2R- (drawn as 2b) 1R,2S- 1S,2R-(2a로 표시) 및 1S,2S- 따라서 표시된 두 구조물은 모두 D-형과 L형식으로 존재할 것이다.:[10]
이 제품 분포는 1에서 히드록시 그룹의 상실이 3차 탄수화물 A를 제공한다고 가정하여 합리화할 수 있으며, 이는 외관상 안정성이 떨어지는 2차 탄수화물 B로 재배열된다.염소는 관찰된 이소머의 혼합으로 이어지는 두 얼굴에서 이 중심에 접근할 수 있다.
마르코브니코프 반(反) 마코브니코프 추가의 또 다른 주목할 만한 예는 하이드로보레이션이다.
참고 항목
참조
- ^ W. Markownikoff (1870). "Ueber die Abhängigkeit der verschiedenen Vertretbarkeit des Radicalwasserstoffs in den isomeren Buttersäuren". Annalen der Pharmacie. 153 (1): 228–59. doi:10.1002/jlac.18701530204.
- ^ Hughes, Peter (2006). "Was Markovnikov's Rule an Inspired Guess?". Journal of Chemical Education. 83 (8): 1152. Bibcode:2006JChEd..83.1152H. doi:10.1021/ed083p1152.
- ^ Lewis, David E. (2021). "The Logic Behind Markovnikov's Rule: Was It an Inspired Guess? …No!". Angewandte Chemie International Edition. 60 (9): 4412–4421. doi:10.1002/anie.2020082282.
- ^ McMurry, John. "Section 7.8: Orientation of Electrophilic Reactions: Markovnikov's Rule". Organic Chemistry (8th ed.). p. 240. ISBN 9780840054548.
- ^ Clayden, Jonathan (2012). Organic Chemistry. Oxford University Press. pp. 977, 985.
- ^ Drahl, Carmen. "Light-Driven Reaction Modifies Double Bonds With Unconventional Selectivity - April 15, 2013 Issue - Vol. 91 Issue 15 - Chemical & Engineering News". cen.acs.org.
- ^ Hamilton, David S.; Nicewicz, David A. (2012). "Direct Catalytic Anti-Markovnikov Hydroetherification of Alkenols". Journal of the American Chemical Society. 134 (45): 18577–18580. doi:10.1021/ja309635w. PMC 3513336. PMID 23113557.
- ^ Cp 및 나프탈렌 리간드와 두 번째 부피가 큰 피리딘 리간드를 이용한 루테노센의 현장반응에 기초한 촉매계
- ^ Labonne, Aurélie; Kribber, Thomas; Hintermann, Lukas (2006). "Highly Active in Situ Catalysts for Anti-Markovnikov Hydration of Terminal Alkynes". Organic Letters. 8 (25): 5853–6. doi:10.1021/ol062455k. PMID 17134289.
- ^ Nishizawa, Mugio; Asai, Yumiko; Imagawa, Hiroshi (2006). "TiCl4 Induced Anti-Markovnikov Rearrangement". Organic Letters. 8 (25): 5793–6. doi:10.1021/ol062337x. PMID 17134274..