생물직교화학
Bioorthogonal chemistry생물직교화학이라는 용어는 고유의 생화학적 과정을 방해하지 않고 생물계 내부에서 일어날 수 있는 모든 화학적 반응을 말합니다.[1][2][3]그 용어는 캐롤린 R에 의해 만들어졌습니다. 2003년의 베르토지.[4][5]생체직교반응의 개념은 도입 이후 세포 독성이 없는 생체 시스템에서 글리칸, 단백질,[6] 지질[7] 등 생체 분자를 실시간으로 연구할 수 있게 했습니다.아지드와 시클로틸린 사이의 1,3-이극 사이클로딩(동이 없는 클릭 화학으로도 지칭됨),[8] 니트론과 시클로틸린 사이의 1,3-이극 사이클로딩,[9] 알데하이드와 케톤으로부터의 옥심/하이드라존 형성,[10] 테트라진 결찰,[11] 아이소크를 포함한 생물학적 직교성의 요건을 충족시키는 많은 화학적 결찰 전략이 개발되었습니다.야나이드 기반의 클릭 반응,[12] 그리고 가장 최근의 쿼드리시클레인 결찰.[13]
생물직교화학의 사용은 일반적으로 두 단계로 진행됩니다.첫째, 세포 기질은 생물직교 작용기(chemical reporter)로 변형되어 세포에 도입되고; 기질은 대사물질, 효소 억제제 등을 포함하는 것을 특징으로 하는 세포.화학 신고자는 생체 활성에 영향을 주지 않기 위해 기판의 구조를 급격하게 변경해서는 안 됩니다.두 번째로, 상보적 작용기를 포함하는 프로브가 도입되어 기판을 반응시키고 표지합니다.

무동 클릭 화학과 같은 효과적인 생체 직교 반응이 개발되었지만, 새로운 반응의 개발은 동일한 생체 시스템에서 여러 방법의 라벨링을 사용할 수 있도록 라벨링에 대한 직교 방법을 계속 생성합니다.베르토지는 클릭 화학과 생물직교 화학을 발전시킨 공로로 2022년 노벨 화학상을 수상했습니다.[14]
어원
생물직교라는 단어는 그리스 생물학에서 "살아있는" 것과 직각인 "직각형"에서 유래했습니다.따라서 말 그대로 생물계에 수직으로 작용하여 방해가 되지 않는 반응입니다.
생물학적 직교성 요건
생물학적 직교로 간주되기 위해서는 반응이 다음과 같은 몇 가지 요건을 충족해야 합니다.
- 선택성:생물학적 화합물과의 부반응을 피하기 위해서는 내생 작용기 사이에서 반응이 선택적이어야 합니다.
- 생물학적 불활성도:반응성 파트너와 그에 따른 연관성은 연구 중인 유기체의 고유한 화학적 기능을 방해할 수 있는 어떤 반응성 모드도 가지고 있어서는 안 됩니다.
- 화학적 불활성도:공유 결합은 생물학적 반응에 대해 강하고 불활성이어야 합니다.
- 운동학:프로브 대사 및 클리어런스 전에 공유결찰이 이루어지도록 반응이 빨라야 합니다.반응은 세포 과정의 시간 척도(분)에 따라 빨라야 덜 풍부한 종의 작은 신호를 감소시킬 수 있는 반응 경쟁을 방지할 수 있습니다.또한 신속한 반응은 동적 프로세스를 정확하게 추적하기 위해 필요한 빠른 응답을 제공합니다.
- 반응 생체적합성:반응은 독성이 없어야 하며 pH, 수성 환경 및 온도를 고려한 생물학적 조건에서 작동해야 합니다.약동학은 생물 직교 화학이 살아있는 동물 모델로 확장되면서 점점 더 큰 관심사가 되고 있습니다.
- 접근 가능한 엔지니어링:화학 기자는 대사 또는 단백질 공학의 어떤 형태를 통해 생체 분자에 통합될 수 있어야 합니다.최적으로, 작용 그룹 중 하나는 또한 매우 작아서 고유의 행동을 방해하지 않습니다.
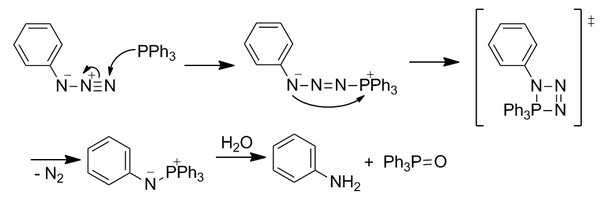
스타우딩거 결찰
스타우딩거 결찰은 2000년 베르토지 그룹에 의해 개발된 반응으로, 아지드와 트리아릴포스핀의 고전적인 스타우딩거 반응을 기반으로 합니다.[15]비록 더 이상 널리 사용되지는 않지만 완전히 비생물학적 작용기를 가진 첫 반응으로 생물직교화학 분야를 시작했습니다.스타우딩거 결찰은 살아있는 세포와 살아있는 쥐 모두에게 사용되어 왔습니다.[5]
생물 직교성
아지드는 포스핀과 같은 부드러운 친핵체를 선호하는 부드러운 전기영동체로 작용할 수 있습니다.이것은 일반적으로 단단한 친핵체인 대부분의 생물학적 친핵체와 대조적입니다.이 반응은 방수 조건에서 선택적으로 진행되어 안정적인 생성물을 생성합니다.
포스핀은 생체계에 전혀 존재하지 않으며 가벼운 감소 가능성에도 불구하고 이황화 결합을 감소시키지 않습니다.아지드는 아지도티미딘과 같은 FDA 승인 의약품에서 생체 적합성이 있는 것으로 나타났으며, 가교제로서 다른 용도를 통해서도 가능했습니다.게다가, 그들의 작은 크기는 세포 대사 경로를 통해 생체 분자에 쉽게 포함되도록 합니다.
매커니즘
고전적 스타우딩거 반응
친핵성 포스핀은 친핵성 말단 질소에서 아지드화물을 공격합니다.4원 전이 상태를 통해 N은2 손실되어 아자일라이드를 형성합니다.불안정한 일라이드는 가수분해되어 포스핀 옥사이드와 1차 아민을 형성합니다.그러나 가수분해가 아자일라이드의 공유결합을 깨뜨리기 때문에 이 반응이 즉각적으로 생물직교적이지는 않습니다.
스타우딩거 결찰
반응은 아릴 고리 중 하나에 인 원자에 대한 에스테르기 오르쏘를 포함하도록 변형되어 에스터를 위치시켜 국부적인 농도를 증가시킴으로써 즉각적인 가수분해를 능가하기 위해 새로운 반응성 경로를 통해 아자일라이드를 유도하였습니다.아지드에 대한 최초의 친핵성 공격은 속도 제한 단계입니다.일라이드는 분자 내 고리화를 통해 친전자성 에스테르 트랩과 반응하여 5원 고리를 형성합니다.이 고리는 가수분해를 거쳐 안정한 아미드 결합을 형성합니다.
한계
포스핀 시약은 생물계에서 서서히 공기 산화를 겪습니다.또한, 그들은 사이토크롬 P450 효소에 의해 시험관 내에서 대사될 가능성이 있습니다.
반응의 속도는 약 0.0020−1 M•s의−1 2차 속도 상수로 느립니다.포스핀에 전자 공여기를 추가하여 친핵성 공격률을 증가시키려는 시도는 운동학을 향상시켰지만 공기 산화율을 증가시켰습니다.
열악한 운동학에서는 높은 농도의 포스핀을 사용해야 하므로 이미징 애플리케이션에서 높은 배경 신호에 문제가 발생합니다.플루오레세인과 루시퍼린을 기반으로 한 플루오제닉 포스핀 시약의 개발을 통해 배경이 높은 문제를 해결하려는 시도가 있었지만, 고유동역학은 한계로 남아 있습니다.[16]
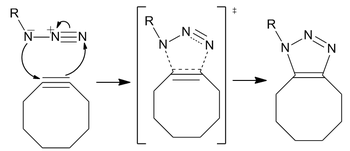
무동 클릭 화학
무동 클릭 화학은 칼 배리 샤플리스 등의 연구를 기반으로 카롤린 베르토지가 아지드 알킨 후이스겐 사이클로딩의 활성화된 변형으로 처음 개발한 생체 직교 반응입니다.Cu-free click chemistry는 CuAAC와 달리 세포독성 구리 촉매를 제거함으로써 생물직교로 변형되어 살아있는 세포 독성 없이 신속하게 반응이 진행될 수 있습니다.구리 대신에, 그 반응은 변형 촉진된 알킨-아지드 사이클로디션(SPAAC)입니다.스타우딩거 라이그에 대한 더 빠른 대안으로 개발되었으며, 초기 세대는 60배 이상 빠르게 반응했습니다.반응의 생물 직교성은 Cu-free 클릭 반응을 배양된 세포, 살아있는 제브라피쉬 및 마우스에 적용할 수 있게 했습니다.
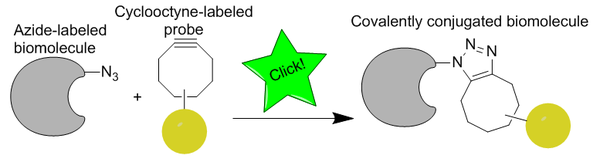
구리독성
고전적인 구리 촉매 아지드-알킨 사이클로딩은 생체 접합을 위해 매우 빠르고 효과적인 클릭 반응이었지만, Cu(I) 이온의 독성 때문에 살아있는 세포에서 사용하기에 적합하지 않습니다.독성은 구리 촉매에 의해 형성된 활성 산소종의 산화적 손상 때문입니다.구리 복합체는 세포 대사의 변화를 유도하고 세포가 차지하는 것으로 밝혀졌습니다.
생체 분자 손상을 방지하고 체외 적용에서 제거를 용이하게 하는 리간드의 일부 개발이 있었습니다.그러나 복합체의 다른 리간드 환경이 여전히 신진대사와 흡수에 영향을 미쳐 세포 기능에 달갑지 않은 섭동을 일으킬 수 있다는 것이 밝혀졌습니다.[17]
생물 직교성
아지드 그룹은 매우 작고(세포 투과성에 유리하고 섭동을 피하므로), 대사적으로 안정하며, 세포에 자연적으로 존재하지 않으므로 경쟁하는 생물학적 부반응이 없기 때문에 특히 생물직교적입니다.아지드는 반응에 이용할 수 있는 가장 반응성이 높은 1,3-다이폴은 아니지만, 부작용이 상대적으로 부족하고 일반적인 합성 조건에서 안정성이 좋기 때문에 선호됩니다.[18]알킨은 그렇게 작지는 않지만, 생체 내 라벨링에 필요한 안정성과 직교성을 여전히 가지고 있습니다.사이클로톨리엔은 전통적으로 라벨링 연구를 위한 가장 일반적인 사이클로알카인이며, 이는 가장 작은 안정적인 알킬링이기 때문입니다.
매커니즘
반응은 비동기적이고 일치된 주기적 이동의 한 종류인 표준 1,3-dipolar cycload dition으로 진행됩니다.1,3-다이폴의 양가적 특성은 아지드 상의 친전자성 또는 친핵성 중심을 식별하는 것을 불가능하게 만들어야 하며 따라서 순환 전자 흐름의 방향은 의미가 없습니다.[p] 그러나 계산 결과 질소 사이의 전자 분포가 가장 안쪽에 있는 질소 원자가 가장 큰 음전하를 띠는 것으로 나타났습니다.[19]
지역선택성
비록 이 반응이 트라이아졸의 지역 이성질체 혼합물을 생성하지만, 반응에서 지역 선택성의 부족은 대부분의 현재 응용 분야에서 주요한 관심사가 아닙니다.특히 변형된 사이클로틴을 합성하는 합성 난이도(말단 알킨 첨가에 비해)를 고려할 때 구리 촉매 Huisgen 사이클로딩에 의해 더 특정적이고 덜 생물학적인 요구사항이 가장 잘 충족됩니다.
사이클로틴의 발달
| 사이클로틴 | 2차율상수(Ms−1−1) |
|---|---|
| OCT | 0.0024 |
| 알로 | 0.0013 |
| MOFO | 0.0043 |
| 디포 | 0.076 |
| 디보 | 0.057 |
| 바라크 | 0.96 |
| DIBAC(아디보) | 0.31 |
| 디맥 | 0.0030 |

OCT는 Cu-free click chemistry를 위해 개발된 최초의 사이클로틴입니다.선형 알킨은 생리적 온도에서 반응성이 없는 반면 OCT는 독성을 보이지 않으면서 생물학적 조건에서 아지드와 쉽게 반응할 수 있었습니다.그러나, 이것은 수용성이 좋지 않았고, 운동학은 스타우딩거 결찰을 통해 거의 개선되지 않았습니다.ALO(아릴리스 옥틴)는 수용성을 향상시키기 위해 개발되었지만, 여전히 낮은 속도론을 가지고 있었습니다.
모노플루오린화(MOFO) 및 디플루오린화(DIFO) 사이클로틴은 양성자 위치에 전자 인출 불소 치환기를 추가하여 비율을 증가시키기 위해 생성되었습니다.불소는 합성 접근성과 생물학적 불활성 측면에서 좋은 전자인출 그룹입니다.특히, 생물학적 친핵체와 부반응할 수 있는 친전자성 마이클 수용체를 형성할 수 없습니다.[8]DIBO(dibenzocyclooctyne)는 두 개의 아릴 고리에 대한 융합으로 개발되어 매우 높은 변형률과 왜곡 에너지의 감소를 초래했습니다.비아릴 치환은 고리 변형률을 증가시키고 알킨과의 컨쥬게이션(conjugation)을 제공하여 반응성을 향상시키는 것이 제안되었습니다.계산 결과에 따르면 모노아릴 치환이 입체 충돌(아지드 분자와의 충돌)과 변형률 사이의 최적 균형을 제공할 것으로 예측되었지만 모노아릴 관련 제품은 불안정한 것으로 나타났습니다.[20]
BARAC (biarylazacycloctynone)는 왜곡에 의한 비율을 증가시키기 위해 sp-like2 center를 추가하는 아미드 결합을 추가했습니다.아미드 공명은 불안정한 분자로 이어질 수 있는 추가적인 비포화를 만들지 않고 추가적인 변형을 일으키는데 기여합니다.또한, 시클로로틸린 고리에 헤테로 원자를 추가하면 분자의 용해도와 약동학이 향상됩니다.BARAC는 배경을 줄이기 위해 과잉 프로브를 씻어낼 필요가 없을 정도로 충분한 속도(및 감도)를 가지고 있습니다.이를 통해 실시간 영상 촬영이나 동물 전체 영상 촬영처럼 세척이 불가능한 상황에서 매우 유용합니다.BARAC는 매우 유용하지만, 낮은 안정성으로 인해 빛과 산소로부터 보호하기 위해 0°C에서 보관해야 합니다.[21]
DIBAC/ADIBO를 생성하기 위해 BARAC에 대한 추가 조정 변형을 수행하여 원위 고리 변형을 추가하고 알킨 주변의 스테릭을 감소시켜 반응성을 더욱 증가시켰습니다.하이드록실기가 케톤으로 전환된 케토-다이보는 고리형태의 변화로 인해 속도가 3배 증가합니다.불안정으로 인해 디플루오로벤조시클로틴(DIFBO)을 만들려는 시도가 실패했습니다.
생체내 마우스 연구에서 DIFO의 문제는 생체직교 반응을 생성하는 어려움을 보여줍니다.DIFO는 세포 표지에 극도로 반응성이 있었지만 혈청 알부민과의 결합으로 인해 마우스 연구에서 저조한 성과를 보였습니다.시클로틸린의 소수성은 막과 혈청 단백질에 의한 격리를 촉진하여 생체이용가능 농도를 감소시킵니다.이에 대응하여 DIMAC(dimethoxyazacycloltyne)는 수용성, 극성 및 약동학을 증가시키기 위해 개발되었지만 마우스 모델의 생물직교 라벨링에 대한 노력은 여전히 개발 중에 있습니다.[22]
반응성
계산 노력은 반응을 계속 개선하는 데 중요한 역할을 한 사이클로더레이션 반응의 열역학과 운동학을 설명하는 데 필수적이었습니다.안정성을 희생하지 않고 알킨을 활성화시키기 위한 두 가지 방법: 전이 상태 에너지를 감소시키거나 반응물 안정성을 감소시키는 것.

반응물 안정성 저하:후크는[23] 아지드와 알킨을 전이 상태 기하학적 구조로 왜곡하는 데 필요한 에너지(Ed ‡)의 차이가 반응에 대한 장벽 높이를 제어한다고 제안했습니다.활성화 에너지(E ‡)는 왜곡을 불안정화하고 상호작용을 안정화하는 것(Ei ‡)의 합입니다.가장 중요한 왜곡은 알킨 왜곡의 기여도가 더 적은 아지드 작용기에서 발생합니다.그러나 반응성을 높이기 위해 쉽게 수정할 수 있는 것은 사이클로틴뿐입니다.계산된 페닐 아지드 및 아세틸렌(16.2kcal/mol) 대 시클로틴(8.0kcal/mol)의 반응 장벽은 10의6 예측 속도 증가를 가져옵니다.사이클로틸린은 왜곡 에너지(1.4kcal/mol 대 4.6kcal/mol)가 적게 필요하므로 상호작용 에너지가 더 적음에도 불구하고 활성화 에너지가 더 낮아집니다.
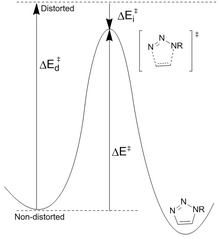
전환 상태 에너지 감소:불소와 같은 전자인출기는 LUMO 에너지를 감소시키고 HOMO-LUMO 갭을 감소시켜 증가율을 증가시킵니다.이는 전이 상태에서 아지드에서 불소화 사이클로틴으로의 전하 이동을 증가시켜 상호작용 에너지(낮은 음의 값)와 전체 활성화 에너지를 증가시킵니다.[24]LUMO의 감소는 알킨 π 도너 오비탈과 CF σ* 수용체 사이의 초결합의 결과입니다.이러한 상호작용은 왜곡될 때 결합의 증여자/수용자 능력 증가의 결과로 주로 전이 상태에서 안정화를 제공합니다.NBO 계산 결과 전이 상태 왜곡은 상호작용 에너지를 2.8kcal/mol 증가시키는 것으로 나타났습니다.
면내 π 결합이 잘 정렬되지 않기 때문에 면외 π 결합 사이의 초결합이 더 큽니다.그러나 전이 상태 벤딩을 통해 평면 내 π 결합이 상호 작용을 용이하게 하는 더 많은 안티페리플레인 배열을 가질 수 있습니다.형성되는 CN 결합으로 인해 σ*의 전자 인구 증가를 통해 추가적인 과결합 상호작용 에너지 안정화가 달성됩니다.σ* CF 결합과의 음의 초결합은 이러한 안정화 상호작용을 향상시킵니다.
지역선택성
현재 무동 클릭 화학의 이미징 응용에서 국소 선택성은 큰 문제가 아니지만, 약물 설계 또는 펩티도모메틱과 같은 분야에서 향후 응용을 방해하는 문제입니다.[25]
현재 대부분의 사이클로틴은 반응하여 국소 이성질체 혼합물을 형성합니다.[m] 계산 분석 결과, 기상 영역 선택도는 활성화 에너지에서 1,4 첨가보다 1,5 첨가를 최대 2.9kcal/mol 선호하는 것으로 계산되지만 용해 보정은 두 영역 이성질체 모두에 동일한 에너지 장벽을 초래하는 것으로 나타났습니다.DIFO의 사이클로딩에 있는 1,4 이성질체는 더 큰 쌍극자 모멘트에 의해 불리한 반면, 용해는 1,5 이성질체보다 더 강하게 안정화시켜 영역 선택성을 약화시킵니다.[24]

BCN(bicyclo[6.1.0]nonyne)과 같은 대칭 사이클로틴은 사이클로딩[26] 시 단일 영역 이성질체를 형성하며 향후 이 문제를 해결하는 역할을 할 수 있습니다.
적용들
구리가 없는 클릭 화학의 가장 광범위한 응용은 아지드 태그가 부착된 생체 분자와 영상제를 함유한 시클로틴을 사용하는 살아있는 세포 또는 동물의 생물학적 이미징입니다.
DIBO의 형광 케토 및 옥심 변형은 반응에서 형성되는 트리아졸에 의해 사이클로톨린의 형광이 퀀칭되는 플루오로 스위치 클릭 반응에 사용됩니다.[27]다른 한편으로, coumarin-conjugated cycloltynes, 예를 들어 coumB와 같은 coumarin-conjugated cycloltynesARAC는 알킨이 형광을 억제하는 반면 트리아졸 형성은 형광 양자 수율을 10배 증가시키도록 개발되었습니다.[28]
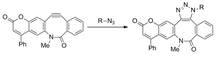
광활성화 가능한 사이클로틴을 사용하여 기판 라벨링의 공간적 및 시간적 제어를 조사했습니다.이를 통해 농도 구배의 결과로 아티팩트를 줄이기 위해 반응 전에 알킨을 평형화할 수 있습니다.마스크된 사이클로톨리엔은 어둠 속에서 아지드와 반응할 수 없지만 빛을 조사받으면 반응성 알킨이 됩니다.[29]
무동 클릭 화학은 PET 영상제 합성에 사용하기 위해 연구되고 있으며, PET 영상제는 동위원소 붕괴를 최소화하기 위해 높은 순도와 수율로 신속하게 제조되어야 하며 화합물을 투여할 수 있습니다.SPAAC의 높은 속도 상수와 생물 직교성은 모두 PET 화학에 적용할 수 있습니다.[30]
샤스키(Shasqi)라는 회사는 암 치료제에 클릭 화학을 적용하고 2상 시험에서 암 환자의 주요 후보 물질을 평가하고 있습니다.[31][32]
기타 생물직교반응
니트로네 쌍극자 사이클로딩
구리가 없는 클릭 화학은 아지드가 아닌 니트론을 1,3-다이폴로 사용하도록 적용되었으며 펩타이드의 변형에 사용되었습니다.[9]
니트론과 사이클로톨린 사이의 사이클로딩은 N-알킬화 이소옥사졸린을 형성합니다.반응 속도는 물에 의해 향상되며 니트로네의 치환에 따라 12~32 M−1•s의−1 2차 속도 상수로 매우 빠릅니다.반응이 매우 빠르지만 대사 표지를 통해 니트로네를 생체분자에 포함시키는 문제에 직면해 있습니다.라벨링은 번역 후 펩타이드 수정을 통해서만 달성되었습니다.
노르보르넨 사이클로딩
1,3-dip롤인 니트릴 옥사이드와 2극성 친밀도인 노르보르넨을 이용한 생체직교 반응으로 1,3개의 2극성 사이클로디온이 개발되었습니다.이것의 주된 용도는 자동화된 올리고뉴클레오티드 합성기에서 DNA와 RNA를 표지하고 [33]살아있는 세포가 있을 때 고분자 가교를 하는 것이었습니다.[34]
노르보르넨은 변형 촉진 반응성과 안정성 사이의 균형 때문에 두극성 동물로 선택되었습니다.이 반응의 단점으로는 강한 친전자성과 느린 반응속도론으로 인한 니트릴 산화물의 교차반응성이 있습니다.
Oxanorbornadiene 사이클로다이엔
Oxanorbornadiene 사이클로딩은 1,3-dipolar 사이클로딩에 이어 레트로-Diels Alder 반응으로 퓨란 분자가 제거된 트리아졸-결합체를 생성하는 것입니다.[35]예비 연구는 펩타이드 라벨링 실험에서 유용성을 입증했으며 SPECT 영상 화합물 생성에도 사용되었습니다.[36]최근, 옥사노르보나디엔의 사용은 촉매가 없는 상온 "아이클릭([37]iClick)" 반응에서 생물직교 반응에 대한 새로운 접근법으로 설명되었습니다.
옥사노르보나디엔의 고리 변형 및 전자 결핍은 사이클로딩 속도 제한 단계에 대한 반응성을 증가시킵니다.레트로 디엘스 알더 반응은 이후에 빠르게 일어나 안정한 1,2,3 트리아졸을 형성합니다.옥사노르보나디엔의 전자 장치를 변화시킬 수 있는 치환기에 대한 낮은 공차 및 낮은 비율(10차−4 이상의 2차 속도 상수)이 문제입니다.
테트라진 결찰
테트라진 결찰은 역요구 디엘스 알더 반응에서 트랜스-사이클로옥텐과 s-테트라진의 반응으로 질소 가스를 제거하는 레트로 디엘스 알더 반응이 뒤따르는 것입니다.[38]반응은 2차 속도 상수가 2000 M−1–s−1(9:1 메탄올/물에서)로 매우 빠르며 매우 낮은 농도에서 생체 분자를 수정할 수 있습니다.
Bach의 계산 작업에 따르면, Z-사이클로옥텐의 변형 에너지는 두 개의 초년절 상호 작용의 손실로 인해 사이클로옥탄의 12.4 kcal/mol에 비해 7.0 kcal/mol입니다.E-사이클로옥텐은 매우 뒤틀린 이중 결합을 가지고 있으며, 이로 인해 17.9 kcal/mol의 변형 에너지가 발생합니다.[39]이와 같이, 고도로 변형된 트랜스-사이클로옥텐은 반응성 디에노필로서 사용됩니다.디엔은 물과의 즉각적인 반응에 저항하기 위해 치환된 3,6-다이아릴-s-테트라진입니다.반응은2 N을 제거하고 반응의 가역성을 방지하기 위해 초기 사이클로딩에 이어 역방향 디아스 알더를 통해 진행됩니다.[11]
반응이 물에 대한 내성이 있을 뿐만 아니라, 수성 매질에서 반응 속도가 증가하는 것으로 밝혀졌습니다.또한 수성 매질에서 1−1 M•s−1 정도의 2차 속도로 노르보르넨을 디엔오필로서 사용하여 반응이 수행되었습니다.이 반응은 살아있는[40] 세포와 고분자 결합에 적용되었습니다.[41]
[4+1] 싸이클로드 에디션
이 이소시아나이드 클릭 반응은 [4+1] 사이클로딩에 이어 N의2 레트로 다이엘스 알더 제거입니다.[12]
반응은 초기 [4+1] 사이클로딩을 진행한 후 역전을 통해 열역학적 싱크를 제거하고 가역성을 방지합니다.이 제품은 3차 아민 또는 이소시아노프로파노에이트를 사용하면 안정적입니다.2차 또는 1차 이소시아나이드를 사용하면 생성물은 빠르게 가수분해되는 이민을 형성합니다.
이소시아나이드는 작은 크기, 안정성, 무독성, 포유류 시스템의 부재로 인해 선호되는 화학 기자입니다.그러나 반응이 느리고 2차 속도 상수가 10−2 M−1•s−1 정도입니다.
테트라졸 광클릭 화학
광클릭 화학은 광유도 사이클로 엘리미네이션을 이용하여 N을2 방출합니다.이것은 질소 가스의 손실을 통해 짧은 수명의 1,3 니트릴 이민 중간체를 생성하고, 이것은 피라졸린 사이클로덕트를 생성하기 위해 알켄과 함께 1,[12]3 다이폴라 사이클로딩을 거칩니다.
광 유도는 세포에 대한 광 손상을 최소화하기 위해 빛에 잠깐 노출(파장은 테트라졸 의존적)되는 과정에서 이루어집니다.반응은 수성 조건에서 향상되고 단일 레지오이소머를 생성합니다.
과도 니트릴리민은 왜곡 에너지를 감소시키는 구부러진 구조로 인해 1,3-dipolar cycload dition에 대해 높은 반응성을 갖습니다.페닐 고리에 전자 공여기로 치환하면 1,3 니트릴 이민에 놓였을 때 HOMO 에너지가 증가하고 반응 속도가 증가합니다.
이 접근법의 장점은 공간적으로 또는 시간적으로 반응을 조절할 수 있는 능력과 유전자 인코딩과 같은 간단한 생물학적 방법을 사용하여 알켄과 테트라졸 둘 다를 생체 분자에 통합할 수 있는 능력을 포함합니다.[42]또한, 테트라졸은 반응의 진행을 모니터링하기 위해 플루오로겐성으로 설계될 수 있습니다.[43]
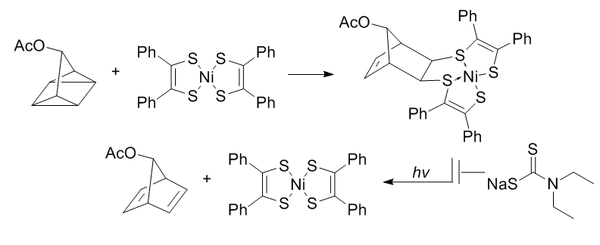
사류면 결찰
쿼드리사이클론 결찰은 고도로 변형된 쿼드리사이클론을 이용하여 π 시스템으로 [2+2+2] 사이클로딩을 수행합니다.
쿼드리시클레인은 생물학적이지 않고 생체 분자와 반응하지 않으며(완전 포화로 인해), 상대적으로 작고 매우 긴장됩니다(~80kcal/mol).그러나 실온에서는 매우 안정적이고, 생리적 pH에서는 수성 조건에서 안정적입니다.전자가 부족한 π 시스템과 선택적으로 반응할 수 있지만 단순한 알켄, 알킨 또는 사이클로틴은 반응할 수 없습니다.
비스(디티오벤질)니켈(II)는 반응성에 기초하여 후보화면 중에서 반응상대자로 선정되었습니다.노르보르나디엔으로의 빛에 의한 환원을 방지하기 위해, 디에틸디티오카르바메이트를 첨가하여 제품 내의 니켈을 킬레이트합니다.
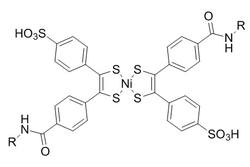
이러한 반응은 0.25 M•s의−1−1 2차 속도 상수를 갖는 수성 조건에 의해 향상됩니다. 특히 흥미로운 것은 옥심 형성과 구리가 없는 클릭 화학 모두에 생물학적으로 직교한다는 것이 증명되었다는 것입니다.
사용하다
생물직교 화학은 핵 영상 및 방사선 치료 실험의 사전 표적화를 위한 매력적인 도구입니다.[44]테트라진-사이클로옥텐 화학은 진행성 고형 종양 치료를 위한 임상 시험 중입니다.[45]
참고문헌
- ^ Sletten, Ellen M.; Bertozzi, Carolyn R. (2009). "Bioorthogonal Chemistry: Fishing for Selectivity in a Sea of Functionality". Angewandte Chemie International Edition. 48 (38): 6974–98. doi:10.1002/anie.200900942. PMC 2864149. PMID 19714693.
- ^ Prescher, Jennifer A.; Dube, Danielle H.; Bertozzi, Carolyn R. (2004). "Chemical remodelling of cell surfaces in living animals". Nature. 430 (7002): 873–7. Bibcode:2004Natur.430..873P. doi:10.1038/nature02791. PMID 15318217. S2CID 4371934.
- ^ Prescher, Jennifer A; Bertozzi, Carolyn R (2005). "Chemistry in living systems". Nature Chemical Biology. 1 (1): 13–21. doi:10.1038/nchembio0605-13. PMID 16407987. S2CID 40548615.
- ^ Hang, Howard C.; Yu, Chong; Kato, Darryl L.; Bertozzi, Carolyn R. (2003-12-09). "A metabolic labeling approach toward proteomic analysis of mucin-type O-linked glycosylation". Proceedings of the National Academy of Sciences. 100 (25): 14846–14851. Bibcode:2003PNAS..10014846H. doi:10.1073/pnas.2335201100. ISSN 0027-8424. PMC 299823. PMID 14657396.
- ^ a b Sletten, Ellen M.; Bertozzi, Carolyn R. (2011). "From Mechanism to Mouse: A Tale of Two Bioorthogonal Reactions". Accounts of Chemical Research. 44 (9): 666–676. doi:10.1021/ar200148z. PMC 3184615. PMID 21838330.
- ^ Plass, Tilman; Milles, Sigrid; Koehler, Christine; Schultz, Carsten; Lemke, Edward A. (2011). "Genetically Encoded Copper-Free Click Chemistry". Angewandte Chemie International Edition. 50 (17): 3878–3881. doi:10.1002/anie.201008178. PMC 3210829. PMID 21433234.
- ^ Neef, Anne B.; Schultz, Carsten (2009). "Selective Fluorescence Labeling of Lipids in Living Cells". Angewandte Chemie International Edition. 48 (8): 1498–500. doi:10.1002/anie.200805507. PMID 19145623.
- ^ a b Baskin, J. M.; Prescher, J. A.; Laughlin, S. T.; Agard, N. J.; Chang, P. V.; Miller, I. A.; Lo, A.; Codelli, J. A.; Bertozzi, C. R. (2007). "Copper-free click chemistry for dynamic in vivo imaging". Proceedings of the National Academy of Sciences. 104 (43): 16793–7. Bibcode:2007PNAS..10416793B. doi:10.1073/pnas.0707090104. PMC 2040404. PMID 17942682.
- ^ a b Ning, Xinghai; Temming, Rinske P.; Dommerholt, Jan; Guo, Jun; Blanco-Ania, Daniel; Debets, Marjoke F.; Wolfert, Margreet A.; Boons, Geert-Jan; Van Delft, Floris L. (2010). "Protein Modification by Strain-Promoted Alkyne-Nitrone Cycloaddition". Angewandte Chemie International Edition. 49 (17): 3065–8. doi:10.1002/anie.201000408. PMC 2871956. PMID 20333639.
- ^ Yarema, K. J.; Mahal, LK; Bruehl, RE; Rodriguez, EC; Bertozzi, CR (1998). "Metabolic Delivery of Ketone Groups to Sialic Acid Residues. Application to Cell Surface Glycoform Engineering". Journal of Biological Chemistry. 273 (47): 31168–79. doi:10.1074/jbc.273.47.31168. PMID 9813021.
- ^ a b Blackman, Melissa L.; Royzen, Maksim; Fox, Joseph M. (2008). "The Tetrazine Ligation: Fast Bioconjugation based on Inverse-electron-demand Diels-Alder Reactivity". Journal of the American Chemical Society. 130 (41): 13518–9. doi:10.1021/ja8053805. PMC 2653060. PMID 18798613.
- ^ a b c Stöckmann, Henning; Neves, André A.; Stairs, Shaun; Brindle, Kevin M.; Leeper, Finian J. (2011). "Exploring isonitrile-based click chemistry for ligation with biomolecules". Organic & Biomolecular Chemistry. 9 (21): 7303–5. doi:10.1039/C1OB06424J. PMID 21915395.
- ^ a b Sletten, Ellen M.; Bertozzi, Carolyn R. (2011). "A Bioorthogonal Quadricyclane Ligation". Journal of the American Chemical Society. 133 (44): 17570–3. doi:10.1021/ja2072934. PMC 3206493. PMID 21962173.
- ^ "The Nobel Prize in Chemistry". The Nobel Prize. Retrieved 6 October 2022.
- ^ Saxon, E.; Bertozzi, CR (2000). "Cell Surface Engineering by a Modified Staudinger Reaction". Science. 287 (5460): 2007–10. Bibcode:2000Sci...287.2007S. doi:10.1126/science.287.5460.2007. PMID 10720325. S2CID 19720277.
- ^ Pamela, Chang.; Prescher, Jennifer A.; Hangauer, Matthew J.; Bertozzi, Carolyn R. (2008). "Imaging Cell Surface Glycans with Bioorthogonal Chemical Reporters". J Am Chem Soc. 129 (27): 8400–8401. doi:10.1021/ja070238o. PMC 2535820. PMID 17579403.
- ^ Kennedy, David C.; McKay, Craig S.; Legault, Marc C. B.; Danielson, Dana C.; Blake, Jessie A.; Pegoraro, Adrian F.; Stolow, Albert; Mester, Zoltan; Pezacki, John Paul (2011). "Cellular Consequences of Copper Complexes Used to Catalyze Bioorthogonal Click Reactions". Journal of the American Chemical Society. 133 (44): 17993–8001. doi:10.1021/ja2083027. PMID 21970470.
- ^ Huisgen, Rolf. (1976). "1,3-Dipolar cycloadditions. 76. Concerted nature of 1,3-dipolar cycloadditions and the question of diradical intermediates". The Journal of Organic Chemistry. 41 (3): 403–419. doi:10.1021/jo00865a001.
- ^ a b Gold, Brian; Shevchenko, Nikolay E.; Bonus, Natalie; Dudley, Gregory B.; Alabugin, Igor V. (2011). "Selective Transition State Stabilization via Hyperconjugative and Conjugative Assistance: Stereoelectronic Concept for Copper-Free Click Chemistry". The Journal of Organic Chemistry. 77 (1): 75–89. doi:10.1021/jo201434w. PMID 22077877.
- ^ Chenoweth, Kimberly; Chenoweth, David; Goddard Iii, William A. (2009). "Cyclooctyne-based reagents for uncatalyzed click chemistry: A computational survey" (PDF). Organic & Biomolecular Chemistry. 7 (24): 5255–8. doi:10.1039/B911482C. PMID 20024122.
- ^ Jewett, John C.; Sletten, Ellen M.; Bertozzi, Carolyn R. (2010). "Rapid Cu-Free Click Chemistry with Readily Synthesized Biarylazacyclooctynones". Journal of the American Chemical Society. 132 (11): 3688–90. doi:10.1021/ja100014q. PMC 2840677. PMID 20187640.
- ^ Sletten, Ellen M.; Bertozzi, Carolyn R. (2008). "A Hydrophilic Azacyclooctyne for Cu-Free Click Chemistry". Organic Letters. 10 (14): 3097–9. doi:10.1021/ol801141k. PMC 2664610. PMID 18549231.
- ^ Ess, Daniel H.; Jones, Gavin O.; Houk, K. N. (2008). "Transition States of Strain-Promoted Metal-Free Click Chemistry: 1,3-Dipolar Cycloadditions of Phenyl Azide and Cyclooctynes". Organic Letters. 10 (8): 1633–6. doi:10.1021/ol8003657. PMID 18363405.
- ^ a b Schoenebeck, Franziska; Ess, Daniel H.; Jones, Gavin O.; Houk, K. N. (2009). "Reactivity and Regioselectivity in 1,3-Dipolar Cycloadditions of Azides to Strained Alkynes and Alkenes: A Computational Study". Journal of the American Chemical Society. 131 (23): 8121–33. doi:10.1021/ja9003624. PMID 19459632.
- ^ Lutz, Jean-François (2008). "Copper-Free Azide Alkyne Cycloadditions: New Insights and Perspectives". Angewandte Chemie International Edition. 47 (12): 2182–4. doi:10.1002/anie.200705365. PMID 18264961.
- ^ Dommerholt, Jan; Schmidt, Samuel; Temming, Rinske; Hendriks, Linda J. A.; Rutjes, Floris P. J. T.; Van Hest, Jan C. M.; Lefeber, Dirk J.; Friedl, Peter; Van Delft, Floris L. (2010). "Readily Accessible Bicyclononynes for Bioorthogonal Labeling and Three-Dimensional Imaging of Living Cells". Angewandte Chemie International Edition. 49 (49): 9422–5. doi:10.1002/anie.201003761. PMC 3021724. PMID 20857472.
- ^ Mbua, Ngalle Eric; Guo, Jun; Wolfert, Margreet A.; Steet, Richard; Boons, Geert-Jan (2011). "Strain-Promoted Alkyne-Azide Cycloadditions (SPAAC) Reveal New Features of Glycoconjugate Biosynthesis". ChemBioChem. 12 (12): 1912–21. doi:10.1002/cbic.201100117. PMC 3151320. PMID 21661087.
- ^ Jewett, John C.; Bertozzi, Carolyn R. (2011). "Synthesis of a fluorogenic cyclooctyne activated by Cu-free click chemistry". Organic Letters. 13 (22): 5937–9. doi:10.1021/ol2025026. PMC 3219546. PMID 22029411.
- ^ Poloukhtine, Andrei A.; Mbua, Ngalle Eric; Wolfert, Margreet A.; Boons, Geert-Jan; Popik, Vladimir V. (2009). "Selective Labeling of Living Cells by a Photo-Triggered Click Reaction". Journal of the American Chemical Society. 131 (43): 15769–76. doi:10.1021/ja9054096. PMC 2776736. PMID 19860481.
- ^ Carpenter, Richard D.; Hausner, Sven H.; Sutcliffe, Julie L. (2011). "Copper-Free Click for PET: Rapid 1,3-Dipolar Cycloadditions with a Fluorine-18 Cyclooctyne". ACS Medicinal Chemistry Letters. 2 (12): 885–889. doi:10.1021/ml200187j. PMC 4018166. PMID 24900276.
- ^ "Life Is Sweet". stanfordmag.org. 2022-02-15. Retrieved 2022-11-11.
- ^ "'Honeymoon-Phase' Chemical Partners Deliver a Toxic Drug to Tumors". Discover Magazine. Retrieved 2022-11-11.
- ^ Gutsmiedl, Katrin; Wirges, Christian T.; Ehmke, Veronika; Carell, Thomas (2009). "Copper-Free "Click" Modification of DNA via Nitrile Oxide Norbornene 1,3-Dipolar Cycloaddition". Organic Letters. 11 (11): 2405–8. doi:10.1021/ol9005322. PMID 19405510.
- ^ Truong, Vinh X.; Zhou, Kun; Simon P., George; Forsythe, John S. (2015). "Nitrile Oxide-Norbornene Cycloaddition as a Bioorthogonal Crosslinking Reaction for the Preparation of Hydrogels". Macromolecular Rapid Communications. 36 (19): 1729–34. doi:10.1002/marc.201500314. PMID 26250120.
- ^ Van Berkel, Sander S.; Dirks, A. (Ton) J.; Debets, Marjoke F.; Van Delft, Floris L.; Cornelissen, Jeroen J. L. M.; Nolte, Roeland J. M.; Rutjes, Floris P. J. T. (2007). "Metal-Free Triazole Formation as a Tool for Bioconjugation". ChemBioChem. 8 (13): 1504–8. doi:10.1002/cbic.200700278. PMID 17631666. S2CID 45813826.
- ^ Van Berkel, Sander S.; Dirks, A. (Ton) J.; Meeuwissen, Silvie A.; Pingen, Dennis L. L.; Boerman, Otto C.; Laverman, Peter; Van Delft, Floris L.; Cornelissen, Jeroen J. L. M.; Rutjes, Floris P. J. T. (2008). "Application of Metal Free Triazole Formation in the Synthesis of Cyclic RGD DTPA Conjugates". ChemBioChem. 9 (11): 1805–15. doi:10.1002/cbic.200800074. PMID 18623291. S2CID 205552916.
- ^ Henry, Lucas; Schneider, Christopher; Mützel, Benedict; Simpson, Peter V.; Nagel, Christoph; Fucke, Katharina; Schatzschneider, Ulrich (2014). "Amino acid bioconjugation via iClick reaction of an oxanorbornadiene-masked alkyne with a MnI(bpy)(CO)3-coordinated azide" (PDF). ChemComm. 50 (99): 15692–95. doi:10.1039/C4CC07892F. PMID 25370120. S2CID 24060126.
- ^ Row, R. David; Prescher, Jennifer A. (2016). "Tetrazine Marks the Spot". ACS Central Science. 2 (8): 493–494. doi:10.1021/acscentsci.6b00204. PMC 4999966. PMID 27610408.
- ^ Bach, Robert D. (2009). "Ring Strain Energy in the Cyclooctyl System. The Effect of Strain Energy on [3 + 2] Cycloaddition Reactions with Azides". Journal of the American Chemical Society. 131 (14): 5233–43. doi:10.1021/ja8094137. PMID 19301865.
- ^ Devaraj, Neal K.; Weissleder, Ralph; Hilderbrand, Scott A. (2008). "Tetrazine-Based Cycloadditions: Application to Pretargeted Live Cell Imaging". Bioconjugate Chemistry. 19 (12): 2297–9. doi:10.1021/bc8004446. PMC 2677645. PMID 19053305.
- ^ Hansell, Claire F.; Espeel, Pieter; Stamenovic, Milan M.; Barker, Ian A.; Dove, Andrew P.; Du Prez, Filip E.; o Reilly, Rachel K. (2011). "Additive-Free Clicking for Polymer Functionalization and Coupling by Tetrazine Norbornene Chemistry". Journal of the American Chemical Society. 133 (35): 13828–31. doi:10.1021/ja203957h. PMID 21819063.
- ^ Lim, Reyna K. V.; Lin, Qing (2011). "Photoinducible Bioorthogonal Chemistry: A Spatiotemporally Controllable Tool to Visualize and Perturb Proteins in Live Cells". Accounts of Chemical Research. 44 (9): 828–839. doi:10.1021/ar200021p. PMC 3175026. PMID 21609129.
- ^ Song, Wenjiao; Wang, Yizhong; Qu, Jun; Lin, Qing (2008). "Selective Functionalization of a Genetically Encoded Alkene-Containing Protein via "Photoclick Chemistry" in Bacterial Cells". Journal of the American Chemical Society. 130 (30): 9654–5. doi:10.1021/ja803598e. PMID 18593155.
- ^ Knight, James C.; Cornelissen, Bart (2014). "Bioorthogonal chemistry: implications for pretargeted nuclear (PET/SPECT) imaging and therapy". American Journal of Nuclear Medicine and Molecular Imaging. 4 (2): 96–113. ISSN 2160-8407. PMC 3992206. PMID 24753979.
- ^ Shasqi, Inc. (2023-02-08). "A Multicenter Phase 1/2a, Open-Label Study of SQ3370 in Patients With Advanced Solid Tumors".
{{cite journal}}:저널 요구사항 인용journal=(도움말)