하이드로보레이션
Hydroboration화학에서 하이드로보레이션은 C-C, C-N, C-O 이중결합에 수소보론 결합을 더하는 것뿐만 아니라 C-C 삼중결합까지 더하는 것을 말한다. 이 화학반응은 유기화합물의 유기적 합성에 유용하다. 이 기술의 발전과 그 밑바탕에 깔린 개념들은 노벨 화학상 허버트 C에게 인정되었다. 브라운.[1] 그는 중요한 합성 매개체로서 오르가노보레네스에 대한 선구적인 연구로 1979년[2] 게오르크 위티그와 노벨 화학상을 공유했다.
하이드로보레이션은 알콜, 아민, 알킬 할로겐과 같은 유용한 화합물을 생산하기 위해 다양한 시약과 반응하는 오르간오보레인 화합물을 생산한다. 오르가노보레인의 가장 널리 알려진 반응은 과산화수소에 의한 알코올을 생산하기 위한 산화작용이다. 이러한 유형의 반응은 경미한 상태와 광범위한 용인된 연골 때문에 수력보존에 대한 연구를 촉진했다. 또 다른 연구 소지는 금속으로 만들어진 수력보존이다.
C-C 이중결합에 H-B 결합 추가
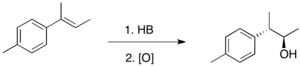
하이드로보레이션은 전형적으로 반 마르코브니코프(anti-Markovnikov), 즉 수소가 이중 결합의 가장 대체적인 탄소에 더해진다. 레지화학이 일반적인 HX 덧셈의 역행이라는 것은 B-Hδ+δ− 결합의 극성을 반영한다. 수력 보관은 4-membed transition state: 수소와 붕소 원자가 이중 결합의 동일한 표면에 추가되는 것을 통해 진행된다. 메커니즘이 결합되는 것을 전제로 C-B 본드의 형성은 C-H 본드의 형성에 비해 약간 더 빠르게 진행된다. 그 결과, 전환 상태에서 붕소는 부분적으로 음전하를 띠는 반면, 더 많은 대체 탄소가 부분적으로 양의 전하를 띠게 된다. 이 부분적 양의 전하가 더 대체되는 탄소에 의해 더 잘 지지된다. 형식적으로는 집단 이양반응의 한 예다. 그러나 관련 궤도를 분석하면 반응이 '의사적 반복'이며, 주기적 반응성에 대한 우드워드-호프만 규칙의 적용을 받지 않는다는 것을 알 수 있다.

BH를3 하이드로보류 시약으로 사용할 경우, 일반적으로 모노칼보레인 화합물, 특히 강직성 방해를 덜 받는 작은 올레핀에 대해 반응이 진행된다. 삼분해성 올레핀은 다이얼킬 붕소를 빠르게 생산할 수 있지만, 오르간오보레인의 추가적인 알킬화가 장력 장애로 인해 느려진다. di-alkyl 및 tri-alkyl 보란드를 생산하는 데 있어 이 유의한 비율 차이는 재열성을 향상시킬 수 있는 부피가 큰 보란기의 합성에 유용하다(아래 참조).
대체 연고를 포함하는 반응
1과 같은 삼분해성 연골의 경우 붕소는 대체되지 않는 탄소에 주로 배치된다.[3] 붕소 원자가 더 대체되는 탄소 위에 놓여 있는 경미한 생산물은 보통 10% 미만으로 생산된다. 레지오셀레이션율이 낮은 주목할 만한 경우는 스티렌이며, 선택성은 파라 포지션의 대체물의 영향을 강하게 받는다.
시스나 트랜스 올레핀과 같은 1,2-분산 알케인의 가수 분해는 대체물이 강체 부피 측면에서 매우 다르더라도 일반적으로 유사한 양의 두 유기발광체를 혼합하여 생산한다. 그러한 1,2분산 올레핀의 경우, 두 가지 대체물 중 하나가 페닐 링일 때만 섭생성을 관찰할 수 있다. 이러한 경우 trans-1-페닐프로펜과 같이 붕소 원자는 페닐 링에 인접한 탄소 위에 위치한다. 위의 관찰은 올레핀에 H-B 결합을 추가하는 것이 강직 제어보다는 전자 제어 하에 있음을 나타낸다.
오르가노보레인의 반응
하이드로보레이션에 의해 생성된 C-B 결합은 다양한 시약으로 반응하며, 가장 흔한 것은 과산화수소다. 올레핀에 H-B를 첨가하는 것은 입체적이기 때문에 알켄이 삼분해되면 이 산화반응은 이질회수반응이 된다.[4] 따라서 수산화물은 입체적이고 반 마코브니코프 방식으로 알코올을 생산하는 훌륭한 방법이다.
하이드로보레이션은 또한 중간 오르가노보레인을 모노클로라민 또는 O-히드록시아민술폰산(HSA)으로 처리함으로써 아민으로 이어질 수 있다.[5]
단자 올레핀은 오르가노보란 중간체를 브롬이나[6] 요오드로 처리하여 해당 알킬 브로미이드와 알킬 요오드화물로 변환한다.[7] NIS나 NBS와 같은 숙시니미드 기반 시약이 더 다용도적이며 오르가노보레인처럼 엄격한 조건을 요구하지 않기 때문에 그러한 반응은 그다지 인기가 있는 것으로 증명되지 않았다. 등
보레인 인덕트
Diborane은 NaBH로4 BF를3 감소시켜 현장에서 생산될 수 있다(플라보피리돌은 참조). 그러나 보통 BH의3 원천으로는 보란 디메틸설피드 복합체 BHS3(CH3)(2BMS)가 사용된다.[9] 그것은 고도로 집중된 형태로 얻을 수 있다.[10]
인덕트 BH3(THF)는 1:1 인덕트로 존재하는 THF 솔루션으로도 상용화될 수 있다. 시간이 흐를수록 그것은 가치가 떨어진다.[11]
인광과 아민이 함유된 보란 유도체도 이용할 수 있지만 널리 쓰이지 않는다.[12] 보레인은 트리에틸아민으로 강한 인덕트를 만든다. 이 인덕트를 사용하는 것은 수력보조에 있어 더 가혹한 조건을 필요로 한다. 이것은 중합성을 피하기 위해 수력보존 삼진 같은 경우에 유리할 수 있다. 좀 더 강직하게 방해되는 3차 아민과 실릴 아민은 상온에서 보란을 연고에 전달할 수 있다.
단분해 붕소
모노칼 붕소는 비교적 드물다. 알킬 그룹이 메틸과 같이 작을 때, 모노칼보레인은 디보레인과 디알킬보레인과 삼알킬보레인의 혼합물을 주기 위해 재배포하는 경향이 있다. 모노칼보레인은 일반적으로 [RBH2]2 형태의 조광기로 존재한다. 테트라메틸렌의 하이드로보레이션에 의해 생산된 헥시엘보레인(TxBH2)이 한 예다.[13]
- BH26 + 2 MecC2=CMe2 → [MecHCMeBH222]2
치랄의 예로는 모노이스피노캄페일보레인(monoisopinocampheylborane. IpcBH로2 표기되는 경우가 많지만, 조광기 [IpcBH2]2이다. 보란 디메틸 황화 보란 디메틸을 함유한 (-)α-핀의 하이드로보레이션으로 얻는다.[14]
RBH2 형식의 종은 R = 알킬 및 할로겐화용으로 사용할 수 있다. Monobromo-와 Monochloro-borane은 BMS와 해당 붕소 3할라이드로부터 준비될 수 있다. 모노클로보레인과 1,4-다이옥산의 안정적 복합체는 단자알케인의 수력보조에 영향을 미친다.[15]
방부 붕소
다임시틸보레인
dimesitylborane은 조광기(CHMe623)2BH이다22. 그것은 단지 간단한 단자 연고로 천천히 반응한다. 반면 알케인은 알케닐보레인을 생산하기 위해 메스BH와2 단수화 과정을 쉽게 거친다.[16]
디시아밀보레인
방해받는 다이얼킬보레인 중에는 디시아밀보레인(SiaBH2)이 있다. 그것은 또한 어둑어둑하다. 그것의 견고한 덩어리 때문에, 그것은 선택적으로 더 많은 대체 알케인이 있는 곳에서 일반적으로 말단 알케인을 덜 방해하는 수력 보관을 한다.[17] 디시아밀보레인은 용액을 몇 시간 동안 0°C에서만 저장할 수 있으므로 새로 준비해야 한다. Dicyclohexylborane ChxBH는2 SiaBH보다2 열 안정성이 향상되었다.
BBN 9
다용도 다이얼킬보레인은 9-BBN이다. "바나나 보라네"라고도 불리며, 그것은 조광기로 존재한다. 195 °C(12mm Hg)에서 분해 없이 증류할 수 있다. 9-BBN과의 반응은 일반적으로 60-80°C에서 발생하며 대부분의 연골은 1시간 이내에 반응한다. 테트라즈볼트화 연골은 높은 온도에서 9-BBN을 더한다. 9-BBN을 가진 연골의 하이드로보레이션은 뛰어난 재생성으로 진행된다. 그것은8 아마도 단단한2 C 백본 때문에 SiaBH보다 장력 차이에 더 민감하다. 9-BBN은 알카인보다 알케인에 더 반응적이다.[18]
기타 2차 붕소
단순하고 숨김이 없는 다이얼킬보레기는 실온에서 대부분의 연골과 단자 알키네에 반응하지만 모노 및 삼알킬보레와 평형 상태에서 존재하기 때문에 높은 순도로 준비하기 어렵다. 그것들을 준비하는 일반적인 방법 중 하나는 금속 하이드라이드를 사용한 다이얼킬할로겐노보레인(dialkylhalogenoboranes)의 감소다.[19] 디에틸보레인과 같은 다이얼킬보레인을 이용한 중요한 합성 어플리케이션은 오르가노보론 화합물을 형성하기 위한 오르가노보론 화합물의 전송이다.[20][21]
피나콜보레인 및 카테콜보레인
촉매 하이드로보레이션의 경우 피나콜보레인과 카테콜보레인이 널리 사용된다. 그들은 또한 알키네스에 대해 더 높은 반응성을 보인다.[22] 피나콜보레인은 촉매 없는 하이드로보레이션에도 널리 사용된다.
참고 항목
참조
- ^ Brown, H.C. (1961). "Hydroboration-A Powerful Synthetic Tool". Tetrahedron. 12 (3): 117. doi:10.1016/0040-4020(61)80107-5.
- ^ "The Nobel Prize in Chemistry 1979". www.nobelprize.org. Retrieved 21 March 2017.
- ^ Brown, H. C.; Zwefei, G. (1960). "Isomerization of Organoboranes Derived Addition Mechanism of Isomerization from Branched-Chain and Ring Olefins- Further Evidence for the Elimination-Addition Mechanism of Isomerizaton". Journal of the American Chemical Society. 82: 1504. doi:10.1021/ja01491a058.
{{cite journal}}: CS1 maint: 작성자 매개변수 사용(링크) - ^ Allred, E. L.; Sonnenbcrg, J.; Winstcin S. (1960). "Preparation of Homobenzyl and Homoallyl Alcohols by the Hydroboration Method". Journal of Organic Chemistry. 25: 25. doi:10.1021/jo01071a007.
- ^ 히드록시아민
- ^ Brown, H. C.; Lane, C. F. (1970). "The Base-Induced Reaction of Organoboranes with Bromine. A Convenient Procedure for the Anti-Markovnikov Hydrobromination of Terminal Olefins via Hydroboration-Bromination". Journal of the American Chemical Society. 92 (22): 6660. doi:10.1021/ja00725a057.
- ^ Brown, H. C.; Rathke, M.; Rogic, M. M. (1968). "A Fast Reaction of Organoboranes with Iodine under the Influence of Base. A Convenient Procedure for the Conversion of Terminal Olefins into Primary Iodides via Hydroboration-Iodination". Journal of the American Chemical Society. 90 (18): 5038. doi:10.1021/ja01020a056.
- ^ Hutchins, Robert O.; Cistone, Frank (1981). "Utility and Applications of Borane Dimethylsulfide in Organic Synthesis. A Review". Organic Preparations and Procedures International. 13 (3–4): 225. doi:10.1080/00304948109356130.
- ^ Borane-dimethylsulfide 복합체 참조
- ^ Zaidlewicz, Marek; Baum, Ofir; Srebnik, Morris. "Borane Dimethyl Sulfide". Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rb239.pub2.
- ^ Kollonitisch, J (1961). "Reductive Ring Cleavage of Tetrahydrofurans by Diborane". J. Am. Chem. Soc. 83 (6): 1515. doi:10.1021/ja01467a056.
- ^ Carboni, B.; Mounier, L. (1999). "Recent developments in the chemistry of amine- and phosphine-boranes". Tetrahedron. 55 (5): 1197. doi:10.1016/S0040-4020(98)01103-X.
- ^ Negishi, Ei-Ichi; Brown, Herbert C. (1974). "Thexylborane-A Highly Versatile Reagent for Organic Synthesis via Hydroboration". Synthesis. 1974 (2): 77–89. doi:10.1055/s-1974-23248.
- ^ Dhar, Raj K.; Josyula, Kanth V. B.; Todd, Robert; Gagare, Pravin D.; Ramachandran, Veeraraghavan (2001). "Diisopinocampheylborane". Encyclopedia of Reagents for Organic Synthesis. pp. 1–10. doi:10.1002/047084289X.rd248.pub3. ISBN 9780470842898.
- ^ Kanth, J. V. B.; Brown, H.C. (2001). "Hydroboration. 97. Synthesis of New Exceptional Chloroborane−Lewis Base Adducts for Hydroboration. Dioxane−Monochloroborane as a Superior Reagent for the Selective Hydroboration of Terminal Alkenes". Journal of Organic Chemistry. 66 (16): 5359–65. doi:10.1021/jo015527o. PMID 11485456.
- ^ Pelter, A.; Singaram, S.; Brown, H. C. (1983). "The Dimesitylboron Group in Organic Chemistry. 6 Hydroborations with dimesitylborane". Tetrahedron Letters. 24 (13): 1433. doi:10.1016/S0040-4039(00)81675-5.
- ^ Dodd, D.S.; Ochlschlager, A. C. (1992). "Synthesis of inhibitors of 2,3-oxidosqualene-lanosterol cyclase: conjugate addition of organocuprates to N-(carbobenzyloxy)-3-carbomethoxy-5,6-dihydro-4-pyridone". Journal of Organic Chemistry. 57 (10): 2794. doi:10.1021/jo00036a008.
- ^ Dhillon, R. S. (2007). Hydroboration and Organic Synthesis : 9-Borabicyclo [3.3.1] Nonane (9-BBN). Springer.
- ^ Brown, H. C.; Kulkarni, S. U. (1981). "Organoboranes: XXV. Hydridation of dialkylhaloboranes. New practical syntheses of dialkylboranes under mild conditions". Journal of Organometallic Chemistry. 218: 299. doi:10.1016/S0022-328X(00)81001-3.
- ^ Boudier, A.; Hupe, E.; Knochel, P. (2000). "Highly Diastereoselective Synthesis of Monocyclic and Bicyclic Secondary Diorganozinc Reagents with Defined Configuration". Angewandte Chemie International Edition. 39 (13): 2294. doi:10.1002/1521-3773(20000703)39:13<2294::AID-ANIE2294>3.0.CO;2-J.
- ^ Hupe, E.; Knochel, P. (2001). "Stereoselective Synthesis of Secondary Organozinc Reagents and Their Reaction with Heteroatomic Electrophiles". Organic Letters. 3 (1): 127–30. doi:10.1021/ol0068400. PMID 11429854.
- ^ Brown, H.C.; Zaidlewicz, M. (2001). Organic Syntheses Via Boranes, Vol. 2. Milwaukee, WI: Aldrich Chemical Co. ISBN 978-0-9708441-0-1.