할로겐 첨가 반응
Halogen addition reaction할로겐 첨가 반응은 알켄 기능 그룹의 탄소-탄소 이중 결합에 할로겐 분자가 첨가되는 단순한 유기 반응이다.[1]
할로겐 첨가 반응의 일반적인 화학 공식은 다음과 같다.
- C=C + X2 → X−C−C−X
(X는 할로겐 브로민 또는 염소를 나타내며, 이 경우 용제는 CHCl22 또는 CCl일4 수 있다.) 그 제품은 바이실린 디할라이드다.
이러한 유형의 반응은 할로겐화 및 전기영양 첨가물이다.
반응 메커니즘
알켄 브롬화를 위한 반응 메커니즘은 다음과 같이 설명할 수 있다. 반응의 첫 번째 단계에서 브롬 분자는 전자가 풍부한 알켄 탄소-탄소 이중 결합에 접근한다. 본드에 더 가까운 브롬 원자는 그것의 전자가 이중 본드의 전자에 의해 밀어내면서 부분적인 양의 전하를 띠게 된다.
 | |
| 알켄 반응 메커니즘에 브롬 첨가 | 브롬화 이온은 브로모늄 이온의 C-Br molecular* 항균 분자 궤도 를 공격한다. |
원자는 이 때 전기영양성이며 알켄[탄소-탄소 이중 결합]의 파이 전자에 의해 공격받는다. 그것은 관련된 두 탄소 원자에 하나의 시그마 결합을 형성한다. 브롬의 본딩은 탄소에 비해 상대적으로 큰 크기 때문에 브롬화 이온은 한때 π-본드를 공유했던 두 탄소와 상호작용이 가능해 3mb의 링을 만들 수 있다. 브롬화 이온은 양의 공식 전하를 얻는다. 이 순간 할로겐 이온은 각각 "브로모늄 이온" 또는 "클로로늄 이온"이라고 불린다.
첫 번째 브롬 원자가 탄소-탄소 π-본드를 공격할 때, 그것은 Br에서2 결합되었던 다른 브롬과 함께 그것의 전자들 중 하나를 남겨둔다. 그 다른 원자는 이제 음의 브롬화 음이온이고 탄소 원자의 약간의 양전하로 끌린다. 첫 번째 브롬 원자에 의해 탄소 사슬의 한쪽 면에 대한 핵포함 공격으로부터 차단되어 다른 쪽으로부터만 공격할 수 있다. 그것이 탄소 중 하나를 공격하고 결합을 형성하면서 첫 번째 브롬 원자와 다른 탄소 원자의 결합이 깨지면서 각 탄소 원자는 할로겐 대체물을 갖게 된다.
이러한 방식으로 두 할로겐은 반 첨가 방식으로 추가되며, 알켄이 사이클의 일부일 때 디브로미드는 트랜스 구성을 채택한다. C-Br σ* 항균 분자 궤도(LUMO, 빨간색으로 오른쪽 표시)와 핵분자(X−) 단독 쌍(HOMO, 녹색으로 아래 오른쪽 표시)의 최대 중첩을 위해 X는− 탄소에서 뒤에서 브로모늄 이온을 공격해야 한다.
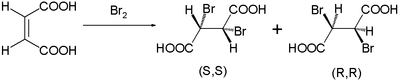
이 반응 메커니즘은 1937년 로버츠와 킴볼에 의해 제안되었다.[2] 그것과 함께 그들은 관찰된 스테레오스펙트 트랜스 첨가물을 수산과 후마산의 브롬으로 설명했다. 시스-이중 결합을 가진 말레산은 항산화제의 혼합물로서 디브로미드를 형성한다.
트랜스 이소머 후마릭산은 단일 메소 화합물을 형성하는 동안:
이 반응은 시스-디-티-부틸렌 화합물에서와 같이 시스 위치에 두 개의 부피가 큰 테르트-부틸 그룹이 있는 알케네에서도 입체적이다.[3] 클로로늄 이온에 존재하는 강건한 반발력에도 불구하고 형성된 제품은 항응고제뿐이다.
β-할로카르보케이션
반응성 중간체 아래에 표시된 대안적 반응 체계에서 탄소 원자 중 하나를 가진 β-브로모카르보늄 이온 또는 β-브로모카르보늄 이온이다.
이 메커니즘을 통해 일어나는 반응의 경우 입체성이 기대되지 않으며 실제로 발견되지 않는다.
1937년 로버츠와 킴볼은 이미 암수이온과의 브롬화가 음전하 카르복실산 음이온 사이의 반발에 의해 시스 덧셈이 할로늄 이온 형성보다 강하다는 사실을 설명하였다. 아네트홀이나 스틸베네와 같은 연골에서는 대체물이 할로늄 이온을 희생하여 전자를 기증함으로써 탄소를 안정시킬 수 있다.[4]
할로늄 이온은 NMR 분광법을 통해 식별할 수 있다. 1967년에 George A의 그룹. 올라는 -60℃에서 매직산에 2,3-디브로모-2,3-디메틸부탄을 녹여 테트라메틸렌브로모늄 이온의 NMR 스펙트럼을 얻었다.[5] 반면에 해당 플루오린 화합물의 스펙트럼은 급속하게 평준화된 β-플루오로카르보케이션 쌍과 일치했다.
참고 항목
- 오우어 합성에서의 브롬화 예
참조
- ^ 유기화학 4번가 모리슨 & 보이드 ISBN0-205-05838-8
- ^ Roberts, Irving; Kimball, George E. (1937). "The Halogenation of Ethylenes". Journal of the American Chemical Society. 59 (5): 947. doi:10.1021/ja01284a507.
- ^ Fahey, Robert C. (1966). "Polar Additions to Olefins. II. The Chlorination of Di-t-butylethylene". Journal of the American Chemical Society. 88 (20): 4681. doi:10.1021/ja00972a030.
- ^ Ruasse, Marie Francoise (1990). "Bromonium ions or β-bromocarbocations in olefin bromination. A kinetic approach to product selectivities". Accounts of Chemical Research. 23 (3): 87. doi:10.1021/ar00171a006.
- ^ Olah, George A.; Bollinger, J. Martin (1967). "Stable carbonium ions. XLVIII. Halonium ion formation via neighboring halogen participation. Tetramethylethylene halonium ions". Journal of the American Chemical Society. 89 (18): 4744. doi:10.1021/ja00994a031.