핵자기공명분광법
Nuclear magnetic resonance spectroscopy
핵자기공명분광법(NMR spectroscopy) 또는 자기공명분광법(MRS)은 원자핵이 외부 자기장에서 0이 아닌 스핀으로 방향을 바꾸는 것을 기반으로 하는 분광 기법입니다. 이러한 방향 전환은 약 4 MHz에서 900 MHz까지의 전파 주파수 영역에서 전자기 방사선의 흡수와 함께 발생하며, 이는 핵의 동위원소 특성에 따라 달라지며 외부 자기장의 세기에 비례하여 증가합니다.[1] 각 NMR 활성 핵의 공진 주파수는 화학적 환경에 따라 달라집니다. 결과적으로 NMR 스펙트럼은 샘플에 존재하는 개별 작용기에 대한 정보뿐만 아니라 동일한 분자 내에서 가까운 핵 사이의 연결에 대한 정보를 제공합니다. NMR 스펙트럼은 개별 화합물 및 작용기에 고유하거나 매우 특징적이기 때문에 NMR 분광법은 특히 유기 화합물의 분자 구조를 식별하는 가장 중요한 방법 중 하나입니다.
NMR의 원리는 일반적으로 세 가지 순차적 단계를 포함합니다.
- 인가된 일정한 자기장 B에서0 자기 핵 스핀의 정렬(편광).
- 약한 진동 자기장에 의한 이러한 핵 스핀 정렬의 섭동은 일반적으로 RF(Radio-Frequency) 펄스라고 합니다.
- 이 섭동에 의한 시료의 핵에 의해 방출되는 전자파의 검출 및 분석
마찬가지로 생화학자들은 NMR을 사용하여 단백질과 다른 복잡한 분자를 식별합니다. 식별 외에도 NMR 분광법은 분자의 구조, 역학, 반응 상태 및 화학 환경에 대한 자세한 정보를 제공합니다. NMR의 가장 일반적인 종류는 양성자와 탄소-13 NMR 분광법이지만 스핀을 가진 핵을 포함하는 모든 종류의 시료에 적용 가능합니다.
NMR 스펙트럼은 독특하고, 잘 분해되며, 분석적으로 다루기 쉽고, 종종 작은 분자에 대해 매우 예측 가능합니다. 서로 다른 기능 그룹은 분명히 구별할 수 있으며, 이웃하는 치환기가 서로 다른 동일한 기능 그룹은 여전히 구별할 수 있는 신호를 제공합니다. NMR은 식별을 위한 색상 시약이나 전형적인 크로마토그래피와 같은 전통적인 습식 화학 테스트를 크게 대체했습니다.
NMR 분광법의 가장 큰 단점은 민감도가 낮다는 것입니다(질량분석법과 같은 다른 분석 방법에 비해). 일반적으로 2-50 mg의 물질이 적절한 품질의 NMR 스펙트럼을 기록하는 데 필요합니다. NMR 방법은 비파괴적이므로 물질을 회수할 수 있습니다. 고해상도 NMR 스펙트럼을 얻기 위해 고체 물질을 용해시켜 액체 용액을 만들지만 고체 상태 NMR 분광법도 가능합니다.
NMR의 시간 척도는 비교적 길기 때문에 빠른 현상을 관찰하는 데 적합하지 않으며 평균 스펙트럼만 생성합니다. 많은 양의 불순물이 NMR 스펙트럼에 나타나지만, NMR은 본질적으로 그다지 민감하지 않기 때문에 더 나은 불순물 검출 방법이 존재합니다. 그러나 더 높은 주파수에서 더 높은 감도를 갖습니다.
상관 분광법은 일반적인 NMR을 발전시킨 것입니다. 2차원 NMR에서는 방출이 단일 주파수를 중심으로 이루어지며, 상관된 공진이 관찰됩니다. 이를 통해 관찰된 기능 그룹의 이웃 대체물을 식별하여 공진을 명확하게 식별할 수 있습니다. 또한 더 복잡한 3D 및 4D 방법과 특정 유형의 공진을 억제하거나 증폭하도록 설계된 다양한 방법이 있습니다. NOE(Nuclear Overhauser Effect) 분광법에서는 공명의 완화가 관찰됩니다. NOE는 핵의 근접성에 따라 달라지므로 각 핵에 대한 NOE를 정량화하면 분자의 3차원 모델을 구축할 수 있습니다.

NMR 분광기는 상대적으로 비싸며, 일반적으로 대학에 있지만 민간 기업에서는 덜 일반적입니다. 2000년에서 2015년 사이에 NMR 분광기의 가격은 약 500,000 - 500,000 [3][4]달러였습니다. 해상도는 자기장 세기에 직접적으로 의존하기 때문에 현대의 NMR 분광기는 매우 강력하고 크고 값비싼 액체 헬륨 냉각 초전도 자석을 가지고 있습니다. 자기장이 높을수록 NMR 분광기의 감도도 향상되는데, NMR 분광기는 자기장 세기에 따라 기하급수적으로 증가하는 두 핵 수준 사이의 모집단 차이에 의존합니다.
영구 자석을 사용하는 더 저렴한 기계와 더 낮은 해상도도 사용할 수 있으며, 이는 여전히 반응 모니터링 및 샘플의 빠른 확인과 같은 특정 응용 분야에 충분한 성능을 제공합니다. 벤치탑 핵자기공명 분광기도 있습니다. 지구 자기장에서도 양성자(1H핵)의 NMR 스펙트럼을 관측할 수 있습니다. 저해상도 NMR은 복잡한 구조를 해결하는 데 있어 문제를 야기하는 서로 쉽게 겹칠 수 있는 더 넓은 피크를 생성합니다. 더 높은 강도의 자기장을 사용하면 피크의 감도가 향상되고 분해능이 높아지며 연구 목적으로 선호됩니다.[5]
역사
NMR의 발견에 대한 공은 1944년 노벨 물리학상을 받은 이시도르 아이작 라비에게 돌아갔습니다.[6] 하버드 대학의 퍼셀 그룹과 스탠퍼드 대학의 블로흐 그룹은 1940년대 후반과 1950년대 초반에 독자적으로 NMR 분광법을 개발했습니다. 에드워드 밀스 퍼셀(Edward Mills Purcell)과 펠릭스 블로흐(Felix Bloch)는 1952년 노벨 물리학상을 공동 수상했습니다.[7]
NMR-활성 기준
원자핵에서 NMR 활성의 핵심 결정 요인은 핵 스핀 양자수(I)입니다. 원자의 "스핀"과 비슷한 이 본질적인 양자적 특성은 핵의 각운동량을 특징짓습니다. NMR을 활성화하려면 핵이 0이 아닌 핵 스핀(I ≠ 0)을 가져야 합니다. 핵이 외부자기장과 상호작용하여 NMR로 신호를 보여주는 것이 바로 이 0이 아닌 스핀입니다. 홀수 개의 양성자와 홀수 개의 중성자, 또는 양성자와 중성자의 홀수 합을 가진 원자는 핵 스핀 양자수에 대해 반 integer 값을 나타냅니다(I = 1/2, 3/2, 3/5 등). 이 원자들은 0이 아닌 핵 스핀을 가지고 있기 때문에 NMR 활성입니다. 반대로 양성자와 중성자가 짝수, 양성자와 중성자가 짝수인 원자는 핵스핀 양자수가 0(I = 0)입니다. 이러한 핵은 활성 스핀을 나타내지 않으므로 NMR-활성이 아닙니다.[9] NMR-활성 핵, 특히 스핀 양자수가 1/2인 핵은 NMR 분광학에서 매우 중요합니다. 예를 들면 H, C, N, P가 있습니다.[10]
NMR 기술의 주요 측면

공진 주파수
자기장 안에 놓이면, NMR 활성 핵(H 또는 C와 같은)은 동위원소의 주파수 특성으로 전자기 방사선을 흡수합니다.[11] 공진 주파수, 흡수된 방사선의 에너지, 신호의 세기는 자기장의 세기에 비례합니다. 예를 들어, 21 Tesla 자기장에서 수소 핵(일반적으로 양성자라고 함)은 900 MHz에서 공명합니다. 가장 많이 검출되는 핵은 수소이기 때문에 21T 자석을 900MHz 자석이라고 부르는 것이 일반적입니다. 그러나 이 자기장 세기에서 다른 핵들은 핵자기 모멘트에 비례하여 서로 다른 주파수에서 공명하게 됩니다.[citation needed]
시료취급
NMR 분광기는 일반적으로 매우 강한 자석 내부에 회전하는 샘플 홀더, 무선 주파수 방출기 및 자석 내부로 들어가 샘플을 둘러싸는 프로브(안테나 어셈블리)가 있는 수신기, 확산 측정을 위한 경사 코일 및 시스템을 제어하기 위한 전자 장치로 구성됩니다. 일반적으로 확산 운동을 평균하기 위해서는 표본을 회전시키는 것이 필요하지만, 일부 실험에서는 용액 운동이 중요한 변수일 때 고정 표본이 필요합니다. 예를 들어, 확산 상수(diffusion ordered spectroscopy 또는 DOSY)[12][13]의 측정은 스핀 오프(spining off) 상태에서 고정된 샘플을 사용하여 수행되며, 플로우 셀은 공정 흐름의 온라인 분석에 사용될 수 있습니다.
중수소화 용매
용액의 분자 대부분은 용매 분자이고, 대부분의 일반 용매는 탄화수소이므로 NMR-활성 수소-1 핵을 포함합니다. 용매 수소 원자의 신호가 실험을 압도하고 용해된 분석물의 분석을 방해하는 것을 피하기 위해 양성자의 99% 이상이 중수소(수소-2)로 대체되는 중수소화 용매를 사용합니다.[14] 가장 널리 사용되는 중수소화 용매는 CDCl3(deuterochloroform)이지만, 다른 용매는 시료의 용해도, 수소 결합을 제어하려는 욕구 또는 용융점 또는 끓는점과 같은 다양한 이유로 사용될 수 있습니다. 분자의 화학적 이동은 용매 간에 약간 변화하며, 따라서 사용되는 용매는 거의 항상 화학적 이동과 함께 보고됩니다.[citation needed] 프로톤 NMR 스펙트럼은 일반적으로 0의 화학적 이동을 갖는 것으로 정의되는 테트라메틸실란(Tetramethylsilane, TMS)을 첨가하는 대신 내부 표준으로서 알려진 용매 잔류[15] 프로톤 피크에 대해 교정되는 경우가 많습니다.[16]
심앤락
핵자기공명에 의한 매우 작은 주파수 이동을 검출하기 위해서는 인가되는 자기장이 샘플 부피 전체에 걸쳐 매우 균일해야 합니다. 고해상도 NMR 분광기는 심을 사용하여 자기장의 균질성을 수 입방센티미터의 부피로 10억분의 1(ppb)로 조정합니다. 자기장의 비균질성과 드리프트를 감지하고 보상하기 위해 분광계는 별도의 잠금 장치를 사용하여 용매 중수소 주파수에 대한 "잠금"을 유지합니다. 이는 기본적으로 관심 샘플의 핵이 아닌 잠금 핵(중수소)에 맞춰 조정된 추가 송신기 및 RF 프로세서입니다.[17] 현대 NMR 분광계에서 시밍은 자동으로 조정되지만, 경우에 따라 작업자는 가능한 최상의 해상도를 얻기 위해 시밍 파라미터를 수동으로 최적화해야 합니다.[18][19]
스펙트럼의 획득
무선 주파수(60–1000 MHz) 펄스로 샘플을 여기시키면 핵자기 공명 반응 - 자유 유도 붕괴(FID)가 얻어집니다. 매우 약한 신호이며, 수신하려면 민감한 무선 수신기가 필요합니다. 원시 시간 영역 FID에서 주파수 영역 스펙트럼을 추출하기 위해 푸리에 변환이 수행됩니다. 단일 FID의 스펙트럼은 신호 대 잡음비가 낮지만 반복 획득의 평균화로 쉽게 향상됩니다. 좋은 HNMR 스펙트럼은 16회 반복으로 획득할 수 있으며, 이는 단 몇 분 만에 이루어집니다. 그러나 수소보다 무거운 원소의 경우 이완 시간이 다소 길며, 예를 들어 C의 경우 약 8초 정도입니다. 따라서 정량적인 중원소 스펙트럼을 획득하는 데는 수십 분에서 몇 시간이 소요되는 시간이 소요될 수 있습니다.[citation needed]
펄스에 따라 핵은 평균적으로 분광계 자기장에 비해 특정 각도로 여기됩니다. 여기 범위는 펄스 폭(일반적으로 3-8 µ)을 사용하여 제어할 수 있습니다. 최적의 90° 펄스에 대해. 펄스 폭은 (서명된) 세기를 펄스 폭의 함수로 표시하여 결정할 수 있습니다. 사인 곡선을 따르며, 이에 따라 180° 및 360° 펄스에 해당하는 펄스 폭에서 부호가 변경됩니다.[citation needed]
일반적으로 초 단위로 측정되는 여기의 붕괴 시간은 완화 효과에 따라 달라지는데, 완화 효과는 가벼운 핵과 고체에서 더 빠르고 무거운 핵과 용액에서 더 느리며 기체에서는 매우 길 수 있습니다. 이완이 완료되기 전에 두 번째 여기 펄스가 조기에 전송되면 평균 자화 벡터가 접지 상태로 붕괴되지 않고 예측할 수 없는 방식으로 신호의 강도에 영향을 미칩니다. 실제로 피크 면적은 화학량론에 비례하지 않으며, 존재 여부만 식별할 수 있을 뿐 기능기의 양은 식별할 수 없습니다. 펄스 간의 이완 시간 및 따라서 필요한 지연을 결정하기 위해 반전 복구 실험을 수행할 수 있습니다. 180° 펄스, 조정 가능한 지연 및 90° 펄스가 전송됩니다. 90° 펄스가 신호를 정확하게 상쇄하면 지연은 90° 이완에 필요한 시간에 해당합니다.[20] 반전 복구는 정량적 C, 2D 및 기타 시간 소모적인 실험을 위해 가치가 있습니다.
스펙트럼 해석
NMR 신호는 일반적으로 화학적 이동, 스핀-스핀 결합 및 이완 시간의 세 가지 변수로 특징지어집니다.
화학적 이동
핵 스핀 상태 사이의 에너지 차이인 δE는 자기장에 비례합니다(제만 효과). δE는 또한 핵의 전자 환경에 민감하여 화학적 이동, δ이라고 알려진 것을 발생시킵니다. 가장 간단한 유형의 NMR 그래프는 분자에서 연구되는 핵의 다양한 화학적 이동에 대한 도표입니다. δ의 값은 종종 "차폐"로 표현됩니다. 차폐된 핵은 더 높은 δE를 갖습니다. δ 값의 범위를 분산이라고 합니다. H 신호의 경우 분산이 다소 작지만 다른 핵의 경우 분산이 훨씬 더 큽니다. NMR 신호는 기준 신호(일반적으로 TMS(테트라메틸실란)와 관련하여 보고됩니다. 또한 NMR 신호의 분포는 필드에 따라 다르므로 이러한 주파수를 분광기 주파수로 구분합니다. 그러나 Hz를 MHz로 나누기 때문에 결과적인 수가 너무 적으므로 백만을 곱합니다. 따라서 이 작업은 백만 개의 부품 단위로 "화학적 이동"이라고 하는 로케이터 번호를 제공합니다.[21] 화학적 이동은 구조적 정보를 제공합니다.
화학적 이동의 변환(및 J's, 아래 참조)을 스펙트럼 할당이라고 합니다. 반자성 유기 화합물의 경우, 1H 및 13C NMR 스펙트럼의 할당은 큰 데이터베이스와 쉬운 계산 도구 때문에 매우 정교합니다. 일반적으로 양성자의 화학적 이동은 주로 차폐 효과(전자 밀도)에 의해 결정되기 때문에 예측 가능성이 높습니다. 많은 무거운 핵의 화학적 이동은 들뜬 상태("paramagnetic" contribution to shield tensor)를 포함한 다른 요인에 의해 더 강하게 영향을 받습니다. 상자성과 무관한 이 상자성 기여는 화학 이동의 경향을 방해할 뿐만 아니라 할당을 복잡하게 할 뿐만 아니라 매우 큰 화학 이동 범위를 만듭니다. 예를 들어, 대부분의 유기 화합물에 대한 대부분의 HNMR 신호는 15 ppm 이내입니다. PNMR의 경우 범위는 수백 ppm입니다.[22]

상자성 NMR 분광법에서 샘플은 상자성입니다. 즉 쌍을 이루지 않은 전자를 포함합니다. 상자성은 매우 다양한 화학적 이동을 일으킵니다. HNMR 분광법에서 화학적 이동 범위는 최대 수천 ppm에 이를 수 있습니다.[23]
제이커플링
| 다중성 | 강도비 |
|---|---|
| 싱글릿(s) | 1 |
| 더블렛(d) | 1:1 |
| 세쌍둥이(t) | 1:2:1 |
| 4중주 (q) | 1:3:3:1 |
| 퀸텟 | 1:4:6:4:1 |
| Sextet | 1:5:10:10:5:1 |
| 셉테트 | 1:6:15:20:15:6:1 |
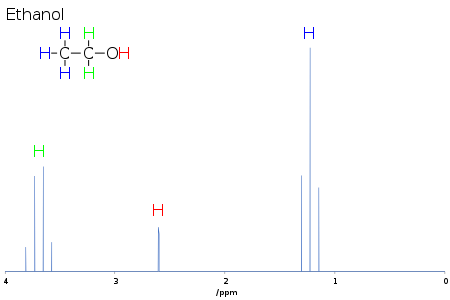
1차원 NMR 스펙트럼에서 구조 결정에 가장 유용한 정보 중 일부는 NMR 활성 핵 사이의 J-커플링 또는 스칼라 커플링(스핀-스핀 커플링의 특별한 경우)에서 나옵니다. 이 결합은 분자의 화학적 결합을 통해 서로 다른 스핀 상태의 상호작용에서 발생하며 NMR 신호의 분할을 초래합니다. 양성자의 경우 인접한 핵이 분광계 자기장을 가리키는지 반대로 가리키는지에 따라 국소 자기장이 약간 달라지는데, 이는 양성자당 하나가 아니라 두 개의 신호를 발생시킵니다. 이러한 분할 패턴은 복잡하거나 단순할 수 있으며, 마찬가지로 직접 해석하거나 기만적일 수 있습니다. 이 커플링은 분자 내 원자의 연결성에 대한 자세한 통찰력을 제공합니다.[citation needed]
분열의 다중성은 결합된 핵들의 스핀과 결합에 관여하는 핵들의 개수의 영향입니다. n개의 등가(스핀 ½) 핵에 결합하면 오른쪽에 설명된 파스칼의 삼각형을 따라 강도비가 있는 n+1 배수로 신호가 분할됩니다. 추가 스핀에 커플링하면 다중의 각 구성 요소가 추가로 분할됩니다. 예를 들어 커플링 상수가 상당히 다른 두 개의 서로 다른 스핀 ½ 핵에 커플링하면 더블렛(약칭: dd)이 발생합니다. 화학적으로 동등한(즉, 동일한 화학적 이동을 갖는) 핵 사이의 결합은 NMR 스펙트럼에 영향을 미치지 않으며, 멀리 떨어져 있는 핵 사이의 결합(보통 유연한 분자의 양성자에 대해 3개 이상의 결합)은 관찰 가능한 분열을 일으키기에는 일반적으로 너무 작습니다. 3개 이상의 결합에 대한 장거리 커플링은 종종 고리형 및 방향족 화합물에서 관찰될 수 있으며, 이는 더 복잡한 분할 패턴으로 이어집니다.[citation needed]
예를 들어, 상기 에탄올에 대한 양성자 스펙트럼에서, CH3 그룹은 이웃하는 2개의 CH2 양성자에 의해 1:2:1의 세기비를 갖는 삼중항으로 분할되는 것을 특징으로 하는 에탄올용 양성자. 마찬가지로, CH는2 이웃한 세 개의3 CH 양성자에 의해 1:3:3:1의 강도비를 가진 4중주로 분할됩니다. 원칙적으로 두 개의2 CH 양성자도 다시 이중결합으로 분리되어 하이드록실 양성자에 의해 이중결합을 형성하지만 산성 하이드록실 양성자의 분자 간 교환은 종종 결합 정보의 손실을 초래합니다.
인-31 또는 불소-19와 같은 스핀 1/2 핵에 대한 결합은 이러한 방식으로 작동합니다(결합 상수의 크기는 매우 다를 수 있지만). 그러나 스핀 양자수는 두 가지 이상의 가능한 값을 가지므로 스핀이 ½보다 큰 핵에 대해서는 앞에서 설명한 것과 분할 패턴이 다릅니다. 예를 들어, 스핀 1은 3개의 스핀 상태를 가지므로 중수소(스핀 1 핵)에 결합하면 신호가 1:1:1 삼중항으로 분할됩니다. 마찬가지로 Cl과 같은 스핀 3/2 핵은 신호를 1:1:1:1 4중주 등으로 나눕니다.
화학적 이동(및 양성자에 대한 통합)과 결합된 결합은 핵의 화학적 환경뿐만 아니라 분자 내 이웃한 NMR 활성 핵의 수에 대해서도 알려줍니다. 유사한 화학적 이동 또는 수소 이외의 핵의 스펙트럼에서 여러 개의 피크를 갖는 더 복잡한 스펙트럼에서 커플링은 종종 다른 핵을 구별하는 유일한 방법입니다.
결합의 크기(결합 상수, J)는 핵들이 서로 얼마나 강하게 결합되어 있는지에 대한 영향입니다. 단순한 경우, 이것은 핵들 사이의 결합 거리, 핵들의 자기 모멘트, 그리고 핵들 사이의 정이십면체 각도의 영향입니다.

2차(또는 강한) 커플링
상기 기술은 비등가 스핀 간의 NMR 주파수 차이에 비해 결합 상수가 작은 것으로 가정합니다. 시프트 분리가 감소하면(또는 결합 강도가 증가하면) 다중 강도 패턴이 먼저 왜곡되고, 그 다음에 더 복잡해지고 덜 쉽게 분석됩니다(특히 2개 이상의 스핀이 관련된 경우). 다중에서 일부 피크의 강화는 나머지를 희생시키면서 달성되며, 피크 아래의 통합 영역은 일정하게 유지되지만 때때로 배경 잡음에서 거의 사라집니다. 그러나 대부분의 높은 필드 NMR에서 왜곡은 보통 완만하며 특성 왜곡(루프)은 실제로 관련 피크를 식별하는 데 도움이 될 수 있습니다.
이러한 패턴 중 일부는 범위가 [24]제한적이지만 John Pople이 발표한 방법으로 분석할 수 있습니다.
다중 ts 사이의 주파수 차이가 증가함에 따라 2차 효과가 감소하므로 고주파(즉, 고주파) NMR 스펙트럼이 낮은 주파수 스펙트럼보다 왜곡이 적습니다. 60 MHz에서의 초기 스펙트럼은 일반적으로 200 MHz 이상의 주파수에서 작동하는 후기 기계의 스펙트럼보다 왜곡되기 쉬웠습니다.
또한 오른쪽 그림과 같이 J-커플링을 사용하여 고리의 오르토-메타-파라 치환을 식별할 수 있습니다. Ortho 커플링은 15 Hz로 가장 강하며, Meta가 평균 2 Hz로 그 뒤를 따르며, 마지막으로 파라 커플링은 연구에 일반적으로 중요하지 않습니다.
자기 부등식
화학적으로 동등한 스핀(즉, 대칭에 의해 관련되고 따라서 동일한 NMR 주파수를 갖는 핵)이 외부 스핀과 다른 결합 관계를 갖는 경우 더 미묘한 효과가 발생할 수 있습니다. 화학적으로 동등하지만 구별할 수 없는(결합 관계에 따라) 스핀을 자기적으로 비등가라고 합니다. 예를 들어, 1,2-디클로로벤젠의 4개의 H 부위는 대칭에 의해 두 개의 화학적으로 동등한 쌍으로 나뉘지만, 한 쌍의 개별 구성원은 다른 쌍을 구성하는 스핀에 대해 서로 다른 커플링을 가지고 있습니다. 자기 부등식은 계산 모델링으로만 분석할 수 있는 매우 복잡한 스펙트럼으로 이어질 수 있습니다. 이러한 효과는 방향족 및 기타 비유연 시스템의 NMR 스펙트럼에서 더 일반적인 반면 유연한 분자의 C-C 결합에 대한 구조적 평균은 인접 탄소의 양성자 간 결합을 동일화하여 자기 부등식에 대한 문제를 줄이는 경향이 있습니다.
상관분광학
상관분광학은 2차원 핵자기공명(NMR) 분광법 또는 2D-NMR의 여러 유형 중 하나입니다. 이런 유형의 NMR 실험은 그것의 머리글자인 COSY로 가장 잘 알려져 있습니다. 2차원 NMR의 다른 유형에는 J-분광기, 교환 분광기(EXSY), Nuclear Overhauser 효과 분광기(NOESY), 총 상관 분광기(TOCSY) 및 HSQC, HMQC와 같은 이핵 상관 실험이 있습니다. 상관 분광학에서 방출은 개별 핵의 피크를 중심으로 이루어지며, 자기장이 관통 결합(COSY, HSQC 등) 또는 관통 공간(NOE) 결합에 의해 다른 핵과 상관되어 있으면 상관된 핵의 주파수에 대한 반응도 감지할 수 있습니다. 2차원 NMR 스펙트럼은 1차원 NMR 스펙트럼보다 분자에 대한 더 많은 정보를 제공하며 특히 1차원 NMR을 사용하기에는 너무 복잡한 분자의 구조를 결정하는 데 유용합니다. 최초의 2차원 실험인 COSY는 1971년에 Universityé Libre de Bruxelles의 교수인 Jean Jean Jeener에 의해 제안되었습니다.[25][26] 이 실험은 나중에 월터 P에 의해 실행되었습니다. 아우, 엔리코 바르톨디, 리처드 R. 1976년에 그들의 작품을 출판한 에른스트.[27]
고체 핵자기 공명

다양한 물리적 환경은 분자를 용액에서 연구하는 것을 허용하지 않으며, 동시에 원자 수준으로 다른 분광학적 기술에 의해서도 연구되지 않습니다. 결정, 미세결정 분말, 겔, 이방성 용액 등과 같은 고체상 매질에서, 특히 핵 스핀 시스템의 거동에 지배적이 되는 것은 쌍극자 결합 및 화학 이동 이방성입니다. 기존의 용액 상태 NMR 분광법에서 이러한 추가 상호 작용은 스펙트럼 라인의 상당한 확장으로 이어질 것입니다. 다양한 기술을 통해 고해상도 조건을 설정할 수 있으며, 이는 적어도 C 스펙트럼의 경우 솔루션 상태 NMR 스펙트럼과 유사할 수 있습니다.
고해상도 고체 상태 NMR 분광법의 두 가지 중요한 개념은 샘플 방향에 의한 가능한 분자 방향의 제한과 샘플 방사에 의한 이방성 핵자기 상호작용의 감소입니다. 후자의 접근법 중, 시스템이 스핀 1/2 핵을 포함할 때 마법 각도를 중심으로 빠르게 회전하는 것은 매우 두드러진 방법입니다. 회전 속도는 ca. 20kHz가 사용되어 특수 장비가 필요합니다. 현재 NMR 분광법은 부분 정렬 또는 이동도가 감소된 샘플과 함께 여러 가지 중간 기법을 사용하고 있습니다.
고체 상태 NMR 효과가 발생하는 응용 분야는 종종 막 단백질, 단백질 섬유 또는 모든 종류의 고분자에 대한 구조 조사 및 무기 화학에서의 화학 분석과 관련이 있지만 식물 잎 및 연료 전지와 같은 "이색적인" 응용 분야도 포함됩니다. 예를 들어, Rahmani et al. 에서는 중수소 NMR 분광법을 이용하여 압력과 온도가 이중 세포 구조의 자기 조립에 미치는 영향을 연구했습니다.[29]
생체분자 NMR 분광법
단백질
NMR 분광학 내의 혁신의 대부분은 구조 생물학의 중요한 기술인 단백질 NMR 분광학 분야에 있었습니다. 이러한 조사의 일반적인 목표는 X선 결정학으로 달성할 수 있는 것과 유사한 단백질의 고해상도 3차원 구조를 얻는 것입니다. X선 결정학과 대조적으로 NMR 분광학은 일반적으로 35 kDa보다 작은 단백질로 제한되지만 더 큰 구조는 해결되었습니다. NMR 분광법은 종종 부분적으로 또는 완전히 본질적으로 구조화되지 않은 단백질에 대한 고해상도 정보를 얻을 수 있는 유일한 방법입니다. 예를 들어 약물 후보 물질과의 상호 작용 전후의 구조를 알려진 생화학적 활성과 비교하는 형태 활동 관계를 결정하는 일반적인 도구가 되었습니다. 단백질은 앞서 이 기사에서 논의한 작은 유기 분자보다 수십 배 더 크지만, 기본적인 NMR 기법과 일부 NMR 이론도 적용됩니다. 기본적인 1D 스펙트럼은 작은 유기 화합물에 비해 단백질 분자에 존재하는 원자의 수가 훨씬 많기 때문에 직접적인 스펙트럼 분석이 불가능할 정도로 중첩된 신호로 붐빕니다. 따라서 이 문제를 다루기 위해 다차원(2, 3 또는 4D) 실험이 고안되었습니다. 이러한 실험을 용이하게 하기 위해서는 단백질에 C와 N을 동위원소로 표지하는 것이 바람직한데, 이는 우세한 자연 발생 동위원소 C가 NMR 활성이 아니며 우세한 자연 발생 N 동위원소의 핵 4중극 모멘트가 이 질소 동위원소로부터 고해상도 정보를 얻는 것을 방해하기 때문입니다. 단백질의 구조 결정에 사용되는 가장 중요한 방법은 분자 내 원자 간 거리를 측정하기 위해 NOE 실험을 활용합니다. 이어서 얻은 거리는 거리 기하학 문제를 해결하여 분자의 3D 구조를 생성하는 데 사용됩니다. NMR은 또한 단백질의 여러 영역의 역학 및 형태적 유연성에 대한 정보를 얻는 데 사용될 수 있습니다.
핵산
핵산 NMR은 NMR 분광법을 이용하여 DNA나 RNA와 같은 다핵산의 구조와 역학에 대한 정보를 얻는 것입니다. 2003년[update] 기준으로 알려진 모든 RNA 구조의 거의 절반이 NMR 분광법에 의해 결정되었습니다.[30]
핵산과 단백질 NMR 분광법은 비슷하지만 차이가 있습니다. 핵산은 NMR 분광법에서 일반적으로 관찰되는 원자인 수소 원자의 비율이 더 작고, 핵산 이중 나선은 뻣뻣하고 대략 선형이기 때문에 스스로 접혀 '장거리' 상관관계를 부여하지 않습니다.[31] 일반적으로 핵산으로 하는 NMR의 종류는 H 또는 양성자 NMR, C NMR, N NMR, P NMR입니다. 관통결합 핵결합을 검출하기 위한 상관분광법(COSY)과 전간섭전달분광법(TOCSY)과 같은 2차원 NMR 방법은 거의 항상 사용됩니다. 그리고 우주 공간에서 서로 가까운 핵 사이의 결합을 감지하기 위한 핵 오버하우저 효과 분광법(NOESY).[32]
스펙트럼에서 가져온 매개변수, 주로 NOESY 교차 피크 및 결합 상수를 사용하여 글리코시드 결합 각도, 다면체 각도(Karplus 방정식 사용) 및 슈가 퍼커 형태와 같은 로컬 구조적 특징을 결정할 수 있습니다. 대규모 구조의 경우 이중나선이 통과할 때 오류가 누적되고 단백질과 달리 이중나선은 내부가 조밀하지 않고 자체적으로 접히지 않기 때문에 이러한 로컬 매개변수를 다른 구조적 가정이나 모델로 보완해야 합니다. NMR은 또한 구부러진 나선, 비 Watson-Crick 기저 쌍 및 동축 적층과 같은 비표준 기하학적 구조를 조사하는 데 유용합니다. 줄기 루프 및 유사노트와 같은 복잡한 형태를 채택하는 경향이 있는 천연 RNA 올리고뉴클레오티드의 구조를 조사하는 데 특히 유용했습니다. NMR은 또한 단백질이나 약물과 같은 다른 분자에 대한 핵산 분자의 결합을 조사하는 데 유용합니다.[32]
탄수화물
탄수화물 NMR 분광법은 탄수화물의 구조와 형태에 대한 질문을 해결합니다. 1H NMR에 의한 탄수화물의 분석은 NMR 스펙트럼의 좁은 대역에 집중된 1H 공명을 유도하는 작용기의 제한된 변화로 인해 어렵다. 즉, 스펙트럼 분산이 잘 되지 않습니다. 아노머 탄소가 두 개의 산소 원자를 가지고 있기 때문에 아노머 양성자 공명은 다른 것들과 분리됩니다. 더 작은 탄수화물의 경우 아노머 양성자 공명의 분산은 개별 탄수화물 잔류물의 전체 스핀 시스템을 조사하기 위한 1D TOCSY 실험의 사용을 용이하게 합니다.
드럭 디스커버리
예를 들어 자유 리간드 구조 선호도와 구조 역학을 각각 살펴보는 등 NMR을 사용하여 용액에서 작은 분자의 에너지 최소 및 회전 에너지 장벽에 대한 지식을 확인할 수 있습니다. 이는 실험값과 계산값이 비슷하기 때문에 약물 설계 가설을 안내하는 데 사용할 수 있습니다. 예를 들어, 아스트라제네카는 종양학 연구 및 개발에 NMR을 사용합니다.[33]
고압 NMR 분광법
NMR 실험에서 압력을 가변 매개변수로 사용하는 데 전념한 최초의 과학적 연구 중 하나는 1994년 J. Jonas의 연구입니다.[34] NMR 분광학에서 고압의 사용은 주로 생화학 시스템을 연구하려는 욕구에 의해 주도되었으며, 고압의 사용은 큰 동요 없이 분자 간 상호 작용의 제어된 변화를 허용합니다.
물론 고압 NMR 분광법을 이용하여 과학적인 문제를 해결하려는 시도가 있었습니다. 하지만 대부분 고압을 만들고 유지하기 위한 장비의 문제로 재현이 어려웠습니다. 고압 NMR 실험을 실현하기 위한 가장 일반적인 NMR 셀 유형이 제공됩니다.
현재까지 고압 NMR 분광법은 주로 단백질 분자의 구조 특성과 관련된 다양한 응용 분야에 널리 사용되고 있습니다.[38][39] 그러나 최근에는 상태 파라미터를 그러한 변화의 원동력으로 사용하여 [40]초임계 유체 환경에서 작은 분자의 화학적 및 공간적 구조를 특성화하기 위한 소프트웨어 및 설계 솔루션이 제안되었습니다.[41]
참고 항목
핵분광법의 관련 방법:
참고문헌
- ^ Charles P. Slichter (1963). Principles of magnetic resonance: with examples from solid state physics. Harper & Row. ISBN 9783540084761.
- ^ Structural biology : practical NMR applications (PDF) (2nd ed.). Springer. 6 September 2012. p. 67. ISBN 978-1-4614-3964-6. Retrieved 7 December 2018.
- ^ Marc S. Reisch (June 29, 2015). "NMR Instrument Price Hikes Spook Users". CEN.
- ^ "Taking It Higher". The Scientist. Oct 30, 2000.
- ^ Paudler, William (1974). Nuclear Magnetic Resonance. Boston: Allyn and Bacon Chemistry Series. pp. 9–11.
- ^ "Discovery of NMR".
- ^ "Background and Theory Page of Nuclear Magnetic Resonance Facility". Mark Wainwright Analytical Centre - University of Southern Wales Sydney. 9 December 2011. Archived from the original on 27 January 2014. Retrieved 9 February 2014.
- ^ "4.7: NMR Spectroscopy". Chemistry LibreTexts. 2016-07-14. Retrieved 2023-11-25.
- ^ Balci, Metin (2005), "Dynamic NMR Spectroscopy", Basic 1H- and 13C-NMR Spectroscopy, Elsevier, pp. 213–231, doi:10.1016/b978-044451811-8.50008-5, ISBN 9780444518118, retrieved 2023-11-25
- ^ "NMR active nuclei for biological and biomedical applications". Open Medscience. Retrieved 2023-11-25.
- ^ Shah, N; Sattar, A; Benanti, M; Hollander, S; Cheuck, L (January 2006). "Magnetic resonance spectroscopy as an imaging tool for cancer: a review of the literature". The Journal of the American Osteopathic Association. 106 (1): 23–27. PMID 16428685. Archived from the original on 2013-04-07.
- ^ Johnson Jr., C. S. (1999). "Diffusion ordered nuclear magnetic resonance spectroscopy: principles and applications". Progress in Nuclear Magnetic Resonance Spectroscopy. 34 (3–4): 203–256. doi:10.1016/S0079-6565(99)00003-5.
- ^ Neufeld, R.; Stalke, D. (2015). "Accurate Molecular Weight Determination of Small Molecules via DOSY-NMR by Using External Calibration Curves with Normalized Diffusion Coefficients". Chem. Sci. 6 (6): 3354–3364. doi:10.1039/C5SC00670H. PMC 5656982. PMID 29142693.

- ^ Hanson, John E. (2013). "5. NMR Spectroscopy in Nondeuterated Solvents (No-D NMR): Applications in the Undergraduate Organic Laboratory". NMR Spectroscopy in the Undergraduate Curriculum. ACS Symposium Series. Vol. 1128. American Chemical Society. pp. 69–81. doi:10.1021/bk-2013-1128.ch005. ISBN 9780841227941.
- ^ Gottlieb, Hugo E.; Kotlyar, Vadim; Nudelman, Abraham (1997-10-01). "NMR Chemical Shifts of Common Laboratory Solvents as Trace Impurities". The Journal of Organic Chemistry. 62 (21): 7512–7515. doi:10.1021/jo971176v. ISSN 0022-3263.
- ^ Tiers, George Van Dyke (September 1958). "Reliable Proton Nuclear Resonance Shielding Values by "Internal Referencing" with Tetramethyl-silane". The Journal of Physical Chemistry. 62 (9): 1151–1152. doi:10.1021/j150567a041. ISSN 0022-3654.
- ^ "Nuclear Magnetic Resonance Spectroscopy Center Washington State University".
- ^ "Center for NMR Spectroscopy: The Lock". nmr.chem.wsu.edu.
- ^ "NMR Artifacts". www2.chemistry.msu.edu.
- ^ Parella, Teodor. "INVERSION-RECOVERY EXPERIMENT". triton.iqfr.csic.es.
- ^ James Keeler. "Chapter 2: NMR and energy levels" (reprinted at University of Cambridge). Understanding NMR Spectroscopy. University of California, Irvine. Retrieved 2007-05-11.
- ^ Peter Atkins (1994) [1990]. Physical Chemistry (5 ed.). Freeman.
- ^ Ott, J. C.; Wadepohl, H.; Enders, M.; Gade, L. H. (2018). "Taking Solution Proton NMR to Its Extreme: Prediction and Detection of a Hydride Resonance in an Intermediate-Spin Iron Complex". J. Am. Chem. Soc. 140 (50): 17413–17417. doi:10.1021/jacs.8b11330. PMID 30486649. S2CID 207195859.
- ^ Pople, J. A.; Bernstein, H. J.; Schneider, W. G. (1957). "The Analysis of Nuclear Magnetic Resonance Spectra". Can. J. Chem. 35: 65–81. doi:10.1139/v57-143.
- ^ Aue, W. P. (1976). "Two-dimensional spectroscopy. Application to nuclear magnetic resonance". The Journal of Chemical Physics. 64 (5): 2229. Bibcode:1976JChPh..64.2229A. doi:10.1063/1.432450.
- ^ Jeener, Jean (2007). "Jeener, Jean: Reminiscences about the Early Days of 2D NMR". Encyclopedia of Magnetic Resonance. doi:10.1002/9780470034590.emrhp0087. ISBN 978-0470034590.
- ^ 마틴, G.E; Zekter, A.S., 분자 연결성을 확립하기 위한 2차원 NMR 방법; VCH Publishers, Inc.: 뉴욕, 1988 (p.59)
- ^ "National Ultrahigh-Field NMR Facility for Solids". Retrieved 2014-09-22.
- ^ A. 라흐마니, C. 나이트, M. R. 모레. 음이온성 지질을 포함하는 양세포 분산액의 정수압에 대한 반응: 압력에 의한 상호 번호이동입니다. 2013, 29 (44), pp 13481–13490, doi:10.1021/la4035694
- ^ Fürtig, Boris; Richter, Christian; Wöhnert, Jens; Schwalbe, Harald (2003). "NMR Spectroscopy of RNA". ChemBioChem. 4 (10): 936–62. doi:10.1002/cbic.200300700. PMID 14523911. S2CID 33523981.
- ^ Addess, Kenneth J.; Feigon, Juli (1996). "Introduction to 1H NMR Spectroscopy of DNA". In Hecht, Sidney M. (ed.). Bioorganic Chemistry: Nucleic Acids. New York: Oxford University Press. ISBN 978-0-19-508467-2.
- ^ a b Wemmer, David (2000). "Chapter 5: Structure and Dynamics by NMR". In Bloomfield, Victor A.; Crothers, Donald M.; Tinoco, Ignacio (eds.). Nucleic acids: Structures, Properties, and Functions. Sausalito, California: University Science Books. ISBN 978-0-935702-49-1.
- ^ Balazs, Amber; Davies, Nichola; Longmire, David; Packer, Martin; Chiarparin, Elisabetta (2021). "NMR free ligand conformations and atomic resolution dynamics". Magnetic Resonance Discussions: 1–16. doi:10.5194/mr-2021-27. S2CID 233441183.
- ^ Jonas, J; Jonas, A (June 1994). "High-Pressure NMR Spectroscopy of Proteins and Membranes". Annual Review of Biophysics and Biomolecular Structure. 23 (1): 287–318. doi:10.1146/annurev.bb.23.060194.001443. ISSN 1056-8700.
- ^ Benedek, G. B.; Purcell, E. M. (1954-12-01). "Nuclear Magnetic Resonance in Liquids under High Pressure". The Journal of Chemical Physics. 22 (12): 2003–2012. doi:10.1063/1.1739982. ISSN 0021-9606.
- ^ Kamatari, Y (September 2004). "High-pressure NMR spectroscopy for characterizing folding intermediates and denatured states of proteins". Methods. 34 (1): 133–143. doi:10.1016/j.ymeth.2004.03.010.
- ^ Peterson, Ronald W.; Wand, A. Joshua (2005-09-01). "Self-contained high-pressure cell, apparatus, and procedure for the preparation of encapsulated proteins dissolved in low viscosity fluids for nuclear magnetic resonance spectroscopy". Review of Scientific Instruments. 76 (9): 1–7. doi:10.1063/1.2038087. ISSN 0034-6748. PMC 1343520. PMID 16508692.
- ^ Dubois, Cécile; Herrada, Isaline; Barthe, Philippe; Roumestand, Christian (2020-11-26). "Combining High-Pressure Perturbation with NMR Spectroscopy for a Structural and Dynamical Characterization of Protein Folding Pathways". Molecules. 25 (23): 5551. doi:10.3390/molecules25235551. ISSN 1420-3049. PMC 7731413. PMID 33256081.
- ^ Gagné, Donald; Azad, Roksana; Aramini, James M.; Xu, Xingjian; Isiorho, Eta A.; Edupuganti, Uthama R.; Williams, Justin; Marcelino, Leandro Pimentel; Akasaka, Kazuyuki (2020-08-26). Use of High Pressure NMR Spectroscopy to Rapidly Identify Proteins with Internal Ligand-Binding Voids (Report). Biophysics. doi:10.1101/2020.08.25.267195.
- ^ Khodov, I.A.; Belov, K.V.; Krestyaninov, M.A.; Sobornova, V.V.; Dyshin, A.A.; Kiselev, M.G. (August 2023). "Does DMSO affect the conformational changes of drug molecules in supercritical CO2 Media?". Journal of Molecular Liquids. 384: 122230. doi:10.1016/j.molliq.2023.122230.
- ^ Khodov, I.A.; Belov, K.V.; Dyshin, A.A.; Krestyaninov, M.A.; Kiselev, M.G. (December 2022). "Pressure effect on lidocaine conformational equilibria in scCO2: A study by 2D NOESY". Journal of Molecular Liquids. 367: 120525. doi:10.1016/j.molliq.2022.120525.
더보기
- John D. Roberts (1959). Nuclear Magnetic Resonance : applications to organic chemistry. McGraw-Hill Book Company. ISBN 9781258811662.
- J.A.Pople; W.G.Schneider; H.J.Bernstein (1959). High-resolution Nuclear Magnetic Resonance. McGraw-Hill Book Company.
- A. Abragam (1961). The Principles of Nuclear Magnetism. Clarendon Press. ISBN 9780198520146.
- Charles P. Slichter (1963). Principles of magnetic resonance: with examples from solid state physics. Harper & Row. ISBN 9783540084761.
- John Emsley; James Feeney; Leslie Howard Sutcliffe (1965). High Resolution Nuclear Magnetic Resonance Spectroscopy. Pergamon. ISBN 9781483184081.
외부 링크
- James Keeler. "Understanding NMR Spectroscopy" (reprinted at University of Cambridge). University of California, Irvine. Retrieved 2007-05-11.
- NMR의 기초 - RIT 화학 교수 Joseph Hornak 박사의 NMR 이론, 장비 및 기법에 대한 비기술적 개요
- GAMMA 및 PyGAMMA 라이브러리 - GAMMA는 핵자기 공명 분광학 실험을 위해 작성된 오픈 소스 C++ 라이브러리입니다. PyGAMMA는 GAMMA 주변의 파이썬 래퍼입니다.
- NMR 동역학 분석을 위한 이완 소프트웨어
- Vespa - Vespa (Versatile Simulation, Puls and Analysis)는 3개의 Python 애플리케이션으로 구성된 자유 소프트웨어 제품군입니다. 이러한 GUI 기반 도구는 자기 공명(MR) 스펙트럼 시뮬레이션, RF 펄스 설계, MR 데이터의 스펙트럼 처리 및 분석을 위한 것입니다.


