하이포아염소산염
Hypochlorite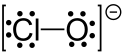 | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 하이포아염소산염 | |
| 시스템 IUPAC 이름 염소산염(I) | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 켐스파이더 | |
| ECHA 정보 카드 | 100.235.795 |
| 682 | |
PubChem CID | |
| 유니 | |
| UN 번호 | 3212 |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| 켤레산 | 차아염소산 |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
화학에서 차아염소산염은 화학식이− ClO인 음이온이다.그것은 많은 양이온과 결합하여 차아염소산염을 형성한다.일반적인 예로는 차아염소산나트륨(가정 표백제)과 차아염소산칼슘(표백제 분말의 성분, 수영장 "염소")[1]이 있습니다.ClO에서의− Cl-O 거리는 1.69Ω입니다.[2]
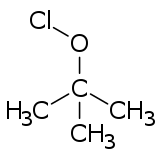
이름은 또한 차아염소산의 에스테르, 즉 ClO-기가 분자의 나머지 부분에 공유 결합되어 있는 유기 화합물을 나타낼 수 있다.대표적인 예가 유용한 염소화제인 [3]차아염소산테르트 부틸이다.
대부분의 차아염소산염은 수용액으로 취급된다.표백제, 소독제, 수처리제 등 주요 용도가 있습니다.그것들은 또한 염소와 산화 반응에 화학적으로 사용된다.
반응
산반응
차아염소산염의 산성화에 의해 차아염소산이 생성되며, 차아염소산은 염소와 평형상태로 존재한다.pH가 높으면 반응이 왼쪽으로 진행됩니다.
- 2+
H + ClO−
+ Cl−
† Cl
2 + HO
2
안정성.
하이포아염소산염은 일반적으로 불안정하며 많은 화합물이 용액에만 존재한다.차아염소산 리튬 LiOCl, 차아염소산칼슘 Ca(OCL)2 및 차아염소산바륨 Ba(ClO)2를 순수 무수화합물로 분리하였다.모두 고체입니다.몇 개는 수용액으로 더 생산될 수 있다.일반적으로 희석량이 클수록 안정성이 높아집니다.알칼리 토류 금속염의 상당수는 형성할 수 없기 때문에 동향을 판단할 수 없다.차아염소산 베릴륨은 전례가 없다.순수 차아염소산 마그네슘은 제조할 수 없지만 고체 Mg(OH)는OCL이 [4]인식되고 있다.차아염소산칼슘은 산업 규모로 생산되어 안정성이 좋다.차아염소산 스트론튬, Sr(OCL)2은 특성이 뛰어나지 않으며 안정성은 아직 [5]결정되지 않았다.
가열 시 차아염소산염은 염화물, 산소 및 염소산염의 혼합물로 분해됩니다.
- 2−
ClO → 2 Cl−
+ O
2 - 3−
ClO → 2 Cl−
+ ClO−
3
이 반응은 발열성이며 LiOCL 및 Ca(OCL)2와 같은 농축 차아염소산염의 경우 위험한 열 폭주 및 잠재적 [6][7]폭발로 이어질 수 있습니다.
알칼리 금속 차아염소산염은 군에서 안정성이 떨어진다.무수 차아염소산리튬은 상온에서 안정적이지만 차아염소산나트륨은 펜타히드레이트(NaOCl·(HO2))5보다 건조하게 제조되지 않았다.이는 0°[8]C 이상에서는 불안정하지만 가정용 표백제로 접하는 희석 용액이 안정성이 더 우수합니다.차아염소산칼륨(KOCl)은 [4]용액에서만 알려져 있습니다.
란타니드 차아염소산염은 또한 불안정하지만,[9] 물이 있을 때보다 무수 형태로 더 안정적이라고 보고되어 왔다.하이포아염소산염은 세륨을 +3에서 +4 산화 [10]상태로 산화시키는 데 사용되어 왔다.
차아염소산 자체는 분해되어 염소를 형성하기 때문에 격리되어 안정적이지 않다.그것의 분해는 또한 어떤 형태로든 산소를 발생시킨다.
암모니아와의 반응
하이포아염소산염은 먼저 암모니아와 반응하여 모노클로라민(NHCl
2), 디클로라민(NHCl
2), 그리고 마지막으로 질소 트리클로라이드(NCL
3)[1]를 생성한다.
- NH
3 + ClO−
→ HO−
+ NHCl
2
- NHCl
2 + ClO−
→ HO−
+ NHCl
2
- NHCl
2 + ClO−
→ HO−
+ NCl
3
준비
차아염소산염
염소와 알칼리 및 알칼리 토류 금속 수산화물의 반응에 의해 형성되는 차아염소산염.염소산염의 형성을 억제하기 위해 상온에 가까운 온도에서 반응한다.이 과정은 차아염소산나트륨(NaClO)과 차아염소산칼슘(Ca(ClO))2의 산업 생산에 널리 사용된다.
- Cl2 + 2 NaOH → NaCl + NaClO + HO2
- 2 Cl2 + 2 Ca(OH)2 → CaCl2 + Ca(ClO)2 + 2 HO2
또한 많은 양의 차아염소산나트륨은 분리되지 않은 클로로알칼리 과정을 통해 전기화학적으로 생산된다.이 공정에서 염수를 전해하여 Cl을 형성하고
2, Cl은 물에서 해리하여 차아염소산염을 형성한다.이 반응은 염소의 방출을 방지하기 위해 비산 조건에서 수행되어야 한다:
- 2−
Cl → Cl
2 + 2− e
- Cl
2 + HO
2 h HClO + Cl−
+ H+
일부 차아염소산염은 차아염소산칼슘과 다양한 금속 황산염 사이의 염화수소 반응으로 얻어질 수도 있다.이 반응은 물에서 수행되며 용해되지 않는 황산칼슘의 형성에 의존하며, 황산칼슘은 용액 밖으로 침전되어 반응을 완료로 이끈다.
- Ca(ClO)2 + MSO4 → M(ClO)2 + CaSO4
유기 차아염소산염
차아염소산에스테르류는 일반적으로 대응하는 알코올로부터 여러 시약(예: 염소, 차아염소산, 디클로로인 및 다양한 산화된 차아염소산염)[3] 중 하나로 처리된다.
생화학
유기염소화합물의 생합성
클로로페르옥시다아제는 유기화합물의 염소화를 촉매하는 효소이다.이 효소는 무기 기질인 염화수소와 과산화수소를 결합하여 Cl의 상당량을+ 생성하며, 이는 탄화수소 기질의 양성자를 대체합니다.
- R-H + Cl− + HO22+ + H → R-Cl + 2 HO2
Cl의+ 공급원은 차아염소산(HOCl)[12]이다.많은 유기염소화합물들은 이런 방식으로 생합성된다.
면역 반응
감염에 대한 반응으로, 인간의 면역체계는 호중구 과립구라고 불리는 특별한 백혈구 [13]내에서 미량의 차아염소산염을 생성한다.이 과립구들은 세포 내 액포에 있는 바이러스와 박테리아를 삼켜서 소화된다.
소화 메커니즘의 일부는 효소 매개 호흡 버스트를 포함하며, 이는 (NADPH 산화효소에 의해 생산되는) 슈퍼옥시드를 포함한 반응성 산소 유래 화합물을 생성한다.슈퍼옥시드는 산소와 과산화수소로 분해되는데, 이는 염화물을 차아염소산염으로 [14][15][16]변환하기 위해 미엘로페르옥시다아제 촉매 반응에서 사용됩니다.
저농도의 차아염소산염은 또한 미생물의 열충격 단백질과 상호작용하여 세포 내 보호자 역할을 자극하고 박테리아가 결국 [17]사멸할 덩어리로 형성되도록 하는 것으로 밝혀졌다.같은 연구에서 낮은 (미소극) 차아염소산염 수치가 대장균과 비브리오콜레라균이 보호 메커니즘을 활성화하도록 유도한다는 것이 밝혀졌지만 그 의미는 [17]명확하지 않았다.
어떤 경우에, 차아염소산염의 염기 산도는 [citation needed]풍선을 터뜨리는 것과 유사한 반응인 박테리아의 지질막을 손상시킨다.
산업용 및 국내용
차아염소산염, 특히 나트륨("액상 표백제", "자벨 물")과 칼슘("표백 분말")은 의류를 하얗게 하고 머리색을 밝게 하며 얼룩을 제거하는 데 산업 및 가정에서 널리 사용됩니다.그것들은 1785년 프랑스 화학자 클로드 베르톨레가 그 성질을 발견한 직후에 개발된 최초의 상업용 표백 제품이었다.
하이포아염소산염은 광스펙트럼 살균제 및 탈취제로도 널리 사용된다.이 응용은 프랑스 화학자 라바라크가 1820년경 그러한 성질을 발견한 직후에 시작되었다.
실험실의 용도
산화제로서
하이포아염소산염은 염소 옥시 음이온 중 가장 강한 산화제이다.이는 시리즈 전체에서 표준 반전지 전위를 비교함으로써 확인할 수 있습니다. 또한 데이터는 염소 산화 음이온이 산성 조건에서 [18]더 강한 산화제임을 보여줍니다.
| 이온 | 산성 반응 | E°(V) | 중성/기초 반응 | E°(V) |
|---|---|---|---|---|
| 하이포아염소산염 | H+ + HOCL + e− →1⁄2 Cl2(g) + H2O | 1.63 | ClO− + HO2 + 2− e → Cl− + 2 OH− | 0.89 |
| 아염소산염 | 3+ H + HOCLO + 3 e− → 1µ2 Cl2(g) + 2 HO2 | 1.64 | ClO− 2 + 22 HO + 4 e− → Cl− + 4 OH− | 0.78 |
| 염소산염 | 6+ H + ClO− 3 + 5 e− → 1µ2 Cl2(g) + 3 HO2 | 1.47 | ClO− 3 + 32 HO + 6 e− → Cl− + 6 OH− | 0.63 |
| 과염소산염 | 8+ H + ClO− 4 + 7 e− → 1µ2 Cl2(g) + 4 HO2 | 1.42 | ClO− 4 + 42 HO + 8 e− → Cl− + 8 OH− | 0.56 |
하이포아염소산염은 야콥센 에폭시화 반응 중에 Mn(III)을 Mn(V)로 변환하고 Ce를 [10]Ce로4+
변환하기에3+
충분히 강한 산화제이다.이 산화력이 그들을 효과적인 표백제와 소독제로 만든다.
유기화학에서 차아염소산염은 1차 알코올을 카르본산으로 [19]산화시키는 데 사용될 수 있다.
염소화제로서
하이포아염소염은 염소화제로도 사용할 수 있다.예를 들어, 그들은 페놀을 클로로페놀로 변환한다.차아염소산칼슘은 피페리딘을 N-클로로피페리딘으로 변환한다.
관련 산소 음이온
염소는 산화 상태가 -1, +1, +3, +5, 또는 +7인 옥시 음이온의 핵이 될 수 있다(중성 화합물 이산화염소2 ClO에서 +4의 산화 상태를 가정할 수도 있다).
| 염소 산화 상태 | −1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| 이름. | 염화물 | 차아염소산염 | 염소산염 | 염소산염 | 과염소산염 |
| 공식 | 클론− | CLO− | CLO− 2 | CLO− 3 | CLO− 4 |
| 구조. |  |  |  |
「 」를 참조해 주세요.
레퍼런스
- ^ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Topić, Filip; Marrett, Joseph M.; Borchers, Tristan H.; Titi, Hatem M.; Barrett, Christopher J.; Friščić, Tomislav (2021). "After 200 Years: The Structure of Bleach and Characterization of Hypohalite Ions by Single-Crystal X-Ray Diffraction". Angew. Chem. Int. Ed. 60 (46): 24400–24405. doi:10.1002/anie.202108843. PMID 34293249. S2CID 236199263.
- ^ a b Mintz, M. J.; C. Walling (1969). "t-Butyl hypochlorite". Organic Syntheses. 49: 9. doi:10.15227/orgsyn.049.0009.
- ^ a b Aylett, founded by A.F. Holleman ; continued by Egon Wiberg ; translated by Mary Eagleson, William Brewer ; revised by Bernhard J. (2001). Inorganic chemistry (1st English ed., [edited] by Nils Wiberg. ed.). San Diego, Calif. : Berlin: Academic Press, W. de Gruyter. p. 444. ISBN 978-0123526519.
- ^ Ropp, Richard (2012). Encyclopedia of the Alkaline Earth Compounds. Newnes. p. 76. ISBN 978-0444595539.
- ^ Ropp, Richard C. (2012-12-31). Encyclopedia of the alkaline earth compounds. Oxford: Elsevier Science. p. 75. ISBN 978-0444595539.
- ^ Clancey, V.J. (1975). "Fire hazards of calcium hypochlorite". Journal of Hazardous Materials. 1 (1): 83–94. doi:10.1016/0304-3894(75)85015-1.
- ^ Brauer, G. (1963). Handbook of Preparative Inorganic Chemistry; Vol. 1 (2nd ed.). Academic Press. p. 309.
- ^ Vickery, R. C. (1 April 1950). "Some reactions of cerium and other rare earths with chlorine and hypochlorite". Journal of the Society of Chemical Industry. 69 (4): 122–125. doi:10.1002/jctb.5000690411.
- ^ a b V. R. Sastri; et al. (2003). Modern Aspects of Rare Earths and their Complexes (1st ed.). Burlington: Elsevier. p. 38. ISBN 978-0080536682.
- ^ Simpkins, Nigel S.; Cha, Jin K. (2006). "t-Butyl Hypochlorite". Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rb388.pub2. ISBN 0471936235.
- ^ Hofrichter, M.; Ullrich, R.; Pecyna, Marek J.; Liers, Christiane; Lundell, Taina (2010). "New and classic families of secreted fungal heme peroxidases". Appl Microbiol Biotechnol. 87 (3): 871–897. doi:10.1007/s00253-010-2633-0. PMID 20495915. S2CID 24417282.
- ^ Marcinkiewicz, Janusz; Kontny, Ewa (2014). "Taurine and inflammatory diseases". Amino Acids. 46 (1): 7–20. doi:10.1007/s00726-012-1361-4. PMC 3894431. PMID 22810731.
- ^ Harrison, J. E.; J. Schultz (1976). "Studies on the chlorinating activity of myeloperoxidase". Journal of Biological Chemistry. 251 (5): 1371–1374. doi:10.1016/S0021-9258(17)33749-3. PMID 176150.
- ^ Thomas, E. L. (1979). "Myeloperoxidase, hydrogen peroxide, chloride antimicrobial system: Nitrogen-chlorine derivatives of bacterial components in bactericidal action against Escherichia coli". Infect. Immun. 23 (2): 522–531. doi:10.1128/IAI.23.2.522-531.1979. PMC 414195. PMID 217834.
- ^ Albrich, JM; McCarthy, CA; Hurst, JK (January 1981). "Biological reactivity of hypochlorous acid: implications for microbicidal mechanisms of leukocyte myeloperoxidase". Proceedings of the National Academy of Sciences of the United States of America. 78 (1): 210–4. Bibcode:1981PNAS...78..210A. doi:10.1073/pnas.78.1.210. PMC 319021. PMID 6264434.
- ^ a b Jakob, U.; J. Winter; M. Ilbert; P.C.F. Graf; D. Özcelik (14 November 2008). "Bleach Activates A Redox-Regulated Chaperone by Oxidative Protein Unfolding". Cell. Elsevier. 135 (4): 691–701. doi:10.1016/j.cell.2008.09.024. PMC 2606091. PMID 19013278.
- ^ Cotton, F. Albert; Wilkinson, Geoffrey (1988), Advanced Inorganic Chemistry (5th ed.), New York: Wiley-Interscience, p. 564, ISBN 0-471-84997-9
- ^ Warren, Jonathan Clayden, Nick Greeves, Stuart (2012-03-15). Organic chemistry (2nd ed.). Oxford: Oxford University Press. p. 195. ISBN 978-0-19-927029-3.