삼요오드화질소
Nitrogen triiodide | |||
| | |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름 | |||
| 기타 이름 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 켐스파이더 | |||
PubChem CID | |||
CompTox 대시보드 (EPA ) | |||
| |||
| |||
| 특성. | |||
| NI3 | |||
| 몰 질량 | 394.719 g/g | ||
| 외모 | 암고체 | ||
| 비등점 | -20°C에서의 서브라이임 | ||
| 불용해 | |||
| 용해성 | 디에틸에테르와 같은 유기 [2]용제 | ||
| 위험 요소 | |||
| 산업안전보건(OHS/OSH): | |||
주요 위험 요소 | 폭발성이 매우 높다 | ||
| NFPA 704(파이어 다이아몬드) | |||
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |||
트리요오드화질소는 식3 NI의 무기화합물이다.그것은 매우 민감한 접촉 폭발물입니다: 소량이 가볍게 건드리면 크고 날카로운 찰칵 소리와 함께 폭발하여 보라색 요오드 증기의 구름을 방출합니다. 알파 방사선에 의해 폭발할 수도 있습니다.NI는3 파생물의 불안정성 때문에 연구하기 어려운 복잡한 구조 화학을 가지고 있다.
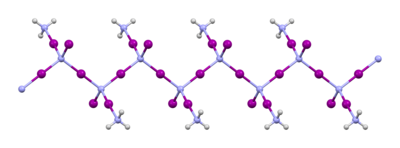
NI 및 그 파생상품의 구조3
삼요오드화 질소는 1990년 암모니아가 없는 경로를 통해 제조된 라만 분광법에 의해 처음 특징지어졌다.질화 붕소는 -30°C에서 트리클로로플루오로메탄에서 모노플루오르화 요오드(monofluoride)와 반응하여 낮은3 수율:[3]
- BN + 3 IF → NI3 + BF3
NI는3 다른 삼할화질소와 암모니아와 [4]마찬가지로 피라미드형이다3v.
보통 "질소 삼요오드화물"이라고 불리는 물질은 요오드와 암모니아가 반응하여 만들어집니다.무수 암모니아에서 저온에서 이 반응을 할 때 초기 생성물은 NI · 5(NH)이지만33, 이 물질은 가열 시 약간의 암모니아가 손실되어 1:1 부가물3 NI3 · NH가 된다.이 부가물은 1812년 Bernard Courtois에 의해 처음 보고되었고, 그 공식은 마침내 1905년 Oswald Silberrad에 [5]의해 결정되었다.그것의 고체 구조는 -NI-I-NI-I-NI-의222 [6]사슬들로 구성되어 있다.암모니아 분자는 사슬 사이에 있다.NI · NH는 암모니아로 어두운 곳에서 차갑게 유지하고 축축하게 유지하면3 안정적이다3.
분해 및 폭발성
NI 및3 NI · NH의3 불안정성은3 3개의 큰 요오드 원자가 상대적으로 작은 질소 원자 주위에 서로 근접하게 유지되어 발생하는 큰 입체 변형에 기인할 수 있다.따라서 분해에 대한 활성화 에너지가 매우 낮으며, N-요오드화물의2 안정성이 뛰어나기 때문에 반응이 더욱 유리하다. 질소 삼요오드화물은 충격 감도가 매우 높아서 실질적인 상업적 가치가 없으므로 폭발을 통제하기 위해 저장, 운송 및 활용할 수 없다.순수한 니트로글리세린은 강력하면서도 충격에 매우 민감하지만(날개의 접촉으로 폭발할 수 있는 질소 트리요오드화물만큼은 아니지만), 니트로글리세린의 충격 민감도가 낮아지고 다이너마이트 형태로 취급하고 운반하는 것이 안전해졌다.
NI의 분해는3 다음과 같이 진행되어 질소가스와 요오드를 얻는다.
- 23 NI (s) → N2 (g) + 3 I2 (g) (-130 kJ/mol)
그러나 건조 재료는 접촉 폭약으로,[4] 대략 다음과 같이 분해됩니다.
- 83 NI · NH3 → 52 N + 64 NHI + 9 I2
이러한 폭발은 티오황산나트륨 용액으로 제거할 수 있는 요오드의 주황색에서 보라색 얼룩을 남긴다.얼룩 제거의 다른 방법은 단순히 요오드 시간이 승화되도록 하는 것이다.소량의 삼요오드화 질소는 때때로 고등학교 화학 학생들에게 시연하거나 "화학 마술"[7]의 작용으로 합성된다.화합물의 민감성을 강조하기 위해, 그것은 보통 깃털로 그것을 만지면 폭발하지만, 아주 작은 기류, 레이저 빛 또는 다른 움직임도 폭발을 일으킬 수 있다.삼요오드화질소는 알파 입자와 핵분열 [8]생성물에 노출되면 폭발하는 유일한 화학 폭발물로도 유명하다.
레퍼런스
- ^ a b c 아날로그 암별, NF 이름, IUPAC Red Book 2005, 페이지 314 참조3
- ^ (4) 분석 기법acornusers.org
- ^ Tornieporth-Oetting, I.; Klapötke, T. (1990). "Nitrogen Triiodide". Angewandte Chemie International Edition. 29 (6): 677–679. doi:10.1002/anie.199006771.
- ^ a b Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ Silberrad, O. (1905). "The Constitution of Nitrogen Triiodide". Journal of the Chemical Society, Transactions. 87: 55–66. doi:10.1039/CT9058700055.
- ^ Hart, H.; Bärnighausen, H.; Jander, J. (1968). "Die Kristallstruktur von Stickstofftrijodid‐1‐Ammoniak NJ3 · NH3". Z. Anorg. Allg. Chem. 357 (4–6): 225–237. doi:10.1002/zaac.19683570410.
- ^ Ford, L. A.; Grundmeier, E. W. (1993). Chemical Magic. Dover. p. 76. ISBN 0-486-67628-5.
- ^ Bowden, F. P. (1958). "Initiation of Explosion by Neutrons, α-Particles, and Fission Products". Proceedings of the Royal Society of London A. 246 (1245): 216–219. Bibcode:1958RSPSA.246..216B. doi:10.1098/rspa.1958.0123. S2CID 137728239.