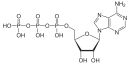유기산무수화물
Organic acid anhydride유기산 무수화물은[citation needed] 유기 화합물인 무수화물이다. 무수화산은 동일한 산소 원자에 두 개의 아틸 그룹을 결합한 화합물이다.[1] 무수화물 유기산의 일반적인 유형은 무수화물인 카복실산인데, 모산은 무수화물 존재(RC(O)2O)의 공식인 카복실산이다. 이러한 유형의 대칭산 무수체는 모카복실산의 이름으로 무수라는 단어로 산이라는 단어를 대체하여 명명한다.[2] 따라서 (CHCO3)2O는 아세트산 무수화물이라고 불린다. 혼합(또는 비대칭)산 무수화물(아래 참조)은 서로 다른 두 개의 카르복실산 사이에서 반응이 발생하는 아세트산 포말릭 무수화물(아세트산)과 같은 무수화물이 알려져 있다. 비대칭산 무수화물 명명법에는 "무수화"라는 단어 앞에 반응한 두 카복실산의 이름이 모두 열거되어 있다(예를 들어, 벤조산과 프로파노산 사이의 탈수 반응은 "벤조아 프로파노화 무수화"를 산출한다).[3]
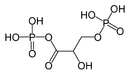
무수화물 산의 아킬 그룹 중 하나 또는 둘 다 설폰산이나 인산 같은 다른 유형의 유기산에서 파생될 수 있다. 무수산의 아틸 그룹 중 하나는 인산과 같은 무기산에서 파생될 수 있다. 혼합 무수화물 1,3-비스포글리세르산은 글리코분해를 통한 ATP 형성의 중간 물질로, 3-인포글리세르산과 인산 혼합 무수화물이다.[4] 산성 산화물은 또한 산성 무수화물로 분류된다.
준비
유기산 무수화물은 다양한 수단으로 산업에서 준비된다. 아세트산 무수화물은 주로 아세트산 메틸의 카보닐화에 의해 생성된다.[5] 말레틱 무수화물은 벤젠이나 부탄의 산화에 의해 생성된다. 실험실 경로는 해당 산의 탈수 현상을 강조한다. 산마다 조건이 다르지만 오산화 인은 일반적인 탈수제다.
- 2 CH3COOH + P4O10 → CH3C(O)OC(O)CH3 + "P4O9(OH)2"
- CHC3(O)Cl + HCONA2 → HCOCOCH23 + NaCl
아세틸 그룹을 포함하는 혼합 무수체는 케틴으로부터 준비된다.
- RCO2H + H2C=C=O → RCO2C(O)CH3
반응
무수산은 반응성 아킬 그룹의 원천이며, 이들의 반응과 용도는 아킬 할리드의 반응과 유사하다. 원성 기질과의 반응에서, 반응은 아큐레이트 제품과 카복실산을 동일한 양으로 제공한다.
- RC(O)OC(O)R + HY → RC(O)Y + RCO2H
HY = HOR(알코올), HNR'(2암모니아, 1차, 2차 아민), 방향족 링(Friedel-Crafts acylation 참조).
무수산은 아킬염화물에 비해 전기생성이 떨어지는 경향이 있고, 무수화산 분자당 1개의 아킬그룹만 전달돼 원자효율이 낮다. 그러나 저비용의 무수화물은 아세틸화 반응을 위한 일반적인 선택이다.
무수화물의 적용 및 발생
- 무수화합물 예시료
복잡한 유기화합물의 구성 요소인 나프탈렌테트라카복실리 디아나리드는 디아나리드의 예다.
"혼합 무수화물" 1,3-bisphosphoglycer acid는 대사 경로에서 광범위하게 발생한다.
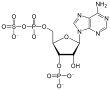
3'-인산소아데노신-5'-인산황산염(PAPS)은 황산과 인산이 혼합된 무수체로 생물학적 황산 전달 반응에서 가장 흔한 코엔자임이다.
아세트산 무수화물은 아세트산 에스테르(예: 셀룰로오스 아세테이트)를 준비하는 데 널리 사용되는 주요 산업 화학 물질이다. 말레닉 무수화물은 스티렌과 결합하여 다양한 수지의 전구체다. 말레닉 무수화물(Maleic anhilide)은 디엘-알데르 반응의 디엔노필이다.[7]
두 개의 산성 무수화물 함수를 포함하는 분자인 디아나리드는 폴리이미드를 합성하는 데 사용되며, 때로는 폴리에스테르와 폴리아미드를 합성하는 데 사용된다. Examples of dianhydrides: pyromellitic dianhydride (PMDA), 3,3’, 4,4’ - oxydiphtalic dianhydride (ODPA), 3,3’, 4,4’-benzophenone tetracarboxylic dianhydride (BTDA), 4,4’-diphtalic (hexafluoroisopropylidene) anhydride (6FDA), benzoquinonetetracarboxylic dianhydride, ethylenetetracarboxylic dianhydride. 폴리아나무화물은 폴리머 백본 체인의 반복 단위를 연결하는 무수화합물이 특징인 폴리머의 일종이다.
생물학적 발생
산성 무수화물을 함유한 천연물들은 동물, 박테리아, 곰팡이로부터 격리되어 왔다.[8][9][10] 스페인 파리, 리타 베시카토리아, 토토마이신 등 물집벌레 종의 카나타리딘이 대표적이다. 광범위한 항생제 및 항균 활성을 가진 진균 2차 대사물의 말리드라이드 계열은 수성 무수화물 기능군을 가진 알리사이클릭 화합물이다.[11] 원핵생물과[12] 진핵생물의[13] 많은 단백질은 무수화물 중간 산물을 통해 아미노산 잔류 아스파르트산과 프롤라인 사이에서 자발적인 갈라짐을 겪는다. 어떤 경우에는 무수체가 네이세리아 메닌기티디스균의 표면이나 근처에 국부화된 단백질과 같은 다른 세포 성분의 핵소체와 반응할 수 있다.[14]
아날로그
질소
Imides는 구조적으로 관련된 유사 물질로, 브리징 산소가 질소로 대체된다. 그것들은 유사하게 암모니아와 함께 디카복실산의 응축에 의해 형성된다. 모든 산소 원자를 질소로 대체하면 이미딘이 생기는데, 이것들은 가수분해되기 쉬운 희귀한 기능 그룹이다.
유황
유황은 카보닐 그룹이나 다리에서 산소를 대체할 수 있다. 전자의 경우, (thioacetic) 무수화([2]CHC3(S)OC(S)CH3)와 같이 이름에서 모호성을 피하기 위해 아틸 그룹의 이름을 괄호 안에 감싼다. 두 개의 아틸 그룹이 동일한 황 원자에 부착될 때, 그 결과 화합물은 티오아나 무수화물([2]예: 아세트산 티오아나이드(CHC3(O)2S))이라고 한다.
참고 항목
| Wikiquote는 다음과 관련된 인용구를 가지고 있다: 유기산 무수화물 |
참조
- ^ IUPAC, 화학용어 종합편찬, 제2편. ("금책")(1997년). 온라인 수정 버전: (2006–) "무수화물". doi:10.1351/골드북.A00072
- ^ a b c Panico R, Powell WH, Richer JC, eds. (1993). "Recommendation R-5.7.7". A Guide to IUPAC Nomenclature of Organic Compounds. IUPAC/Blackwell Science. pp. 123–25. ISBN 0-632-03488-2.
- ^ "Nomenclature of Anhydrides". 8 November 2013.
- ^ 넬슨, D. L.; 콕스, M. M. "레닝거, 생화학의 원리" 3차 에드. 게시할 가치가 있는 항목: 2000년 뉴욕 ISBN 1-57259-153-6
- ^ Zoeller, J. R.; Agreda, V. H.; Cook, S. L.; Lafferty, N. L.; Polichnowski, S. W.; Pond, D. M. "Eastman Chemical Company Acetic Anhydride Process" Catalysis Today (1992), volume 13, pp.73-91. doi:10.1016/0920-5861(92)80188-S
- ^ Lewis I. Krimen (1988). "Acetic Formic Anhydride". Organic Syntheses.; Collective Volume, 6, p. 8
- ^ 하이모 홀드, 알프레드 렝스틀, 디터 마이어 "아세트산 무수화물 및 혼합 지방산 무수화물" 울만의 2002 산업 화학 백과사전, 와일리-VCH, 웨인하임. doi:10.1002/14356007.a01_065
- ^ Saleem, Muhammad; Hussain, Hidayat; Ahmed, Ishtiaq; Draeger, Siegfried; Schulz, Barbara; Meier, Kathrin; Steinert, Michael; Pescitelli, Gennaro; Kurtán, Tibor; Flörke, Ulrich; Krohn, Karsten (February 2011). "Viburspiran, an Antifungal Member of the Octadride Class of Maleic Anhydride Natural Products". European Journal of Organic Chemistry. 2011 (4): 808–812. doi:10.1002/ejoc.201001324.
- ^ Han, Chunguang; Furukawa, Hiroyuki; Tomura, Tomohiko; Fudou, Ryosuke; Kaida, Kenichi; Choi, Bong-Keun; Imokawa, Genji; Ojika, Makoto (24 April 2015). "Bioactive Maleic Anhydrides and Related Diacids from the Aquatic Hyphomycete Tricladium castaneicola". Journal of Natural Products. 78 (4): 639–644. doi:10.1021/np500773s. PMID 25875311.
- ^ Heard, David M.; Tayler, Emyr R.; Cox, Russell J.; Simpson, Thomas J.; Willis, Christine L. (3 January 2020). "Structural and synthetic studies on maleic anhydride and related diacid natural products" (PDF). Tetrahedron. 76 (1): 130717. doi:10.1016/j.tet.2019.130717. S2CID 209714625.
- ^ Chen, Xiaolong; Zheng, Yuguo; Shen, Yinchu (May 2007). "Natural Products with Maleic Anhydride Structure: Nonadrides, Tautomycin, Chaetomellic Anhydride, and Other Compounds". Chemical Reviews. 107 (5): 1777–1830. doi:10.1021/cr050029r. PMID 17439289.
- ^ Kuban, Vojtech (2020). "Structural Basis of Ca 2+-Dependent Self-Processing Activity of Repeat-in-Toxin Proteins". mBio. 11 (2): e00226-20. doi:10.1128/mBio.00226-20. PMC 7078468. PMID 32184239.
- ^ Bell, Christian (2013). "Structure of the repulsive guidance molecule (RGM)-neogenin signaling hub". Science. 341 (6141): 77–80. Bibcode:2013Sci...341...77B. doi:10.1126/science.1232322. PMC 4730555. PMID 23744777.
- ^ Scheu, Arne (2021). "NeissLock provides an inducible protein anhydride for covalent targeting of endogenous proteins". Nature Communications. 12 (1): 717. Bibcode:2021NatCo..12..717S. doi:10.1038/s41467-021-20963-5. PMC 7846742. PMID 33514717.