질화규소
Silicon nitride 소결 실리콘 질화 세라믹 | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 질화규소 | |
| 기타 이름 니에라이트 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.031.620 |
| EC 번호 |
|
| 메슈 | 실리콘+니트라이드 |
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| Si3N4 | |
| 어금질량 | 140.283 g·1998−1 |
| 외관 | 회색 무취 분말[1] |
| 밀도 | 3.17 g/cm3[1] |
| 녹는점 | 1,900 °C(3,450 °F, 2,170 K)[1] (손상) |
| 불용성[1] | |
굴절률(nD) | 2.016[2] |
| 열화학[3] | |
성 어금니 엔트로피 (S | 101.3 J·몰−1·K−1 |
의 성 엔탈피 대형화 (ΔfH⦵298) | −743.5 kJ·mol−1 |
기브스 자유 에너지 (ΔfG˚) | −642.6 kJ·mol−1 |
| 위험 | |
| 산업안전보건(OHS/OSH): | |
주요 위험 | [4] |
| 관련 화합물 | |
기타 음이온 | 실리콘 카바이드, 이산화규소 |
기타 양이온 | 질화 붕소 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
질화실리콘은 실리콘과 질소의 화학적 화합물이다.SiN은
3
4 질화규소 중에서 가장 열역학적으로 안정적이고 상업적으로 중요한 물질로,[5] 흔히 '질화규소'라는 용어는 이런 구체적인 성분을 가리킨다.묽은 HF와 뜨거운 HSO의
2
4 공격을 받아 비교적 화학적으로 불활성화된 흰색 고융점 고형분이다.매우 어렵다(모스 척도 8.5).전광학적 응용을 위한 강한 광학적 비선형성으로 열 안정성이 높다.[6]
생산
질소 실리콘은 분말 실리콘을 질소 대기에서 1300°C~1400°C 사이에서 가열하여 제조한다.
- 3 Si + 2 N
2 → Si
3N
4
실리콘 샘플 중량은 실리콘과 질소의 화학적 결합으로 인해 점진적으로 증가한다.철촉매가 없으면 (실리콘 그램 당) 질소 흡수로 인한 추가 체중 증가가 감지되지 않을 때(~7) 몇 시간 후에 반응이 완료된다.[citation needed]SiN
3
4 외에도 몇 가지 다른 실리콘 질화 단계(질화/Si 산화 상태에 따른 화학 공식 포함)가 문헌에 보고되었다.여기에는 기체 이실리콘 모노니트라이드(SiN
2), 실리콘 모노니트라이드(SiN), 실리콘 세스퀴니트리드(SiN
2
3)가 포함되며 각각 스토오치메트릭 페이즈다.다른 굴절과 마찬가지로, 이러한 고온 합성물에서 얻은 제품은 반응 조건(반응제 및 용기 재료를 포함한 시간, 온도, 시동 물질)과 정화 모드에 따라 달라진다.그러나, 세스퀴니트라이드의 존재는 그 이후로 의심받게 되었다.[7]
또한 다음과 같은 diimide 경로로 준비할 수 있다.[8]
- SiCl
4 + 6 NH
3 → Si(NH)
2 + 0°C에서 4 NHCl
4 - 1000 °C에서 3
2Si(NH
3
4) → SiN
2 + N + 3 H
2(g)
1400–1450 °C에서 질소 대기 중 이산화 규소의 카본온 감소도 조사되었다.[8]
- 3 SiO
2 + 6 C + 2 N
2 → Si
3N
4 + 6 CO
실리콘 분말의 질화효과는 1950년대에 질화규소의 '재발견'에 따라 개발되었으며 분말 생산을 위한 최초의 대규모 방법이었다.그러나, 저순도 원실리콘의 사용은 규산염과 철에 의한 질화 실리콘의 오염을 초래했다.다이미드 분해로 인해 아모르퍼스 실리콘 질화물이 생성되는데, 이 질소는 1400–1500 °C에서 질소 아래 더 나아가서 결정 분말로 전환해야 한다. 이것이 이제 상업적 생산에 있어 두 번째로 중요한 경로다.카본온 감소는 실리콘 질화물 생산에 가장 먼저 사용된 방법이었으며, 현재는 고순도 실리콘 질화물 분말로의 가장 비용 효율적인 산업 루트로 간주되고 있다.[8]
전자 등급의 실리콘 질화물 필름은 화학 증기 증착(CVD) 또는 플라즈마 강화 화학 증기 증착(PECVD)과 같은 변형 중 하나를 사용하여 형성된다.[8][9]
- 3 SiH
4(g) + 4 NH
3(g) → 750–850°C에서 SiN
3
4(s[10]) + 12 H(g
2) - 3 SiCl
4(g) + 4 NH
3(g) → Si
3N
4(s) + 12 HCl(g) - 3 SiCl
2H
2(g) + 4 NH
3(g) → Si
3N
4(s) + 6 HCl(g) + 6 H
2(g)
반도체(일반적으로 실리콘) 기판에 실리콘 질화물 층을 증착하는 경우 다음 두 가지 방법을 사용한다.[9]
- 저압 화학 증기 증착(LPCVD) 기술로, 다소 높은 온도에서 작동하며 수직 또는 수평 튜브 [11]용해로에서 수행되거나
- 다소 낮은 온도와 진공 조건에서 작동하는 플라즈마 강화 화학 증기 증착(PECVD) 기술.
질화규소와 실리콘의 격자 상수가 다르기 때문에 증착 과정에 따라 장력이나 응력이 발생할 수 있다.특히 PECVD 기술을 사용할 경우 증착 파라미터를 조정하여 이 장력을 줄일 수 있다.[12]
실리콘 질화 나노와이어도 카보온 감소를 이용한 솔겔 방식에 이어 초미세 탄소 입자를 함유한 실리카겔 질화 방식으로 생산할 수 있다.입자는 1200–1350 °C 온도 범위에서 덱스트로스 분해에 의해 생성될 수 있다.가능한 합성 반응은 다음과 같다.[13]
- SiO
2 + C → SiO(g) + CO(g) 및 - 3 SiO(g) + 2 N
2(g) + 3 CO(g) → SiN
3
4(s) + 3 CO
2(g) 또는 - 3 SiO(g) + 2 N(g
2) + 3 C → SiN
3
4(s) + 3 CO(g)
처리.
질화규소는 대량 원료로 생산하기 어렵다. 실리콘과 질소와의 분화로 인해 용해점에 훨씬 못 미치는 1850 °C에서 가열할 수 없다.따라서 기존의 고온 프레스 소싱 기법의 적용은 문제가 있다.실리콘 질화 분말의 결합은 일반적으로 액체 위상 변질을 유발하는 소결 보조제 또는 "소결제"라고 불리는 물질을 첨가함으로써 낮은 온도에서 달성될 수 있다.[14]더 깨끗한 대안은 스파크 플라즈마 소결제를 사용하는 것으로, 압축된 분말을 통해 전류의 펄스를 통과시켜 매우 빠르게(초) 가열한다.1500–1700 °C 온도에서 이 기법으로 고밀도 실리콘 질화합물을 얻었다.[15][16]
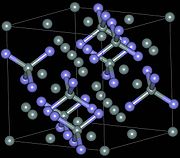
결정 구조 및 특성
질화규소(SiN
3
4)의 결정 구조는 3가지가 있으며, α, β, three 단계로 지정되어 있다.[17]α 및 β 페이즈는 SiN의
3
4 가장 일반적인 형태로서 정상적인 압력 조건에서 생성될 수 있다.γ 위상은 고압과 온도에서만 합성할 수 있으며 경도는 35 GPA이다.[18][19]
α-와 β-SiN은
3
4 각각 3각(Pearson 기호 hP28, 우주군 P31c, 159호)과 육각(hP14, P63, 173) 구조를 가지며, 이 구조물은 코너 공유
4 SiN 사면체에 의해 구축된다.그것들은 ABAB의 순서에서 실리콘과 질소 원자의 층으로 구성된 것으로 간주될 수 있다...또는 각각 β-SiN과
3
4 α-SiN에서
3
4 ABCDABCD.AB층은 α와 β상에서도 동일하며, α상에서의 CD층은 c-글라이드 평면에 의해 AB와 관련된다.β-SiN의
3
4 SiN
3
4 테트라헤드라는 단위 셀의 c축과 평행하게 달리면서 터널이 형성되는 방식으로 상호 연결된다.AB와 CD를 연결하는 c-글라이드 평면 때문에 α 구조에는 터널 대신 충치가 들어 있다.문헌에서 큐빅 si-SiN은
3
4 질화 붕소(c-BN)의 큐빅 수정과 유사하게 c 수정체로 지정되는 경우가 많다.두 개의 실리콘 원자가 각각 6개의 질소 원자를 옥타헤드로, 한 개의 실리콘 원자가 4개의 질소 원자를 사방으로 조정하는 스피넬 형태의 구조를 갖고 있다.[20]
적층 시퀀스가 길수록 α 위상은 β 위상보다 높은 경도를 갖게 된다.그러나 α 위상은 β 위상에 비해 화학적으로 불안정하다.액체 위상이 존재할 때 고온에서 α 위상은 항상 β 위상으로 변한다.따라서 β-SiN은
3
4 SiN
3
4 세라믹에서 사용되는 주요 형태다.[21]비정상적인 곡물 성장은
3
4 도핑된 β-SiN에서 발생할 수 있으며, 이 경우 비정상적으로 큰 길쭉한 곡물이 보다 미세한 곡물 행렬에서 형성되며 균열 브리징을 통해 이 재료의 파괴 강도를 높이는 기법이 될 수 있다.[22]도핑된 실리콘 질화물의 비정상적인 곡물 증가는 첨가제 강화 확산에 의해 발생하며 복합 마이크로 구조물이 발생하는데, 이를 '현장 합성물' 또는 '자체보강 재료'로도 볼 수 있다.[23]
질화규소의 결정성 폴리모르프 외에도 유리성 아모르퍼스 물질은 대부분 다양한 양의 잔류 탄소를 함유하고 있는 세라믹 전 폴리머의 열분해 제품으로서 형성될 수 있다(그것들은 실리콘 탄산염으로 보다 적절하게 간주된다).구체적으로 폴리카르보실라잔은 열분해 시 아모르퍼스 형태의 실리콘 탄산염 기반 물질로 쉽게 변환할 수 있으며, 폴리머에 더 흔히 사용되는 가공 기법을 통한 실리콘 질화물질 처리에서 중요한 의미를 갖는다.[24]
적용들
일반적으로 질화규소 용도의 주요 쟁점은 기술적 성능이 아니라 비용이었다.원가가 낮아지면서 생산 신청이 가속화되고 있다.[25]
자동차 산업
질화규소의 주요 적용 분야 중 하나는 엔진 부품의 재료로서 자동차 산업에 있다.디젤 엔진의 경우, 더 빠른 시동을 위한 예열 플러그, 더 낮은 배기 가스, 더 빠른 시동 및 소음 저감을 위한 프리컴버션 챔버(스월 챔버), 엔진 지연 및 배기 가스 저감을 위한 터보차저가 그것이다.스파크 점화 엔진에서 질화규소는 낮은 마모를 위한 로커 암 패드, 낮은 관성과 낮은 엔진 지연을 위한 터보차저 터빈, 가속도를 높이기 위한 배기 가스 제어 밸브에 사용된다.생산 수준의 예로 연간 30만 대 이상의 소결 실리콘 질화물 터보차저가 생산되고 있다.[8][14][25]
베어링
실리콘 질화물 베어링은 풀 세라믹 베어링과 세라믹 하이브리드 베어링으로 세라믹과 레이스에 볼이 있는 강철로 되어 있다.질화규소 세라믹은 다른 세라믹에 비해 충격 저항성이 뛰어나다.따라서 질화규소 세라믹으로 만들어진 볼베어링은 성능베어링에 사용된다.대표적인 예가 나사의 우주왕복선 주요 엔진에 실리콘 질화물 베어링을 사용하는 것이다.[26][27]
질화규소 볼 베어링은 금속보다 단단하기 때문에 베어링 트랙과의 접촉이 줄어든다.그 결과 기존의 금속 베어링에 비해 마찰이 80% 감소하고 수명이 3~10배 길어지고 속도가 80% 빨라지고 무게가 60% 감소하며 윤활유 기아로 작동하고 부식 저항성이 높아지며 작동온도가 높아진다.[25]질화규소 볼은 텅스텐 카바이드 볼보다 무게가 79% 적게 나간다.질화 실리콘 볼 베어링은 고급 자동차 베어링, 산업용 베어링, 풍력 터빈, 모터스포츠, 자전거, 롤러블레이드 및 스케이트보드에서 찾을 수 있다.실리콘 질화물 베어링은 특히 부식이나 전기장 또는 자기장이 금속의 사용을 금지한 용도에 유용하며, 예를 들어 해수 공격이 문제가 되는 조수량계나 전기장 탐지기에게 유용하다.[14]
SiN은34 1972년에 처음으로 우수한 내공으로 입증되었지만 비용 절감과 관련된 어려움 때문에 1990년 가까이까지 생산에 도달하지 못했다.1990년 이후 생산량이 증가하면서 원가가 크게 줄었다.SiN
3
4 베어링은 여전히 최고의 강철 베어링보다 2~5배 더 비싸지만, 우수한 성능과 수명은 빠른 채택을 정당화하고 있다.약 1,500만–2천만 SiN
3
4 베어링 볼은 1996년 미국에서 공작기계 및 기타 많은 용도로 생산되었다.성장률은 연간 40%로 추산되지만 인라인 스케이트, 컴퓨터 디스크 드라이브 등 소비자용도용으로 세라믹 베어링을 선택하면 더욱 높아질 수 있다.[25]
NASA의 실험에 따르면 세라믹 하이브리드 베어링은 표준 올스틸 베어링보다 피로(마모) 수명이 훨씬 짧다고 한다.[28]
고온재료
질화규소는 오랫동안 고온의 용도에 사용되어 왔다.특히 수소/산소 로켓 엔진에서 발생하는 심한 열충격과 열경사를 견뎌낼 수 있는 몇 안 되는 획일적인 세라믹 소재 중 하나로 확인되었다.복잡한 구성에서 이러한 능력을 입증하기 위해 NASA 과학자들은 1인치 직경의 단일 피스 연소실/노즐(스러스터) 구성 요소를 제작하기 위해 첨단 고속 시제품 제작 기술을 사용했다.이 추진체는 수소/산소 추진체로 시험한 열화재로 5분에서 1320°C의 재료 온도까지 5회 사이클을 유지했다.[29]
2010년 JAXA 우주 탐사선 아카츠키의 추진기에 질화규소가 주 재료로 사용되었다.[30]
질화 실리콘은 제임스 웹 우주 망원경에 탑재된 근적외선 분광기를 위해 개발된 "마이크로셔터"에 사용되었다.NASA에 따르면:"작동 온도는 극저온으로 생성되므로 기기가 매우 낮은 온도에서 작동할 수 있어야 한다.또 다른 과제는 피로 없이 반복적으로 열고 닫고, 개별적으로 열고, 기구의 과학 요구 사항을 충족할 수 있을 만큼 넓게 열 수 있는 셔터를 개발하는 것이었다.질화실리콘은 강도가 높고 피로에 대한 저항성이 강해 마이크로 셔터(micro shutter)에 사용하기로 결정됐다.이 마이크로 셔터 시스템은 계측기가 최대 100개의 천체를 동시에 관측하고 분석할 수 있게 해준다.[31]
메디컬
실리콘 질화물은 정형외과적 용도가 많다.[32][33]이 물질은 척추융합장치에 쓰이는 PEEK(폴리테더 에테르 케톤)와 티타늄의 대체 물질이기도 하다.[34][35]PEEK와 티타늄에 비해 재료의 강도, 내구성, 신뢰성에 기여하는 실리콘 질화질소수성 마이크로 텍스처 표면이다.[33][34][36]이 물질의 특정 구성물은 항균,[37] 항균,[38] 항바이러스 성질을 나타낸다.[39]
금속 작업 및 절삭 공구
SiN의
3
4 첫 번째 주요 적용은 연마 및 절삭 공구였다.질산은 경도, 열 안정성, 내마모성 등의 이유로 절삭 공구의 재료로 대량, 일체형 실리콘 질화물이 사용된다.주철 고속 가공 시 특히 권장된다.고온경도, 파괴강도, 열충격 저항성은 질화규소(질화규소)가 공스텐 카바이드와 같은 기존 재료로 얻은 것보다 표면속도가 최대 25배 빠른 주철, 경성강, 니켈 기반 합금을 절단할 수 있다는 것을 의미한다.[14]SiN
3
4 절삭 공구의 사용은 제조 생산에 극적인 효과를 가져왔다.예를 들어, 질화규소 삽입물을 사용한 회색 주철 페이스 밀링은 기존의 텅스텐 카바이드 공구에 비해 절삭속도를 2배로 높이고, 공구 수명을 1개에서 6개로 늘렸으며, 인서트 평균 비용을 50% 절감했다.[8][25]
전자제품
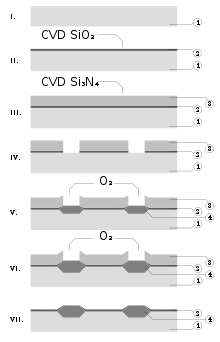
질화실리콘은 집적회로를 제조할 때 절연체와 화학장벽으로, 다른 구조물을 전기적으로 격리하거나 벌크 마이크로마친에서 에치마스크로 사용되는 경우가 많다.마이크로칩의 통과층으로서 마이크로 전자공학에서 부식과 불안정성의 두 주요 원인인 물 분자와 나트륨 이온에 대한 확산 장벽이 현저히 우수하기 때문에 이산화규소보다 우수하다.아날로그 칩의 캐패시터에 있는 폴리실리콘 층 사이의 유전체로도 사용된다.[40]
LPCVD에 의해 침전된 질화 규소는 최대 8%의 수소를 함유하고 있다.그것은 또한 강한 인장응력을 경험하는데, 이것은 200 nm보다 두꺼운 필름을 깨트릴 수 있다.단, 미세조립(각각 10Ω16·cm, 10 MV/cm)에서 흔히 구할 수 있는 대부분의 절연체보다 저항성과 유전강도가 높다.[9]
질화규소뿐만 아니라 실리콘, 질소, 수소(SiNHxy)의 다양한 3차 화합물이 단열층으로 사용된다.이들은 다음과 같은 반응을 통해 축적된 혈장이다.[9]
- 2 SiH
4(g) + N
2(g) → 2 SiNH(s) + 3 H
2(g) - SiH
4(g) + NH
3(g) → SiNH(s) + 3H
2(g)
이러한 SiNH 필름은 인장응력은 훨씬 적지만 전기적 특성(저항 106~10Ω15·cm, 유전강도 1~5MV/cm)[9][41]이 더 나쁘며 특정 물리적 조건에서 고온에 열적으로 안정적이다.질화실리콘은 포토 드럼의 레이어 중 하나로도 세로그래픽 과정에서도 질화실리콘이 사용된다.[42]질화실리콘은 국내 가스기기의 발화원으로도 쓰인다.[43]탄성 특성이 좋아 질화규소는 실리콘, 산화규소와 함께 원자현미경의 감지 요소인 캔틸레버에게 가장 인기 있는 물질이다.[44]
역사
첫 번째 준비는 1857년 앙리 에티엔 사인테 클레어 데빌과 프리드리히 뵐러에 의해 보고되었다.[45]그들의 방법으로는, 실리콘을 탄소로 가득 찬 또 다른 도가니 안에 놓인 도가니에서 가열하여 내부 도가니로 산소가 침투하는 것을 줄였다.그들은 질화규소라고 불리는 제품을 보고했지만 그것의 화학적 성분은 명시하지 않았다.폴 슈에첸버거는 1879년 실리콘을 용광로에서 브라스크(탄탄, 석탄 또는 코카콜라와 혼합하여 만든 페이스트)로 가열하여 얻은 사트라니트라이드 SiN의
3
4 성분을 담은 제품을 처음 보고했다.1910년 루드비히 와이스와 테오도르 엥겔하르트는 실리콘을 순수한 질소로 가열하여 SiN을
3
4 생산하였다.[46]E. Friederich와 L. Sittig는 질소 하에서의 카보온 감소, 즉 실리카, 탄소 및 질소를 1250–1300 °C에서 가열하여 1925년에 SiN을34 만들었다.
질화실리콘은 상업적 용도에 사용되기 전까지 수십 년 동안 화학적 호기심에 불과했다.1948년부터 1952년까지 뉴욕 나이아가라 폭포(Niagara Falls)의 카보룬덤 회사는 질화규소 제조 및 응용에 관한 여러 특허를 출원했다.[8]1958년까지 헤인스(Union Carbide) 실리콘 질화물은 열전대 튜브, 로켓 노즐, 금속 용해용 보트 및 십자가형을 상업적으로 생산하고 있었다.1953년 시작된 영국의 질화규소 연구는 가스 터빈의 고온 부품을 목표로 하였으며, 반응결합규소 질화규소 및 고온압축 실리콘 질화물이 개발되었다.1971년 미국 국방부의 첨단 연구 프로젝트 기관은 포드 및 웨스팅하우스와 두 개의 세라믹 가스 터빈에 대해 미화 1,700만 달러의 계약을 체결했다.[47]
질화규소의 성질이 잘 알려져 있음에도 불구하고, 자연발생은 운석에서 미세한 포함물(약 2 μm× 0.5 μm)으로서 1990년대에야 발견되었다.이 광물은 질량 분광학의 선구자인 알프레드 O. C. 니어의 이름을 따서 니에라이트라고 명명되었다.[48]이 광물은 일찍이 소련의 지질학자들이 운석에서만 발견했을지도 모른다.[49]
참조
- ^ a b c d Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.88. ISBN 1-4398-5511-0.
- ^ 굴절률 데이터베이스.refractiveindex.info
- ^ CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data. William M. Haynes, David R. Lide, Thomas J. Bruno (2016-2017, 97th ed.). Boca Raton, Florida. 2016. ISBN 978-1-4987-5428-6. OCLC 930681942.
{{cite book}}: CS1 maint : 기타(링크) - ^ 항목 # SI-501, 실리콘 니트라이드 파우더 MSDS 웨이백머신에 2014-06-06 보관. metal-powders-compounds.micronmetals.com
- ^ Mellor, Joseph William (1947). A Comprehensive Treatise on Inorganic and Theoretical Chemistry. Vol. 8. Longmans, Green and Co. pp. 115–7. OCLC 493750289.
- ^ López-Suárez, A.; Torres-Torres, C.; Rangel-Rojo, R.; Reyes-Esqueda, J. A.; Santana, G.; Alonso, J. C.; Ortiz, A.; Oliver, A. (2009-06-08). "Modification of the nonlinear optical absorption and optical Kerr response exhibited by nc-Si embedded in a silicon-nitride film". Optics Express. 17 (12): 10056–10068. Bibcode:2009OExpr..1710056L. doi:10.1364/OE.17.010056. ISSN 1094-4087. PMID 19506657.
- ^ Carlson, O. N. (1990). "The N-Si (Nitrogen-Silicon) system". Bulletin of Alloy Phase Diagrams. 11 (6): 569–573. doi:10.1007/BF02841719.
- ^ a b c d e f g Riley, Frank L. (2004). "Silicon Nitride and Related Materials". Journal of the American Ceramic Society. 83 (2): 245–265. doi:10.1111/j.1151-2916.2000.tb01182.x.
- ^ a b c d e Nishi, Yoshio; Doering, Robert (2000). Handbook of semiconductor manufacturing technology. CRC Press. pp. 324–325. ISBN 978-0-8247-8783-7.
- ^ Morgan, D. V.; Board, K. (1991). An Introduction To Semiconductor Microtechnology (2nd ed.). Chichester, West Sussex, England: John Wiley & Sons. p. 27. ISBN 978-0471924784.
- ^ "Crystec Technology Trading GmbH, Comparison of vertical and horizontal tube furnaces in the semiconductor industry". crystec.com. Retrieved 2009-06-06.
- ^ "Crystec Technology Trading GmbH, deposition of silicon nitride layers". Retrieved 2009-06-06.
- ^ Ghosh Chaudhuri, Mahua; Dey, Rajib; Mitra, Manoj K.; Das, Gopes C.; Mukherjee, Siddhartha (2008). "A novel method for synthesis of α-Si3N4 nanowires by sol-gel route". Science and Technology of Advanced Materials. 9 (1): 5002. Bibcode:2008STAdM...9a5002G. doi:10.1088/1468-6996/9/1/015002. PMC 5099808. PMID 27877939.
- ^ a b c d "Silicon Nitride – An Overview". azom.com. 2001-02-06. Retrieved 2009-06-06.
- ^ Nishimura, T.; Xu, X.; Kimoto, K.; Hirosaki, N.; Tanaka, H. (2007). "Fabrication of silicon nitride nanoceramics—Powder preparation and sintering: A review". Science and Technology of Advanced Materials. 8 (7–8): 635. Bibcode:2007STAdM...8..635N. doi:10.1016/j.stam.2007.08.006.
- ^ 펑, 페이지 38
- ^ "Crystal structures of Si3N4". hardmaterials.de. Retrieved 2009-06-06.
- ^ Jiang, J. Z.; Kragh, F.; Frost, D. J.; Ståhl, K.; Lindelov, H. (2001). "Hardness and thermal stability of cubic silicon nitride". Journal of Physics: Condensed Matter. 13 (22): L515. Bibcode:2001JPCM...13L.515J. doi:10.1088/0953-8984/13/22/111.
- ^ "Properties of gamma-Si3N4". Archived from the original on July 15, 2006. Retrieved 2009-06-06.
- ^ 펑, 1-3페이지
- ^ Zhu, Xinwen; Sakka, Yoshio (2008). "Textured silicon nitride: Processing and anisotropic properties". Science and Technology of Advanced Materials. 9 (3): 3001. Bibcode:2008STAdM...9c3001Z. doi:10.1088/1468-6996/9/3/033001. PMC 5099652. PMID 27877995.
- ^ 비정상적 곡물 성장 저널 크리스탈 성장
- ^ 미국세라믹학회 B실리콘 질화물의 곡물성장이 강도, Weibull Modulus, 파괴강도에 미치는 영향
- ^ Wang, Xifan; Schmidt, Franziska; Hanaor, Dorian; Kamm, Paul H.; Li, Shuang; Gurlo, Aleksander (2019). "Additive manufacturing of ceramics from preceramic polymers: A versatile stereolithographic approach assisted by thiol-ene click chemistry". Additive Manufacturing. 27: 80–90. arXiv:1905.02060. Bibcode:2019arXiv190502060W. doi:10.1016/j.addma.2019.02.012. S2CID 104470679.
- ^ a b c d e Richerson, David W.; Freita, Douglas W. "Ceramic Industry". Opportunities for Advanced Ceramics to Meet the Needs of the Industries of the Future. Oak Ridge National Laboratory. hdl:2027/coo.31924090750534. OCLC 692247038.
- ^ "Ceramic Balls Increase Shuttle Engine Bearing Life". NASA. Archived from the original on 2004-10-24. Retrieved 2009-06-06.
- ^ "Space Shuttle Main Engine Enhancements". NASA. Retrieved 2009-06-06.
- ^ Zaretsky, Erwin V.; Vlcek, Brian L.; Hendricks, Robert C. (1 April 2005). "Effect of Silicon Nitride Balls and Rollers on Rolling Bearing Life".
{{cite journal}}:Cite 저널은 필요로 한다.journal=(도움말) - ^ Eckel, Andrew J. (1999). "Silicon Nitride Rocket Thrusters Test Fired Successfully". NASA. Archived from the original on April 4, 2009.
- ^ 금성기후 궤도제어 기동 결과 'AKASUKSKI'.JAXA(2010-07-06)
- ^ 제임스 웹 우주 망원경 / 고다드 우주비행센터 > 혁신 > 마이크로셔터 / 나사(2020-06-25)
- ^ Olofsson, Johanna; Grehk, T. Mikael; Berlind, Torun; Persson, Cecilia; Jacobson, Staffan; Engqvist, Håkan (2012). "Evaluation of silicon nitride as a wear resistant and resorbable alternative for total hip joint replacement". Biomatter. 2 (2): 94–102. doi:10.4161/biom.20710. PMC 3549862. PMID 23507807.
- ^ a b Mazzocchi, M; Bellosi, A (2008). "On the possibility of silicon nitride as a ceramic for structural orthopaedic implants. Part I: Processing, microstructure, mechanical properties, cytotoxicity". Journal of Materials Science: Materials in Medicine. 19 (8): 2881–7. doi:10.1007/s10856-008-3417-2. PMID 18347952. S2CID 10388233.
- ^ a b Webster, T.J.; Patel, A.A.; Rahaman, M.N.; Sonny Bal, B. (2012). "Anti-infective and osteointegration properties of silicon nitride, poly(ether ether ketone), and titanium implants". Acta Biomaterialia. 8 (12): 4447–54. doi:10.1016/j.actbio.2012.07.038. PMID 22863905.
- ^ Anderson, MC; Olsen, R (2010). "Bone ingrowth into porous silicon nitride". Journal of Biomedical Materials Research Part A. 92 (4): 1598–605. doi:10.1002/jbm.a.32498. PMID 19437439.
- ^ Arafat, Ahmed; Schroën, Karin; De Smet, Louis C. P. M.; Sudhölter, Ernst J. R.; Zuilhof, Han (2004). "Tailor-Made Functionalization of Silicon Nitride Surfaces". Journal of the American Chemical Society. 126 (28): 8600–1. doi:10.1021/ja0483746. PMID 15250682.
- ^ Pezzotti, Giuseppe; Marin, Elia; Adachi, Tetsuya; Lerussi, Federica; Rondinella, Alfredo; Boschetto, Francesco; Zhu, Wenliang; Kitajima, Takashi; Inada, Kosuke; McEntire, Bryan J.; Bock, Ryan M. (2018-04-24). "Incorporating Si3 N4 into PEEK to Produce Antibacterial, Osteocondutive, and Radiolucent Spinal Implants". Macromolecular Bioscience. 18 (6): 1800033. doi:10.1002/mabi.201800033. ISSN 1616-5187. PMID 29687593.
- ^ McEntire, B, Bock, R, & Bal, B.S. U.S. 어플리케이션.20200079651번.2020.
- ^ Pezzotti, Giuseppe; Ohgitani, Eriko; Shin-Ya, Masaharu; Adachi, Tetsuya; Marin, Elia; Boschetto, Francesco; Zhu, Wenliang; Mazda, Osam (2020-06-20). "Rapid Inactivation of SARS-CoV-2 by Silicon Nitride, Copper, and Aluminum Nitride". dx.doi.org. doi:10.1101/2020.06.19.159970. S2CID 220044677. Retrieved 2020-09-21.
- ^ Pierson, Hugh O. (1992). Handbook of chemical vapor deposition (CVD). William Andrew. p. 282. ISBN 978-0-8155-1300-1.
- ^ Sze, S.M. (2008). Semiconductor devices: physics and technology. Wiley-India. p. 384. ISBN 978-81-265-1681-0.
- ^ Schein, L.B. (1988). Electrophotography and Development Physics, Springer Series in Electrophysics. Vol. 14. Springer-Verlag, Berlin. ISBN 978-3-642-97085-6.[페이지 필요]
- ^ 레빈슨, L. M. 외. (2001년 4월 17일) "가스 기기용 점화 시스템" 미국 특허 6,217,312
- ^ Ohring, M. (2002). The materials science of thin films: deposition and structure. Academic Press. p. 605. ISBN 978-0-12-524975-1.
- ^ "Ueber das Stickstoffsilicium". Annalen der Chemie und Pharmacie. 104 (2): 256. 1857. doi:10.1002/jlac.18571040224.
- ^ Weiss, L. & Engelhardt, T (1910). "Über die Stickstoffverbindungen des Siliciums". Z. Anorg. Allg. Chem. 65 (1): 38–104. doi:10.1002/zaac.19090650107.
- ^ Carter, C. Barry & Norton, M. Grant (2007). Ceramic Materials: Science and Engineering. Springer. p. 27. ISBN 978-0-387-46270-7.
- ^ Lee, M. R.; Russell, S. S.; Arden, J. W.; Pillinger, C. T. (1995). "Nierite (Si3N4), a new mineral from ordinary and enstatite chondrites". Meteoritics. 30 (4): 387. Bibcode:1995Metic..30..387L. doi:10.1111/j.1945-5100.1995.tb01142.x.
- ^ "Nierite". Mindat. Retrieved 2009-08-08.
인용된 출처
| 위키미디어 커먼스는 실리콘 질화물과 관련된 미디어를 보유하고 있다. |
- Peng, Hong (2004). Spark Plasma Sintering of Si3N4-based Ceramics: Sintering mechanism-Tailoring microstructure-Evaluating properties (PhD thesis). Stockholm University. ISBN 978-91-7265-834-9.