루이스 산과 염기
Lewis acids and bases
| 산과 염기 |
|---|
 |
| 산형 |
| 기본 유형 |
루이스 산(미국의 물리화학자 길버트 N의 이름). 루이스(Lewis)는 루이스 염기로부터 전자쌍을 수용하여 루이스 부가물을 형성할 수 있는 빈 오비탈을 포함하는 화학종입니다. 그렇다면 루이스 염기는 결합에는 관여하지 않지만 루이스 산과 결합하여 루이스 부가물을 형성할 수 있는 전자쌍을 포함하는 꽉 찬 오비탈을 가진 종입니다. 예를3 들어, NH는 루이스 염기인데, 그 이유는 그것이 그것의 유일한 전자 쌍을 기증할 수 있기 때문입니다. 트리메틸보란 B은 단독 쌍을 수용할 수 있는 루이스 산입니다. 루이스 부가물에서 루이스 산과 염기는 루이스 염기에 의해 제공되는 전자 쌍을 공유하여 결정적인 결합을 형성합니다.[1] NH와3 MeB3 사이의 특정한 화학적 반응의 맥락에서3, NH로부터의 단독 쌍은 MeB의3 빈 궤도와 결정적인 결합을 형성하여 NH3•BME3 부가물을 형성할 것입니다. 그 용어는 Gilbert N의 기여를 나타냅니다. 루이스.[2]
친핵성과 친전자성이라는 용어는 각각 루이스 염기와 루이스 산과 교환될 수 있습니다. 이러한 용어들, 특히 그들의 추상 명사는 친핵성과 친전자성을 형성하는 반면, 루이스 염기성과 루이스 산도는 루이스 부가물 형성의 열역학적 측면을 강조합니다.[3]
부가물 묘사
많은 경우 복합체에서 루이스 염기와 루이스 산 사이의 상호작용은 예를 들어, 데이터 결합의 표기법을 사용하여 루이스 산을 향해 전자를 공여하는 루이스 염기를 나타내는 화살표로 표시됩니다. MeB←NH. 일부 출처는 한 쌍의 점으로 루이스 염기를 표시하며(기증되는 명시적인 전자), 염기 자체에서 복합체로의 전이를 산으로 일관되게 표현할 수 있습니다.
- Me3B + :NH3 → Me3B:NH3
중앙 점은 또한 MeB3·NH와3 같은 루이스 부가물을 나타내기 위해 사용될 수도 있습니다. 다른 예로는 삼불화붕소 디에틸에테르산 붕소, BF3·EtO가2 있습니다. MgSO4·7과 같이 중심점은 다양한 결정에서 수화물 배위를 나타내기 위해 사용되는 용도가 약간 다릅니다.물이 금속과 결합을 형성하는지 여부에 관계없이 수화된 황산마그네슘에 대한 HO2.
비록 컴퓨터적이고 실험적인 에너지 기준을 사용하여 데이터 결합을 비-데이터 결합으로부터 구별하려는 시도가 있었지만,[4] 대부분의 경우 그 구별은 단지 전자 쌍의 출처를 기록하고 데이터 결합은 일단 형성되면 다른 공유 결합과 마찬가지로 단순하게 행동합니다. 일반적으로 상당한 극과 극의 성격을 가지고 있지만요. 더욱이, 일부 경우들(예를 들어, RS → O 및 RN → O로서 설폭사이드 및 아민 옥사이드)에 있어서, 데이터 결합 화살표의 사용은 단지 공식 전하의 드로잉을 회피하기 위한 공증적 편의일 뿐입니다. 그러나 일반적으로 공여체-수용체 결합은 단순히 이상화된 공유 결합과 이온 결합 사이의 연속체를 따라 어딘가에 있는 것으로 간주됩니다.[5]
루이스 산

루이스 산은 다양하고 용어가 느슨하게 사용됩니다. 가장 간단한 것은 삼할화붕소와 인, 비소, 안티몬의 펜타할화붕소와 같이 루이스 염기와 직접 반응하는 것입니다.
같은 맥락에서 CH는3+ 메틸화 반응에서 루이스 산이라고 생각할 수 있습니다. 그러나 메틸 양이온은 축합상에서 자유종으로 발생하지 않으며, 친핵체에서 탄소로의 결합의 형성과 탄소와 요오드의 결합의 절단(S2N 반응)을 통해3 CHI와 같은 시약에 의한 메틸화 반응이 동시에 발생합니다. 교과서들은 이 점에 대해 의견이 엇갈리고 있는데, 어떤 교과서들은 알킬할라이드가 전기영동체이지만 루이스 산은 아니라고 주장하는 반면,[6] 다른 교과서들은 알킬할라이드(예를 들어 CHBr3)를 루이스 산의 일종이라고 설명합니다.[7] IUPAC은 루이스 산과 루이스 염기가 반응하여 루이스 부가물을 형성하고,[1] 전기영동체를 루이스 산으로 정의한다고 기술하고 있습니다.[8]
단순 루이스 산
가장 많이 연구된 루이스 산의 예로는 삼할화붕소와 유기붕소가 있습니다.[9]
- BF + F → BF
이 부가물에서는 4개의 불소 중심(또는 더 정확하게는 리간드)이 모두 동등합니다.
- BF3 + OMe2 → BF3OMe2
BF와4− BFOMe는32 모두 삼불화붕소의 루이스 염기 부가물입니다.
많은 부가물들이 옥텟 규칙을 위반합니다. 예를 들어, 트라이아이오다이드 음이온:
- I + I → I
요오드 용액의 색의 가변성은 루이스 산 I과의2 부가물을 형성하는 용매의 다양한 능력을 반영합니다.
일부 루이스 산은 두 개의 루이스 염기와 결합하는데, 유명한 예로는 육불화규산이 생성됩니다.
- SiF4 + 2 F− → SiF62−
복소 루이스 산
Lewis 산으로 간주되는 대부분의 화합물은 Lewis 염기와의 부가물 형성 전에 활성화 단계를 필요로 합니다. EtAlCl323 및 AlCl과3 같은 복합 화합물은 삼각형 평면 Lewis 산으로 취급되지만 Lewis 염기에 의해 분해되어야 하는 응집체 및 중합체로 존재합니다.[10] 더 간단한 경우는 보레인의 부가물을 형성하는 것입니다. 단량체 BH는3 눈에 띄게 존재하지 않으므로, 보란의 부가물은 디보란의 분해에 의해 생성됩니다.
- B2H6 + 2 H− → 2 BH4−
이 경우 중간 BH가27− 분리될 수 있습니다.
많은 금속 복합체가 루이스 산의 역할을 하지만, 대개는 더 약하게 결합된 루이스 염기를 해리한 후에만, 종종 물이 됩니다.
- [Mg(H2O)6]2+ + 6 NH3 → [Mg(NH3)6]2+ + 6 H2O
루이스 산을 가지다+
양성자(H+)는 가장 강하지만 가장 복잡한 루이스 산 중 하나이기도 합니다. 양성자가 심하게 용해되어 있다는 사실을 무시하는 것이 관례입니다. 이러한 단순화를 염두에 두고 산-염기 반응은 부가물의 형성으로 볼 수 있습니다.
- H + NH → NH
- H + OH → HO
루이스 산의 응용
루이스 산이 작용하는 전형적인 예는 Friedel-Crafts 알킬화 반응입니다.[5] 핵심 단계는 염화 이온 단독 쌍의 AlCl에3 의해 수용되어 AlCl을4− 형성하고 강산성, 즉 친전자성, 탄산 이온을 생성하는 것입니다.
- RCl +AlCl3 → R+ + AlCl4−
루이스 베이스
루이스 염기는 가장 높은 점유 분자 궤도(HOMO)가 고도로 국소화된 원자 또는 분자 종입니다. 대표적인 루이스 염기는 암모니아 및 알킬 아민과 같은 전통적인 아민입니다. 다른 일반적인 루이스 염기로는 피리딘과 그 유도체가 있습니다. 루이스 기지의 주요 계급들 중 일부는
- R = 알킬 또는 아릴인 NHR의 아민. 이와 관련된 것은 피리딘 및 그 유도체입니다.
- 포뮬러3−xx PRAr의 포스핀.
- 물, 에테르, 케톤을 포함한 산화 상태 -2의 O, S, Se 및 Te의 화합물
가장 흔한 루이스 기지는 음이온입니다. 루이스의 기본성의 강도는 pKa 모산의: 높은 산 pKa루이스에게 좋은 베이스를 제공합니다. 평소처럼 약한 산일수록 결합염기가 강합니다.
- 전자쌍 공여체의 일반적인 정의에 기초한 루이스 염기의 예는 다음과 같습니다.
Lewis 염기의 강도는 I2, SbCl5 및 BF와3 같은 다양한 Lewis 산에 대해 평가되었습니다.[12]
BF에3 대한 다양한 염기 결합의 열| 루이스 베이스 | 기증자 원자 | 복합화 엔탈피(kJ/mol) |
|---|---|---|
| 퀴누클리딘 | N | 150 |
| Et3N | N | 135 |
| 피리딘 | N | 128 |
| 아세토니트릴 | N | 60 |
| DMA | O | 112 |
| DMSO | O | 105 |
| THF | O | 90.4 |
| Et2O | O | 78.8 |
| 아세톤 | O | 76.0 |
| EtOAc | O | 75.5 |
| 트리메틸포스핀 | P | 97.3 |
| 테트라하이드로티오펜 | S | 51.6 |
루이스 베이스의 응용
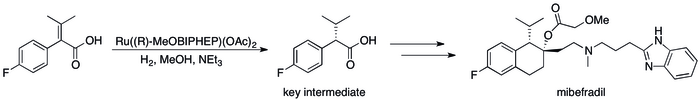
전이원소를 결합하여 화합물을 형성하는 거의 모든 전자쌍 공여체는 리간드로 볼 수 있습니다. 따라서 루이스 염기의 큰 응용은 금속 촉매의 활성과 선택도를 수정하는 것입니다. 키랄 루이스 염기는 촉매에 키랄성(chirality)을 부여하여 비대칭 촉매작용을 가능하게 하여 의약품 생산에 유용합니다. 항고혈압제 미베프라딜의 산업적 합성은 예를 들어 카이랄 루이스 염기(R-MeOBIPHEP)를 사용합니다.[13]
경질 및 연질구분
루이스 산과 염기는 일반적으로 단단함이나 부드러움에 따라 분류됩니다. 이런 맥락에서 딱딱함은 작고 비극성을 의미하고 부드러움은 좀 더 분극성이 높은 더 큰 원자를 나타냅니다.
- 일반적인 하드 산: H+, 알칼리/알칼리 토금속 양이온, 붕산, Zn2+
- 일반적인 소프트 산: Ag+, Mo(0), Ni(0), Pt2+
- 일반적인 경질 염기: 암모니아 및 아민, 물, 카르복실레이트, 불소 및 염화물
- 일반적인 연질염기: 유기포스핀, 티오에테르, 일산화탄소, 요오드화물
예를 들어, 아민은 산 BF와 함께3 부가물로부터 포스핀을 대체할 것입니다. 같은 방법으로 염기를 분류할 수 있습니다. 예를 들어, 산소 원자에서 한 쌍을 기부하는 염기는 질소 원자를 통해 기부하는 염기보다 더 어렵습니다. 분류가 정량화되지는 않았지만, 하드산(경질염기와 연질산)이 하드산(경질염기 또는 연질산)보다 더 강하다는 주요 개념을 사용하여 첨가물 형성의 강도를 예측하는 데 매우 유용한 것으로 입증되었습니다. 상호작용의 열역학에 대한 나중의 연구는 단단한 상호작용은 엔탈피를 선호하는 반면 부드러운 상호작용은 엔트로피를 선호한다는 것을 시사했습니다.[citation needed]
루이스 산도 정량화
루이스 산도를 평가하고 예측하기 위한 많은 방법들이 고안되었습니다. 대부분은 시프트 NMR 신호 또는 IR 대역(예: Gutmann-Beckett 방법 및 Childs[14] 방법)과 같은 분광학적 서명에 기초합니다.
ECW 모델은 Lewis acid base 상호작용의 강도를 기술하고 예측하는 정량적 모델로 - δH. 이 모델은 많은 루이스 산과 염기에 E와 C 매개변수를 할당했습니다. 각 산은 E와A C로A 특징지어집니다. 각 염기도 마찬가지로 고유한B E와B C로 특징지어집니다. E 및 C 매개변수는 각각 산과 염기가 형성할 결합의 강도에 대한 정전기적 및 공유적 기여를 나타냅니다. 방정식은.
- −ΔH = EAEB + CACB + W
W 용어는 이량체 산 또는 염기의 절단과 같은 산-염기 반응에 대한 일정한 에너지 기여를 나타냅니다. 방정식은 산과 염기 강도의 역전을 예측합니다. 방정식의 그래픽 표현은 루이스 염기 강도 또는 루이스 산 강도의 단일 순서가 없음을 보여줍니다.[15][16] 그리고 단일 특성 척도는 더 작은 범위의 산 또는 염기로 제한됩니다.
역사

이 개념은 길버트 N과 함께 시작되었습니다. 화학적 결합을 연구한 루이스. 1923년 루이스는 산 물질은 다른 분자의 전자 단독 쌍을 사용하여 원자 중 하나의 안정한 그룹을 완성할 수 있는 물질이라고 썼습니다.[2][17] 브뢴스테드-같은 해에 Lowry acid-base 이론이 발표되었습니다. 두 이론은 서로 다르지만 상호 보완적입니다. 루이스 기지도 브뢴스테드-염기는 적지만 루이스 산이 브뢴스테드일 필요는 없습니다.저산. 경질 및 연질 산 및 염기로 분류(HSAB 이론)는 1963년에 이어졌습니다. 부가물 형성의 표준 엔탈피에 의해 측정된 루이스 산-염기 상호작용의 강도는 Drago-Wayland 2-매개변수 방정식에 의해 예측될 수 있습니다.
루이스 이론의 재구성
루이스는 1916년에 두 원자가 전자 한 쌍을 공유함으로써 화학적 결합으로 함께 묶여 있다고 제안했습니다.[18] 각각의 원자가 결합에 하나의 전자를 기여할 때, 그것은 공유 결합이라고 불렸습니다. 두 개의 전자가 모두 원자 한 개에서 나올 때, 이것을 데이트 공유 결합 또는 좌표 결합이라고 불렀습니다. 그 구별은 그다지 명확하지 않습니다. 예를 들어 암모니아와 수소에서 암모늄 이온이 형성될 때 암모니아 분자는 양성자에 전자 한 쌍을 제공합니다.[11] 형성된 암모늄 이온에서 전자의 정체성을 잃게 됩니다. 그럼에도 불구하고 루이스는 전자쌍 공여체를 염기로, 전자쌍 수용체를 산으로 분류할 것을 제안했습니다.
루이스 산에 대한 보다 현대적인 정의는 낮은 에너지의 국소적인 빈 원자 또는 분자 궤도를 가진 원자 또는 분자 종입니다. 이 가장 낮은 에너지 분자 궤도(LUMO)는 한 쌍의 전자를 수용할 수 있습니다.
브뢴스테드와의 비교–로우리 이론
루이스 기지는 브뢴스테드(Brönsted)인 경우가 많습니다.전자 한 쌍을 H에+ 기증할 수 있는 낮은 염기;[11] 양성자는 전자 한 쌍을 수용할 수 있는 루이스 산입니다. 브뢴스테드의 공액염기는-산으로부터 H의+ 손실은 A-H 결합에 사용된 전자를 결합염기에 단독 쌍으로 남기 때문에 Lowry acid는 Lewis 염기이기도 합니다. 그러나 루이스 염기는 양성자화하기가 매우 어려울 수 있지만 여전히 루이스 산과 반응합니다. 예를 들어 일산화탄소는 매우 약한 브뢴스테드입니다.베이스가 낮지만 BF와3 함께 강력한 부가물을 형성합니다.
루이스와 브뢴스테드의 또 다른 비교에서-Brown and Kanner에 의한 낮은 산성도,[19] 2,6-di-t-부틸피리딘이 반응하여 HCl과 함께 염산염을 형성하지만 BF와는3 반응하지 않습니다. 이 예는 전자 구성 인자 외에 입체 인자가 부피가 큰 디-t-부틸피리딘과 작은 양성자 사이의 상호 작용 강도를 결정하는 역할을 한다는 것을 보여줍니다.
참고 항목
참고문헌
- ^ a b IUPAC, 화학 용어 해설서, 2ded. ("Gold Book") (1997). 온라인 수정 버전: (2006–) "Lewis acid". doi:10.1351/goldbook.L03508
- ^ a b Lewis, Gilbert Newton (1923). Valence and the Structure of Atoms and Molecules. American chemical society. Monograph series. New York, New York, U.S.A.: Chemical Catalog Company. p. 142. ISBN 9780598985408. 142쪽부터: "우리는 물질을 특별한 용매를 염두에 두지 않고 산이나 염기성을 가지고 있다고 생각하는 경향이 있습니다. 저는 완전한 일반성으로 염기성 물질은 다른 원자의 안정기를 완성하는 데 사용될 수 있는 전자의 단독 쌍을 갖는 물질이고, 산 물질은 다른 분자의 단독 쌍을 사용하여 자신의 원자 중 하나의 안정기를 완성할 수 있는 물질이라고 말할 수 있다고 생각합니다. 즉 염기성 물질은 화학적 결합을 위해 전자 한 쌍을 제공하고, 산성 물질은 그러한 한 쌍을 받아들입니다."
- ^ Anslyn, Eric V. (2006). Modern physical organic chemistry. Dougherty, Dennis A., 1952-. Sausalito, CA: University Science. ISBN 1891389319. OCLC 55600610.[페이지 필요]
- ^ Lepetit, Christine; Maraval, Valérie; Canac, Yves; Chauvin, Remi (2016). "On the Nature of the Dative Bond: Coordination to Metals and Beyond. The Carbon Case". Coordination Chemistry Reviews. 308: 59–75. doi:10.1016/j.ccr.2015.07.018.
- ^ a b J. "첨단 유기 화학" 제4회 Ed. J. Wiley and Sons, 1992: 뉴욕. ISBN 0-471-60180-2.[page needed]
- ^ Vollhardt, K. Peter C. (2018). Organic chemistry : structure and function. Neil Eric Schore (8th ed.). New York. p. 73. ISBN 978-1-319-07945-1. OCLC 1007924903.
{{cite book}}: CS1 maint: 위치 누락 게시자(링크) - ^ Carey, Francis A. (2003). Organic chemistry (5th ed.). Boston: McGraw-Hill. p. 46. ISBN 0-07-242458-3. OCLC 48850987.
- ^ IUPAC, 화학 용어 해설서, 2ded. ("Gold Book") (1997). 온라인 수정 버전: (2006–) "Electrophile (Electrophilic)". doi:10.1351/goldbook.E02020
- ^ Rowsell, Bryan D.; Gillespie, Ronald J.; Heard, George L. (1999). "Ligand Close-Packing and the Lewis Acidity of BF3 and BCl3". Inorganic Chemistry. 38 (21): 4659–4662. doi:10.1021/ic990713m. PMID 11671188.
- ^ 그린우드, N. & 어너쇼, A. (1997) 원소의 화학 (2차 Edn), 옥스포드:버터워스-하이네만. ISBN 0-7506-3365-4.[page needed]
- ^ a b c 전통적으로, 정확히는+ 아니지만, Hion은 "양성자"라고 불립니다. 2ded, IUPAC, 화학 용어 해설 참조. ("Gold Book") (1997). 온라인 수정 버전: (2006–) "hydron". doi:10.1351/goldbook.H02904
- ^ Christian Laurence and Jean-François Gal "루이스 기본성과 친화성 척도: 데이터와 측정" Wiley, 2009. ISBN 978-0-470-74957-9.[page needed]
- ^ Jacobsen, E.N.; Pfaltz, Andreas; Yamamato, H., eds. (1999). Comprehensive Asymmetric Catalysis. Berlin; New York: Springer. pp. 1443–1445. ISBN 978-3-540-64336-4.
- ^ Childs, R.F; Mulholland, D.L; Nixon, A. (1982). "Lewis acid adducts of α,β-unsaturated carbonyl and nitrile compounds. A nuclear magnetic resonance study". Can. J. Chem. 60 (6): 801–808. doi:10.1139/v82-117.
- ^ Vogel, Glenn C.; Drago, Russell S. (1996). "The ECW Model". Journal of Chemical Education. 73 (8): 701. Bibcode:1996JChEd..73..701V. doi:10.1021/ed073p701.
- ^ Cramer, Roger E.; Bopp, Thomas T. (1977). "Great e and C plot. Graphical display of the enthalpies of adduct formation for Lewis acids and bases". Journal of Chemical Education. 54 (10): 612. Bibcode:1977JChEd..54..612C. doi:10.1021/ed054p612.
- ^ Miessler, L. M., Tar, D. A., (1991) p. 166 – 발견표는 Lewis 이론의 출판/발표 날짜를 1923년으로 간주합니다.
- ^ Lewis, Gilbert N. (April 1916). "The atom and the molecule". Journal of the American Chemical Society. 38 (4): 762–785. doi:10.1021/ja02261a002. S2CID 95865413.
- ^ Brown, Herbert C.; Kanner, Bernard (1966). "Preparation and Reactions of 2,6-Di-t-butylpyridine and Related Hindered Bases. A Case of Steric Hindrance toward the Proton". Journal of the American Chemical Society. 88 (5): 986–992. doi:10.1021/ja00957a023.
더보기
- Jensen, W.B. (1980). The Lewis acid-base concepts : an overview. New York: Wiley. ISBN 0-471-03902-0.
- Yamamoto, Hisashi (1999). Lewis acid reagents : a practical approach. New York: Oxford University Press. ISBN 0-19-850099-8.

