수소화 마그네슘
Magnesium hydride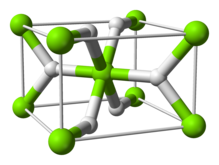 | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 수소화 마그네슘 | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 켐스파이더 | |
| ECHA 정보 카드 | 100.028.824 |
| EC 번호 |
|
PubChem CID | |
| 유니 | |
| |
| |
| 특성. | |
| MgH2 | |
| 몰 질량 | 26.3209 g/g |
| 외모 | 백색 결정 |
| 밀도 | 1.45g/cm3 |
| 녹는점 | 327°C(621°F, 600K) 분해 |
| 분해하다 | |
| 용해성 | 에테르에 녹지 않다 |
| 구조. | |
| 사각형 | |
| 열화학 | |
열용량 (C) | 35.4 J/mol K |
표준 어금니 엔트로피 (S | 31.1 J/mol K |
표준 엔탈피/ 형성 (δHf⦵298) | - 75.2 kJ/mol |
깁스 자유 에너지 ( (Gf)) | - 35.9 kJ/mol |
| 위험 요소 | |
| 산업안전보건(OHS/OSH): | |
주요 위험 요소 | 발열성의[1] |
| 관련 화합물 | |
기타 캐티온 | 수소화 베릴륨 수소화칼슘 수소화 스트론튬 수소화 바륨 |
| 일산화마그네슘 Mg4H6 | |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
수소화 마그네슘은 분자식이2 MgH인 화합물이다.수소 함유량은 7.66%로 잠재적 수소 저장 [2]매체로 연구되어 왔다.
준비
1951년 MgI [3]촉매로 고압2 및 온도(200기압, 500°C)에서 Mg 금속을 직접 수소화하는 과정이 처음 보고되었습니다.
- Mg + H2 → MgH2
볼밀에서 생산되는 나노결정성 Mg를 이용한 Mg 및2 H로부터의 저온생산을 [4]연구하였다.기타 준비는 다음과 같습니다.
- Mg(안트라센) + H2 → MgH2
- 디에틸마그네슘과 수소화리튬의[6] 반응
- 복합2 MgH(예: MgH2)의 생성물.THF 또는 TMEDA가 [1]배위자로 존재하는 상태에서 에테르 또는 탄화수소 용매에서 페닐실란과 디부틸 마그네슘의 반응에 의한 THF.
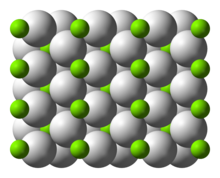
구조 및 본딩
상온형2 α-MgH는 루타일 [7]구조를 가진다.α-PbO2 구조의 [8]γ-MgH2, Pa-3 [9]공간군의 입방β-MgH2, Pbc21 공간군의 입방체 HP1, Pnma 공간군의 [10]입방체 HP2의 적어도 4가지 고압 형태가 있다.또한 화학이론적이지(2-δ) 않은 MgH가 특성화되었지만, 이는 매우[11] 작은 입자에 대해서만 존재하는 것으로 보인다.
(벌크 MgH는2 매우 낮은 농도의 H[12] 공실만을 수용할 수 있기 때문에 본질적으로 화학량학이다.)
루타일 형태의 결합은 순수 [13]이온이 아닌 부분적으로 공유되는 것으로 설명되기도 한다. 싱크로트론 X선 회절에 의한 전하 밀도 측정은 마그네슘 원자가 완전히 이온화되고 구형이며 수소화물 이온이 [14]길다는 것을 나타낸다.수소 [15]존재 하에서 마그네슘을 레이저 절제하여 형성한 10K 미만의 매트릭스 절연 시료에서 진동 스펙트럼으로 식별된 수소화 마그네슘, MgH2, MgH222, MgH2324 분자의 분자 형태가 발견되었다.MgH24 분자는 이합체 수소화 알루미늄,[15] AlH와26 유사한 브리지 구조를 가지고 있습니다.
반응
MgH는2 물과 쉽게 반응하여 수소 가스를 형성합니다.
- MgH2 + 22 HO → 2 H2 + Mg(OH)2
287°C에서 분해되어 1bar [16]압력에서 H를 생성합니다2.필요한 고온은 MgH를2 가역 수소 저장 [17]매체로 사용하는 데 있어 제한으로 간주됩니다.
- MgH2 → Mg + H2
레퍼런스
- ^ a b Michalczyk, Michael J (1992). "Synthesis of magnesium hydride by the reaction of phenylsilane and dibutylmagnesium". Organometallics. 11 (6): 2307–2309. doi:10.1021/om00042a055.
- ^ Bogdanovic, Borislav (1985). "Catalytic Synthesis of Organolithium and Organomagnesium Compounds and of Lithium and Magnesium Hydrides - Applications in Organic Synthesis and Hydrogen Storage". Angewandte Chemie International Edition in English. 24 (4): 262–273. doi:10.1002/anie.198502621.
- ^ Egon Wiberg, Heinz Goeltzer, Richard Bauer (1951). "Synthese von Magnesiumhydrid aus den Elementen (Synthesis of Magnesium Hydride from the Elements)" (PDF). Zeitschrift für Naturforschung B. 6b: 394.
{{cite journal}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ Zaluska, A; Zaluski, L; Ström–Olsen, J.O (1999). "Nanocrystalline magnesium for hydrogen storage". Journal of Alloys and Compounds. 288 (1–2): 217–225. doi:10.1016/S0925-8388(99)00073-0.
- ^ Bogdanovi?, Borislav; Liao, Shih-Tsien; Schwickardi, Manfred; Sikorsky, Peter; Spliethoff, Bernd (1980). "Catalytic Synthesis of Magnesium Hydride under Mild Conditions". Angewandte Chemie International Edition in English. 19 (10): 818. doi:10.1002/anie.198008181.
- ^ Barbaras, Glenn D; Dillard, Clyde; Finholt, A. E; Wartik, Thomas; Wilzbach, K. E; Schlesinger, H. I (1951). "The Preparation of the Hydrides of Zinc, Cadmium, Beryllium, Magnesium and Lithium by the Use of Lithium Aluminum Hydride1". Journal of the American Chemical Society. 73 (10): 4585. doi:10.1021/ja01154a025.
- ^ Zachariasen, W. H; Holley, C. E; Stamper, J. F (1963). "Neutron diffraction study of magnesium deuteride". Acta Crystallographica. 16 (5): 352. doi:10.1107/S0365110X63000967.
- ^ Bortz, M; Bertheville, B; Böttger, G; Yvon, K (1999). "Structure of the high pressure phase γ-MgH2 by neutron powder diffraction". Journal of Alloys and Compounds. 287 (1–2): L4–L6. doi:10.1016/S0925-8388(99)00028-6.
- ^ Vajeeston, P; Ravindran, P; Hauback, B. C; Fjellvåg, H; Kjekshus, A; Furuseth, S; Hanfland, M (2006). "Structural stability and pressure-induced phase transitions inMgH2". Physical Review B. 73 (22): 224102. Bibcode:2006PhRvB..73v4102V. doi:10.1103/PhysRevB.73.224102.
- ^ Moriwaki, Toru; Akahama, Yuichi; Kawamura, Haruki; Nakano, Satoshi; Takemura, Kenichi (2006). "Structural Phase Transition of Rutile-Type MgH2at High Pressures". Journal of the Physical Society of Japan. 75 (7): 074603. Bibcode:2006JPSJ...75g4603M. doi:10.1143/JPSJ.75.074603.
- ^ Schimmel, H. Gijs; Huot, Jacques; Chapon, Laurent C; Tichelaar, Frans D; Mulder, Fokko M (2005). "Hydrogen Cycling of Niobium and Vanadium Catalyzed Nanostructured Magnesium". Journal of the American Chemical Society. 127 (41): 14348–54. doi:10.1021/ja051508a. PMID 16218629.
- ^ Grau-Crespo, R.; K. C. Smith; T. S. Fisher; N. H. de Leeuw; U. V. Waghmare (2009). "Thermodynamics of hydrogen vacancies in MgH2 from first-principles calculations and grand-canonical statistical mechanics". Physical Review B. 80 (17): 174117. arXiv:0910.4331. Bibcode:2009PhRvB..80q4117G. doi:10.1103/PhysRevB.80.174117. S2CID 32342746.
- ^ Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999), Advanced Inorganic Chemistry (6th ed.), New York: Wiley-Interscience, ISBN 0-471-19957-5
- ^ Noritake, T; Towata, S; Aoki, M; Seno, Y; Hirose, Y; Nishibori, E; Takata, M; Sakata, M (2003). "Charge density measurement in MgH2 by synchrotron X-ray diffraction". Journal of Alloys and Compounds. 356–357: 84–86. doi:10.1016/S0925-8388(03)00104-X.
- ^ a b Wang, Xuefeng; Andrews, Lester (2004). "Infrared Spectra of Magnesium Hydride Molecules, Complexes, and Solid Magnesium Dihydride". The Journal of Physical Chemistry A. 108 (52): 11511. Bibcode:2004JPCA..10811511W. doi:10.1021/jp046410h.
- ^ McAuliffe, T. R. (1980). Hydrogen and Energy (illustrated ed.). Springer. p. 65. ISBN 978-1-349-02635-7. 65페이지 발췌
- ^ Schlapbach, Louis; Züttel, Andreas (2001). "Hydrogen-storage materials for mobile applications" (PDF). Nature. 414 (6861): 353–8. Bibcode:2001Natur.414..353S. doi:10.1038/35104634. PMID 11713542. S2CID 3025203.


