염분
Salinity| 시리즈의 일부 |
| 염분 |
|---|
 |
| 염도 수준 |
| 담수 (0.05 % 미만 기수(0.05~3%) 식염수 (3 ~5 %) 브라인(최대 26%~28%) |
| 수역 |
염분(/sˈlnnɪti/)은 염수(토양의 염분도 참조)라고 불리는 물체에 녹아 있는 염분 또는 염분의 양이다.보통 g/L 또는 g/kg(물 1리터/kg당 소금 그램, 후자는 무차원이며 δ와 동일) 단위로 측정된다.
염도는 자연수와 그 안에 있는 생물학적 과정의 많은 측면을 결정하는 데 중요한 요소이며, 온도와 압력과 함께 물의 밀도 및 열 용량과 같은 물리적 특성을 지배하는 열역학 상태 변수입니다.
염도가 일정한 윤곽선은 이소할린, 혹은 때로는 이소할레라고 불립니다.
정의들
강, 호수 및 바다의 염도는 개념적으로 단순하지만 정확하게 정의하고 측정하기가 기술적으로 어렵습니다.개념적으로 염도는 물에 녹아 있는 소금 함량의 양이다.소금은 염화나트륨, 황산마그네슘, 질산칼륨, 중탄산나트륨과 같은 화합물로 이온으로 녹는다.용해된 염화물 이온의 농도를 염소도라고 부르기도 한다.작동상 용해물은 매우 미세한 필터(역사적으로는 0.45μm의 세공 크기를 가진 필터)를 통과할 수 있는 물질로 정의됩니다. 그러나 현재는 일반적으로 0.2μm입니다.[2]염도는 질량 분율, 즉 용액의 단위 질량에서 용해된 물질의 질량의 형태로 표현될 수 있다.
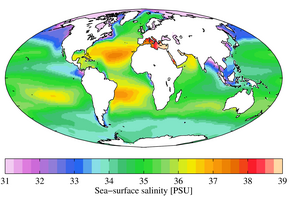
바닷물의 질량 염도는 일반적으로 약 35g/kg이지만, 낮은 값은 일반적으로 강이 바다로 유입되는 해안 근처이다.강이나 호수의 염도는 0.01g/kg[3] 미만에서 몇 g/kg까지 다양하지만 염도가 높은 곳이 많다.사해의 염도는 200g/[4]kg 이상이다.지면에 닿기 전의 빗물은 일반적으로 TDS가 20 mg/Kg [5]이하입니다.
정의에 사용된 모공 크기가 무엇이든 주어진 천연수 샘플의 염도 값은 몇 퍼센트(%) 이상 차이가 나지 않습니다.그러나 심해에서 일하는 물리 해양학자들은 종종 서로 다른 시간에 거의 5자리까지 [6]다양한 연구자들의 측정 정밀도와 상호 비교 가능성에 대해 염려한다.IAPSO 표준 해수라고 알려진 병에 든 해수 제품은 해양학자들이 측정을 이 요구 사항을 충족하기에 충분한 정밀도로 표준화하기 위해 사용합니다.
구성.
측정과 정의의 어려움은 자연수가 다양한 분자 형태로 다양한 소스(용존 소금 모두로부터가 아님)의 많은 다른 요소들의 복잡한 혼합물을 포함하고 있기 때문에 발생한다.이들 형태 중 일부의 화학적 특성은 온도와 압력에 따라 달라집니다.이러한 형태의 대부분은 높은 정확도로 측정하기 어려우며, 여러 샘플을 분석할 때는 어떤 경우에도 완전한 화학 분석이 실용적이지 않습니다.염도에 대한 다른 실용적인 정의는 이러한 문제를 설명하려는 다양한 시도에서 비롯되며, 다른 정밀도 수준에서 여전히 사용하기에 상당히 쉽다.
실제적인 이유로 염도는 일반적으로 이러한 조성을 발생시킨 알려지지 않은 염분 질량보다는 용해된 화학 성분(이른바 용액 염도)의 부분 집합의 질량의 합과 관련이 있다(예외는 인공 바닷물이 생성되는 경우).많은 목적을 위해 이 합계는 자연수에서 [7][8]8개의 주요 이온 세트로 제한될 수 있지만, 최고 정밀도의 바닷물의 경우 추가로 7개의 미량 이온도 포함됩니다.[6]주요 이온은 대부분의 (전부는 아니지만) 천연수의 무기 조성을 지배한다.일부 피트 호수와 일부 열수 샘의 물은 예외입니다.
산소와 질소와 같은 용해 가스의 농도는 일반적으로 염분 [2]설명에 포함되지 않습니다.그러나 용해되면 부분적으로 탄산염과 중탄산염으로 변환되는 이산화탄소가 종종 포함된다.규산 형태의 실리콘은 보통 대부분의 천연수의 pH 범위에서 중성 분자로 나타나며, 어떤 목적으로도 포함될 수 있다(예를 들어 염도/밀도 관계가 조사될 때).
해수
해양학자들에게 '염분'이라는 용어는 보통 일련의 특정한 측정 기술 중 하나와 관련이 있다.지배적인 기술이 발전함에 따라 염도에 대한 다른 기술들도 발전합니다.염도는 1980년대 이전에 적정 기반 기술을 사용하여 주로 측정되었다.질산은에 의한 적정은 염소를 얻기 위해 할로겐화 이온(주로 염소 및 브롬)의 농도를 결정하기 위해 사용될 수 있다.그 후 염소는 다른 모든 성분을 설명하기 위해 인수에 곱했다.결과 'Knudsen 염도'는 ppt 또는 ppt 단위로 표현된다.
바닷물의 이온 함량을 추정하기 위해 전기 전도율 측정을 사용한 결과, 실용 염도 척도 1978(PSS-78)[9][10]이라는 척도가 개발되었습니다.PSS-78을 사용하여 측정된 염도는 단위가 없습니다.접미사 PSU 또는 PSU(실용 염도 단위를 나타냄)가 PSS-78 측정 [11]값에 추가되는 경우가 있습니다.값 뒤에 PSU를 단위로 추가하는 것은 "공식적으로 올바르지 않으며 강력히 권장되지 않습니다."[2]
2010년에는 해수 2010의 열역학 방정식(TEOS-10)이라 불리는 바닷물의 성질에 대한 새로운 표준이 도입되어 실질적인 염도를 대체하기 위한 절대 염도를,[6] 잠재적 온도를 대체하기 위한 보수적 온도를 옹호하였다.이 표준에는 기준 조성 염도 척도라고 하는 새로운 척도가 포함되어 있습니다.이 척도의 절대 염도는 용액 kg당 그램 단위로 질량 분율로 표현됩니다.이 척도의 염도는 전기 전도도 측정과 바닷물 조성의 지역적 변화를 설명할 수 있는 기타 정보를 결합하여 결정된다.직접 밀도를 측정하여 확인할 수도 있습니다.
염화도가 19.37ppt인 대부분의 위치에서 채취한 해수 샘플은 크누센 염도 35.00ppt, PSS-78 실용 염도 약 35.0, TEOS-10 절대 염도 약 35.2g/kg을 갖는다.15 °C 온도에서 이 물의 전기 전도율은 42.9 mS/[6][12]cm입니다.
지구 규모로 보면, 인간이 일으킨 기후 변화가 1950년대 이후 지표면 및 지표면 염도 변화에 영향을 미쳤을 가능성이 매우 높으며, 21세기 내내 지표면 염도 변화에 대한 예측은 신선한 해양 지역이 더 신선해지고 짠 지역은 더 [13]짜질 것이라는 것을 보여준다.
호수와 강
림놀로지스트와 화학자는 종종 단위 부피당 염분 질량의 관점에서 염도를 정의한다.[7] 단위는 리터당 mg 또는 리터당 g이다.이 값은 종종 언급되지는 않지만 일부 기준 온도에서만 정확하게 적용된다는 것을 암시합니다.이 방법으로 표시되는 값은 일반적으로 1% 정도로 정확합니다.림노학자들은 염도의 대용품으로 전기 전도율, 즉 "기준 전도율"을 사용합니다.이 측정은 온도 영향을 보정할 수 있으며, 일반적으로 μS/cm 단위로 표시됩니다.
염도가 약 70mg/L인 강이나 호수 물은 일반적으로 25°C에서 80~130μS/cm의 특정 전도성을 갖는다.실제 비율은 존재하는 [14]이온에 따라 달라집니다.실제 전도율은 보통 섭씨 당 약 2%씩 변화하므로 5°C에서 측정된 전도율은 50~80μS/cm 범위에만 있을 수 있습니다.
직접 밀도 측정은 특히 고염수 [4]호수에서 염도를 추정하는 데도 사용된다.특정 온도에서의 밀도가 염도의 대용물로 사용될 수 있습니다.다른 경우에는 특정 수역에 대해 개발된 경험적 염도/밀도 관계를 사용하여 측정된 밀도에서 시료의 염도를 추정하기도 한다.
| 염분 | |||
|---|---|---|---|
| 민물 | 기수 | 염수 | 소금물 |
| 0.05% 미만 | 0.05 – 3% | 3 – 5% | 5% 이상 |
| < 0.5 µ | 0.5 – 30 ‰ | 30 – 50 ‰ | > 50 † |
염도에 따른 수역 분류
| 탈라기 시리즈 |
| > 300 † |
| 과할린 |
| 60–80 ‰ |
| 메타알린 |
| 40 ‰ |
| 믹소우할린 |
| 30 ‰ |
| 폴리할린 |
| 18 ‰ |
| 메조할린 |
| 5 ‰ |
| 올리고알린 |
| 0.5 ‰ |
바닷물은 바다의 물이고, 다른 용어는 에우할린 바다입니다.에우할린 바다의 염도는 30~35 µ이며, 고사리 바다나 물의 염도는 0.5~29 µ, 메타할린 바다는 36~40 µ이다.염도가 시간에 따라 크게 달라지지 않는다면 염도가 바다에서 유래되고 호모이오할린으로 정의되기 때문에 이 물은 모두 탈라기로 간주됩니다.오른쪽 표는 Por(1972)[15][16]에서 수정된 것으로, "베니스 시스템"(1959)[17]을 따릅니다.
호모이오할린 환경과는 대조적으로 염도 변화가 생물학적으로 [18]중요한 특정한 포이킬로할린 환경도 있다.포이킬로할린 염도는 0.5~300 µ 이상일 수 있다.중요한 특징은 이러한 물의 염도가 계절적 또는 대략적으로 비교할 수 있는 다른 시간 척도로 생물학적으로 유의미한 범위에 걸쳐 변화하는 경향이 있다는 것이다.간단히 말하면 염도가 상당히 다양한 수역입니다.
염분이 결정화(또는 결정화)되는 고염수(high salitous water)를 브라인(brine)이라고 한다.
환경에 관한 고려 사항
염도는 수역에 사는 유기체의 종류에 영향을 미치는 상당히 중요한 생태학적 요인이다.또한, 염도는 수역이나 물(또는 지하수)[19]에 의해 공급되는 땅에서 자랄 식물의 종류에 영향을 미친다.식염수 조건에 적응한 식물은 할로피테라고 불린다.잔류 탄산나트륨 염도에 내성이 있는 할로피식물은 글라스워트, 솔트워트 또는 바릴라 식물이라고 불린다.매우 짠 조건에서 살 수 있는 유기체(대부분의 박테리아)는 극친성, 즉 할로필로 분류된다.다양한 염분을 견딜 수 있는 유기체는 에우리할린이다.
소금은 물에서 제거하는 데 비용이 많이 들고 소금 함량은 물 사용에 있어 중요한 요소입니다.미국의 호수와 강에서 염분 증가는 일반적인 도로염 및 기타 유출 [20]염분 제거제로 인해 관찰되었다.
바다의 염도 정도는 염도 변화와 해수면의 온도 변화에 따른 밀도 변화로 인해 부력이 변화해 수심이 가라앉고 상승하는 세계 해양순환의 원동력이 된다.더 많은 염수가 이산화탄소에 덜 용해되기 때문에 바다의 염도 변화는 이산화탄소의 세계적인 변화에 기여하는 것으로 생각된다.또한, 빙하기 동안, 수문학은 순환 감소의 가능한 원인이 성층 해양의 생산일 수 있다.이러한 경우, 열염 순환을 통해 물을 전도하는 것이 더 어렵습니다.
염도는 해양 순환의 원동력일 뿐만 아니라 해양 순환의 변화도 염도에 영향을 미친다. 특히 1990년부터 2010년까지 그린란드 녹은 물의 기여가 증가한 북대서양에서는 소금기가 많은 대서양 [13][21][22][23]물의 북쪽으로 이동에 의해 상쇄되었다.하지만 그린란드 녹은 물의 [13][24]흐름 증가로 인해 북대서양 물은 2010년대 중반부터 더 신선해졌다.
「 」를 참조해 주세요.
- 경제적 목적을 위한 담수화
- 염도 측정
- 생물학적 맥락에 따른 염도
- 지질학적 맥락에 따른 염도
- 용질 농도의 일반적인 경우
레퍼런스
- ^ World Ocean Atlas 2009.nodc.noaa.gov
- ^ a b c Pawlowicz, R. (2013). "Key Physical Variables in the Ocean: Temperature, Salinity, and Density". Nature Education Knowledge. 4 (4): 13.
- ^ Eilers, J. M.; Sullivan, T. J.; Hurley, K. C. (1990). "The most dilute lake in the world?". Hydrobiologia. 199: 1–6. doi:10.1007/BF00007827. S2CID 30279782.
- ^ a b Anati, D. A. (1999). "The salinity of hypersaline brines: concepts and misconceptions". Int. J. Salt Lake. Res. 8: 55–70. doi:10.1007/bf02442137.
- ^ "Learn about salinity and water quality". Retrieved 21 July 2018.
- ^ a b c d IOC, SCOR, and IAPSO (2010). The international thermodynamic equation of seawater – 2010: Calculation and use of thermodynamic properties. Intergovernmental Oceanographic Commission, UNESCO (English). pp. 196pp.
{{cite book}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ a b Wetzel, R. G. (2001). Limnology: Lake and River Ecosystems, 3rd ed. Academic Press. ISBN 978-0-12-744760-5.
- ^ Pawlowicz, R.; Feistel, R. (2012). "Limnological applications of the Thermodynamic Equation of Seawater 2010 (TEOS-10)". Limnology and Oceanography: Methods. 10 (11): 853–867. doi:10.4319/lom.2012.10.853. S2CID 93210746.
- ^ 유네스코(1981년).1978년 실용 염도 척도 및 1980년 국제 해수 상태 방정식.테크, 아빠, 마사이언스, 36세
- ^ 유네스코(1981년).1978년 실용 염도 척도에 대한 배경 논문 및 지원 데이터.테크, 파파, 마사이언스, 37세
- ^ Millero, F. J. (1993). "What is PSU?". Oceanography. 6 (3): 67.
- ^ Culkin, F.; Smith, N. D. (1980). "Determination of the Concentration of Potassium Chloride Solution Having the Same Electrical Conductivity, at 15C and Infinite Frequency, as Standard Seawater of Salinity 35.0000‰ (Chlorinity 19.37394‰)". IEEE J. Oceanic Eng. OE-5 (1): 22–23. Bibcode:1980IJOE....5...22C. doi:10.1109/JOE.1980.1145443.
- ^ a b c Fox-Kemper, B.; Hewitt, H.T.; Xiao, C.; Aðalgeirsdóttir, G.; Drijfhout, S.S.; Edwards, T.L.; Golledge, N.R.; Hemer, M.; Kopp, R.E.; Krinner, G.; Mix, A. (2021). Masson-Delmotte, V.; Zhai, P.; Pirani, A.; Connors, S.L.; Péan, C.; Berger, S.; Caud, N.; Chen, Y.; Goldfarb, L. (eds.). "Ocean, Cryosphere and Sea Level Change". Climate Change 2021: The Physical Science Basis. Contribution of Working Group I to the Sixth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge, UK and New York, NY, USA: Cambridge University Press: 1211–1362. doi:10.1017/9781009157896.011 (inactive 31 July 2022).
{{cite journal}}: CS1 유지 : 2022년 7월 현재 DOI 비활성화 (링크) - ^ van Niekerk, Harold; Silberbauer, Michael; Maluleke, Mmaphefo (2014). "Geographical differences in the relationship between total dissolved solids and electrical conductivity in South African rivers". Water SA. 40 (1): 133. doi:10.4314/wsa.v40i1.16.
- ^ Por, F. D. (1972). "Hydrobiological notes on the high-salinity waters of the Sinai Peninsula". Marine Biology. 14 (2): 111–119. doi:10.1007/BF00373210. S2CID 86601297.
- ^ "Salinity Freshwater Inflows". www.freshwaterinflow.org. Retrieved 2020-10-25.
- ^ 베니스 시스템(1959년).기수 분류 심포지엄의 최종 결의안.아르코 오셔노그르. 림놀, 11(공급): 243~248.
- ^ Dahl, E. (1956). "Ecological salinity boundaries in poikilohaline waters". Oikos. 7 (1): 1–21. doi:10.2307/3564981. JSTOR 3564981.
- ^ Kalcic, Maria, Turowski, Mark; Hall, Callie (2010-12-22). "Stennis Space Center Salinity Drifter Project. A Collaborative Project with Hancock High School, Kiln, MS". Stennis Space Center Salinity Drifter Project. NTRS. Retrieved 2011-06-16.
- ^ "Hopes To Hold The Salt, And Instead Break Out Beet Juice And Beer To Keep Roads Clear". www.wbur.org.
- ^ Dukhovskoy, D.S.; Myers, P.G.; Platov, G.; Timmermans, M.L.; Curry, B.; Proshutinsky, A.; Bamber, J.L.; Chassignet, E.; Hu, X.; Lee, C.M.; Somavilla, R. (2016). "Greenland freshwater pathways in the sub‐Arctic Seas from model experiments with passive tracers". Journal of Geophysical Research: Oceans. 121 (1): 877–907. doi:10.1002/2015JC011290.
- ^ Dukhovskoy, D.S.; Yashayaev, I.; Proshutinsky, A.; Bamber, J.L.; Bashmachnikov, I.L.; Chassignet, E.P.; Lee, M.; Tedstone, A.J. (2019). "Role of Greenland freshwater anomaly in the recent freshening of the subpolar North Atlantic". Journal of Geophysical Research: Oceans. 124 (5): 3333–3360. doi:10.1029/2018JC014686. PMC 6618073. PMID 31341755.
- ^ Stendardo, I.; Rhein, M.; Steinfeldt, R. (2020). "The North Atlantic Current and its volume and freshwater transports in the subpolar North Atlantic, time period 1993–2016". Journal of Geophysical Research: Oceans. 125 (9). doi:10.1029/2020JC016065. S2CID 225238073.
- ^ Holliday, N. Penny; Bersch, Manfred; Berx, Barbara; Chafik, Léon; Cunningham, Stuart; Florindo-López, Cristian; Hátún, Hjálmar; Johns, William; Josey, Simon A.; Larsen, Karin Margretha H.; Mulet, Sandrine (2020-01-29). "Ocean circulation causes the largest freshening event for 120 years in eastern subpolar North Atlantic". Nature Communications. 11 (1): 585. doi:10.1038/s41467-020-14474-y. ISSN 2041-1723. PMC 6989661. PMID 31996687.
추가 정보
- Mantyla, A.W. (1987). "Standard Seawater Comparisons updated". J. Phys. Oceanogr. 17 (4): 543–548. Bibcode:1987JPO....17..543M. doi:10.1175/1520-0485(1987)017<0543:sscu>2.0.co;2.
- Matlab, EES 및 Excel VBA 라이브러리 루틴을 포함한 해수 속성의 MIT 페이지
- 바닷물의 기본 특성을 계산하기 위한 방정식 및 알고리즘.
- 염도 측정 이력
- 실용 염도 척도 1978.
- 염도 계산기
- 루이스, E. L. 1982년1978년의 실제 염도 척도와 그 이전 요소.해상 측지. 5(4): 350~357.
- 내해수 염도 계산식 및 알고리즘