양성자 교환막 연료전지
Proton-exchange membrane fuel cell폴리머 전해질 멤브레인(PEM) 연료전지라고도 알려진 양성자 교환막 연료전지(PEMFC)는 고정 연료전지 애플리케이션 및 휴대용 연료전지 애플리케이션뿐만 아니라 운송 애플리케이션용으로 주로 개발되고 있는 연료전지 유형이다. 이들의 구별되는 특징은 낮은 온도/압력 범위(50~100°C)와 특수 양성자 전도성 고분자 전해질 멤브레인이다. PEMFC는 전기를 발생시켜 전기를 소비하는 PEM 전기분해와는 정반대의 원리로 작동한다. 이들은 우주왕복선에서 사용된 노후 알칼리성 연료전지 기술을 대체할 유력한 후보다.[1]
과학
PEMFC는 전극, 전해질, 촉매 및 가스 확산 층을 포함하는 멤브레인 전극 조립체(MEA)로 제작된다. 촉매, 탄소, 전극의 잉크를 고체 전해액에 분사하거나 도장하고 탄소 종이는 어느 한쪽을 뜨겁게 눌러 세포 내부를 보호하며 전극의 역할도 한다. 세포의 중추적인 부분은 전해질, 촉매, 반응 물질이 혼합되어 세포 반응이 실제로 일어나는 3상 경계(TPB)이다.[2] 중요한 것은 반작용이 섞이지 않도록 막은 전기 전도성이 없어야 한다. 100[citation needed] °C 이상의 작동 온도는 물 부산물이 증기가 되고 물 관리는 셀 설계에서 덜 중요해진다.
반응
양성자 교환막 연료 전지는 수소와 산소의 전기 화학 반응에서 해방된 화학 에너지를 전기 에너지로 변환시켜 열 에너지를 생산하기 위한 수소와 산소 가스의 직접 연소와 반대로 변환시킨다.
MEA의 양극 측에 수소가 한 줄기 전달된다. 양극 쪽에서는 촉매적으로 양성자와 전자로 분리된다. 이 산화 반전지 반응 또는 수소 산화 반응(HOR)은 다음과 같이 표현된다.
양극에서:
새로 형성된 양자는 중합체 전해액막을 통해 음극측으로 스며든다. 전자는 외부 부하 회로를 따라 MEA의 음극 측으로 이동하며, 따라서 연료 전지의 전류 출력을 생성한다. 한편, MEA의 음극측으로 산소 스트림이 전달된다. 음극측에서 산소 분자는 폴리머 전해액 막을 통해 스며드는 양자와 반응하고 전자는 외부 회로를 통해 도달하여 물 분자를 형성한다. 이 감소 반전지 반응 또는 산소 감소 반응(ORR)은 다음과 같이 표현된다.
음극에서:
| [3] |
전체 반응:
가역반응은 방정식으로 표현되며 산소분자와 함께 수소양자와 전자의 재조합과 하나의 물분자의 형성을 보여준다. 각 경우의 전위는 표준 수소 전극과 관련하여 주어진다.
고분자 전해질막
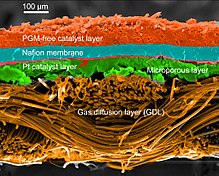

기능을 발휘하기 위해, 막은 수소 이온(프로톤)을 전도해야 하지만, 이것이 실제로 연료 전지를 "단락"시킬 것이기 때문에 전자는 전도해서는 안 된다. 또한 이 막은 가스 교차라고 알려진 문제인 어느 한쪽 기체가 세포의 다른 쪽으로도 전달되지 않도록 해야 한다.[5][6] 마지막으로, 막은 양극의 거친 산화 환경뿐만 아니라 음극의 감소 환경에도 내성을 가져야 한다.
수소 분자의 분열은 백금 촉매를 사용하여 비교적 쉽다. 하지만 불행히도 산소 분자를 분리하는 것은 더 어렵고, 이것은 상당한 전기 손실을 초래한다. 이 공정에 적합한 촉매 물질은 발견되지 않았으며, 백금이 최선의 선택이다.
힘
PEMFC는 소형화 때문에 모든 크기의 자동차와 다른 모바일 어플리케이션에 적합하다.
약점
PEM 기반 연료 전지에는 여전히 많은 문제가 있다.
1.물관리
물 관리는 성과에 결정적이다: 물이 너무 천천히 증발하면 막이 범람하고 밭 유량판 내부에 물이 축적되면 연료전지로의 산소 흐름을 방해하지만, 물이 너무 빨리 증발하면 막이 마르고 그 전체의 저항이 증가한다. 두 경우 모두 안정성 및 출력 손상을 초래할 것이다. 물 관리는 PEM 시스템에서 매우 어려운 과목으로, 주로 막내의 물이 양극화를 통해 세포의 음극 쪽으로 끌리기 때문이다.[7]
물 관리를 위한 다양한 해결책들이 존재하며 여기에는 전기전자 펌프 통합도 포함된다.
물 재순환 문제를 해결하기 위한 또 다른 혁신적인 방법은 2014년 토요타 미라이에서 사용된 3D 미세 메시 유동장 설계다. 기존의 FC 스택 설계는 직선 채널과 다공성 금속 흐름장이[54] 있는 가습기를 통해 공기 배출구에서 공기 유입구로 물을 재순환시킨다.유동장은 갈비뼈와 통로로 이루어진 구조물이다. 그러나 늑골은 부분적으로 가스 확산층(GDL)을 덮고 그 결과 기체-이동 거리가 채널간 거리보다 길다. 또한 GDL과 늑골 사이의 접촉 압력도 GDL을 압축하여 늑골과 채널의[55] 두께가 균일하지 않게 된다. 갈비뼈의 큰 폭과 균일하지 않은 두께는 수증기가 축적될 가능성을 증가시키고 산소가 손상될 것이다. 그 결과 산소가 촉매층으로 확산되는 것을 방해하여 FC에서 균일하지 않은 전력이 발생하게 된다.
이 새로운 설계는 첫 번째 FC 스택 기능을 가습 시스템 없이 사용할 수 있게 하는 한편, 물의 재순환 문제를 극복하고 높은 출력 안정성을[54] 달성했다. 3D 마이크로 격자는 기체 흐름을 위한 더 많은 경로를 허용하기 때문에 멤브레인 전극과 가스 확산층 조립체(MEGA)로 향하는 기류를 촉진하고 촉매층으로 O2 확산을 촉진한다. 기존 흐름장과 달리 GDL과 흐름장[53] 사이에 배플 역할을 하고 마이크로 스케일 인터페이스 플럭스를 빈번하게 유도하는 복합장 내 3D 마이크로 래티스(micro-latterface flows. 이러한 반복적인 미세 스케일 대류 흐름으로 인해 촉매층(CL)으로의 산소 운반과 GDL로부터의 액체 물 제거가 현저하게 향상된다. 생성된 물은 유동장을 통해 빠르게 빠져나와 모공 속 축적을 막아준다. 그 결과 이 흐름장으로부터의 발전은 단면 전체에 걸쳐 균일하게 이루어지며 자습이 활성화된다.
2.촉매의 취약성
막에 있는 백금 촉매는 일산화탄소에 의해 쉽게 중독되는데, 이 일산화탄소는 메탄 개혁으로 형성된 제품 가스(보통 백만분의 1 부분 이하가 허용된다)에 존재하는 경우가 많다. 이것은 일반적으로 제품 가스로부터 CO를 제거하고 더 많은 수소를 형성하기 위해 물 가스 이동 반응을 사용할 필요가 있다.[8] 또한 이 막은 금속 이온의 존재에 민감하여 양성자 전도 메커니즘을 손상시킬 수 있으며 금속 양극판, 연료 전지 시스템의 금속 구성 요소 또는 연료/산화물의 오염물질의 부식에 의해 유입될 수 있다.
다임러 크라이슬러 네카 5에서와 같이 개혁된 메탄올을 사용하는 PEM 시스템이 제안되었다. 즉, 메탄올을 수소를 얻기 위해 반응하게 하는 것은 매우 복잡한 과정이며, 그 반응으로 발생하는 일산화탄소로부터 정화가 필요하다. 일부 일산화탄소는 불가피하게 막에 도달하기 때문에 백금-루테늄 촉매가 필요하다. 그 수준은 백만분의 10을 초과해서는 안 된다. 더욱이 이런 개혁형 원자로의 가동 시간은 약 30분이다. 또는, 메탄올과 일부 다른 바이오 연료는 개선되지 않고 PEM 연료 전지에 직접 공급될 수 있으므로 직접 메탄올 연료 전지(DMFC)를 만들 수 있다. 이 장치들은 제한된 성공으로 작동한다.
3. 작동온도의 제한
가장 많이 사용되는 막은 케뮤르에 의한 나피온으로, 양자를 운반하기 위해 막의 액체 수분 가습에 의존한다. 이는 막이 마르기 때문에 80~90°C 이상의 온도를 사용하는 것이 불가능함을 의미한다. 기타, PBI(polybenzimidazole) 또는 인산을 기반으로 하는 보다 최근의 멤브레인 타입은 물 관리 없이 220 °C까지 도달할 수 있다(고온 프로토온 교환 멤브레인 연료전지, HT-PEMFC 참조): 높은 온도로 효율, 전력 밀도, 냉각 용이성(허용 가능한 온도 차이가 더 크기 때문에)그러나 이러한 최근 유형은 일산화탄소 중독에 대한 민감도 감소 및 관리 용이성 개선(막내 물 관리 문제 없음)이 일반적이지 않다.[9] PBI는 인산 또는 황산으로 도핑될 수 있으며 도핑량과 온도에 따라 전도성 눈금이 조정된다.[10] 고온에서는 나피온에 수분을 공급하기 어렵지만 이 산성 도핑 물질은 물을 양성자 전도의 매개체로 사용하지 않는다. 또한 나피온보다 우수한 기계적 특성, 높은 강도를 보이며 가격이 저렴하다. 그러나 산성 침출은 상당한 문제로서 촉매를 혼합하여 잉크를 형성하는 과정이 까다롭다는 것이 입증되었다. PEEK와 같은 방향성 고분자는 테플론(PTFE, Nafion의 백본)보다 훨씬 저렴하고 극성 캐릭터는 나피온보다 온도에 의존하는 수분이 적다. 그러나 PEEK는 나피온에 비해 이온 전도성이 훨씬 떨어지기 때문에 전해질 선택이 덜 유리하다.[11] 최근에는 양성 이온액체와 양성 유기 이온 플라스틱 결정이 고온(100~200℃) PEMFC에 대한 대체 전해질 재료로 유망한 것으로 나타났다.[12][13][14]
전극
전극은 일반적으로 탄소 지지대, Pt 입자, Nafion ionomer 및/또는 Teflon 바인더로 구성된다. 탄소 지지대는 전기 전도체로서 기능한다; Pt 입자는 반응 현장이다; 아이노머는 양성자 전도를 위한 경로를 제공하며, 테플론 바인더는 전극의 친수성을 증가시켜 잠재적 홍수를 최소화한다. 전극에서 전기화학적 반응을 가능하게 하기 위해서는 양성자, 전자 및 반응성 가스(수소 또는 산소)가 전극의 촉매 표면에 접근할 수 있어야 하며, 액체 또는 기체상 또는 양상일 수 있는 제품 물은 촉매에서 가스 출구로 스며들 수 있어야 한다. 이러한 특성은 일반적으로 탄소 입자에 지원되는 폴리머 전해질 바인더(아이노머)와 촉매 나노입자의 다공성 복합체에 의해 실현된다.[15] 일반적으로 백금은 양극과 음극에서 전기화학반응의 촉매로 사용되는 반면 나노입자는 높은 표면 대 중량비(아래 자세히 설명)를 실현하여 값비싼 백금의 양을 감소시킨다. 폴리머 전해질 바인더는 이온 전도성을 제공하는 반면 촉매의 탄소 지지대는 전기 전도성을 향상시키고 낮은 백금 금속 하중을 가능하게 한다.[16] 합성 전극의 전기 전도도는 일반적으로 양성자 전도율보다 40배 이상 높다.[17]
가스확산층
GDL은 촉매와 전류 수집기를 전기적으로 연결한다. 다공성, 전기 전도성, 얇아야 한다. 반응 물질은 촉매에 도달할 수 있어야 하지만 전도성과 다공성은 반대되는 힘의 역할을 할 수 있다. 최적으로 GDL은 약 1/3 나피온 또는 15% PTFE로 구성되어야 한다. 표면적이 이 층에서 가장 중요한 변수가 아니기 때문에 GDL에 사용된 탄소 입자는 촉매에 사용된 것보다 클 수 있다. GDL은 필요한 다공성과 기계적 강도의 균형을 맞추려면 두께가 약 15–35 µm이어야 한다.[18] 종종 GDL과 촉매층 사이에 중간 다공성 층이 추가되어 GDL의 큰 모공과 촉매층의 작은 다공성 사이의 전환을 용이하게 한다. GDL의 주요 기능은 제품인 물을 제거하는 것이기 때문에 물이 GDL을 효과적으로 차단할 때 홍수가 발생할 수 있다. 이것은 촉매에 접근할 수 있는 반응제 능력을 제한하고 성능을 현저히 떨어뜨린다. Teflon은 범람 가능성을 제한하기 위해 GDL에 코팅될 수 있다.[11] GDLS에서는 다공성, 고문성 및 투과성 등 몇 가지 미시적 변수가 분석된다. 이 변수들은 연료전지의 동작에 대해 발생률이 있다.[19]
효율성
Gibbs 자유에너지 방정식 ΔG = -237.13 kJ/mol을 적용하고 수소 가열값(ΔH = -285.84 kJ/mol)을 사용하는 최대 이론 효율은 298 K에서 83%이다.[citation needed]
PEM의 실제 효율성은 50~60%이다.[citation needed] 손실을 유발하는 주요 요인은 다음과 같다.
- 활성화손실
- 오미크 손실
- 대중교통손실
금속-유기체 프레임워크
금속-유기체 프레임워크(MOF)는 유기 링커에 의해 연결된 금속 노드로 구성된 비교적 새로운 종류의 다공성 고결정 물질이다. 금속 중심부와 리간드를 조작하거나 대체하는 단순성 때문에 가능한 조합의 수가 사실상 제한 없이 많아 디자인적인 관점에서 매력적이다. MOF는 튜닝 가능한 모공 크기, 열 안정성, 대용량, 큰 표면적 및 바람직한 전기 화학적 특성 때문에 많은 독특한 특성을 보인다. MOF는 수소 저장, 가스 분리, 슈퍼캐패시터, 리이온 배터리, 태양 전지, 연료 전지 등과 같은 청정에너지를 응용할 수 있는 유망한 후보들이다. 연료전지 연구 분야에서는 MOF가 기존의 고분자막과 Pt 촉매를 대체할 수 있는 잠재적 전해질 재료와 전극 촉매로 각각 연구되고 있다.
전해질 재료로서, MOF의 포함은 처음에는 직관에 반하는 것처럼 보인다. 연료전지막은 일반적으로 양극과 음극 사이의 연료 교차 및 전압 손실을 방지하기 위해 다공성이 낮다. 게다가, 이온의 수송이 질서 없는 물질에 더 유리하기 때문에, 막은 낮은 결정성을 갖는 경향이 있다. 한편, 모공에는 궁극적으로 시스템의 이온 전도성을 높여주는 추가 이온 캐리어로 채워질 수 있으며 높은 결정성으로 인해 설계 과정이 덜 복잡해진다.
좋은 전해질 PEMFCs에 대한 일반 요건: 높은 양성자 전도(실질적인 응용을 위해>10−2 S/cm)연료 전지 작동 조건에 따라 전극, 좋은 화학 및 열 안정성(환경 습도, 가변적인 기온, 독성 있는 종에 대한 저항, 등), 적은 비용, 사이에 양성자 수송을 가능하게 할 것이다.bility는 다른 셀 구성 요소와의 전체적인 호환성과 씬 프로비저닝으로 처리되어야 한다.[20] 고분자 물질은 현재 양성자 전도막의 선호되는 선택이지만, 적절한 성능을 위해 가습이 필요하며, 때로는 수화 효과로 인해 물리적으로 저하되어 효율 손실을 야기할 수 있다. 앞서 말한 바와 같이 나피온은 탈수온도 < 100 °C>로 제한되어 있어 반응동력학 속도가 느려지고 비용 효율이 저하되며 Pt 전극 촉매의 CO중독이 발생할 수 있다. 반대로, MOF는 광범위한 습도 조건뿐만 아니라 저온 및 고온에서 양성자 전도성을 장려했다. 100 °C 이하와 수화하에서는 수소 본딩과 용제 물 분자의 존재가 양성자 수송에 도움이 되는 반면, 무수 상태는 100 °C 이상의 온도에 적합하다. MOF는 또한 모공에 전하 운반(즉, 물, 산 등)을 포함시키는 것 외에 프레임워크 자체로 양성자 전도성을 나타낼 수 있는 뚜렷한 이점이 있다.
저온의 예로는 2차원 옥살레이트 교량 음이온층 골조를 숙주로 삼아 암모늄 양이온과 아디프산 분자를 모공에 도입해 양성자 농도를 높인 키타가와 외 연구원의 작업이 있다.[21] 그 결과는 25 °C에서 "초프로토닉" 전도도(8 × 10−3 S/cm)와 98% 상대습도(RH)를 나타내는 MOF의 첫 번째 사례 중 하나이다. 그들은 나중에 모공에 유입된 양이온의 친수성을 증가시키면 양성자 전도성을 더욱 높일 수 있다는 것을 발견했다. 수화 정도에 의존하는 이 저온체제에서 양성자 전도도가 습도 수준에 크게 의존하는 것도 나타났다.
고온 무수성의 예로는 PCMOF2가 있는데, PCMOF2는 트리황폰 벤젠 파생상품으로 조정된 나트륨 이온으로 구성되어 있다.[22] 성능을 향상시키고 더 높은 작동 온도를 허용하기 위해, 모공 내의 덜 휘발성 이미다졸 또는 트라이아졸 분자에 의해 물을 양성자 운반체로 대체할 수 있다. 달성된 최대 온도는 150 °C로 다른 현재의 전해액막보다 낮은 5 × 10−4 S/cm의 최적 전도성을 보였다. 그러나 이 모델은 온도계, 무수 조건, 모공 내 게스트 분자의 양을 조절할 수 있는 능력에 대한 가능성을 가지고 있으며, 이 모든 것이 양성자 전도성의 튜닝성을 가능하게 했다. 또한, 트라이아졸에 탑재된 PCMOF2는 H2/공기막 전극 어셈블리에 통합되어 100 °C에서 1.18 V의 개방 회로 전압을 달성하여 72시간 동안 안정적이고 시험 내내 가스가 꽉 찬 상태를 유지하였다. 이는 MOF가 실제로 기능하는 연료전지에 구현될 수 있음을 입증한 첫 사례였으며, 적당한 전위차이는 다공성으로 인한 연료 교차 문제가 아니라는 것을 보여주었다.
현재까지 MOF 전해액에 대해 달성한 최고 양성자 전도도는 습도 조건(98% RH)에서 25°C에서 4.2 × 10−2 S/cm로 나피온과 경쟁적이다.[20] 최근 몇몇 실험에서는 산업적 적용성에 중요한 전통적인 대량 샘플이나 단일 결정체 대신 박막 MOF막을 성공적으로 생산하기도 했다. 일단 MOF가 충분한 전도성 수준, 기계적 강도, 물 안정성 및 간단한 처리를 일관되게 달성할 수 있게 되면 가까운 장래에 PEMFC에서 중요한 역할을 할 수 있는 잠재력을 갖게 된다.
MOF는 전극 촉매를 위한 백금 그룹 금속(PGM) 재료의 잠재적 대체물로도 선정되었지만, 이 연구는 아직 개발 초기 단계에 있다. PEMFCs에서는 Pt 음극에서의 산소 감소 반응(ORR)이 양극에서의 연료 산화 반응보다 현저히 느리므로 비 PGM 및 금속 무첨가 촉매가 대안으로 조사되고 있다. MOF의 높은 부피밀도, 큰 모공 표면적, 금속 이온 부위의 개방성은 촉매 전구체에 이상적인 후보자로 만든다.[23] 전도유망한 촉매 능력에도 불구하고, 제안된 MOF 기반 촉매의 내구성은 현재 바람직한 수준보다 낮으며, 이 맥락에서 ORR 메커니즘은 여전히 완전히 이해되지 않는다.
촉매 연구
PEM 연료전지의 촉매에 대한 현재 연구의 대부분은 다음과 같은 주요 목표 중 하나를 가진 것으로 분류할 수 있다.
- 현재의 PEM 연료 전지에 사용되는 표준 탄소 지원 백금 입자 촉매보다 높은 촉매 활성도를 얻는다.
- 불순물 가스에 의한 PEM 연료전지 촉매의 중독을 줄이다
- 백금 기반 촉매의 사용으로 인한 연료 전지 비용 절감
- 백금 그룹 무금속 전기[24] 촉매의 ORR 활동 강화
이러한 접근방법의 예는 다음 절에 제시되어 있다.
촉매 활성 증가
위에서 언급했듯이, 백금은 PEM 연료전지 촉매에 사용되는 가장 효과적인 원소로서, 거의 모든 현재의 PEM 연료전지는 다공성 탄소 지지대에 백금 입자를 사용하여 수소 산화 및 산소 감소 모두를 촉매한다. 그러나 비용이 많이 들기 때문에 현재의 Pt/C 촉매는 상용화가 불가능하다. 미국 에너지부는 백금 기반 촉매들이 내연기관의 현실적인 대안을 나타내기 위해서는 현재의 PEM 연료전지 설계에 사용되는 백금보다 약 4배 적은 백금을 사용해야 할 것으로 추산하고 있다.[25] 따라서 PEM 연료 전지에 대한 촉매 설계의 한 가지 주요 목표는 백금의 촉매 활성도를 4배 증가시켜 유사한 성능을 얻기 위해 귀금속 중 4분의 1만 필요하도록 하는 것이다.
백금 촉매의 성능을 높이는 한 가지 방법은 백금 입자의 크기와 모양을 최적화하는 것이다. 입자의 크기를 줄이는 것만으로 사용 가능한 백금 부피 당 반응에 참여할 수 있는 촉매의 총 표면적이 증가하지만, 최근의 연구는 촉매 성능을 더욱 향상시키는 추가적인 방법을 입증했다. 예를 들어, 한 연구는 백금 나노입자(Pt (730)와 같이 정수가 큰 밀러 지수)의 높은 지수 면적이 일반적인 백금 나노입자보다 산소 감소에 대한 반응성 부위의 밀도를 더 많이 제공한다고 보고한다.[26]
가장 보편적이고 효과적인 촉매인 플래티넘은 매우 비싸기 때문에 표면적을 극대화하고 하중을 최소화하기 위해서는 대체 처리가 필요하다. 나노화 Pt 입자를 탄소 분말(Pt/C)에 침적하면 Pt 표면적이 넓으며, 탄소는 촉매와 나머지 세포 사이에 전기적 연결을 허용한다. 플래티넘은 전자전달을 용이하게 할 수 있을 정도로만 수소에 대한 높은 활성도와 결합을 가지고 있지만 수소가 세포주위를 계속 움직이는 것을 억제하지 않기 때문에 매우 효과적이다. 그러나, 백금은 음극 산소 감소 반응에서 덜 활동적이다. 이것은 더 많은 백금을 사용해야 하고, 셀의 비용을 증가시키고, 따라서 실현가능성을 높여야 한다. 많은 잠재적 촉매 선택은 세포의 극단적인 산성으로 인해 배제된다.[11]
현재 최고의 선택사항인 탄소분말 나노스케일 Pt를 달성하는 가장 효과적인 방법은 진공 증착, 스퍼터링, 전기적하전 등이다. 백금 입자는 PTFE가 스며든 탄소 종이에 침전된다. 그러나 이 촉매층에는 최적의 두께가 있어 낮은 비용 한도를 제한한다. 4nm 이하에서는 Pt가 종이에 섬을 형성해 활동을 제한한다. 이 두께 이상으로 Pt는 탄소를 코팅하고 효과적인 촉매제가 될 것이다. 상황을 더욱 복잡하게 만들기 위해 나피온은 10 um 이상 침투할 수 없으므로, 이것보다 더 많은 Pt를 사용하는 것은 불필요한 비용이다. 따라서 촉매의 양과 형태는 다른 물질의 제약에 의해 제한된다.[18]
백금의 촉매 활성을 증가시키는 두 번째 방법은 백금을 다른 금속과 합금하는 것이다. 예를 들어, PtNi3(111) 표면의 산소 감소 활성도가 순수 Pt(111)보다 10배 높은 것으로 최근 나타났다.[27] 저자들은 이러한 급격한 성능 증대를 표면의 전자적 구조 변경으로 인해 PEM 연료 전지에 존재하는 산소를 함유하는 이온종과 결합하는 경향이 줄어들고, 따라서 산소 흡착 및 감소를 위한 가용 부지가 증가한다고 보고 있다.
초음파 노즐을 사용하여 대기 조건에서 백금 촉매를 전해질 층이나 탄소 종이에 적용하여 고효율 분무 효과를 얻을 수 있다.[28] 연구 결과 노즐의 비클러킹 특성 때문에, 그리고 마지막으로 초음파 에너지가 분자화 직전에 서스펜션을 응집시키는 점 때문에, 이러한 종류의 분무로 인해 생성되는 물방울의 균일한 크기 때문에, 노즐의 비클러킹 특성 때문에, 연료전지 MEA가 이 방식으로 제조된 연료전지 MEA는, MEA가 가지고 있는 것으로 나타났다. 최종 MEA에서 더 큰 동질성이 있으며, 셀을 통한 기체 흐름은 더 균일하여 MEA에서 백금의 효율을 극대화한다.[29] 최근 잉크젯 프린팅을 이용해 촉매를 막 위에 침전시키는 연구도 침전된 촉매 층의 두께가 줄어 촉매 활용도가 높은 것으로 나타났다.[30][31]
매우 최근에는 Pt-M(M-Fe[32] and Co) 시스템의 경우 Pt-rich 셸 내에 순서가 지정된 금속 간 코어를 캡슐화한 새로운 등급의 ORR 전기 촉매가 도입되었다.[33] 이러한 금속간 코어-셸(IMCS) 나노촉매들은 이전 많은 설계에 비해 향상된 활성도와 확장된 내구성을 보이는 것으로 확인되었다. 활동에서 관찰된 개선은 격자 변형에서 기인하지만, 저자들은 열화동력학에서 발견된 결과 연장된 촉매 내구성이 지속적인 원자 질서에 기인한다는 것을 입증한다고 보고한다.
중독감소
촉매 성능을 개선하기 위한 또 다른 일반적인 접근법은 연료 공급원의 불순물, 특히 일산화탄소(CO)에 대한 민감도를 줄이는 것이다.[8] 현재 순수 수소 가스는 전기분해로 대량생산이 경제적이 되고 있다. 그러나, 수소가스가 증기 개혁 경탄화수소에 의해 생산되는 순간, CO (1~3%), CO2 (19–25%), N (252%)[34]을 포함한 가스를 혼합하여 생산하는 공정이다. CO의 수천만분의 수천만분의 1이라도 순수 백금 촉매를 독살할 수 있으므로, CO에 대한 백금의 저항력을 높이는 것이 연구 활동 영역이다.
예를 들어, 한 연구는 (100) 면의 정육면체 모양의 백금 나노입자가 유사한 크기의 무작위 면의 백금 나노입자에 비해 산소 감소 활성도가 4배 증가했다고 보고했다.[35] 저자들은 무작위로 형성된 나노입자의 (111) 면이 (100) 면보다 황산염 이온에 더 강하게 접합되어 산소 분자에 개방되는 촉매 부위의 수가 감소한다고 결론지었다. 반대로 그들이 합성하는 나노튜브는 황산염과 더 약하게 상호작용하는 것으로 알려진 거의 독점적인 (100) 면들을 가지고 있었다. 그 결과, 그러한 입자의 표면적 중 더 많은 부분을 산소 감소에 이용할 수 있었고, 촉매의 산소 감소 활성을 증가시켰다.
이와 함께 연구진은 수소연료가 연료전지에 들어가기 전 수소연료의 CO 함량을 줄이는 방법을 촉매에 중독되지 않도록 가능한 방법으로 연구해왔다. 최근 한 연구는 루테늄-플라티넘 코어-쉘 나노입자가 CO를 산화시켜 훨씬 덜 해로운 연료 오염물질인 CO를2 형성하는데 특히 효과적이라는 것을 밝혀냈다.[36] 이러한 효과를 내는 메커니즘은 개념적으로 위의 PtNi에3 대해 설명한 것과 유사하다: 입자의 루테늄 코어는 백금 표면의 전자 구조를 변화시켜 CO의 산화를 촉진시킬 수 있게 한다.
비용 절감
오늘날 PEM 연료전지의 생존가능성에 대한 도전은 여전히 비용과 안정성에 있다. 높은 비용은 상당 부분 PEM 셀의 촉매 층에서 백금의 귀금속을 사용했기 때문이라고 할 수 있다. 현재 전기 촉매가 연료전지 스택 비용의 거의 절반을 차지한다.[37] PEM 연료전지의 Pt 로딩은 지난 10년 동안 2회 정도 감소했지만, 상용화를 위해 이 기술이 경제적으로 실현될 수 있도록 하려면 더 이상의 감소가 필요하다.[38] 일부 연구 노력은 Pt 기반 촉매의 전기 촉매 활성도를 개선하여 이 문제를 해결하는 것을 목표로 하는 반면, 대안은 Pt 기반 기술에 필적하는 비 플라스티넘 그룹-금속(비 PGM) 음극 촉매를 개발하여 Pt의 사용을 완전히 제거하는 것이다. 미국 에너지부는 5000시간의 내구성과 300Acm의−3 비PGM 촉매 ORR 체적 활성을 목표로 연료전지 개발에 이정표를 세워왔다.[39]
Pt 기반 촉매의 대안으로는 메탈/니트로겐/탄소 촉매(M/N/C 촉매)가 있다. 높은 전력 밀도 또는 셀 표면적에 대한 전력 출력을 달성하려면 양호한 대중 교통 특성과 함께 [37]Pt 기반 촉매의 1/10 이상의 체적 활성도를 충족해야 한다. M/N/C 촉매들은 여전히 Pt 기반 촉매들보다 부피계 활동이 저조하다는 것을 보여주지만, 그러한 촉매들의 감소된 비용은 보상하기 위해 더 큰 부하를 허용한다. 그러나 M/N/C 촉매의 부하를 증가시키면 촉매 층도 두꺼워져 그 질량 전달 특성이 손상된다. 즉 H2, O2, 양성자, 전자는 촉매층을 통해 이동하는 데 더 큰 어려움을 가지고 있어 셀의 전압 출력이 감소한다. M/N/C 촉매 네트워크의 높은 마이크로포도성으로 인해 높은 부피 활성도가 발생하는 반면, 개선된 대중 교통 특성은 오히려 네트워크의 고밀도성과 관련된다. 이러한 M/N/C 재료는 금속, 질소 및 탄소를 함유한 전구체의 고온 열분해 및 기타 고온 처리를 사용하여 합성된다.[40]
최근 연구진은 철(II) 아세테이트(FeAc), 페난트로라인(Phen), 금속-유기체프레임워크(MOF) 호스트에서 파생된 Fe/N/C 촉매를 개발했다. MOF는 ZIF-8이라 불리는 Zn(II) 제올리티틱 이미다졸레이트 프레임워크(ZIF-8)로, ORR 활동에 도움이 되는 높은 마이크로파 표면적과 높은 질소 함량을 보여준다.[37] FeAc/Phen/Z의 출력 밀도IF-8 촉매의 0.6V에서 0.75 W cm가−2 검출되었다. 이 값은 이전 M/N/C 촉매의 최대 출력 밀도 0.37 W cm에−2 비해 상당히 개선된 값이며 Pt 기반 촉매의 경우 1.0–1−2.2 W cm의 일반적인 값을−2 0.3 mg cm의 Pt 부하로 일치시키는 데 훨씬 가깝다. 촉매도 현재까지 비 PGM 촉매의 최고치인 230A·cm의−3 체적 활성도를 보여 미국 에너지부 이정표에 근접했다.[37]
소설 FeAc/Phen/Z에 의해 달성되는 전력 밀도 동안IF-8 촉매가 유망해 상용화에 부적합한 내구성을 유지하고 있다. 이 촉매가 보여주는 최고 내구성은 여전히2 H/공기 100시간 이상 전류 밀도가 15% 떨어진 것으로 알려졌다.[37] 따라서 Fe 기반 비 PGM은 전기 촉매 활성에서 경쟁사인 Pt 기반 촉매들을 촉매로 만들지만, 그 분해 메커니즘을 이해하고 내구성을 향상시키기 위해 여전히 해야 할 일이 많다.[41][42]
적용들
PEM 연료전지의 주요 적용은 주로 환경에 미치는 잠재적 영향(예: 온실가스(GHG)의 배출 제어) 때문에 운송에 초점을 맞춘다. 다른 애플리케이션에는 분산/스테이션 및 휴대용 발전이 포함된다. 대부분의 주요 자동차 회사들은 다른 유형의 연료 전지들에 비해 높은 출력 밀도와 우수한 동적 특성 때문에 PEM 연료 전지만을 위해 일한다.[43] 무게가 가볍기 때문에 PEMFC는 운송 애플리케이션에 가장 적합하다. 압축수소를 연료로 사용하는 버스용 PEMFC는 최대 40%의 효율로 운행할 수 있다. 일반적으로 PEMFC는 시스템을 수용하고 연료를 저장하는 데 사용할 수 있는 용량 때문에 소형차 이상의 버스에서 구현된다. 운송을 위한 기술적 문제에는 PEM을 현재 차량 기술에 통합하고 에너지 시스템을 업데이트하는 것이 포함된다. 수소가 화석연료에서 공급된다면 연료전지 차량은 유리하지 않다. 그러나 그것들은 하이브리드로 구현될 때 이로운 것이 된다. PEMFC는 30%의 효율로 5 kW를 제공하는 정지 발전용으로 사용될 가능성이 있지만, 주로 SOFC와 MCFC 등 다른 유형의 연료전지와 경쟁하게 된다. PEMFC는 일반적으로 작동을 위해 고순도 수소를 필요로 하는 반면, 다른 연료 전지 유형은 메탄 위에서 달릴 수 있으므로 보다 유연한 시스템이다. 따라서 PEMFC는 경제적으로 확장 가능한 순수 수소를 이용할 수 있을 때까지 소규모 시스템에 가장 적합하다. 더욱이 PEMFC는 특히 장치 내에 저장하기에 편리한 위치가 없는 경우 수소 공급의 통합이 기술적 난제임에도 불구하고 휴대용 전자 장치의 배터리를 교체할 가능성이 있다.[44]
역사
PEM 연료전지가 발명되기 전에는 고체산화 연료전지와 같은 기존 연료전지 유형이 극한 조건에서만 적용되었다. 그러한 연료전지는 또한 매우 비싼 재료가 필요했고 크기 때문에 정지해 있는 용도에만 사용될 수 있었다. 이 문제들은 PEM 연료전지에서 다루어졌다. PEM 연료전지는 1960년대 초 제너럴 일렉트릭의 윌러드 토마스 그루브와 레오나드 니드라흐에 의해 발명되었다.[45] 당초 전해질에는 황화 폴리스티렌 막이 사용됐으나 1966년 나피온 아이노머로 대체돼 황화 폴리스티렌에 비해 성능과 내구성이 우수하다는 것이 입증됐다.
PEM 연료 전지는 NASA 제미니 우주선 시리즈에서 사용되었지만, 아폴로 계획과 우주 왕복선에서는 알칼리성 연료 전지로 대체되었다. 제너럴 일렉트릭(General Electric)은 PEM 셀에 대한 작업을 계속했으며 1970년대 중반 해저 생명 유지용 PEM 수분 전해분해 기술을 개발하여 미국 해군 산소 발전소로 이끌었다. 영국 왕실 해군은 1980년대 초 잠수함 함대를 위해 이 기술을 채택했다. 1980년대 후반과 1990년대 초반 로스앨러모스 국립 연구소와 텍사스 A&M 대학은 PEM 세포에 필요한 백금 양을 줄이는 방법을 실험했다.[46]
Pratt 및 Whitney Aircraft와 병행하여 제너럴 일렉트릭은 1960년대 초 제미니 우주 임무를 위한 최초의 양성자 교환막 연료전지(PEMFCs)를 개발하였다. PEMFC를 사용하는 첫 번째 임무는 제미니 V였다. 그러나 아폴로 우주 임무와 그에 따른 아폴로-소유스, 스카이랩, 우주왕복선 임무는 프랫과 휘트니 항공기가 개발한 베이컨의 설계에 기반한 연료전지를 사용했다.
극도로 비싼 재료가 사용되었고 연료전지는 매우 순수한 수소와 산소를 필요로 했다. 초기 연료전지는 많은 용도에서 문제가 되는 불편하게 높은 작동온도를 요구하는 경향이 있었다. 그러나 연료전지는 이용 가능한 연료(수소 및 산소)가 많기 때문에 바람직한 것으로 보였다.[citation needed]
우주 프로그램에서의 성공에도 불구하고 연료 전지 시스템은 높은 비용이 견딜 수 있는 우주 임무와 다른 특별한 용도에 제한되었다. 1980년대 후반과 1990년대 초반에 이르러서야 연료전지는 보다 넓은 적용기반을 위한 실질적인 옵션이 되었다. 저백금 촉매 로딩과 박막 전극과 같은 몇 가지 중추적인 혁신은 연료 전지 비용을 낮추어 PEMFC 시스템의 개발을 더욱 현실적으로 만들었다.[47] 다만 수소연료전지가 자동차나 다른 자동차에서 사용할 수 있는 현실적인 기술이 될지에 대해서는 상당한 논란이 있다. (수소 경제 참조) PEMFC 생산의 상당 부분은 도요타 미라이를 위한 것이다. 미국 에너지부는 연간 50만 대가 만들어졌을 경우 2016년 가격을 kW당 53달러로 추산하고 있다.[48]
참고 항목
참조
- ^ Loyselle, Patricia; Prokopius, Kevin (August 2011). "Teledyne Energy Systems, Inc., Proton Exchange Member (PEM) Fuel Cell Engineering Model Powerplant. Test Report: Initial Benchmark Tests in the Original Orientation". NASA. Glenn Research Center. hdl:2060/20110014968.
- ^ Millington, Ben; Du, Shangfeng; Pollet, Bruno G. (2011). "The Effect of Materials on Proton Exchange Membrane Fuel Cell Electrode Performance". Journal of Power Sources. 196 (21): 9013–017. Bibcode:2011JPS...196.9013M. doi:10.1016/j.jpowsour.2010.12.043.
- ^ Bratsch, Stephen G. (1989). "Standard Electrode Potentials and Temperature Coefficients in Water at 298.15 K". J. Phys. Chem. Ref. Data. 18 (1): 1–21. Bibcode:1989JPCRD..18....1B. doi:10.1063/1.555839. S2CID 97185915.
- ^ a b Yin, Xi; Lin, Ling; Chung, Hoon T; Komini Babu, Siddharth; Martinez, Ulises; Purdy, Geraldine M; Zelenay, Piotr (4 August 2017). "Effects of MEA Fabrication and Ionomer Composition on Fuel Cell Performance of PGM-Free ORR Catalyst". ECS Transactions. 77 (11): 1273–1281. Bibcode:2017ECSTr..77k1273Y. doi:10.1149/07711.1273ecst. OSTI 1463547.
- ^ Schalenbach, Maximilian; Hoefner, Tobias; Paciok, Paul; Carmo, Marcelo; Lueke, Wiebke; Stolten, Detlef (2015-10-28). "Gas Permeation through Nafion. Part 1: Measurements". The Journal of Physical Chemistry C. 119 (45): 25145–25155. doi:10.1021/acs.jpcc.5b04155.
- ^ Schalenbach, Maximilian; Hoeh, Michael A.; Gostick, Jeff T.; Lueke, Wiebke; Stolten, Detlef (2015-10-14). "Gas Permeation through Nafion. Part 2: Resistor Network Model". The Journal of Physical Chemistry C. 119 (45): 25156–25169. doi:10.1021/acs.jpcc.5b04157.
- ^ "Wang, Y., & Chen, K. S. (2013). PEM fuel cells: thermal and water management fundamentals. Momentum Press".
{{cite journal}}: Cite 저널은 필요로 한다.journal=(도움말) - ^ a b 콜레타, 비토 C 등 "수질-가스 이동 카탈리틱 강화 방향으로 SrTiO3 Perovskites 수정: 실험과 계산이 결합된 연구." ACS 적용 에너지 재료(2021), 4, 1, 452–461
- ^ Lee, J. S.; et al. (2006). "Polymer electrolyte membranes for fuel cells" (PDF). Journal of Industrial and Engineering Chemistry. 12: 175–183. doi:10.1021/ie050498j.
- ^ Wainright, J. S. (1995). "Acid-Doped Polybenzimidazoles: A New Polymer Electrolyte". Journal of the Electrochemical Society. 142 (7): L121. Bibcode:1995JElS..142L.121W. doi:10.1149/1.2044337.
- ^ a b c [오헤이어, 라이언 P. 연료 셀 기본 원리. 호보켄, NJ: John Wiley & Sons, 2006. 인쇄하다.
- ^ Jiangshui Luo; Jin Hu; Wolfgang Saak; Rüdiger Beckhaus; Gunther Wittstock; Ivo F. J. Vankelecom; Carsten Agert; Olaf Conrad (2011). "Protic ionic liquid and ionic melts prepared from methanesulfonic acid and 1H-1,2,4-triazole as high temperature PEMFC electrolytes". Journal of Materials Chemistry. 21 (28): 10426–10436. doi:10.1039/C0JM04306K.
- ^ Jiangshui Luo; Annemette H. Jensen; Neil R. Brooks; Jeroen Sniekers; Martin Knipper; David Aili; Qingfeng Li; Bram Vanroy; Michael Wübbenhorst; Feng Yan; Luc Van Meervelt; Zhigang Shao; Jianhua Fang; Zheng-Hong Luo; Dirk E. De Vos; Koen Binnemans; Jan Fransaer (2015). "1,2,4-Triazolium perfluorobutanesulfonate as an archetypal pure protic organic ionic plastic crystal electrolyte for all-solid-state fuel cells". Energy & Environmental Science. 8 (4): 1276–1291. doi:10.1039/C4EE02280G. S2CID 84176511.
- ^ Jiangshui Luo; Olaf Conrad & Ivo F. J. Vankelecom (2013). "Imidazolium methanesulfonate as a high temperature proton conductor". Journal of Materials Chemistry A. 1 (6): 2238–2247. doi:10.1039/C2TA00713D.
- ^ Litster, S.; McLean, G. (2004-05-03). "PEM fuel cell electrodes". Journal of Power Sources. 130 (1–2): 61–76. Bibcode:2004JPS...130...61L. doi:10.1016/j.jpowsour.2003.12.055.
- ^ Gasteiger, H. A.; Panels, J. E.; Yan, S. G. (2004-03-10). "Dependence of PEM fuel cell performance on catalyst loading". Journal of Power Sources. Eighth Ulmer Electrochemische Tage. 127 (1–2): 162–171. Bibcode:2004JPS...127..162G. doi:10.1016/j.jpowsour.2003.09.013.
- ^ Schalenbach, Maximilian; Zillgitt, Marcel; Maier, Wiebke; Stolten, Detlef (2015-07-29). "Parasitic Currents Caused by Different Ionic and Electronic Conductivities in Fuel Cell Anodes". ACS Applied Materials & Interfaces. 7 (29): 15746–15751. doi:10.1021/acsami.5b02182. ISSN 1944-8244. PMID 26154401.
- ^ a b Litster, S.; Mclean, G. (2004). "PEM Fuel Cell Electrodes". Journal of Power Sources. 130 (1–2): 61–76. Bibcode:2004JPS...130...61L. doi:10.1016/j.jpowsour.2003.12.055.
- ^ Espinoza, Mayken (2015). "Compress effects on porosity, gas-phase tortuosity, and gas permeability in a simulated PEM gas diffusion layer". International Journal of Energy Research. 39 (11): 1528–1536. doi:10.1002/er.3348.
- ^ a b Ramaswamy, Padmini; Wong, Norman E.; Shimizu, George K. H. (2014). "MOFs as proton conductors – challenges and opportunities". Chem. Soc. Rev. 43 (16): 5913–5932. doi:10.1039/c4cs00093e. PMID 24733639.
- ^ Li, Shun-Li; Xu, Qiang (2013). "Metal–organic frameworks as platforms for clean energy". Energy & Environmental Science. 6 (6): 1656. doi:10.1039/c3ee40507a.
- ^ Kitagawa, Hiroshi (2009). "Metal–organic frameworks: Transported into fuel cells". Nature Chemistry. 1 (9): 689–690. Bibcode:2009NatCh...1..689K. doi:10.1038/nchem.454. PMID 21124353.
- ^ Lux, Lacey; Williams, Kia; Ma, Shengqian (2015). "Heat-treatment of metal–organic frameworks for green energy applications". CrystEngComm. 17 (1): 10–22. doi:10.1039/c4ce01499e.
- ^ "Department of Energy Announces $39 million for Innovative Hydrogen and Fuel Cell Technologies Research and Development". Archived from the original on 2018-06-15.
- ^ 수소, 연료 전지 및 인프라 기술 프로그램 다년 연구, 개발 및 시연 계획 미국 에너지부 웨이백머신(Wayback Machine, 2007년 10월.
- ^ N. Tian; Z.-Y. Zhou; S.-G. Sun; Y. Ding; Z. L. Wang (2007). "Synthesis of tetrahexahedral platinum nanocrystals with high-index facets and high electro-oxidation activity". Science. 316 (5825): 732–735. Bibcode:2007Sci...316..732T. doi:10.1126/science.1140484. PMID 17478717. S2CID 939992.
- ^ V. R. Stamenkovic, B. Fowler, B. S. Mun, G. Wang, P. N. Ross, C. A. Lucas, N. M. Marković. Activity on Pt3Ni(111) via increased surface site availability (2007). "Improved Oxygen Reduction Activity on Pt3Ni(111) via Increased Surface Site Availability". Science. 315 (5811): 493–497. Bibcode:2007Sci...315..493S. doi:10.1126/science.1135941. PMID 17218494. S2CID 39722200.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Koraishy, Babar (2009). "Manufacturing of membrane electrode assemblies for fuel cells" (PDF). 6.2.1: Singapore University of Technology and Design. p. 9.
{{cite web}}: CS1 maint : 위치(링크) - ^ Engle, Robb (2011-08-08). Maximizing the Use of Platinum Catalyst by Ultrasonic Spray Application (PDF). Proceedings of Asme 2011 5Th International Conference on Energy Sustainability & 9Th Fuel Cell Science, Engineering and Technology Conference. Vol. ESFUELCELL2011-54369. pp. 637–644. doi:10.1115/FuelCell2011-54369. ISBN 978-0-7918-5469-3.
- ^ Shukla, S (2015). "Analysis of Low Platinum Loading Thin Polymer Electrolyte Fuel Cell Electrodes Prepared by Inkjet Printing". Electrochimica Acta. 156: 289–300. doi:10.1016/j.electacta.2015.01.028.
- ^ Shukla, S (2016). "Analysis of Inkjet Printed PEFC Electrodes with Varying Platinum Loading". Journal of the Electrochemical Society. 163 (7): F677–F687. doi:10.1149/2.1111607jes.
- ^ Sagar Prabhudev; Matthieu Bugnet; Christina Bock; Gianluigi Botton (2013). "Strained Lattice with Persistent Atomic Order in Pt3Fe2 Intermetallic Core–Shell Nanocatalysts". ACS Nano. 7 (7): 6103–6110. doi:10.1021/nn4019009. PMID 23773037.
- ^ Minna Cao, Dongshuang Wu & Rong Cao (2014). "Recent Advances in the Stabilization of Platinum Electrocatalysts for Fuel-Cell Reactions". ChemCatChem. 6 (1): 26–45. doi:10.1002/cctc.201300647. S2CID 97620646.
- ^ G. Hoogers (2003). Fuel Cell Technology Handbook. Boca Raton, FL: CRC Press. pp. 6–3. ISBN 978-0-8493-0877-2.
- ^ C. Wang, H. Daimon, T. Onodera, T. Koda, S. Sun. A general approach to the size- and shape-controlled synthesis of platinum nanoparticles and their catalytic reduction of oxygen (2008). "A General Approach to the Size- and Shape-Controlled Synthesis of Platinum Nanoparticles and Their Catalytic Reduction of Oxygen". Angewandte Chemie International Edition. 47 (19): 3588–3591. doi:10.1002/anie.200800073. PMID 18399516.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ S. Alayoglu, A. U. Nilekar, M. Mavrikakis, B. Eichhorn. Ru–Pt core–shell nanoparticles for preferential oxidation of carbon monoxide in hydrogen (2008). "Ru–Pt core–shell nanoparticles for preferential oxidation of carbon monoxide in hydrogen". Nature Materials. 7 (4): 333–338. Bibcode:2008NatMa...7..333A. doi:10.1038/nmat2156. PMID 18345004.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ a b c d e E. 프로이에티, F. 자우엔, M. 르페브르, N. 라루슈, J. 톈, J. 헤란즈, J.P. 도들렛. 2011 폴리머 전해질 멤브레인 연료전지의 출력밀도가 향상된 철 기반 음극촉매" 자연통신 2(1)
- ^ Litster, S.; McLean, G. (2004). "PEM fuel cell electrodes". Journal of Power Sources. 130 (1–2): 61–76. Bibcode:2004JPS...130...61L. doi:10.1016/j.jpowsour.2003.12.055.
- ^ "Y. Wang, Daniela Fernanda Ruiz Diaz, Ken S. Chen, Zhe Wang, and Xavier Cordobes Adroher. "Materials, technological status, and fundamentals of PEM fuel cells–A review." Materials Today, 32 (2020) 178-203" (PDF). doi:10.1016/j.mattod.2019.06.005. S2CID 201288395.
{{cite journal}}: Cite 저널은 필요로 한다.journal=(도움말) - ^ Serov, A.; Artyushkova, K.; Atanassov, P. (2014). "Fe-N-C Oxygen Reduction Fuel Cell Catalyst Derived from Carbendazim: Synthesis, Structure, and Reactivity". Adv. Energy Mater. 4 (10): 1301735. doi:10.1002/aenm.201301735.
- ^ Yin, Xi; Zelenay, Piotr (13 July 2018). "Kinetic Models for the Degradation Mechanisms of PGM-Free ORR Catalysts". ECS Transactions. 85 (13): 1239–1250. doi:10.1149/08513.1239ecst. OSTI 1471365.
- ^ Martinez, Ulises; Babu, Siddharth Komini; Holby, Edward F.; Zelenay, Piotr (April 2018). "Durability challenges and perspective in the development of PGM-free electrocatalysts for the oxygen reduction reaction". Current Opinion in Electrochemistry. 9: 224–232. doi:10.1016/j.coelec.2018.04.010. OSTI 1459825.
- ^ [1] Y. Wang, Ken S. Chen, Jeffrey Misshler, Sung Cho, Xavier Cordobes Adroher, A Review of Polymer Delete Membrane Fuel Cells: 기술, 응용 및 기초 연구에 대한 니즈, 응용 에너지 88(2011) 981-1007.
- ^ [위, 정호야. "프로톤 교환 막 연료전지 시스템 적용" 재생 가능 및 지속 가능한 에너지 리뷰 11.8(2007): 1720-738. 웹.]
- ^ PEM 연료 전지. Americanhistory.si.edu. 2013-04-19년에 검색됨.
- ^ "Collecting the History of Proton Exchange Membrane Fuel Cells". americanhistory.si.edu. Retrieved 2022-01-07.
- ^ Eberle, Ulrich; Mueller, Bernd; von Helmolt, Rittmar (2012-07-15). "Fuel cell electric vehicles and hydrogen infrastructure: status 2012". Royal Society of Chemistry. Retrieved 2013-01-08.
- ^ Klippenstein, Matthew (24 April 2017). "Is Toyota's hydrogen fuel-cell fervor foolish, or foresighted? (with charts)". Retrieved 13 May 2017.
Toyota's 2,000 or so Mirai sales in 2016 represented more than three times the megawattage of PEMFCs produced worldwide in 2014.













