오피네이트
Opiate아편제는 고전 약리학에서 아편에서 파생된 물질이다.보다 현대적인 용법에서, 오피오이드라는 용어는 뇌의 오피오이드 수용체([1]길항제 포함)에 결합하는 모든 물질(자연 및 합성 물질)을 나타내기 위해 사용됩니다.아편화합물은 양귀비 식물인 파파버 [2]솜니페룸에서 자연적으로 발견되는 알칼로이드 화합물이다.아편 식물에서 발견되는 정신작용성 화합물에는 모르핀, 코데인, 테바인이 포함된다.아편제는 AD [3]8세기부터 아편 거래와 통증 완화를 위한 사용의 증거와 함께 다양한 의학적 조건에 오랫동안 사용되어 왔다.아편제는 중간에서 높은 남용 가능성을 가진 약물로 간주되며, 미국 통일 통제 물질법에 따라 다양한 "물질 통제 일정"에 열거되어 있다.
2014년에는 1,300만 명에서 2,000만 명이 아편제를 레크리에이션용으로 사용했습니다(15~[4]65세 전 세계 인구의 0.3%에서 0.4%).CDC에 따르면 2000년부터 [5]2014년까지 이 인구 중 47,000명이 사망했고 총 50만 명이 사망했다고 한다.2016년 세계보건기구는 2700만 명의 사람들이 오피오이드 남용 장애를 겪고 있다고 보고했다.그들은 또한 2015년에 약물의 사용으로 45만 명이 사망했으며, 그 중 3분의 1에서 5분의 1이 오피오이드 [6]때문이라고 보고했다.
개요
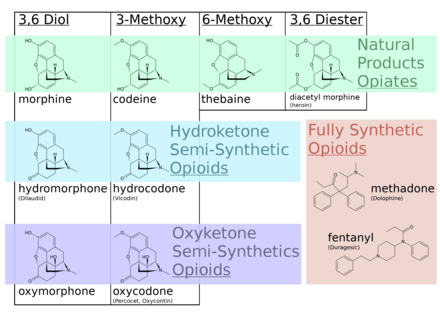
아편제는 벤질리소퀴놀린 알칼로이드의 큰 생합성 그룹에 속하며, 아편 양귀비에서 자연적으로 발생하는 알칼로이드이기 때문에 이러한 이름이 붙었다.주요 정신작용성 아편제는 모르핀, 코데인, 테베인이다.파파베린, 노스카핀, 그리고 약 24개의 다른 알칼로이드들도 아편에 존재하지만 인간의 중추 신경계에는 거의 또는 전혀 영향을 미치지 않습니다.중추신경계에 영향을 미치지 않는 알칼로이드는 아편제로 간주되지 않는다.극소량의 하이드로코돈과 하이드로모르폰이 아편 분석에서 드물게 검출된다.그것은, 현시점에서는 이해되지 않고,[citation needed] 죽을지도 모르는 환경하에서 식물에 의해서 생산되고 있는 것으로 보인다.디히드로코데인, 옥시모르폴, 옥시코돈, 옥시모르폰, 메토폰, 스큐오모르핀 및 기타 모르핀 및/또는 하이드로모르폰 유도체도 [citation needed]아편에서 미량 검출된다.
모르핀이 의학적으로 가장 중요한 아편제임에도 불구하고, 코데인은 의학적으로 더 많이 소비되며, 대부분은 모르핀에서 합성된다.코데인은 보다 크고 예측 가능한 경구 생체 가용성을 가지고 있어 용량 적정화가 용이하다.코데인은 또한 모르핀보다 남용 가능성이 적고, 더 순하기 때문에 더 많은 양의 코데인이 필요하다.[7]
아편 금단 증후군 효과는 장기간의 아편 복용의 갑작스러운 중단 또는 감소와 관련이 있다.
아편 의존성과 남용의 징후는 아편제의 약동학적 특성과 사용자의 중독 [8]성향을 포함한 다양한 요인에 의존한다.
합성
나프토키논(게이트 합성) 또는 기타 간단한 유기 시작 물질에서 오피오이드를 완전히 합성하는 것은 가능하지만, 그것들은 지루하고 비경제적인 과정이다.따라서 오늘날 사용되는 아편형 진통제의 대부분은 파파버 솜니페럼에서 추출되거나 이들 아편제, 특히 [9]테바인에서 합성된다.
2015년 연구는 유전자 변형 효모를 사용하여 테바인과 하이드로코돈의 생합성에 성공했다고 보고했다.이 공정을 상업용으로 확장하면 생산 시간이 1년에서 며칠로 단축되고 비용을 [10][11]90% 절감할 수 있습니다.
약동학
코데인
코데인은 모르핀으로 전환되는 프로드러그이며 μ-opiate 수용체에 작용한다.CYP2D6 효소의 대사에 의해 모르핀으로 전환된다.CYP2D6 활성이 낮은 사람은 코데인이 진통 효과를 경험할 만큼 충분히 효율적으로 대사되지 않을 수 있다.반대로, CYP2D6 활성이 높은 개인은 약물을 너무 빨리 대사하고 진정제 및 호흡 [12]우울증과 같은 선량 관련 부작용을 경험할 수 있다.
펜타닐
펜타닐은 아릴피페리딘과 구조적으로 유사한 합성 오피오이드이다.모르핀보다 80~100배 더 강력하며, 모르핀보다 활동 지속 시간이 짧은 빠른 발병을 보이는 강력한 μ수용체 작용제이다.CYP3A4 효소에 의해 간에서 노르펜타닐 [13]화합물로 대사된다.
헤로인
| 물질. | 최량 추정 | 낮다 추정 | 높은 추정 |
|---|---|---|---|
| 암페타민- 활자 자극제 | 34.16 | 13.42 | 55.24 |
| 대마초 | 192.15 | 165.76 | 234.06 |
| 코카인 | 18.20 | 13.87 | 22.85 |
| 엑스터시 | 20.57 | 8.99 | 32.34 |
| 오피제 | 19.38 | 13.80 | 26.15 |
| 오피오이드 | 34.26 | 27.01 | 44.54 |
디아세틸모르핀의 상표명인 헤로인은 천연 [15]아편의 성분인 모르핀에서 파생된 여러 반합성 오피오이드 중 첫 번째입니다.천연 아편에서 직접 추출된 것이 아니라 아편에서 추출된 것이지만, 일반적으로 아편이라고 [citation needed]불립니다.헤로인(디아세틸모르핀)은 모르핀 프로드러그이며 투여 후 간에서 모르핀으로 대사된다.헤로인의 주요 대사물 중 하나인 6-모노아세틸모르핀(6-MAM)도 모르핀 프로드러그이다.
하이드로모르폰
하이드로모르폰은 모르핀의 대안으로 사용된다.이것은 높은 퍼스트패스 대사를 가지며, 주로 간에서 하이드로모르폰-3-글루코로니드(H3G)로 글루쿠론화된다.하이드로모르폰의 75%는 경구적으로 배출되며, 7%는 모 아편제로 [13]배출됩니다.
메페리딘
메페리딘은 아릴피페리딘 클래스의 합성 아편제 부분이다.모르핀의 1/10 효력을 가진 강력한 μ수용체 작용제입니다.혹독한 치료를 위해 사용되며 반감기는 3~4시간입니다.노메피리딘, 노메피리딘산 및 메드페리딘산의 활성 대사물로 간 대사된다.독극물 수준의 노르메리딘은 CNS 흥분과 [13]발작을 일으킬 수 있다.
메타돈
메타돈은 [16]모르핀에 비해 생물학적 가용성과 반감기가 높다.간에서 CYP3A4 효소에 의한 N-탈메틸화에 의해 비활성 생성물로 대사된다.개인별로 [17]CYP3A4의 수치가 다르기 때문에 사람 대 사람 간의 변동성이 높습니다.중간에서 심각한 통증 [18]및 오피오이드 의존증 치료에 대해 승인되었습니다.약물 상호작용의 위험, 간 독성 및 환자 변동성 때문에, 환자들은 메타돈 [19]클리닉에서 면밀히 관찰되어야 한다.
모르핀
니코모르핀(빌란, 디니코틴산 모르핀), 디아모르핀(헤로인, 모르핀 디아세테이트), 디프로파노일모르핀(모르핀 디프로피온산), 데소모르핀(페르모니드, 디히드로피오닐모르핀), 메틸데솔핀, 아세틸프로피오닐모르핀, 디벤조일모르핀, 디벤조일모르핀
모르핀은 간에서 모르핀-3-글루쿠로니드(M3G) 및 모르핀-6-글루쿠로니드(M6G)로 대사되어 신장에 의해 배설된다.그들은 또한 혈액-뇌 장벽을 넘어 뇌척수액으로 들어갈 수 있다.M6G는 강력한 진통제 활성을 가지고 있고, 오피오이드 수용체에 결합하며,[21] 모르핀의 치료적 이점에 주요 기여자이다.M3G는 진통제로 작용하지 않고, 오피오이드 수용체에 대한 친화력이 낮으며, 모르핀과 M6G의 치료 효과를 길항시킬 수 있다. 또한, M3G는 다량의 모르핀, 알로디니아, 미오클로누스 [22]등의 신경독성 부작용과 관련이 있다.
옥시모르폰
옥시모르폰은 모르핀의 총칭이다.6-히드록시-옥시몰폰 및 옥시몰폰-3-글루쿠로니드로 대사되며 40%는 대사물로 배설된다.6-히드록시-옥시모르핀은 활성이며 모약과 1:1 비율로 존재한다.옥시몰폰-3-글루쿠로니드의 활성은 알려지지 않았다.[13]
표시
아편제는 주로 통증 관리에 사용되며 [23]통증과 기능 모두에 대해 환자의 위험을 능가하는 이점이 있다는 전제 하에 사용됩니다.또 다른 징후는 급성 환경(예: 폐부종)과 말기 [24][25]환자 모두에서 호흡 부족의 증상 완화이다.
아편제 간 약역학이 다르기 때문에 약물을 전환할 때 아편제 용량 변환이 필요할 수 있습니다.일반적으로 모르핀은 동등한 진통제 효과를 얻기 위해 아편제 간 전환의 표준으로 사용된다.모르핀 당량의 이러한 차이는 동일한 [26]약물의 제제 간에 다를 수 있다.모르핀 밀리그램 당량을 사용하여 일일 총 투여량을 계산하여 과다 [27]복용 위험이 있는 환자를 식별한다.
합병증과 부작용
오피오이드 사용과 관련된 일반적인 부작용은 진정, 메스꺼움, 어지럼증, 구토, 변비, 신체적 의존성, 내성 및 호흡 우울증을 포함한다.이들 중 가장 흔한 것은 변비와 메스꺼움이며 이러한 부작용에 [28]대한 내성이 발달하지 않았다.이것이 변의 연화제나 설사제(폴리에틸렌 글리콜, 도쿠세이트, 세나)가 오피오이드와 [29]함께 종종 처방되는 이유입니다.
덜 흔한 부작용으로는 지연된 위 비우기, 과알제증, 면역 및 호르몬 기능 장애, 근육 경직, 미오클로누스 [30]등이 있습니다.
통증을 위한 아편 사용은 의료 시스템에서 널리 받아들여지고 있습니다.그러나 만성통증에 대한 장기치료는 적절한 [31]복용을 하더라도 남용과 다른 사람에게의 전환으로 이어질 수 있는 중독의 위험이 높기 때문에 매우 논란이 많다.아편 중독자들은 그들의 직업적, 개인적 관계에 부정적인 영향을 미치면서 그들의 삶에서 다른 활동들보다 이러한 약물을 얻는 것을 우선시할 것이다.
오피오이드를 만성적으로 사용하면 내성이 발생할 수 있습니다.이것은 종종 환자가 원하는 효과를 [32]얻기 위해 더 많은 양의 약물을 필요로 한다.
농도 의존성 부작용은 약물 대사를 변화시킬 수 있는 사용자의 유전자 다형에 따라 달라질 수 있다.시토크롬 P450(특히 CYP2D6)은 활성 대사물에 대한 다양한 아편제 대사에 관여하며 CYP450 활성의 변화는 다양한 혈청 약물 [33]수준을 유발한다.
통증에 시달리는 약리
통증은 실제 또는 잠재적 조직 손상과 관련된 불쾌한 감각 및 감정적 경험입니다.통증이 조직 손상을 방지하거나 제한하기 위한 경보 역할을 하는 필수적인 방어 기능이다.아편제는 억제제 G 단백질 결합 수용체(GPCR)와 결합된 오피오이드 수용체에 작용한다.이러한 수용체는 μ([34]mu), γ(delta), γ(kappa) 수용체의 3가지로 분류된다.
오피오이드 수용체의 70% 이상이 μ 수용체이며, 주로 척수의 등쪽 뿔에 있는 노키셉터의 중앙 말단에 위치한다.나머지 30%의 오피오이드 수용체는 시냅스 후 2차 스피노탈람 뉴런과 인터뉴론의 [34]수상돌기에 위치한다.
아편제가 GPCR에 작용제로 결합할 때, 칼륨 이온 채널의 자극으로 아데닐산 사이클라아제 및 칼슘 이온 채널의 억제를 초래하는 신호 캐스케이드가 있을 것이다.이러한 변화의 순효과는 세포 내 cAMP의 감소와 신경세포의 과분극이 신경전달물질 [35]방출을 감소시키는 것이다.이 경로를 통해 아편제가 mu 수용체에 결합하고 활성화되면 통증 신호 전달이 감소한다.이 경로는 아편제 진통제 성질을 대상으로 하며, 그 성질을 위해 알려져 있다.mu의 다른 임상적으로 중요한 역할은 호흡 및 심혈관 기능, 위장 연동, 식사, 그리고 [36]기분에 대한 관여이다.이러한 다른 경로들은 높은 용량에서의 호흡 억제, 만성적인 사용에 의한 변비, 중독성과 [30]같은 아편제 사용의 부작용을 설명하기 때문에 중요하다.
절대 금기 사항
다음 조건을 가진 사용자는 opioid를 사용하지 [37]않아야 합니다.
- 심한 호흡 불안정
- 급성 정신 불안정
- 통제 불능의 자살 위험
- 진단된 비독점 약물 남용
- 처방된 메타돈의 경우 QTc 간격이 500밀리초보다 길다.
- 통제 물질의 급격한 전환
- 특정 오피오이드에 대한 이전 시험 사용에 대한 내성
- 심각한 부작용 또는 효과 부족.
처방전 남용 위험 요소
다음은 아편제 처방 [38]오용의 위험 요인입니다.
- 약물 남용의 과거 또는 현재 이력
- 치료되지 않은 정신 질환
- 젊은 환자
- 약물 남용 가족력
- 물질 사용을 장려하는 사회적 환경
- 오피오이드로 장기간 사용하거나 치료한다.
통계적으로, 약물 사용 이력과 정신 질환이 있는 중년 환자는 자살과 같은 사망 위험이 더 높은 것으로 보인다.
「 」를 참조해 주세요.
레퍼런스
- ^ Hemmings, Hugh C.; Egan, Talmage D. (2014). Pharmacology and Physiology for Anesthesia: Foundations and Clinical Application: Expert Consult - Online and Print. Elsevier Health Sciences. p. 253. ISBN 978-1437716795.
Opiate is the older term classically used in pharmacology to mean a drug derived from opium. Opioid, a more modern term, is used to designate all substances, both natural and synthetic, that bind to opioid receptors (including antagonists).
- ^ "Opiate - Definitions from Dictionary.com". dictionary.reference.com. Retrieved 2008-07-04.
- ^ Brownstein, M J (1993-06-15). "A brief history of opiates, opioid peptides, and opioid receptors". Proceedings of the National Academy of Sciences of the United States of America. 90 (12): 5391–5393. Bibcode:1993PNAS...90.5391B. doi:10.1073/pnas.90.12.5391. ISSN 0027-8424. PMC 46725. PMID 8390660.
- ^ "Status and Trend Analysis of Illict [sic] Drug Markets" (PDF). World Drug Report 2015. Retrieved 26 June 2015.
- ^ "CDC Press Releases". CDC. 2016-01-01. Retrieved 2019-10-17.
- ^ "WHO Information sheet on opioid overdose". WHO. Retrieved 2019-10-21.
- ^ "Canadian Guideline for Opioid Use for Pain — Appendix B-8: Opioid Conversion and Brand Availability in Canada". nationalpaincentre.mcmaster.ca. Retrieved 2016-04-18.
- ^ Gruber, Staci A.; Silveri, Marisa M.; Yurgelun-Todd, Deborah A. (2007-09-01). "Neuropsychological Consequences of Opiate Use". Neuropsychology Review. 17 (3): 299–315. doi:10.1007/s11065-007-9041-y. ISSN 1573-6660. PMID 17690984. S2CID 22057898.
- ^ Urbana-Champaign 일리노이대 화학과학대학 모르핀 알칼로이드 합성 2013-02-28 Wayback Machine에 보관된 2013-02-2010
- ^ Galanie, Stephanie; Thodey, Kate; Trenchard, Isis J.; Interrante, Maria Filsinger; Smolke, Christina D. (2015-09-04). "Complete biosynthesis of opioids in yeast". Science. 349 (6252): 1095–1100. Bibcode:2015Sci...349.1095G. doi:10.1126/science.aac9373. ISSN 0036-8075. PMC 4924617. PMID 26272907.
- ^ Mobley, Emily (2015-08-13). "Yeast cells genetically modified to create morphine-like painkiller". The Guardian. ISSN 0261-3077. Retrieved 2016-04-17.
- ^ Kirchheiner, J.; Schmidt, H.; Tzvetkov, M.; Keulen, J.-Tha; Lötsch, J.; Roots, I.; Brockmöller, J. (August 2007). "Pharmacokinetics of codeine and its metabolite morphine in ultra-rapid metabolizers due to CYP2D6 duplication". The Pharmacogenomics Journal. 7 (4): 257–265. doi:10.1038/sj.tpj.6500406. ISSN 1473-1150. PMID 16819548.
- ^ a b c d Inturrisi, Charles E. (July 2002). "Clinical pharmacology of opioids for pain". The Clinical Journal of Pain. 18 (4 Suppl): S3–13. doi:10.1097/00002508-200207001-00002. ISSN 0749-8047. PMID 12479250. S2CID 17984040.
- ^ "Annual prevalence of use of drugs, by region and globally, 2016". World Drug Report 2018. United Nations Office on Drugs and Crime. 2018. Retrieved 7 July 2018.
- ^ Copeland, CS (Jul–Aug 2014). "The Human Side of the Heroin Epidemic" (PDF). Healthcare Journal of New Orleans.
- ^ Grissinger, Matthew (August 2011). "Keeping Patients Safe From Methadone Overdoses". Pharmacy and Therapeutics. 36 (8): 462–466. ISSN 1052-1372. PMC 3171821. PMID 21935293.
- ^ Ferrari, Anna; Coccia, Ciro Pio Rosario; Bertolini, Alfio; Sternieri, Emilio (December 2004). "Methadone--metabolism, pharmacokinetics and interactions". Pharmacological Research. 50 (6): 551–559. doi:10.1016/j.phrs.2004.05.002. ISSN 1043-6618. PMID 15501692.
- ^ Anderson, Ilene B; Kearney, Thomas E (January 2000). "Use of methadone". Western Journal of Medicine. 172 (1): 43–46. doi:10.1136/ewjm.172.1.43. ISSN 0093-0415. PMC 1070723. PMID 10695444.
- ^ Lugo, Ralph A.; Satterfield, Kristin L.; Kern, Steven E. (2005). "Pharmacokinetics of methadone". Journal of Pain & Palliative Care Pharmacotherapy. 19 (4): 13–24. doi:10.1080/J354v19n04_05. ISSN 1536-0288. PMID 16431829. S2CID 29509469.
- ^ "Esters of Morphine". www.unodc.org. United Nations Office on Drugs and Crime. Retrieved 10 March 2012.
- ^ Christrup, L. L. (January 1997). "Morphine metabolites". Acta Anaesthesiologica Scandinavica. 41 (1): 116–122. doi:10.1111/j.1399-6576.1997.tb04625.x. PMID 9061094. S2CID 9858042.
- ^ Andersen, Gertrud; Christrup, Lona; Sjøgren, Per (January 2003). "Relationships among morphine metabolism, pain and side effects during long-term treatment: an update". Journal of Pain and Symptom Management. 25 (1): 74–91. doi:10.1016/s0885-3924(02)00531-6. ISSN 0885-3924. PMID 12565191.
- ^ Cohen, Brandon; Preuss, Charles V. (2019), "Opioid Analgesics", StatPearls, StatPearls Publishing, PMID 29083658, retrieved 2019-10-31
- ^ Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JGF, Coats AJS; et al. (2016). "2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC". Eur Heart J. 37 (27): 2129–2200. doi:10.1093/eurheartj/ehw128. PMID 27206819.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Albert RH (2017). "End-of-Life Care: Managing Common Symptoms". Am Fam Physician. 95 (6): 356–361. PMID 28318209.
- ^ Patanwala, Asad E; Duby, Jeremiah; Waters, Dustin; Erstad, Brian L (2007-02-01). "Opioid Conversions in Acute Care". Annals of Pharmacotherapy. 41 (2): 255–267. doi:10.1345/aph.1H421. ISSN 1060-0280. PMID 17299011. S2CID 2684749.
- ^ "Morphine Equivalent Units/Morphine Milligram Equivalents". www.asam.org. Retrieved 2019-11-10.
- ^ Benyamin, Ramsin; Trescot, Andrea M.; Datta, Sukdeb; Buenaventura, Ricardo; Adlaka, Rajive; Sehgal, Nalini; Glaser, Scott E.; Vallejo, Ricardo (2008). "Opioid complications and side effects". Pain Physician. 11 (2 Suppl): S105–120. doi:10.36076/ppj.2008/11/S105. ISSN 1533-3159. PMID 18443635.
- ^ Publishing, Harvard Health (27 September 2018). "Pain relief, opioids, and constipation". Harvard Health. Retrieved 2019-10-24.
- ^ a b Benyamin, Ramsin; Trescot, Andrea M.; Datta, Sukdeb; Buenaventura, Ricardo; Adlaka, Rajive; Sehgal, Nalini; Glaser, Scott E.; Vallejo, Ricardo (March 2008). "Opioid complications and side effects". Pain Physician. 11 (2 Suppl): S105–120. doi:10.36076/ppj.2008/11/S105. ISSN 1533-3159. PMID 18443635.
- ^ Reference, Genetics Home. "Opioid addiction". Genetics Home Reference. Retrieved 2019-10-24.
- ^ Abuse, National Institute on Drug. "Prescription Opioids". www.drugabuse.gov. Retrieved 2019-10-24.
- ^ Foster, Adriana; Mobley, Elizabeth; Wang, Zixuan (2007). "Complicated Pain Management in a CYP450 2D6 Poor Metabolizer". Pain Practice. 7 (4): 352–356. doi:10.1111/j.1533-2500.2007.00153.x. ISSN 1533-2500. PMID 17986163. S2CID 30624022.
- ^ a b Fornasari, Diego (2014). "Pain pharmacology: focus on opioids". Clinical Cases in Mineral and Bone Metabolism. 11 (3): 165–168. ISSN 1724-8914. PMC 4269136. PMID 25568646.
- ^ Pathan, Hasan; Williams, John (2012). "Basic opioid pharmacology: an update". British Journal of Pain. 6 (1): 11–16. doi:10.1177/2049463712438493. ISSN 2049-4637. PMC 4590096. PMID 26516461.
- ^ Pasternak, Gavril W.; Pan, Ying-Xian (October 2013). "Mu Opioids and Their Receptors: Evolution of a Concept". Pharmacological Reviews. 65 (4): 1257–1317. doi:10.1124/pr.112.007138. ISSN 0031-6997. PMC 3799236. PMID 24076545.
- ^ "Appendix C – Opioid Pharmacology". ICSI. Retrieved 2019-10-24.
- ^ Webster, Lynn R. (2017). "Risk Factors for Opioid-Use Disorder and Overdose". Anesthesia and Analgesia. 125 (5): 1741–1748. doi:10.1213/ANE.0000000000002496. ISSN 1526-7598. PMID 29049118.