근육 수축
Muscle contraction근육 수축은 근육 [1][2]세포 내에서 긴장을 생성하는 부위의 활성화이다.생리학적으로 근육 수축은 근육 길이의 변화 없이 만들어질 수 있기 때문에 반드시 근육 단축을 의미하는 것은 아니다. 예를 들어, 같은 위치에서 무거운 [1]것을 잡을 때처럼 근육 긴장은 근육 길이의 변화 없이 만들어질 수 있기 때문이다.근육수축의 종료는 근육의 이완을 수반하는데, 이는 근육섬유가 저긴장 생성 [1]상태로 되돌아가는 것이다.
근육 수축은 길이와 긴장이라는 [1]두 가지 변수를 기준으로 설명할 수 있습니다.근육의 수축은 근육의 긴장이 변화하지만 근육의 길이는 [1][3][4][5]변하지 않는 경우 등각도로 기술된다.반대로,[1][3][4][5] 근육 수축은 수축 내내 근육 긴장이 동일하게 유지된다면 등각성입니다.근육 길이가 짧아지면 수축이 [1][6]동심원이고, 근육 길이가 길어지면 수축이 편심합니다.운동기 활동의 기초가 되는 자연 운동에서, 근육 수축은 시간 가변적인 [7]방식으로 길이와 장력에 변화를 일으킬 수 있기 때문에 다면적이다.따라서, 운동 중 수축하는 골격근에서는 길이와 장력이 동일하지 않을 수 있다.
척추동물에서 골격근 수축은 운동뉴런으로부터 시냅스 입력을 필요로 하기 때문에 신경유전적이다.단일 운동 뉴런은 여러 개의 근육 섬유를 동시에 수축시킬 수 있다.일단 신경화된 후, 각 골격근 섬유 내의 단백질 필라멘트는 수축하기 위해 서로 미끄러져 지나가는데, 이것은 슬라이딩 필라멘트 이론에 의해 설명된다.발생하는 수축은 활동 전위의 빈도에 따라 경련, 합산 또는 파상풍으로 설명할 수 있습니다.골격근육에서 근육의 장력은 길이-장력 관계에 의해 설명되는 중간 길이로 근육이 늘어났을 때 가장 크다.
골격근과 달리 평활근과 심장근육의 수축은 자율신경계의 자극에 의해 조절될 수 있지만 근원적이다.이러한 근육조직의 수축 메커니즘은 골격근조직의 수축 메커니즘과 유사하다.
종류들
근육 수축은 힘과 길이라는 두 가지 변수를 기준으로 설명할 수 있습니다.힘 자체는 장력 또는 하중으로 구분할 수 있습니다.근육의 장력은 물체에 가해지는 힘인 반면, 하중은 [1]물체에 가해지는 힘이다.근육 길이의 변화 없이 근육의 긴장이 변화하면 근육 수축은 등각도로 [1][3][4][5]표현된다.만약 근육의 길이가 변하지 않고 근육의 긴장이 변하지 않는다면, 근육의 수축은 [1][3][4][5]등각성입니다.동위원소 수축에서 근육 길이는 동심원 수축으로 짧아지거나 편심 [1][6]수축으로 길어질 수 있다.운동기 활동의 기초가 되는 자연 운동에서, 근육 수축은 시간 가변적인 [7]방식으로 길이와 장력에 변화를 일으킬 수 있기 때문에 다면적이다.따라서, 운동 중 근육이 활동할 때 길이와 장력이 일정하게 유지되지 않을 수 있다.
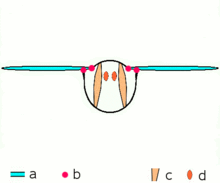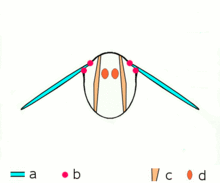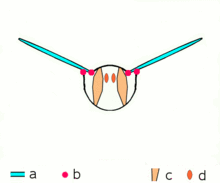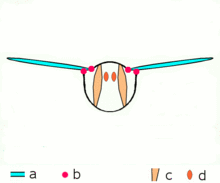
등각 수축
근육의 등각 수축은 [1][3][4][5]길이를 바꾸지 않고 장력을 발생시킨다.예를 들어 손과 팔뚝의 근육이 물체를 잡았을 때, 손의 관절은 움직이지 않지만, 근육이 물체를 떨어뜨리는 것을 막기 위해 충분한 힘을 발생시킬 수 있다.
동위원소 수축
동위원소 수축에서는 근육 [1][3][4][5]길이의 변화에도 불구하고 근육의 장력은 일정하게 유지됩니다.이것은 근육의 수축력이 근육에 가해지는 총 하중과 일치할 때 발생합니다.
동심원 수축
동심원 수축에서는 근육의 긴장이 하중을 극복하기에 충분하고 [8]수축하면서 근육이 짧아진다.이는 근육에 의해 생성된 힘이 수축에 대항하는 하중을 초과할 때 발생합니다.
동심원 수축 중에는 슬라이딩 필라멘트 이론에 따라 근육이 수축하도록 자극된다.이것은 근육의 길이 전체에 걸쳐서 발생하며, 원점과 삽입부에 힘을 발생시켜 근육이 짧아지고 관절의 각도를 변화시킵니다.팔꿈치와 관련하여, 이두박근의 동심원 수축은 손이 다리에서 어깨로 이동할 때 팔이 팔꿈치에서 구부러지게 한다(이두박근 컬).삼두근의 동심원 수축은 관절의 각도를 반대 방향으로 변화시켜 팔을 곧게 펴고 손을 다리 쪽으로 이동시킨다.
편심 수축
편심수축에서는 등각시 발생하는 장력이 근육에 가해지는 외부하중을 극복하기에 불충분하고 [9]수축에 따라 근섬유가 늘어난다.근육은 근육이 수축하는 방향으로 관절을 당기기 위해 일하는 대신, 움직임의 끝에서 관절을 감속시키거나 하중의 위치를 조절하는 역할을 한다.이는 비자발적으로(예: 근육이 들어올리기에는 너무 무거운 무게를 움직이려고 할 때) 또는 자발적으로(예: 근육이 운동을 '평활하게' 하거나 내리막길 걷기 등 중력에 저항하는 경우) 발생할 수 있다.단기적으로는 편심수축과 동심수축을 모두 포함한 근력훈련이 동심수축만으로 [10]하는 훈련보다 근력을 높이는 것으로 보인다.그러나,[11] 운동으로 인한 근육 손상 또한 수축이 길어질 때 더 크다.
이두근의 편심 수축 중에 팔꿈치는 구부러진 상태에서 운동을 시작하고 손이 어깨에서 멀어지면 곧게 펴진다.삼두근의 편심 수축이 진행되는 동안 팔꿈치는 똑바로 움직이기 시작하고 손이 어깨 쪽으로 움직이면 구부러진다.데스민, 티틴 및 기타 z라인 단백질은 편심수축에 관여하지만, [9]동심수축에서의 교차교 사이클링에 비해 그 메커니즘은 잘 알려져 있지 않다.
비록 근육은 음의 양의 기계적 작업을 하고 있지만, 같은 힘의 동심원 수축 시 소비되는 것보다 적지만, 그럼에도 불구하고 화학 에너지는 소비된다.예를 들어, 한 사람은 같은 비행기를 타는 것보다 계단을 오르는 데 더 많은 에너지를 소비한다.
심한 편심 하중을 받는 근육은 (근육 형성 또는 근력 훈련 중 등) 동심 하중에 비해 과부하 시 더 큰 손상을 입습니다.웨이트 트레이닝에서 편심 수축이 사용될 때, 그것들은 보통 부정이라고 불립니다.동심원 수축 중에 미오신과 액틴의 수축성 근필라멘트가 서로 미끄러져 Z라인을 함께 당깁니다.편심 수축 중 미오필라멘트는 서로 반대 방향으로 미끄러지지만 편심 수축 중 미오신 헤드의 실제 움직임은 알려져 있지 않습니다.심한 편심 하중을 특징으로 하는 운동은 실제로 더 큰 무게를 지탱할 수 있으며(근육은 동심 수축 시보다 편심 수축 시 약 40% 더 강함) 또한 훈련 후 1~2일 후에 더 큰 근육 손상과 지연된 시작 근육통을 야기합니다.편심근 수축과 동심근 수축이 모두 포함된 운동(즉, 강한 수축과 체중 감소 제어 포함)은 동심근 수축만 [10][12]하는 운동보다 강도에 더 큰 이득을 가져올 수 있다.익숙하지 않은 심한 편심 수축은 과도한 훈련으로 이어질 수 있지만, 적당한 훈련은 [10]부상에 대한 보호를 제공할 수 있습니다.
이동 시 편심 수축
편심 수축은 일반적으로 접합부를 손상으로부터 보호하기 위해 동심 수축에 대한 제동력으로 발생합니다.거의 모든 일상적인 움직임에서 편심 수축은 움직임을 부드럽게 유지하는 데 도움이 되지만 펀치나 던지기 같은 빠른 움직임도 느려질 수 있습니다.야구 중 피칭과 같은 빠른 움직임을 위한 훈련의 일부는 편심 제동을 줄여 운동 전반에 걸쳐 더 큰 힘을 개발할 수 있도록 하는 것이다.
편심 수축은 약하거나 다친 힘줄의 재활을 빠르게 할 수 있는 능력을 위해 연구되고 있다.아킬레스건염과[13][14] 슬개건염[15](점퍼 무릎 또는 슬개건염으로도 알려져 있음)은 높은 부하 편심 수축의 혜택을 받는 것으로 나타났다.
척추동물
척추동물의 근육조직에는 골격, 평활, 심장의 세 가지 종류가 있다.골격근은 신체 근육량의 대부분을 구성하며 운동 활동을 담당합니다.평활근은 혈관, 위장관, 그리고 지속적인 수축을 일으키는 신체의 다른 영역을 형성합니다.심근은 심장을 구성하고 혈액을 펌프질한다.골격근과 심장근육은 현미경 아래 줄무늬가 있어 줄무늬근육이라고 불리는데, 이는 A밴드와 I밴드가 교대로 매우 조직화되어 있기 때문이다.
골격근
반사를 제외한 모든 골격근 수축은 뇌에서 발생하는 신호의 결과로 일어난다.뇌는 신경계를 통해 여러 개의 근육 [16]섬유를 내장하는 운동 뉴런으로 전기화학적 신호를 보낸다.일부 반사의 경우, 수축 신호는 회백질과의 피드백 루프를 통해 척수에서 발생할 수 있습니다.운동, 호흡, 씹는 것과 같은 다른 행동들은 그들에게 반사적인 측면이 있다: 수축은 의식적으로 또는 무의식적으로 시작될 수 있다.
신경근 접합부
신경근접합은 운동뉴런과 [17]근섬유의 접촉에 의해 형성되는 화학적 시냅스이다.운동뉴런이 근육섬유에 신호를 전달해 근육수축을 시작하는 부위다.신경근 접합부의 근섬유의 탈분극을 초래하는 일련의 사건들은 운동 뉴런의 세포체에서 활동 전위가 시작되었을 때 시작되며, 운동 전위는 신경근 접합부를 향해 축삭을 따라 염분 전도에 의해 전파됩니다.말단 부톤에 도달하면 활동 전위가 전압 개폐 칼슘 채널을 통해 말단으로 Ca2+
이온 유입을 일으킵니다.Ca 유입은2+
신경전달물질인 아세틸콜린을 포함한 시냅스 소포를 혈장막과 융합시켜 운동뉴런 말단과 골격근 섬유 사이의 시냅스 틈으로 아세틸콜린을 방출시킨다.아세틸콜린은 시냅스로 확산되어 신경근 접합부의 니코틴성 아세틸콜린 수용체와 결합하고 활성화한다.니코틴 수용체가 활성화되면 고유의 나트륨/칼륨 채널이 열려 나트륨이 밀려들고 칼륨이 흘러나옵니다.그 결과, 사르콜레마는 극성을 역전시켜 나트륨이 들어가면 휴지막 전위 -90mV에서 +75mV까지 전압이 빠르게 상승한다.막 전위는 칼륨이 빠져나갈 때 과분극이 되고 그 후 휴식막 전위로 다시 조정됩니다.이러한 급격한 변동을 엔드 플레이트[18] 전위라고 합니다. 엔드 플레이트 전위에 반응하여 엔드 플레이트 옆에 있는 사르콜레마의 전압 게이트 이온 채널이 열립니다.그것들은 나트륨과 칼륨에 특유하며 한 개만 통과시킬 수 있다.이 이온 이동의 파동은 모터 엔드 플레이트에서 모든 방향으로 [18]퍼지는 활동 전위를 생성합니다.활동 전위가 도착하지 않으면 아세틸콜린은 말단 부톤에서 방출되지 않습니다.시냅스 균열에 남아 있는 아세틸콜린은 활성 아세틸콜린 에스테라아제에 의해 분해되거나 시냅스 노브에 의해 재흡수되며, 분해된 아세틸콜린을 대체할 아세틸콜린은 남아 있지 않다.
들뜸-수축 결합
들뜸-수축 결합은 근섬유의 근육 활동 전위가 근섬유를 [19]수축시키는 과정이다.골격근에서 들뜸-수축 결합은 주요 단백질, 석소체 칼슘 방출 채널(리아노딘 수용체 1, RYR1) 및 전압-게이트 L형 칼슘 채널(디히드로피리딘 수용체, DHRs) 사이의 직접 결합에 의존한다.RyR이 SR 막에 걸쳐 있는 동안 표면 사콜렘마와 횡관).RyRs를 포함하는 2개의 SR 영역과 횡관과의 근접 배치는 3중으로 설명되며, 주로 들뜸-수축 결합이 이루어지는 곳이다.들뜸-수축 결합은 골격근세포의 탈분극이 근육 활동 전위를 가져오고, 이는 세포 표면을 가로질러 T-튜브의 근육 섬유 네트워크로 확산되어 근육 섬유 내부를 탈분극시킬 때 발생한다.내부 부분의 탈분극은 인접한 석소체 망막의 리아노딘 수용체에 근접한 말단 시스터내 디히드로피리딘 수용체를 활성화한다.활성화된 디히드로피리딘 수용체는 발 과정을 통해 그들을 활성화하기 위해 물리적으로 리아노딘 수용체와 상호작용한다(알로스테릭하게 리아노딘 수용체를 활성화하는 구조 변화를 포함한다).리아노딘 수용체가 열리면 Ca는2+
석소체에서 국소 접합부 공간으로 방출되어 부피 세포질로 확산되어 칼슘 스파크를 일으킨다.석소체 망막은 부분적으로 칼세케스트린이라는 칼슘 결합 단백질 때문에 칼슘 완충 능력이 크다는 점에 유의하십시오.활동 전위에 의해 수천 개의 칼슘 스파크가 거의 동시에 활성화되면 칼슘이 세포 전체에서 증가하여 일시적인 칼슘의 상승이 발생합니다.세포에 방출된 Ca는2+
액틴 필라멘트에 의해 트로포닌 C에 결합되어 교차교 사이클링, 힘 생성 및 일부 상황에서 움직임을 가능하게 한다.SERCA(Sarco/Endoplasmic reticulum calcium-ATPase)는 Ca를 다시 sarcplasmic reticulum으로 능동적으로2+
펌프합니다.Ca가 다시 안정 수준으로 떨어지면 힘이2+
감소하고 이완이 일어납니다.
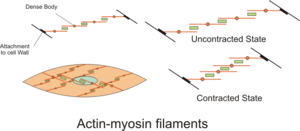
슬라이딩 필라멘트 이론
슬라이딩 필라멘트 이론은 근육이 수축하기 위해 사용하는 과정을 설명합니다.그것은 얇은 필라멘트가 두꺼운 필라멘트 위로 미끄러지게 하고 [20]근육에 긴장을 발생시키는 반복적인 사건의 순환이다.그것은 Andrew Huxley와 Rolf Niedergerke에 의해 독립적으로 개발되었고,[21][22] Hugh Huxley와 Jean Hanson에 의해 1954년에 개발되었습니다.생리학적으로, 이러한 수축은 육질 전체에 걸쳐 균일하지 않다. 두꺼운 필라멘트의 중심 위치는 불안정해지고 수축 중에 이동할 수 있지만, 이것은 티틴의 탄성 근필라멘트의 작용에 의해 상쇄된다.이 미세한 근필라멘트는 두꺼운 필라멘트를 중앙 [23]위치로 당김으로써 육체를 가로질러 균일한 장력을 유지합니다.
크로스 브리지 사이클
교차교 사이클링은 슬라이딩 필라멘트 이론의 기초가 되는 일련의 분자 사건입니다.크로스 브릿지는 두 개의 [1]미오신 헤드로 구성된 미오신 투영으로 두꺼운 필라멘트에서 연장됩니다.각 미오신 헤드는 아데노신 삼인산(ATP)과 액틴(actin)의 두 가지 결합 부위를 가진다.미오신 헤드에 대한 ATP의 결합은 미오신을 액틴으로부터 분리하여 미오신이 다른 액틴 분자와 결합할 수 있게 한다.일단 결합되면, ATP는 방출된 에너지를 액틴 결합 부위의 일부에 약하게 결합하는 "코킹 위치"로 이동하기 위해 사용하는 미오신에 의해 가수 분해된다.액틴 결합 부위의 나머지 부분은 트로포미오신에 [24]의해 차단된다.ATP가 가수 분해되면서, 코킹된 미오신 헤드는 이제 아데노신 이인산(ADP) + P를i 포함합니다. 두 Ca 이온은2+
액틴 필라멘트의 트로포닌 C에 결합합니다.트로포닌-Ca2+
복합체는 트로포미오신이 액틴 결합 부위의 나머지 부분을 미끄러져 차단 해제하게 한다.나머지 액틴 결합 부위의 차단을 해제하면 두 개의 미오신 헤드가 닫히고 미오신이 액틴과 [24]강하게 결합할 수 있습니다.그런 다음 미오신 헤드는 무기인산을 방출하고 파워 스트로크를 시작합니다. 파워 스트로크는 2pN의 힘을 생성합니다.파워 스트로크는 액틴 필라멘트를 안쪽으로 이동시켜 육체를 짧게 합니다.그러면 미오신은 ADP를 방출하지만 여전히 작용에 단단히 묶여 있습니다.파워 스트로크의 마지막에, 미오신 헤드에서 ADP가 방출되어 미오신은 다른 ATP가 미오신에 결합할 때까지 엄격한 상태로 액틴에 부착되어 있습니다.ATP의 부족은 사망 경직의 특징인 경직 상태를 초래할 것이다.일단 다른 ATP가 미오신에 결합하면, 미오신 헤드는 다시 액틴에서 분리되고 또 다른 교량 순환이 일어납니다.
교량 [24]순환은 세포질에 충분한2+
양의 ATP와 Ca가 있는 한 지속될 수 있다.교차교 사이클링의 종료는 Ca가 석소체망으로 활발하게 펌핑될 때 발생할2+
수 있습니다.얇은2+
필라멘트에 더 이상 Ca가 존재하지 않으면 트로포미오신은 결합 부위를 다시 차단하기 위해 배열을 이전 상태로 되돌린다.미오신은 얇은 필라멘트에 대한 결합을 멈추고 근육이 이완된다.Ca2+
이온은 석회질에서 Ca2+
이온 농도를 유지하기 위해 트로포닌 분자를 떠난다.Ca 이온의 활성2+
펌프질은 근섬유 주변의 유체에 결핍을 일으킨다.이로 인해 트로포닌에서 Ca 이온이2+
제거된다.따라서 트로포미오신-트로포닌 복합체는 다시 액틴 필라멘트의 결합 부위를 덮고 수축을 멈춘다.
골격근 수축의 단계적 변화
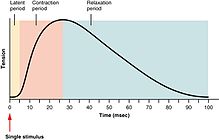
골격근 수축의 세기는 크게 경련, 합상, 파상풍으로 나눌 수 있다.경련은 근섬유 자체의 [25]활동 전위에 의해 생성되는 단일 수축 및 이완 주기입니다.운동신경에 대한 자극과 신경근육의 후속 수축 사이의 시간은 잠복기라고 불리며, 이것은 보통 약 10밀리초가 걸리고 신경 활동 전위가 전파되는 데 걸리는 시간, 신경근육 접합부의 화학적 전달 시간, 그리고 들뜸-조절의 후속 단계에 의해 발생한다.ction [26]커플링
만약 근육 경련이 완전히 이완되기 전에 또 다른 근육 활동 전위가 생성된다면, 다음 경련은 단순히 이전의 경련에 합산하여 [27]합계를 생성하게 될 것이다.합계는 주파수 합계와 다중 파이버 합계의 두 [28]가지 방법으로 실행할 수 있습니다.주파수 합산에서는 활동전위가 근섬유로 보내지는 빈도를 변화시킴으로써 골격근에 의해 가해지는 힘을 제어한다.활동 전위는 동시에 근육에 도달하지 않고, 수축하는 동안 근육의 섬유 중 일부는 주어진 시간에 발사될 것입니다.인간이 의식적으로 가능한 한 열심히 근육을 사용할 때, 각각의 근육에 있는 섬유 중 약 1/3이 동시에[citation needed] 발사되지만, 이 비율은 다양한 생리적, 심리적 요인(골지 힘줄 기관과 렌쇼 세포 포함)에 의해 영향을 받을 수 있다.이 '낮은' 수준의 수축은 힘줄의 박리를 방지하기 위한 보호 메커니즘이다. 즉, 모든 섬유의 95% 수축에 의해 발생하는 힘은 신체를 손상시키기에 충분하다.다섬유 합계에서 중추신경계가 약한 신호를 보내 근육을 수축시키면 큰 운동단위보다 작은 운동단위가 먼저 자극된다.신호의 강도가 증가함에 따라 대형 모터 유닛 외에 더 많은 모터 유닛이 들뜨게 되며, 가장 큰 모터 유닛은 작은 모터 유닛보다 수축 강도가 50배나 높습니다.점점 더 큰 운동 단위가 활성화됨에 따라 근육 수축의 힘은 점차 강해진다.크기 원리로 알려진 개념은 약한 수축 시 근육력의 단계적 변화를 작은 단계로 발생시키고, 더 많은 양의 힘이 필요할 때 점차적으로 커진다.
마지막으로, 근육 활동 전위의 빈도가 증가하여 근육 수축이 이 수준에서 최고 힘과 고원에 도달한다면, 그 수축은 파상풍이다.
길이-장력 관계
길이-장력 관계는 등축 수축의 강도를 수축이 발생하는 근육의 길이에 관련짓는다.근육은 이상적인 길이에 가까울 때 가장 큰 활동적인 장력으로 작동한다.(근육 자체의 작용에 의한 것이든 외부의 힘에 의한 것이든) 이 이상으로 늘어나거나 줄어들면 발생하는 최대 활성 장력은 [29]감소한다.이 감소는 작은 편차에 대해서는 미미하지만, 길이가 이상에서 더 멀어짐에 따라 장력이 빠르게 감소합니다.근육세포(티틴 등)와 세포외 매트릭스 내에 탄성단백질이 존재하기 때문에 근육이 주어진 길이를 초과하여 늘어나면 장력을 방해하는 완전히 수동적인 장력이 발생한다.복합적으로, 활동적인 근육의 길이를 늘리는 것에 대한 강한 저항이 있습니다.
힘-속도 관계
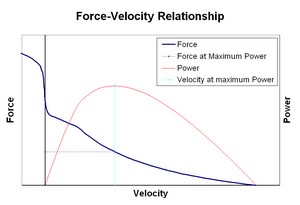
힘-속도 관계는 근육의 길이(일반적으로 하중이나 다른 근육과 같은 외부 힘에 의해 조절됨)가 근육에서 발생하는 힘의 양에 따라 변하는 속도를 관련짓는다.힘은 단축 속도가 증가함에 따라 등각력에 비해 쌍곡선 형태로 감소하며, 결국 최대 속도에서 0에 도달합니다.근육이 늘어나면 그 반대도 마찬가지입니다. 즉, 힘은 절대 최대치에 도달할 때까지 등각 최대치 이상으로 증가합니다.이러한 활성 근육 조직의 본질적 특성은 동시에 활성화된 반대 근육에 의해 작동되는 관절의 활성 감쇠에 역할을 한다.이 경우 힘-속도 프로파일은 단축근육을 희생시키면서 신장근육에 의해 생성되는 힘을 강화한다.어느 근육이 평형상태로 돌아가는지에 대한 선호는 관절의 감쇠를 효과적으로 증가시킨다.또한 근육의 힘에 따라 감쇠 강도가 높아집니다.따라서 모터 시스템은 반대되는 근육 [30]그룹의 동시 수축(공수축)을 통해 관절 감쇠를 능동적으로 제어할 수 있습니다.
평활근
평활근은 두 개의 하위 그룹으로 나눌 수 있다: 단일 단위와 다중 단위.단일 단위 평활근 세포는 내장과 혈관에서 발견될 수 있다.이 세포들은 갭 접합에 의해 서로 연결되어 있기 때문에 기능성 합성 세포로 수축할 수 있다.단일 단위 평활근 세포는 근원적으로 수축하며 자율신경계에 의해 조절될 수 있다.
단일 단위 평활근 세포와 달리, 다단위 평활근 세포는 눈의 근육과 모낭의 기저부에서 발견됩니다.멀티유닛 평활근 세포는 자율신경계의 신경에 의해 개별적으로 자극을 받아 수축합니다.따라서 골격근의 운동 단위 모집과 같이 미세 제어와 점진적인 반응을 가능하게 합니다.
평활근 수축 메커니즘
평활근 세포의 수축성 활동은 강장제(유지) 또는 단계적(일시적)[31]일 수 있으며 자발적인 전기 활동, 신경 및 호르몬 입력, 화학 조성의 국소 변화, [1]스트레칭과 같은 여러 입력에 의해 영향을 받습니다.이것은 단일 신경 입력에 의존하는 골격근 세포들의 수축 활동과는 대조적이다.평활근세포의 어떤 종류는 그들 자신의 활동전위를 자발적으로 발생시킬 수 있는데, 이것은 보통 심박조율기 전위 또는 느린 파동 전위를 따라 발생한다.이러한 활동전위는 Na가 아닌+
세포외2+
Ca의 유입에 의해 생성된다.골격근과 마찬가지로, 세포질2+
Ca 이온도 평활근 세포에서 교량 순환에 필요합니다.
평활근 세포에서 세포내2+
Ca의 두 가지 공급원은 칼슘 채널을 통해 들어오는 세포외2+
Ca와 석소체에서 방출되는 Ca 이온이다2+
.세포질2+
Ca의 상승은 칼모듈린에 더 많은2+
Ca 결합을 초래하고, 칼모듈린은 미오신 경쇄 키나제를 결합하고 활성화시킨다.칼슘-칼모듈린-마이오신 경쇄인산화효소 복합체는 아미노산 잔기-세린 19의 20킬로달톤(kDa) 미오신 경쇄에서 미오신을 인산화하여 수축을 개시하고 미오신 ATP화효소를 활성화한다.골격근 세포와 달리, 평활근 세포는 얇은 필라멘트 단백질 트로포미오신과 다른 주목할 만한 단백질인 칼데스몬과 칼포닌을 포함함에도 불구하고 트로포닌이 부족하다.따라서 평활근 수축은 골격근 및 심장근육에서와 같이 액틴에 미오신 결합 부위를 조절하는 트로포닌 복합체에 Ca 결합이 아닌2+
미오신의 Ca2+
활성화 인산화로 시작된다.
교량 순환의 종료는 미오신 경쇄 포스파타아제가 미오신 헤드에서 인산기를 제거할 때 발생합니다.20 kDa 미오신 경쇄의 인산화는 평활근의 단축 속도와 잘 관련된다.이 기간 동안 산소 소비량에 의해 측정된 에너지 사용률이 급격히 상승합니다.개시 후 몇 분 이내에 칼슘 수치는 현저하게 감소하고, 20 kDa 미오신 경쇄의 인산화량은 감소하며, 에너지 이용은 감소하지만, 강장 평활근의 힘은 유지됩니다.근육이 수축하는 동안, 활성화된 액틴과 인산화 미오신 사이에 빠르게 순환하는 교차가 형성되어 힘을 발생시킨다.힘의 유지는 천천히 순환하고 힘을 유지하는 탈인산화 "래치 브리지"에서 비롯된다는 가설이다.rho 키나아제, DAPK3, 단백질 키나아제 C 등의 다수의 키나아제들은 수축의 지속상에 관여하는 것으로 생각되며2+
, Ca 플럭스는 유의할 수 있다.
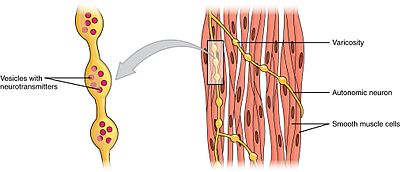
신경조절
평활근 수축은 근원성이지만, 그 수축의 속도와 강도는 자율신경계에 의해 조절될 수 있다.부교감 신경계의 신경 섬유는 평활근 세포의 무스카린성 아세틸콜린 수용체(mAChRs)에 결합하는 신경 전달 물질인 아세틸콜린을 방출합니다.이 수용체들은 메타오트로픽, 즉 두 번째 메신저 캐스케이드를 시작하는 G-단백질 결합 수용체들이다.반대로 교감신경계의 신경 섬유는 신경전달물질인 에피네프린과 노르에피네프린을 방출하며, 에피네프린은 메타모트로픽인 아드레날린 수용체에 결합한다.평활근에 대한 정확한 영향은 활성화된 수용체의 특정 특성에 따라 달라진다. 부교감 입력과 교감 입력은 모두 흥분성(수축성) 또는 억제성(완화)일 수 있다.
심근
심장 근육 세포에는 두 가지 유형이 있습니다: 자동 리듬과 수축성.자동리듬세포는 수축하지 않고 자율신경계에 의해 조절될 수 있는 다른 심장근육세포의 수축속도를 설정한다.반대로 수축성 근육 세포(심근 세포)는 심장 근육의 대부분을 구성하며 수축할 수 있다.
들뜸 수축 결합
골격 및 심근 들뜸 수축(E-C) 커플링 모두에서 탈분극 전도 및2+ Ca 방출 과정이 발생한다.그러나 관련된 단백질은 비슷하지만 구조와 조절은 다르다.디히드로피리딘 수용체(DHPRs)는 다른 유전자에 의해 암호화되며, 리아노딘 수용체(RyRs)는 별개의 아이소폼이다.또한 DHR은 RyR1(골격근의 주요 RyR 동소형)과 접촉하여 골격근의 Ca 방출을 조절하고2+, L형 칼슘 채널(심근근의 DHCPR)과 RyR2(심근의 주요 RyR 동소형)는 심근에서 물리적으로 결합하지 않고 접합결합에 [32]의해 서로 마주보고 있다.
골격근과 달리, 심장근의 E-C 커플링은 주로 칼슘 유도 칼슘 [33]방출이라고 불리는 메커니즘에 의존하는 것으로 생각되는데, 이것은 T-튜브와 석소체 사이의 접합 구조에 기초한다.Junctophilin-2(JPH2)는 T-튜브의 [34][35][36]무결성뿐만 아니라 이 구조를 유지하기 위해 필수적이다.또 다른 단백질인 수용체 부속단백질 5(REEP5)는 접합 [37]SR의 정상적인 형태를 유지하는 기능을 한다.접합 결합의 결함은 두 단백질 중 하나의 결핍으로 인해 발생할 수 있다.칼슘유도칼슘방출공정에서는 칼슘트리거에 의해 RyR2s가 활성화되며, L형 칼슘채널을 통과하는 Ca의 흐름에2+ 의해 RyR2s가 활성화된다.그 후, 심근은 삼합체라기보다는 디아드 구조를 보이는 경향이 있다.
심근세포에서의 들뜸-수축결합은 활동전위가 동심방결절 또는 방실결절의 심박조절세포에 의해 개시되어 갭 접합을 통해 심장의 모든 세포에 전달될 때 발생한다.활동 전위는 표면막을 따라 T-튜브로 이동하며(심장세포의 모든 유형에서 볼 수 있는 것은 아니며), 탈분극은 고원 단계 초기에 L형 칼슘 채널과 아마도 나트륨-칼슘 교환기(NCX)를 통해 세포로2+
유입된다.이러한2+ Ca 유입은 활성화에 필요한 Ca의2+ 약 10%에 불과하지만 골격근보다 상대적으로 크다.이2+
Ca 유입은 세포2+
내 Ca의 국소적인 증가를 일으킨다.세포내2+
Ca의 증가는 RyR2에 의해 석소체막에서 검출되며, RyR2는 Ca를 양성 피드백 생리 반응으로 방출한다2+
.이 양성 피드백은 칼슘 유도 칼슘[33] 방출로 알려져 칼슘 스파크(Ca[38] 스파크)를2+
일으킵니다.30,000Ca2+
스파크의 공간적 및 시간적 합계는 세포 전체의 칼슘 [39]농도를 증가시킨다.세포막과 석소체를 통한 칼슘의 흐름에 따른 세포 내 칼슘의 증가는 세포 내 칼슘의 많은 부분을 결합하는 칼슘 버퍼에 의해 완화된다.그 결과 총칼슘이 크게 증가하면 유리2+
[40]Ca가 상대적으로 적게 증가한다.
세포질 칼슘은 트로포닌 C에 결합하고, 트로포미오신 복합체를 액틴 결합 부위 밖으로 이동시켜 미오신 헤드가 액틴 필라멘트에 결합할 수 있게 한다.이때부터 수축 메커니즘은 골격근(위)과 기본적으로 동일합니다.간단히, ATP 가수분해를 사용하여, 미오신 헤드는 육식동물 중심 쪽으로 액틴 필라멘트를 당깁니다.
수축기에 이어 세포 내 칼슘은 사르코/내소체 ATPase(SERCA) 펌프에 의해 흡수되어 다음 사이클이 시작될 준비가 된 석소체 안으로 되돌아간다.또한 칼슘은 주로 나트륨칼슘교환기(NCX)에 의해 세포에서 배출되며, 보다 적은 범위로 혈장막 칼슘 ATP화효소에 의해 배출된다.일부 칼슘은 또한 미토콘드리아에 [41]의해 흡수된다.효소인 포스폴람반은 SERCA의 브레이크 역할을 한다.낮은 심박수에서, 포스폴람반은 활성하고 Ca가 세포를 완전히 떠날 필요가 없도록2+
ATP 효소의 활동을 느리게 합니다.높은 심박수에서 포스포람반은 인산화 및 비활성화되어 세포질에서 석소체망으로 대부분의2+
Ca를 다시 가져간다.다시 한 번 칼슘 완충제는 올 가을 카콘센트2+
농도를 완화하여 총 칼슘의 큰 변화에 반응하여 상대적으로 유리 카콘센트2+
농도의 감소를 가능하게 합니다.떨어지는 카콘센트2+
농도는 트로포닌 착체가 액틴 필라멘트로부터 분리되도록 하여 수축을 끝낸다.심장이 이완되어 심실이 혈액으로 채워지고 심장 주기가 다시 시작됩니다.
무척추동물
원형근육 및 종근육
지렁이나 거머리와 같은 고리 모양의 근육 세포는 이러한 동물의 체벽을 형성하고 움직임을 [42]담당한다.예를 들어 흙 속을 이동하는 지렁이에서는 지렁이의 [43]강성을 유지하여 강장액이 히드로스켈톤 역할을 하면서 원형근육과 세로근육의 수축이 상호 작용한다.앞부분의 원형 근육이 수축할 때, 동물의 몸 앞부분은 방사상으로 수축하기 시작하고, 이것은 압축할 수 없는 강골액을 앞으로 밀어내고 동물의 길이를 증가시킨다.그 결과, 동물의 앞부분이 앞으로 이동한다.지렁이의 앞부분이 고정되고 앞부분의 원형 근육이 이완되면서 종방향 근육 수축의 물결이 뒤로 지나가고, 이것은 나머지 동물의 꼬리를 앞으로 [42][43]당긴다.이러한 원형과 종방향 수축의 번갈아 일어나는 파동은 지렁이의 살금살금 움직이는 기초가 되는 연동파라고 불립니다.
비스듬히 줄무늬가 있는 근육
고리형 동물, 연체동물, 선충과 같은 무척추동물은 척추동물 골격이나 심장 [44]근육처럼 가로가 아닌 나선형으로 배열된 굵고 얇은 필라멘트의 띠를 포함하는 비스듬히 줄무늬 근육을 가지고 있다.이매패에서는 비스듬히 줄무늬가 있는 근육은 에너지를 많이 사용하지 않고 긴 시간 동안 긴장을 유지할 수 있습니다.이매패는 껍데기를 닫아두기 위해 이 근육을 사용합니다.
비동기근
말벌, 파리, 벌, 딱정벌레와 같은 발달한 곤충들은 이러한 [44]동물들의 비행 근육을 구성하는 비동기 근육을 가지고 있다.이러한 비행근육은 두껍고 [45]눈에 띄는 근섬유를 포함하고 있기 때문에 종종 섬유근육이라고 불립니다.이러한 근육의 주목할 만한 특징은 근육 수축마다 자극을 필요로 하지 않는다는 것이다.따라서 이러한 근육의 수축 수가 활동 전위의 수와 일치하지 않기 때문에 비동기 근육이라고 불립니다.예를 들어 쇠사슬 파리 날개 근육은 3Hz의 주파수에서 활동전위를 받을 수 있지만 120Hz의 주파수에서 [44]박동할 수 있다.고주파 박동은 근육이 자연스러운 진동수로 구동되는 공명 시스템에 연결되어 있기 때문에 가능합니다.
역사

1780년, Luigi Galvani는 죽은 개구리의 다리 근육이 전기 [47]스파크에 부딪혔을 때 경련을 일으킨다는 것을 발견했습니다.이것은 신경과 근육과 같은 조직의 전기적 패턴과 신호를 여전히 연구하는 분야인 생체 전기에 대한 첫 번째 연구 중 하나였다.
1952년 들뜸-수축 결합이라는 용어는 전기적 자극을 기계적 [19]반응으로 변환하는 생리 과정을 설명하기 위해 만들어졌다.이 과정은 근육 생리학에 기초적이며, 전기 자극은 보통 활동 전위이고 기계적 반응은 수축이다.들뜸-수축 결합은 많은 질병에서 조절이 잘 되지 않을 수 있다.들뜸-수축 결합은 반세기 이상 알려져 왔지만, 여전히 생물의학 연구의 활발한 영역이다.일반적인 계획은 세포막을 탈분극시키기 위한 활동전위가 도달하는 것이다.근육 유형에 특정한 메커니즘에 의해, 이러한 탈분극은 칼슘 과도라고 불리는 세포질 칼슘의 증가를 초래합니다.칼슘의 증가는 세포 단축을 일으키기 위해 ATP를 사용하는 칼슘에 민감한 수축성 단백질을 활성화시킵니다.
근육 수축의 메커니즘은 수년간 과학자들을 피했고 지속적인 연구와 갱신이 [48]필요하다.슬라이딩 필라멘트 이론은 앤드류 F에 의해 독립적으로 개발되었다. Huxley와 Rolf Niedergerke 그리고 Hugh Huxley와 Jean Hanson에 의해.이들의 연구결과는 1954년 5월 22일 네이처지에 공통 주제인 "수축 중 근육의 구조적 변화"[21][22]라는 제목으로 두 개의 연속 논문으로 발표되었습니다.
「 」를 참조해 주세요.
- 해부학적 운동 조건
- 칼슘유도칼슘유리
- 심장 활동 전위
- 경련
- 디스토니아
- 운동 생리학
- 매혹
- 힐 근육 모형
- 히프닉 얼간이
- 체외근육검사
- 롬바르드의 역설
- 미오클로누스
- 사후경직
- 경련
- 자궁 수축
레퍼런스
- ^ a b c d e f g h i j k l m n o Widmaier, Eric P.; Raff, Hersel; Strang, Kevin T. (2010). "Muscle". Vander's Human Physiology: The Mechanisms of Body Function (12th ed.). New York, NY: McGraw-Hill. pp. 250–291. ISBN 978-0-321-98122-6.
- ^ Silverthorn, Dee Unglaub (2016). "Muscles". Human Physiology: An Integrated Approach (7th ed.). San Francisco, CA: Pearson. pp. 377–416. ISBN 978-0-321-98122-6.
- ^ a b c d e f Aidley, David J. (1998). "Mechanics and energetics of muscular contraction". The Physiology of Excitable Cells (4th ed.). New York, NY: Cambridge University Press. pp. 323–335. ISBN 978-0-521-57421-1.
- ^ a b c d e f Sircar, Sabyasachi (2008). "Muscle elasticity". Principles of Medical Physiology (1st ed.). New York, NY: Thieme. p. 113. ISBN 978-1-588-90572-7.
- ^ a b c d e f Bullock, John; Boyle, Joseph; Wang, Michael B. (2001). "Muscle contraction". NMS Physiology. Vol. 578 (4th ed.). Baltimore, Maryland: Lippincott Williams and Wilkins. pp. 37–56.
- ^ a b Kumar, Shrawan (2008). "Introduction and terminology". In Shrawan Kumar (ed.). Muscle strength (1st ed.). Boca Raton, FL: CRC Press. p. 113. ISBN 978-0-415-36953-4.
- ^ a b Biewener, Andrew A. (2003). "Muscles and skeletons: The building blocks of animal movement". Animal Locomotion. Oxford Animal Biology Series. New York, NY: Oxford University Press. pp. 15–45. ISBN 978-0-198-50022-3.
- ^ Faulkner JA (2003). "Terminology for contractions of muscles during shortening, while isometric, and during lengthening". Journal of Applied Physiology. 95 (2): 455–459. doi:10.1152/japplphysiol.00280.2003. PMID 12851415. S2CID 28649208.
- ^ a b "Types of contractions". 2006-05-31. Retrieved 2007-10-02.
- ^ a b c Colliander EB, Tesch PA (1990). "Effects of eccentric and concentric muscle actions in resistance training". Acta Physiol. Scand. 140 (1): 31–9. doi:10.1111/j.1748-1716.1990.tb08973.x. PMID 2275403.
- ^ Nikolaidis MG, Kyparos A, Spanou C, Paschalis V, Theodorou AA, Vrabas IS (2012). "Redox biology of exercise: an integrative and comparative consideration of some overlooked issues". J. Exp. Biol. 215 (Pt 10): 1615–25. doi:10.1242/jeb.067470. PMID 22539728.
- ^ Brooks, G.A; Fahey, T.D.; White, T.P. (1996). Exercise Physiology: Human Bioenergetics and Its Applications. (2nd ed.). Mayfield Publishing Co.
- ^ Alfredson, H; Pietilä, T; Jonsson, P; Lorentzon, R (1998). "Heavy-load eccentric calf muscle training for the treatment of chronic Achilles tendinosis" (PDF). The American Journal of Sports Medicine. 26 (3): 360–6. doi:10.1177/03635465980260030301. PMID 9617396. S2CID 30259362.
- ^ Satyendra L, Byl N (2006). "Effectiveness of physical therapy for Achilles tendinopathy: An evidence based review of eccentric exercises". Isokinetics and Exercise Science. 14 (1): 71–80. doi:10.3233/IES-2006-0223.[영구 데드링크]
- ^ Cannell LJ, Taunton JE, Clement DB, Smith C, Khan KM (2001). "A randomised clinical trial of the efficacy of drop squats or leg extension/leg curl exercises to treat clinically diagnosed jumper's knee in athletes: pilot study". Br J Sports Med. 35 (1): 60–4. doi:10.1136/bjsm.35.1.60. PMC 1724276. PMID 11157465.
- ^ Tassinary; Cacioppo (2000). "The Skeletomotor system: surface electromyography". In Cacioppo, John T.; Tassinary, Luois G.; Berntson, Gary G. (eds.). Handbook of Psychophysiology (Second ed.). Cambridge: Cambridge University Press. ISBN 978-0-521-62634-7.
- ^ Levitan, Irwin; Kaczmarek, Leonard (August 19, 2015). "Intercellular communication". The Neuron: Cell and Molecular Biology (4th ed.). New York, NY: Oxford University Press. pp. 153–328. ISBN 978-0199773893.
- ^ a b 살라딘, 케네스 S., 스티븐 J. 설리번, 크리스티나 A. 간. 해부학과 생리학:형태와 기능의 통일성.제7판뉴욕: McGrow-Hill Education, 2015.인쇄.
- ^ a b Sandow A (1952). "Excitation-Contraction Coupling in Muscular Response". Yale J Biol Med. 25 (3): 176–201. PMC 2599245. PMID 13015950.
- ^ Saladin, Kenneth (2012). Anatomy and Physiology: The Unity of Form and Function. New York: McGraw Hill. ISBN 978-0-07-337825-1.
- ^ a b Huxley AF, Niedergerke R (1954). "Structural Changes in Muscle During Contraction: Interference Microscopy of Living Muscle Fibres". Nature. 173 (4412): 971–973. Bibcode:1954Natur.173..971H. doi:10.1038/173971a0. PMID 13165697. S2CID 4275495.
- ^ a b Huxley H, Hanson J (1954). "Changes in the cross-striations of muscle during contraction and stretch and their structural interpretation". Nature. 173 (4412): 973–976. Bibcode:1954Natur.173..973H. doi:10.1038/173973a0. PMID 13165698. S2CID 4180166.
- ^ Horowits R, Podolsky RJ (November 1987). "The positional stability of thick filaments in activated skeletal muscle depends on sarcomere length: evidence for the role of titin filaments". J. Cell Biol. 105 (5): 2217–23. doi:10.1083/jcb.105.5.2217. PMC 2114850. PMID 3680378.
- ^ a b c Enoka, Roger M.; Pearson, Keir G. (2013). "The motor unit and muscle action". In Eric R. Kandel; James H. Schwartz; Thomas M. Jessell; Steven A. Siegelbaum; A. J. Hudspeth (eds.). Principles of Neural Science (5th ed.). New York, NY: McGraw-Hill Medical. pp. 768–789. ISBN 978-0-071-39011-8.
- ^ Feher, Joseph (2012). "Chapter 3.4: Skeletal muscle mechanics". Quantitative Human Physiology: An Introduction. Academic Press Series in Biomedical Engineering (1st ed.). New York, NY: Academic Press. pp. 239–248. ISBN 978-0-123-82163-8.
- ^ Khurana, Indu (2006). "Characteristics of muscle excitability and contractility". Textbook Of Medical Physiology (1st ed.). Elsevier. pp. 101–2.
- ^ Smith, Ian C.; Adam, Helen; Herzog, Walter (April 2020). "A brief contraction has complex effects on summation of twitch pairs in human adductor pollicis". Experimental Physiology. 105 (4): 676–689. doi:10.1113/ep088401. PMID 32052487. S2CID 211100581. Retrieved 5 April 2022.
- ^ Shwedyk, E.; Balasubramanian, R.; Scott, R. N. (1977). "A nonstationary model for the Electromyogram". IEEE Transactions on Biomedical Engineering. 24 (5): 417–424. doi:10.1109/TBME.1977.326175. PMID 892834. S2CID 1770255.
- ^ Gordon AM, Huxley AF, Julian FJ (1966). "The variation in isometric tension with sarcomere length in vertebrate muscle fibres". J. Physiol. 184 (1): 170–92. doi:10.1113/jphysiol.1966.sp007909. PMC 1357553. PMID 5921536.
- ^ Heitmann, Stewart; Ferns, Norm; Breakpsear, Michael (2011). "Muscle co-contraction modulates damping and joint stability in a three-link biomechanical limb". Frontiers in Neurorobotics. 5: 5. doi:10.3389/fnbot.2011.00005. ISSN 1662-5218. PMC 3257849. PMID 22275897.
- ^ Zhang, Y; Hermanson, ME; Eddinger, TJ (2013). "Tonic and phasic smooth muscle contraction is not regulated by the PKCα - CPI-17 pathway in swine stomach antrum and fundus". PLOS ONE. 8 (9): e74608. Bibcode:2013PLoSO...874608Z. doi:10.1371/journal.pone.0074608. PMC 3776813. PMID 24058600.
- ^ Martonosi, Anthony N.; Pikula, Slawomir (2003). "The network of calcium regulation in muscle". Acta Biochimica Polonica. 50 (1): 1–30. doi:10.18388/abp.2003_3711. ISSN 0001-527X. PMID 12673344.
- ^ a b Fabiato, A. (1983). "Calcium-induced calcium release from the cardiac sarcoplasmic reticulum". American Journal of Physiology. 245 (1): C1–14. doi:10.1152/ajpcell.1983.245.1.C1. PMID 6346892.
- ^ Guo, Ang; Zhang, Xiaoying; Iyer, Venkat Ramesh; Chen, Biyi; Zhang, Caimei; Kutschke, William J.; Weiss, Robert M.; Franzini-Armstrong, Clara; Song, Long-Sheng (2014-08-19). "Overexpression of junctophilin-2 does not enhance baseline function but attenuates heart failure development after cardiac stress". Proceedings of the National Academy of Sciences of the United States of America. 111 (33): 12240–12245. Bibcode:2014PNAS..11112240G. doi:10.1073/pnas.1412729111. ISSN 1091-6490. PMC 4143026. PMID 25092313.
- ^ Wei, Sheng; Guo, Ang; Chen, Biyi; Kutschke, William; Xie, Yu-Ping; Zimmerman, Kathy; Weiss, Robert M.; Anderson, Mark E.; Cheng, Heping; Song, Long-Sheng (2010-08-20). "T-tubule remodeling during transition from hypertrophy to heart failure". Circulation Research. 107 (4): 520–531. doi:10.1161/CIRCRESAHA.109.212324. ISSN 1524-4571. PMC 2927862. PMID 20576937.
- ^ Takeshima, H.; Komazaki, S.; Nishi, M.; Iino, M.; Kangawa, K. (July 2000). "Junctophilins: a novel family of junctional membrane complex proteins". Molecular Cell. 6 (1): 11–22. doi:10.1016/s1097-2765(00)00003-4. ISSN 1097-2765. PMID 10949023.
- ^ Yao, Lei; Xie, Duanyang; Geng, Li; Shi, Dan; Huang, Jian; Wu, Yufei; Lv, Fei; Liang, Dandan; Li, Li; Liu, Yi; Li, Jun (3 February 2018). "REEP5 (Receptor Accessory Protein 5) Acts as a Sarcoplasmic Reticulum Membrane Sculptor to Modulate Cardiac Function". Journal of the American Heart Association. 7 (3). doi:10.1161/JAHA.117.007205. ISSN 2047-9980. PMC 5850239. PMID 29431104.
- ^ Cheng H, Lederer WJ, Cannell MB (October 1993). "Calcium sparks: elementary events underlying excitation-contraction coupling in heart muscle". Science. 262 (5134): 740–4. Bibcode:1993Sci...262..740C. doi:10.1126/science.8235594. PMID 8235594.
- ^ Cannell MB, Cheng H, Lederer WJ (November 1994). "Spatial non-uniformities in Ca2+
i during excitation-contraction coupling in cardiac myocytes". Biophys. J. 67 (5): 1942–56. Bibcode:1994BpJ....67.1942C. doi:10.1016/S0006-3495(94)80677-0. PMC 1225569. PMID 7858131. - ^ M., Bers, D. (2001). Excitation-contraction coupling and cardiac contractile force (2nd ed.). Dordrecht: Kluwer Academic Publishers. ISBN 9780792371571. OCLC 47659382.
- ^ Crespo LM, Grantham CJ, Cannell MB (June 1990). "Kinetics, stoichiometry and role of the Na-Ca exchange mechanism in isolated cardiac myocytes". Nature. 345 (6276): 618–21. Bibcode:1990Natur.345..618C. doi:10.1038/345618a0. PMID 2348872. S2CID 4348240.
- ^ a b Hillis, David M.; Sadava, David E.; Price, Mary V. (2014). "Muscle and movement". Principles of Life (2nd ed.). Sunderland, MA: Sinauer Associates. pp. 681–698. ISBN 978-1-464-10947-8.
- ^ a b Gardner, C.R. (1976). "The neuronal control of locomotion in the earthworm". Biological Reviews of the Cambridge Philosophical Society. 51 (1): 25–52. doi:10.1111/j.1469-185X.1976.tb01119.x. PMID 766843. S2CID 9983649.
- ^ a b c Alexander, R. McNeill (2003). "Muscle, the motor". Principles of Animal Locomotion (2nd ed.). Princeton, NJ: Princeton University Press. pp. 15–37. ISBN 978-0-691-12634-0.
- ^ Josephson, R. K.; Malamud, J. G.; Stokes, D. R. (2000-09-15). "Asynchronous muscle: a primer". Journal of Experimental Biology. 203 (18): 2713–2722. doi:10.1242/jeb.203.18.2713. ISSN 0022-0949. PMID 10952872.
- ^ David Ames Wells, 공통의 과학: 첫 번째에 대한 친숙한 설명, 323 페이지 (290 페이지)
- ^ Whittaker, E. T. (1951), A History of the Theories of Aether and Electricity. Vol 1, Nelson, London
- ^ Huxley, H. E. (April 2000). "Past, Present and Future Experiments on Muscle". Philosophical Transactions: Biological Sciences. 355 (1396): 539–543. doi:10.1098/rstb.2000.0595. JSTOR 3066716. PMC 1692762. PMID 10836507.
추가 정보
- Saladin, Kenneth S., Stephen J. Sullivan, Christina A. Gan. (2015).해부학 및 생리학:형태와 기능의 통일성.제7판뉴욕: 맥그로-힐 교육.
- Krans, J. L. (2010) 근육 수축의 슬라이딩 필라멘트 이론.자연교육 3(9) : 66
외부 링크
- 근육수축의 미끄럼 필라멘트 모형
- 애니메이션: 2013-05-21 웨이백 머신에 보관된 근필라멘트 수축