세로토닌-노레피네프린 재흡수 억제제
Serotonin–norepinephrine reuptake inhibitor| 세로토닌-노레피네프린 재흡수 억제제 | |
|---|---|
| 약품반 | |
 SNRI의 한 예인 덜록세틴. | |
| 클래스 식별자 | |
| 동의어 | 선택적 세로토닌-노라드레날린 재흡수 억제제; SNaRI |
| 사용하다 | 우울증, 불안증, 통증, 비만, 갱년기 증상 |
| 생물학적 표적 | 세로토닌 수송체; 노르에피네프린 수송체 |
| 외부 링크 | |
| MeSH | D000068760 |
| 법적지위 | |
| 위키데이터에서 | |
세로토닌-노레피네프린 재흡수 억제제(SNRIs)는 주요 우울 장애(MDD), 불안 장애, 강박 장애(OCD), 사회 공포증, 주의력 결핍 과잉 행동 장애(ADHD), 만성 신경병성 통증, 섬유근육통 증후군(FMS) 및 갱년기 증상을 치료하는 데 사용되는 항우울제의 한 종류입니다. SNRI는 모노아민 재흡수 억제제이며, 특히 세로토닌과 노르에피네프린의 재흡수를 억제합니다. 이 신경전달물질들은 기분 조절에 중요한 역할을 하는 것으로 생각됩니다. SNRI는 단일 신경 전달 물질에 작용하는 선택적 세로토닌 재흡수 억제제(SSRI) 및 노르에피네프린 재흡수 억제제(NRI)와 대조될 수 있습니다.
인간 세로토닌 수송체(SERT)와 노르아드레날린 수송체(NAT)는 시냅스 전 신경 말단으로 세로토닌과 노르아드레날린의 재흡수를 담당하는 막 수송 단백질입니다. 세로토닌과 노르아드레날린의 이중 억제는 더 넓은 범위의 증상을 치료함으로써 다른 항우울제에 비해 이점을 제공할 수 있습니다.[1] 그들은 특히 만성 또는 신경병증성 통증에 유용할 수 있습니다.[2]
SNRI는 SSRI 및 NRI와 함께 2세대 항우울제입니다. 1980년대 후반에 2세대 항우울제가 도입된 이후, 3환계 항우울제(TCA) 및 모노아민 산화효소 억제제(MAOI)와 같은 1세대 항우울제는 내약성과 안전성이 향상되어 MDD 치료에 선택되는 약물로 크게 대체되었습니다.[3]
의약품

미국에는 8개의 FDA 승인 SNRI가 있으며, 벤라팍신은 1993년에 최초로 개발된 약물이고 레보밀나시프란은 2013년에 개발된 최신 약물입니다. 약물은 다른 의료 용도, 화학 구조, 부작용 및 효능에 따라 다릅니다.[4]
| 약 | 브랜드명 | FDA 적응증 | 승인연도 | 화학구조 | 메모들 |
|---|---|---|---|---|---|
| Desvenlafaxine[5] | 프리스티크 Khedezla (ER) |
| 2007 |  | 벤라팍신의 활성 대사 물질. 일부 증거는 벤라팍신과 둘록세틴에 비해 낮은 반응률을 시사하지만 유사한 방식으로 작용하는 것으로 여겨집니다. 2008년 5월 Wyeth에 의해 도입되었으며, 당시 세 번째로 승인된 SNRI였습니다.[6] |
| 둘록세틴[7] | 심발타 이렌카 | 2004 |  | 2004년 8월 우울증 및 신경병증성 통증 치료 승인. 둘록세틴은 알코올 사용이 많거나 만성 간 질환이 있는 환자에서는 사용이 금지되는데, 둘록세틴은 특정 위험 환자에서 급성 간염이나 다른 질병을 유발할 수 있는 특정 간 효소의 수치를 증가시킬 수 있기 때문입니다. 간 손상의 위험은 드물지만 건강한 환자에게 자발적으로 간부전을 일으킬 수 있는 항우울제 네파조돈과 달리 이미 위험에 처한 환자에게만 있는 것으로 보입니다.[11] 둘록세틴은 만성 골관절염 통증과 만성 요통을 포함한 주요 우울장애(MDD), 일반불안장애(GAD), 당뇨병성 신경병증, 만성 근골격계 통증에도 승인되었습니다.[9] 둘록세틴도 간 대사를 거치며 간 시토크롬 P450 효소 CYP 2D6를 억제하는 것으로 나타났습니다.[12] 둘록세틴을 CYP 2D6에 의해 대사되는 다른 약물과 함께 복용할 경우 잠재적인 약물-약물 상호 작용을 유발할 수 있으므로 주의해야 합니다.[12] | |
| Levomilnacipran | 페찌마 |
| 2013 | 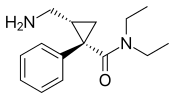 | 밀나시프란의 레보로팅 이성질체. 미국과 캐나다에서 우울증 치료를 위한 개발 중에 2013년 7월 FDA로부터 MDD 치료를 승인받았습니다. |
| Milnacipran | 익셀 사벨라 임펄서 |
| 1996 |  | 우울증 및 섬유근육통 치료에 상당히 효과적인 것으로 나타났습니다.[13] 미국 식품의약국(FDA)은 2009년 1월 미국에서 섬유근육통 치료를 위한 밀나시프란을 승인했지만, 미국에서는 우울증 치료를 위한 승인을 받지 못했습니다.[citation needed] 밀나시프란은 몇 년 전부터 유럽과 아시아에서 상업적으로 판매되고 있습니다.[citation needed] 1996년 프랑스에서 처음 선보였습니다.[citation needed] |
| 시부트라민 | 메리디아 | 1997 |  | 우울증 치료를 위해 개발되는 대신 체중 감량을 목적으로 식욕 억제제로 널리 판매된 SNRI. 시부트라민은 비만 치료제로 30년 만에 처음으로 허가를 받았습니다.[15] 심혈관 질환 및 뇌졸중 증가와 관련이 있으며 2010년 미국을 포함한 여러 국가 및 지역에서 시장에서 철수했습니다.[16] | |
| 트라마돌 | 울트람 |
| 1977 | 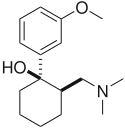 | 이중 약한 오피오이드와 SNRI. 이 제품은 1977년부터 독일에서 시판되고 있지만 1995년 FDA의 승인을 받았습니다. 이 약은 급성 및 만성 통증을 치료하는 데 사용됩니다. 섬유근육통 치료에 효과를 보여주었지만, 이 목적으로 특별히 승인된 것은 아닙니다. 이 약은 항우울제와 신경병증성 통증 치료를 위한 연구도 진행 중입니다. 그것은 벤라팍신과 화학 구조와 관련이 있습니다. 오피오이드이기 때문에 남용 및 중독의 위험이 있지만, 다른 오피오이드(하이드로코돈, 옥시코돈 등)에 비해 남용 가능성, 호흡 저하, 변비 등이 적습니다.[17] |
| Venlafaxine | 이펙서 | 1994 |  | 가장 일반적으로 사용되는 SNRI입니다. 그것은 1994년에 와이스에 의해 소개되었습니다. 벤라팍신의 재흡수 효과는 용량에 따라 다릅니다. 저용량(<150mg/day)에서는 세로토닌성 전염에만 작용합니다. 적당한 용량(>150 mg/day)에서는 세로토닌성 및 노르아드레날린성 시스템에 작용하는 반면, 고용량(>300 mg/day)에서는 도파민성 신경 전달에도 영향을 미칩니다.[20] 소량 투여 시, 벤라팍신은 또한 폐경기의 혈관 운동 증상(뜨거운 섬광과 야간 땀)을 치료하는 데 효과적인 것으로 나타났으며 호르몬 대체 요법(HRT)만큼 효과적일 수 있습니다.[19] |
역사
1952년 결핵 치료제로 연구하던 중 항진균제인 이프로니아지드가 정신 활성을 나타내는 것으로 밝혀졌습니다. 연구원들은 이프로니아지드를 투여받은 환자들이 쾌활해지고, 더 낙관적이며, 신체적으로 더 활동적이 된다는 것에 주목했습니다. 개발 직후 이프로니아지드 및 관련 물질은 모노아민 산화효소의 억제를 통해 세로토닌, 도파민 및 노르에피네프린의 효소 분해를 늦추는 것으로 나타났습니다. 이러한 이유로 이러한 종류의 약물은 모노아민 산화효소 억제제, 즉 MAOI로 알려지게 되었습니다. 이 기간 동안 독특하게 다른 항우울제의 개발도 연구되었습니다. 이미프라민은 최초의 임상적으로 유용한 삼환계 항우울제(TCA)가 되었습니다. 이미프라민은 수많은 신경전달물질 시스템에 영향을 미치고 시냅스에서 노르에피네프린과 세로토닌의 재흡수를 차단하여 이러한 신경전달물질의 수치를 증가시키는 것으로 밝혀졌습니다. MAOI와 TCAs의 사용은 우울증 치료에 큰 발전을 이루었지만, 불쾌한 부작용과 심각한 안전성 및 독성 문제로 인해 사용이 제한되었습니다.[21]
1960년대와 1970년대에 걸쳐 감정과 우울증과의 관계에 대한 카테콜아민 가설은 광범위한 관심을 끌었고 노르에피네프린, 세로토닌 및 도파민과 같은 특정 신경 전달 물질의 감소된 수준이 우울증의 발병기전에 역할을 할 수 있습니다. 이는 최초의 SSRI인 플루옥세틴의 개발로 이어졌습니다. TCAs 및 MAOIs와 비교하여 MDD 환자에서 SSRIs의 개선된 안전성 및 내약성 프로파일은 우울증 치료에서 또 다른 중요한 발전을 나타냈습니다.[21]
1980년대 후반부터 SSRI가 항우울제 시장을 장악해 왔습니다. 오늘날, 효능과 내약성의 향상을 제공할 수 있는 더 넓은 작용 메커니즘을 가진 항우울제에 대한 관심이 증가하고 있습니다. 1993년 세로토닌-노레피네프린 재흡수 억제제인 벤라팍신이라는 신약이 미국 시장에 출시되었습니다.[18] 벤라팍신은 페닐에틸아민이라고 불리는 새로운 종류의 항우울 물질에 기술된 최초의 화합물이었습니다. 이 물질들은 TCA 및 기타 SSRI와 관련이 없습니다. 벤라팍신은 중추신경계의 도파민, 노르아드레날린, 그리고 덜하지만 신경세포의 세로토닌 재흡수를 막습니다. 다른 여러 항우울제와 대조적으로, 벤라팍신은 주로 후속적인 노르에피네프린 재흡수 억제로 인해 빠른 작용 시작을 유도할 수 있습니다.[22] 그림 1의 타임라인을 참조하십시오.

작용기전
모노아민은 우울증의 병태생리와 연결되어 있습니다. 노르에피네프린, 세로토닌 등 신경전달물질의 농도가 부족해 다운스트림 변화로 이어지기 때문에 증상이 나타날 수 있습니다.[8][23] 우울증 약은 세로토닌, 노르에피네프린 및 도파민의 전달에 영향을 미칩니다.[8] TCAs와 MAOIs와 같은 오래되고 덜 선택적인 항우울제는 뇌에서 노르에피네프린과 세로토닌의 재흡수나 대사를 억제하여 신경전달물질의 농도를 높입니다.[23] 이중 작용기전을 가진 항우울제는 세로토닌과 노르에피네프린의 재흡수를 억제하고, 경우에 따라서는 도파민의 재흡수를 약하게 억제합니다.[8] 항우울제는 심장 근육의 무스카린성 콜린성, α-1 및 α-아드레날린성2, H-히스타민성1 및 나트륨 채널과 같은 다양한 신경 수용체에 영향을 미치며, 특히 TCAs와 관련된 심장 전도 및 심장 독성을 감소시키고, SSRIs와는 더 적은 정도로.[24] 항우울제의 선택성은 우울증 증상에 영향을 미치는 것으로 생각되는 신경전달물질에 기초합니다.[25] 세로토닌과 노르에피네프린의 재흡수를 선택적으로 차단하는 약물은 우울증을 효과적으로 치료하며 TCAs보다 더 잘 견딜 수 있습니다. TCAs는 다양한 신경전달물질 수용체에 포괄적인 영향을 미치며, 이는 내성 부족과 독성 위험 증가로 이어집니다.[26]
삼환계 항우울제

TCAs는 이중 작용 메커니즘을 가진 최초의 약물이었습니다. 삼환식 이차 아민 항우울제의 작용 메커니즘은 부분적으로만 이해됩니다. TCAs는 노르에피네프린 재흡수 수송체와 세로토닌 재흡수 수송체에 이중 억제 효과가 있습니다. 증가된 노르에피네프린과 세로토닌 농도는 이 두 수송 단백질을 모두 억제함으로써 얻어집니다. TCAs는 SSRIs보다 노르에피네프린 재흡수 단백질에 대해 훨씬 더 많은 친화력을 갖습니다. 이것은 2차 아민 TCA 대사 생성물의 형성 때문입니다.[27][28]
또한 TCAs는 아드레날린 수용체와 상호 작용합니다. 이 상호작용은 시냅스 틈새 내 또는 근처에서 노르에피네프린의 가용성 증가에 중요한 것으로 보입니다. 이미프라민과 유사한 삼환계 항우울제의 작용은 노르에피네프린 수송의 억제제 및 세로토닌 수송의 가변 차단제로서 초기 및 지속적인 작용에 대한 복합적이고 이차적인 적응을 갖습니다.
노르에피네프린은 시냅스 후 α 및 β 아드레날린 수용체 아형 및 시냅스 전 α2 자가 수용체와 상호 작용합니다. α2 수용체는 중추신경계의 노르아드레날린 뉴런의 신경생리학적 활동을 제한하는 시냅스 전 자가 수용체를 포함합니다. 노르에피네프린의 형성은 효소의 감소된 순환 AMP 매개 인산화 활성화에 의해 매개되는 효과인 속도 제한 효소 tyrosine hydroxylase를 통해 자가수용체에 의해 감소됩니다.[28] α2 수용체는 또한 세포 내 순환 AMP 발현을 감소시켜 평활근 이완 또는 분비 감소를 초래합니다.[29]
TCAs는 시냅스 전 수용체에 대한 효과를 통해 음성 피드백 메커니즘을 활성화합니다. 감소된 신경전달물질 방출에 대한 영향에 대한 한 가지 가능한 설명은 수용체가 활성화됨에 따라 신경전달물질 방출의 억제가 발생한다는 것입니다(전압-게이트 Ca2+ 전류의 억제 및 G 단백질 결합 수용체-작동형+ K 전류의 활성화를 포함함). 이런 기전의 약제가 반복적으로 노출되면 신경전달물질 방출이 억제되지만, TCAs의 반복 투여는 최종적으로 α2 수용체에 의한 반응 감소로 이어집니다. 이러한 반응의 탈감작은 내인성 노르에피네프린에 대한 노출 증가 또는 (알로스테릭 효과를 통한) 노르에피네프린 수송 메커니즘의 장기간 점유로 인한 것일 수 있습니다. 그 적응은 노르에피네프린의 시냅스 전 합성과 분비가 시냅스 틈에서 노르에피네프린의 정상 수준으로 돌아오거나 심지어 초과할 수 있게 합니다. 전반적으로, TCAs에 의해 유도된 노르에피네프린 재흡수의 억제는 뉴런 발화율(α2 자가수용체를 통해 매개됨) 감소, 대사 활성 및 신경전달물질 방출로 이어집니다.[28]
TCAs는 직접적으로 도파민 수송을 차단하지 않지만 대뇌 피질의 노르아드레날린 말단으로 도파민 수송을 억제함으로써 간접적으로 도파민 효과를 촉진할 수 있습니다.[28] TCAs는 매우 다양한 수용체에 영향을 미치기 때문에 부작용, 내약성 저하 및 독성 위험 증가가 있습니다.[26]
선택적 세로토닌 재흡수 억제제
선택적 세로토닌 재흡수 억제제(SSRIs)는 세로토닌의 재흡수를 선택적으로 억제하며 널리 사용되는 항우울제 그룹입니다.[30] TCAs에 비해 수용체 선택성이 증가하면 내약성 저하와 같은 원치 않는 영향을 피할 수 있습니다.[28] 세로토닌은 L-트립토판이라는 아미노산에서 합성됩니다. 능동 수송 시스템은 혈액-뇌 장벽을 가로질러 트립토판의 흡수를 조절합니다. 세로토닌 경로는 뇌에서 크게 두 가지 방법으로 분류됩니다: 안쪽과 등쪽에서 척추로 향하는 상승 돌출부와 꼬리에서 척추로 향하는 하강 돌출부.
선택적 노르에피네프린 재흡수 억제제
노르아드레날린 뉴런은 뇌의 주요 두 영역에 위치합니다. 이 영역들은 locus coeruleus와 lateral tegmental입니다. SNRI의 투여로, 시냅스 간극에 노르에피네프린의 농도 증가로 인해 유전자좌(locus coeruleus) 영역의 뉴런 활성이 유도됩니다. 이것은 앞서 논의한 [23]바와 같이 α2 아드레날린 수용체의 활성화를 초래합니다.
분석 결과 SNRI는 mACH, α1 및 α2 아드레날린 또는 H1 수용체에 대해 미미한 펜촉을 가지고 있는 것으로 나타났습니다.[25]
이중 세로토닌 및 노르에피네프린 재흡수 억제제
이중 세로토닌과 노르에피네프린 재흡수 억제제(SNRIs)가 있는 약제를 비삼환식 세로토닌과 노르에피네프린 재흡수 억제제라고 부르기도 합니다. 임상 연구에 따르면 노르에피네프린과 세로토닌의 시냅스 간극의 농도를 증가시키는 화합물이 우울증 치료에 단일 작용제보다 더 성공적이지만, 데이터는 SNRI가 우울증에 대한 SSRI보다 더 효과적인 치료 옵션인지 결정적이지 않습니다.[31][32][33]
비삼환식 SNRI는 약동학, 활성 대사 산물로의 대사, CYP 동형 억제, 약물-약물 상호 작용의 효과 및 비삼환식 SNRI의 반감기를 기반으로 하는 몇 가지 중요한 차이점을 가지고 있습니다.[27][34]
단일 활성제에서 작용 메커니즘의 조합은 정신약리학에서 중요한 발전입니다.[34]
구조물활동관계
아릴옥시프로파민 스캐폴드
여러 재흡수 억제제에는 아릴옥시프로파민 스캐폴드가 포함되어 있습니다. 이 구조적 모티프는 생체 아민 수송에 대한 높은 친화성 결합 가능성을 가지고 있습니다.[34] 아릴옥시프로파민 스캐폴드를 포함하는 약물은 아릴옥시 고리의 치환 패턴에 의존하는 노르에피네프린 및 세로토닌 수송체에 대한 선택성 프로파일을 갖습니다. 선택적 NRI는 아릴옥시 고리의 2' 위치에 치환기를 포함하지만 SSRI는 아릴옥시 고리의 4' 위치에 치환기를 포함합니다. 아톰옥세틴, 니소세틴, 레복세틴은 모두 2' 위치에 치환기가 있고 선택적인 NRI이며, 플루옥세틴, 파록세틴과 같이 4' 위치에 치환기가 있는 화합물은 SSRI입니다. 둘록세틴은 2' 위치와 3' 위치에 페닐기가 융합되어 있고, 따라서 이중 선택적 노르에피네프린 및 세로토닌 재흡수 억제 효과가 있으며 두 수송체 모두에 대해 유사한 효능을 가지고 있습니다.[35] 방향족 치환기의 특성은 또한 세로토닌 또는 노르에피네프린 수송체의 억제제로서 화합물의 활성 및 선택성에 상당한 영향을 미칩니다.[34]

시클로알칸올에틸아민 스캐폴드
벤라팍신과 데스벤라팍신은 사이클로알칸올 에틸아민 스캐폴드를 함유하고 있습니다. 방향족 고리의 전자 인출 특성을 증가시키면 노르에피네프린 흡수의 더 강력한 억제 효과를 제공하고 세로토닌 수송체보다 노르에피네프린에 대한 선택성을 향상시킵니다.[35] 사이클로알칸올 에틸아민 스캐폴드의 방향족 고리에서 클로로, 메톡시 및 트리플루오로메틸 치환기의 효과를 테스트했습니다. 그 결과 가장 강력한 전자 인출 m-트리플루오로메틸 유사체가 노르에피네프린의 가장 강력한 억제 효과와 세로토닌 흡수에 대한 가장 강력한 선택성을 나타냄을 보여주었습니다.[35] 피페라진 함유 유도체인 WY-46824는 노르에피네프린 및 도파민 재흡수 억제를 나타내지 않았습니다. 추가 합성 및 테스트를 통해 우수한 선택성을 나타내고 우울증, 통증 및 체온 조절 기능 장애의 동물 모델에서 효과적인 강력한 노르에피네프린 재흡수 억제제인 WAY-256805가 확인되었습니다.[36]

Milnacipran

밀나시프란은 다른 SNRI와 구조적으로 다릅니다.[27] 수송체 수준에서 밀나시프란 유도체의 구조 활성 관계는 여전히 대부분 불분명하며 1987년에 보고된 생체 내 효능을 기반으로 합니다. 치환기 그룹 R과4 R에서5 밀나시프란의 N-메틸화는 노르에피네프린과 세로토닌 활성을 감소시킵니다.[37] 치환기 R과 R의 다른 2차 아미드에 대한 연구는 π 전자가 수송체와 리간드 사이의 상호작용에 중요한 역할을 한다는 것을 보여주었습니다. 치환기6 R의 페닐기는 노르에피네프린 수송체에 효과를 보였습니다. 알릴 이중 결합을 가진 R과6 R의7 치환기 그룹은 노르에피네프린과 세로토닌 수송체 모두에서 상당한 개선 효과를 보였습니다.[37] 연구에 따르면 치환기 R에3 2-메틸기를 도입하면 노르에피네프린과 세로토닌 수송체의 효력이 거의 없어집니다. 치환기 그룹 R과1 R의2 메틸 그룹은 또한 노르에피네프린과 세로토닌 수송체에서의 효력을 폐지합니다. 연구원들은 밀나시프란의 에틸 그룹 중 하나를 알릴 부분으로 대체하면 노르에피네프린의 효력이 증가한다는 것을 발견했습니다.[38] 밀나시프란 유도체의 약리포어는 여전히 대부분 불분명합니다.[37]
밀나시프란의 형태는 약리학의 중요한 부분입니다. 입체화학을 바꾸면 노르에피네프린과 세로토닌 농도에 영향을 미칩니다. 밀나시프란은 라세미 혼합물로 판매되고 있습니다. 밀나시프란의 효과는 (1S,2R)-이성질체에 존재하고 (1S,2R)-이성질체에서 페닐기의 치환은 노르에피네프린 농도에 부정적인 영향을 미칩니다.[38] 밀나시프란은 분자량이 낮고 친유성이 낮습니다. 이러한 특성으로 인해 밀나시프란은 높은 생체이용률, 낮은 피험자 간 가변성, 제한된 간 효소 상호작용, 중간 조직 분포 및 합리적으로 긴 제거 반감기와 같은 인간에서 거의 이상적인 약동학을 나타냅니다. 시토크롬 P450 효소를 통한 Milnacipran의 약물-약물 상호작용 부족은 많은 중추신경계 약물들이 친유성이 높고 주로 간 효소에 의해 제거되기 때문에 매력적인 특징으로 생각됩니다.[38]
구조물 활동 관계의 미래 발전
아릴옥시프로파나민 스캐폴드의 적용은 수많은 강력한 MAOI를 생성했습니다.[39] 둘록세틴이 개발되기 전에 아릴옥시프로파민 구조 활성 관계를 탐색한 결과 플루옥세틴과 아토목세틴이 확인되었습니다. 모폴린 고리 시스템에서 제한되는 레복세틴에서도 동일한 모티프를 찾을 수 있습니다. 레복세틴의 산소를 황으로 치환하여 아릴티오메틸 모르폴린을 주는 연구도 있습니다. 일부 아릴티오메틸 모르폴린 유도체는 강력한 수준의 세로토닌 및 노르에피네프린 재흡수 억제를 유지합니다. 이중 세로토닌 및 노르에피네프린 재흡수 억제는 아릴티오메틸 모폴린 스캐폴드에 대한 다른 거울상이성질체에 존재합니다.[40] 이중 세로토닌 및 노르에피네프린 재흡수 억제 활성을 갖는 가능한 약물 후보물질은 또한 피페라진, 3-아미노-피롤리딘 및 벤질아민 주형에서 유래되었습니다.[41]
임상시험
우울증.
세로토닌 재흡수 자체에 작용하는 SSRI보다 세로토닌과 노르아드레날린 활성이 결합된 항우울제가 일반적으로 더 효과적이라는 것이 여러 연구에서 밝혀졌습니다. 세로토닌성 노르아드레날린성 항우울제는 주요 우울증(MDD) 치료에 있어 SSRI에 비해 약간의 효능 이점을 가질 [42]수 있지만 내약성은 약간 낮습니다.[43] 특정 MDD 하위 집단 또는 특정 MDD 증상에 대한 이러한 종류의 항우울제 간의 효능 차이를 조사하기 위해서는 추가 연구가 필요합니다.
진통제
임상 시험의 데이터에 따르면 SNRI는 통증 완화 특성을 가질 수 있습니다. 중추신경계의 통증 자극에 대한 인식과 전달은 완전히 밝혀지지 않았지만 광범위한 데이터는 통증 조절에 세로토닌과 노르에피네프린의 역할을 뒷받침합니다. 인간을 대상으로 한 임상 실험 결과는 이러한 항우울제가 중추성 및 신경병증성 통증 상태에서 통증과 기능 장애를 줄이는 데 도움이 될 수 있다는 것을 보여주었습니다. SNRI의 이러한 특성은 다른 통증 완화 약물의 용량을 줄이고 안전성, 제한된 효능 및 내약성 문제의 빈도를 낮추는 데 사용될 수 있습니다.[44] 임상 연구 데이터는 GAD 환자에서 SNRI duloxetine이 단기 및 장기 치료 후 GAD의 통증 관련 증상을 줄이는 데 위약보다 훨씬 더 효과적임을 보여주었습니다. 그러나 그러한 신체적 고통의 증상이 재발 상황에서 다시 발생한다는 것이 발견되었으며, 이는 GAD 및 동시에 고통스러운 신체적 증상을 가진 환자에서 지속적인 치료가 필요함을 나타냅니다.[45]
적응증
SNRI는 다음 조건의 처리를 위해 테스트되었습니다.
약리학
행정경로
SNRI는 일반적으로 캡슐 또는 정제 형태로 경구로 배송됩니다. SNRI는 아침 식사와 함께 아침에 복용하는 것이 좋으며, 이는 약물 수치에는 영향을 미치지 않지만 특정 부작용에 도움이 될 수 있습니다.[47] 노르에피네프린은 신체에 활성화 효과가 있기 때문에 취침 시간에 복용하면 일부 환자에게 불면증을 유발할 수 있습니다.[48] SNRI는 또한 메스꺼움을 유발할 수 있는데, 이는 보통 경미하고 치료 후 몇 주 이내에 사라지지만, 음식과 함께 약물을 복용하면 이를 완화하는 데 도움이 될 수 있습니다.[49]
행동양식
SNRIs가 주로 나타나는 상태, 주요 우울 장애는 주로 시냅스 틈에서 세로토닌과 노르에피네프린의 수치가 감소하여 불규칙한 신호 전달을 일으키는 것으로 생각되었습니다. 그러나 이 이론은 반박되었습니다.[50] 모노아민 신경전달물질의 농도가 감소하면 우울한 증상이 나타난다고 주장하는 우울증의 모노아민 가설에 기초하여 다음과 같은 관계가 결정되었습니다: " 노르에피네프린은 삶의 불안, 관심, 흥미뿐만 아니라 경계심과 에너지와 관련이 있을 수 있습니다. 세로토닌의 부족은 불안, 강박, 그리고 강박, 그리고 삶에 대한 관심뿐만 아니라 관심, 동기부여, 즐거움, 그리고 보상에 대한 도파민."[51] SNRI는 신경전달물질인 세로토닌과 노르에피네프린의 재흡수를 억제함으로써 작용합니다. 이것은 세포외 세로토닌과 노르에피네프린의 농도를 증가시키고 결과적으로 신경 전달을 증가시킵니다. venlafaxine, desvenlafaxine 및 duloxetine을 포함한 대부분의 SNRI는 노르에피네프린에 비해 세로토닌에 대해 몇 배 더 선택적인 반면, milnacipran은 노르에피네프린에 대해 세로토닌에 비해 3배 더 선택적입니다. 노르에피네프린 수치의 상승은 항우울제가 신경병증성 통증에 효과적이기 위해서는 필요한 것으로 생각되는데, 이는 오래된 삼환계 항우울제(TCA)와 공유되지만 SSRI와는 공유되지 않는 특성입니다.[52]
최근의 연구들은 우울증이 염증 반응 증가와 관련이 있을 수 있다는 것을 보여주었고 [53]따라서 SNRI에 대한 추가적인 메커니즘을 찾으려는 시도가 이루어졌습니다. 연구에 따르면 SSRI뿐만 아니라 SNRI도 세로토닌과 노르에피네프린 수치에 미치는 영향 외에도 미세아교세포에[54] 대한 상당한 항염증 작용을 합니다. 이와 같이, 이전에 이해된 메커니즘과 결합하여 작용하는 이러한 약물들의 추가적인 메커니즘이 존재할 가능성이 있습니다. 이러한 발견 뒤에 숨겨진 의미는 뇌 손상 또는 뇌의 부종이 문제가 되는 다른 질병에 이어 SNRI를 잠재적인 항염증제로 사용하는 것을 시사합니다. 그러나 메커니즘에 관계없이 이러한 약물이 지시된 질병을 치료하는 데 있어 임상적으로나 실제적으로 이러한 약물의 효능이 입증되었습니다.[improper synthesis?]
약력학
대부분의 SNRI는 세로토닌, 노르에피네핀 및 한계량의 도파민의 재흡수를 억제하기 위해 1차 대사산물 및 2차 대사산물과 함께 기능합니다. 예를 들어, 벤라팍신은 주요 대사산물인 O-데스메틸벤라팍신과 함께 작용하여 뇌에서 세로토닌과 노르에피네프린의 재흡수를 강력하게 억제합니다. 그 증거는 또한 도파민 수송체가 주로 부족한 뇌의 한 부분인 전두엽 피질에서 노르에피네프린의 재흡수에 의한 도파민의 비활성화로 인해 도파민과 노르에피네프린이 동시 수송 방식으로 행동한다는 것을 암시합니다. SNRIs의 이러한 효과는 세로토닌과 노르에피네프린 활성의 증가와 더불어 도파민 신경 전달을 증가시킵니다.[55] 또한 SNRI는 매우 선택적이기 때문에 모노아민 산화효소 억제와는 달리 의도하지 않은 다른 수용체에 대해 측정 가능한 영향을 미치지 않습니다.[56] 약학 시험 결과 SNRIs 또는 SSRIs를 모두 사용하면 소교세포에도 상당한 항염증 작용을 일으킬 수 있는 것으로 확인되었습니다.[54][14][57][58][9][59]
활동 프로필
사람을 향한 SNRI와| 컴파운드 | SERT | NET | ~비율 (5-HT : NE) | ||
|---|---|---|---|---|---|
| Ki | IC50 | Ki | IC50 | ||
| Venlafaxine | 7.8 | 145 | 1,920 | 1420 | 9.8:1 |
| Des-venlafaxine | 40.2 | 47.3 | 558.4 | 531.3 | |
| 둘록세틴 | 0.07 | 3.7 | 1.17 | 20 | 5.4:1 |
| 아토목세틴 | 87[61] | 5.4[61] | 0.06:1 (= 1:16) | ||
| Milnacipran | 8.44 | 151 | 22 | 68 | 0.45:1 (= 1:2.2) |
| Levo-milnacipran | 11.2 | 19.0 | 92.2 | 10.5 | |
| 모든i K 및 IC50 값은 다음과 같습니다. 비율은NE 의 IC50 값을 기반으로 합니다.[60] | |||||
약동학
벤라팍신의 반감기는 약 5시간이며, 1일 1회 투약으로 활성대사물질 데벤라팍신이 더 오래 지속되지만 약 3일 후 정상상태 농도가 됩니다.[58] 데스벤라팍신의 반감기는 약 11시간이며, 4~5일이 지나면 정상 상태 농도가 됩니다.[57] 둘록세틴의 반감기는 약 12시간(범위: 8-17시간)이며, 약 3일 후 정상 상태가 됩니다.[9] 밀나시프란은 약 6~8시간의 반감기를 가지며, 36~48시간 이내에 정상 상태 수준에 도달합니다.[59]
금기사항
SNRI는 생명을 위협할 수 있는 세로토닌 증후군의 위험 증가로 인해 최근 2주 이내에 MAOI를 복용하는 환자에서는 사용이 금지됩니다.[63] SNRI와 병용할 경우 세로토닌 증후군의 위험이 증가하므로 피해야 하는 다른 약물 및 물질은 기타 항우울제, 항경련제, 진통제, 항진통제, 항미그레인 약물, 메틸렌 블루, 리네졸리드, 리튬, 세인트존스 워트, 엑스터시 및 LSD입니다.[63] 세로토닌 증후군의 징후와 증상은 고열, 경직, 근클론, 요동치는 활력징후를 동반한 자율적 불안정, 정신상태의 변화 등이 있습니다.[9]
노르에피네프린 수치가 증가하여 노르아드레날린 활성이 높아지기 때문에 SNRI로 치료하기 전에 기존 고혈압을 조절하고 치료 전반에 걸쳐 주기적으로 혈압을 모니터링해야 합니다.[64] 둘록세틴은 또한 간부전 사례와 관련이 있으며 만성 알코올 사용 또는 간질환 환자에게 처방해서는 안 됩니다. 둘록세틴이 간 기능 검사를 정상 상한치보다 3배 높일 수 있다는 연구 결과가 나왔습니다.[65] 관상 동맥 질환 환자는 SNRI 사용에 주의해야 합니다.[66] 또한 비만에 대한 일부 SNRI의 작용으로 인해 거식증이나 폭식증과 같은 주요 섭식 장애가 있는 환자는 SNRI를 처방받아서는 안 됩니다.[14] 둘록세틴과 밀나시프란은 또한 균사증의 발병률을 증가시키는 것으로 나타났기 때문에 조절되지 않는 협각 녹내장 환자에서는 금기입니다.[9][59]
부작용
SNRI와 SSRI는 세로토닌 수치를 높이는 유사한 방식으로 작용하기 때문에 정도에 따라 다르지만 많은 부작용을 공유합니다. 가장 흔한 부작용으로는 메스꺼움/구토, 땀 흘림, 식욕 감퇴, 현기증, 두통, 자살 생각 증가, 성기능 장애 등이 있습니다.[67] 노르에피네프린 수치가 상승하면 때때로 불안감, 맥박이 약간 상승하고 혈압이 상승할 수 있습니다. 그러나 레복세틴, 데시프라민과 같은 노르에피네프린 선택적 항우울제는 불안장애를 성공적으로 치료하지 못했습니다.[68] 고혈압과 심장병의 위험이 있는 사람들은 혈압을 감시해야 합니다.[14][57][58][9][59]
성기능장애
SNRI는 SSRI와 유사하게 발기부전, 성욕 저하, 성적 무호흡증, 무정맥과 같은 여러 종류의 성기능 장애를 유발할 수 있습니다.[9][58][69] 일반적인 두 가지 성적 부작용은 성에 대한 관심 감소(libido)와 클라이맥스에 도달하기 어려운(orgasmia)이며, 이는 일반적으로 SSRI에 비해 SNRI에서 다소 경미합니다.[70] 성기능 장애를 관리하기 위해 부프로피온으로 바꾸거나 증강하거나 PDE5 억제제를 추가하면 성기능 장애 증상이 감소한다는 연구 결과가 나왔습니다.[71] 실데나필(비아그라), 타달라필(시알리스), 바르데나필(레비트라), 아바나필(스텐드라)과 같은 PDE5 억제제는 여성보다 남성에게 더 효과적인 것으로 나타났지만 때때로 발기부전을 포함한 성기능 저하에 도움이 된다는 연구 결과가 나왔습니다.[71]
세로토닌 증후군
SNRIs의 심각하지만 드문 부작용은 체내 세로토닌의 과잉으로 인해 발생하는 세로토닌 증후군입니다. 세로토닌 증후군은 SSRIs나 SNRIs와 같은 여러 세로토닌성 약물을 복용함으로써 발생할 수 있습니다. 세로토닌 증후군에 기여하는 다른 약물에는 MAO 억제제, linezolid, tedizolid, methylene blue, procarbazine, 암페타민, clomipramine 등이 있습니다.[72] 세로토닌 증후군의 초기 증상은 메스꺼움, 구토, 설사, 땀 흘림, 동요, 혼란, 근육 경직, 동공 확장, 고열, 경직, 소름 등을 포함할 수 있습니다. 더 심한 증상으로는 발열, 발작, 불규칙한 심장박동, 섬망, 혼수상태 등이 있습니다.[73][74][9] 징후나 증상이 나타나면 세로토닌성 제제 치료를 즉시 중단합니다.[73] MAO 억제제를 사용하기 전에 세로토닌성 약제의 반감기를 4~5회 씻어내는 것이 좋습니다.[75]
출혈
일부 연구에서는 혈소판 응집의 장애와 혈소판 세로토닌 수치의 고갈로 인한 상부 위장관 출혈, 특히 벤라팍신의 위험이 있음을 시사합니다.[76][77] SSRI와 유사하게, SNRI는 와파린과 같은 항응고제와 상호작용할 수 있습니다. SSRI가 SNRI보다 출혈 위험이 높다는 증거가 더 많습니다.[76] 연구에 따르면 이부프로펜이나 나프록센과 같은 비스테로이드성 항염증제(NSAIDs)를 고용량으로 사용할 때 상부 GI 출혈 위험이 증가하여 SNRI 또는 SSRI를 사용할 때 주의할 것을 제안했습니다.[33]
시각적 문제

다른 항우울제와 유사하게, SNRI 약물은 시각적 정적, 회음부(영상 후 음성), 약시(밤에 시력이 좋지 않음), 광공포증(빛이나 강조된 색상의 더 밝은 표현)을 특징으로 하는 증상인 시각적 눈 증후군을 유발하는 것으로 밝혀졌습니다. SNRI 복용자의 8.9%는 시각적 눈을, 10.5%는 회맹증을, 15.3%는 광공포증을, 17.7%는 SNRI 처방 섭취의 결과로 익토로피아를 경험한 것으로 나타났습니다. 아미트리필린, 시탈로프람 등도 VSS의 증상을 악화시키거나 유발하는 것으로 보고되었습니다.[78]
주의사항
SNRI 요법 시작
노르에피네프린과 세로토닌 재흡수 억제로부터 생성되는 노르아드레날린 활성의 극단적인 변화로 인해, SNRI 요법을 막 시작하는 환자들은 일반적으로 신체가 약물의 효과에 적응할 수 있도록 예상되는 최종 투여량보다 낮은 용량을 투여받습니다. 환자가 부작용 없이 낮은 용량으로 계속 투여하기 때문에 환자가 해로운 부작용 없이 증상이 개선되는 것을 볼 때까지 투여량을 점진적으로 늘립니다.[79]
단종증후군
SSRI와 마찬가지로 SNRI를 갑자기 중단하면 일반적으로 중단 또는 "중단 증후군"이 발생하며, 이는 불안 및 기타 증상을 포함할 수 있습니다. 따라서 SNRI를 중단하려는 사용자는 전문가의 관리 하에 용량을 천천히 줄이는 것이 좋습니다. 중단 증후군은 다른 SNRI와 비교할 때 venlafaxine에서 현저하게 더 나쁜 것으로 보고되었습니다. 이처럼 트라마돌이 벤라팍신과 관련이 있는 만큼 같은 조건이 적용됩니다.[80] 이것은 벤라팍신의 반감기가 비교적 짧기 때문에 중단 시 빠른 제거 때문일 수 있습니다. 경우에 따라서는 중단 증상을 줄이기 위해 venlafaxine에서 지속형 SSRI인 fluoxetine으로 전환한 후 fluoxetine을 테이퍼링하는 것이 권장될 수 있습니다.[81][82] SNRI의 갑작스러운 중단으로 인한 중단의 징후와 증상으로는 현기증, 불안, 불면증, 메스꺼움, 땀 흘림, 무기력 및 권태감과 같은 독감과 유사한 증상이 있습니다.[83]
과다 복용
원인들
SNRIs의 과다복용은 약물 조합 또는 약물 자체의 과다한 양으로 인해 발생할 수 있습니다. 벤라팍신은 둘록세틴이나 SSRI보다 과량 복용 시 약간 더 독성이 있습니다.[14][57][58][9][59][84]
증상
SNRI 과다복용의 증상은 혼합 약물 상호작용이든 약물 단독이든 복용하는 약의 양과 SNRI 치료에 대한 개인의 민감도에 따라 강도와 발병률이 다릅니다. 가능한 증상은 다음과 같습니다.[9]
관리
과다복용은 보통 증상적으로 치료되는데, 특히 세로토닌 독성의 진행에 따른 시프로헵타딘의 치료와 온도 조절이 필요한 세로토닌 증후군의 경우 더욱 그렇습니다.[85] 환자는 종종 적절한 수준의 산소를 공급받고 있는지 확인하기 위해 활력소와 기도가 제거되었는지 여부를 모니터링합니다. 또 다른 방법은 과도한 신경 전달 물질을 흡수하기 위해 위장관에 활성탄을 사용하는 것입니다.[9]
SSRI와 비교
SNRI는 SSRI보다 더 최근에 개발되었기 때문에 상대적으로 그 수가 적습니다. 그러나 SNRI는 오늘날 가장 널리 사용되는 항우울제 중 하나입니다. 2009년, 심발타와 에펙소르는 각각 미국에서 11번째, 12번째로 많이 처방된 브랜드 의약품이었습니다. 이것은 SSRI인 Lexapro(에시탈롭람) 다음으로 두 번째와 세 번째로 흔한 항우울제로 해석됩니다.[86] 일부 연구에서 SNRI가 SSRI보다 약간 더 높은 항우울 효과를 나타냈습니다(응답률 63.6% 대 59.3%).[42] 그러나 한 연구에서 에시탈로프람은 벤라팍신보다 효능 프로파일이 우수했습니다.[87]
특수인구
임신
임신 중에 FDA 승인을 받은 항우울제는 없습니다.[88] 임신 중 항우울제 사용은 뇌의 기능 발달과 행동에 영향을 미치는 태아 이상을 초래할 수 있습니다.[88]
소아과
SSRI와 SNRI는 소아 인구의 주요 우울 장애와 불안을 치료하는 데 효과적인 것으로 나타났습니다.[89] 그러나 주요 우울증 질환, 특히 벤라팍신 치료를 위한 소아 집단에서 자살률이 증가할 위험이 있습니다.[89] 플루옥세틴은 소아/청소년 주요 우울장애에 대해 승인된 유일한 항우울제입니다.[90]
노인학
SNRI를 포함한 대부분의 항우울제는 노인 인구에게 안전하고 효과적입니다. 의사 결정은 종종 동반 질환, 약물 상호 작용 및 환자 내성을 기반으로 합니다. 체성분과 신진대사의 차이로 인해 젊은 성인의 경우 시작 용량이 권장 용량의 절반인 경우가 많습니다.[91]
조사.
통증 완화를 위한 항우울제의 효능을 살펴본 체계적인 검토 결과 42개의 비교 중 11개만이 효능의 증거를 보여주었다고 결론지었습니다. 11개의 비교 중 7개는 SNRI 약물 등급에 속합니다.[92]
참고문헌
- ^ Cashman JR, Ghirmai S (October 2009). "Inhibition of serotonin and norepinephrine reuptake and inhibition of phosphodiesterase by multi-target inhibitors as potential agents for depression". Bioorganic & Medicinal Chemistry. 17 (19): 6890–6897. doi:10.1016/j.bmc.2009.08.025. PMID 19740668.
- ^ Wright ME, Rizzolo D (March 2017). "An update on the pharmacologic management and treatment of neuropathic pain". JAAPA. 30 (3): 13–17. doi:10.1097/01.JAA.0000512228.23432.f7. PMID 28151738. S2CID 205396280.
- ^ Spina E, Santoro V, D'Arrigo C (July 2008). "Clinically relevant pharmacokinetic drug interactions with second-generation antidepressants: an update". Clinical Therapeutics. 30 (7): 1206–1227. doi:10.1016/S0149-2918(08)80047-1. PMID 18691982.
- ^ Hillhouse TM, Porter JH (February 2015). "A brief history of the development of antidepressant drugs: from monoamines to glutamate". Experimental and Clinical Psychopharmacology. 23 (1): 1–21. doi:10.1037/a0038550. PMC 4428540. PMID 25643025.
- ^ a b Deecher DC, Beyer CE, Johnston G, Bray J, Shah S, Abou-Gharbia M, Andree TH (August 2006). "Desvenlafaxine succinate: A new serotonin and norepinephrine reuptake inhibitor". The Journal of Pharmacology and Experimental Therapeutics. 318 (2): 657–665. doi:10.1124/jpet.106.103382. PMID 16675639. S2CID 15063064.
- ^ a b Perry R, Cassagnol M (June 2009). "Desvenlafaxine: a new serotonin-norepinephrine reuptake inhibitor for the treatment of adults with major depressive disorder". Clinical Therapeutics. 31 Pt 1 (1): 1374–1404. doi:10.1016/j.clinthera.2009.07.012. PMID 19698900.
- ^ Iyengar S, Webster AA, Hemrick-Luecke SK, Xu JY, Simmons RM (November 2004). "Efficacy of duloxetine, a potent and balanced serotonin-norepinephrine reuptake inhibitor in persistent pain models in rats". The Journal of Pharmacology and Experimental Therapeutics. 311 (2): 576–584. doi:10.1124/jpet.104.070656. PMID 15254142. S2CID 18022449.
- ^ a b c d Hunziker ME, Suehs BT, Bettinger TL, Crismon ML (August 2005). "Duloxetine hydrochloride: a new dual-acting medication for the treatment of major depressive disorder". Clinical Therapeutics. 27 (8): 1126–1143. doi:10.1016/j.clinthera.2005.08.010. PMID 16199241.
- ^ a b c d e f g h i j k l "Cymbalta- duloxetine hydrochloride capsule, delayed release". DailyMed. 20 September 2021. Retrieved 12 February 2023.
- ^ "Yentreve (duloxetine hydrochloride) Hard Gastro-Resistant Capsules. Summary of Product Characteristics" (PDF). European Medicines Agency. Retrieved 29 August 2016.
- ^ "Nefazodone hydrochloride tablet". DailyMed. 16 November 2021. Retrieved 12 February 2023.
- ^ a b Frampton JE, Plosker GL (2007). "Duloxetine: a review of its use in the treatment of major depressive disorder". CNS Drugs. 21 (7): 581–609. doi:10.2165/00023210-200721070-00004. PMID 17579500.
- ^ a b Morishita S, Arita S (February 2003). "The clinical use of milnacipran for depression". European Psychiatry. 18 (1): 34–35. doi:10.1016/S0924-9338(02)00003-2. PMID 12648895. S2CID 5978467.
- ^ a b c d e "Meridia (sibutramine hydrochloride monohydrate) Capsules C-IV. Full Prescribing Information (archived label)". Abbott Laboratories, North Chicago, IL 60064, USA. Retrieved 2 September 2016.
- ^ Luque CA, Rey JA (April 2002). "The discovery and status of sibutramine as an anti-obesity drug". European Journal of Pharmacology. 440 (2–3): 119–128. doi:10.1016/S0014-2999(02)01423-1. PMID 12007530.
- ^ Rockoff JD, Dooren JC (October 8, 2010). "Abbott Pulls Diet Drug Meridia Off US Shelves". The Wall Street Journal. Retrieved 8 October 2010.[데드링크]
- ^ Keating GM (2006). "Tramadol sustained-release capsules". Drugs. 66 (2): 223–230. doi:10.2165/00003495-200666020-00006. PMID 16451094. S2CID 22620947.
- ^ a b Gutierrez MA, Stimmel GL, Aiso JY (August 2003). "Venlafaxine: a 2003 update". Clinical Therapeutics. 25 (8): 2138–2154. doi:10.1016/s0149-2918(03)80210-2. PMID 14512125.
- ^ a b Joffe H, Guthrie KA, LaCroix AZ, Reed SD, Ensrud KE, Manson JE, et al. (July 2014). "Low-dose estradiol and the serotonin-norepinephrine reuptake inhibitor venlafaxine for vasomotor symptoms: a randomized clinical trial". JAMA Internal Medicine. 174 (7): 1058–1066. doi:10.1001/jamainternmed.2014.1891. PMC 4179877. PMID 24861828.
- ^ Redrobe JP, Bourin M, Colombel MC, Baker GB (July 1998). "Dose-dependent noradrenergic and serotonergic properties of venlafaxine in animal models indicative of antidepressant activity". Psychopharmacology. 138 (1): 1–8. doi:10.1007/s002130050638. PMID 9694520. S2CID 35064471.
- ^ a b Lieberman JA (2003). "History of the Use of Antidepressants in Primary Care" (PDF). Primary Care Companion J Clin Psychiatry. 5 (S7): 6–10.
- ^ Ruelas EG, Diaz-Martinez A, Ruiz RM, Study TV, Group C (1997). "An open assessment of the acceptability, efficacy, and tolerance of venlafaxine in usual care settings". Current Therapeutic Research. 58 (9): 609–630. doi:10.1016/S0011-393X(97)80088-4.
- ^ a b c Grandoso L, Pineda J, Ugedo L (May 2004). "Comparative study of the effects of desipramine and reboxetine on locus coeruleus neurons in rat brain slices". Neuropharmacology. 46 (6): 815–823. doi:10.1016/j.neuropharm.2003.11.033. PMID 15033341. S2CID 13228862.
- ^ Pacher P, Kecskemeti V (2004). "Cardiovascular side effects of new antidepressants and antipsychotics: new drugs, old concerns?". Current Pharmaceutical Design. 10 (20): 2463–2475. doi:10.2174/1381612043383872. PMC 2493295. PMID 15320756.
- ^ a b Brunello N, Mendlewicz J, Kasper S, Leonard B, Montgomery S, Nelson J, et al. (October 2002). "The role of noradrenaline and selective noradrenaline reuptake inhibition in depression". European Neuropsychopharmacology. 12 (5): 461–475. doi:10.1016/s0924-977x(02)00057-3. PMID 12208564. S2CID 7989883.
- ^ a b Stahl SM, Grady MM, Moret C, Briley M (September 2005). "SNRIs: their pharmacology, clinical efficacy, and tolerability in comparison with other classes of antidepressants". CNS Spectrums. 10 (9): 732–747. doi:10.1017/S1092852900019726. PMID 16142213. S2CID 40022100.
- ^ a b c Lemke TL, Williams DA, Roche VF, Zito SW (2008). Foye's principles of medicinal chemistry (6th ed.). USA: Lippincott Williams & Wilkins. pp. 547–67, 581–582.
- ^ a b c d e Brunton, L.L.; Lazo, J.S.; Parker, K.L., eds. (2006). Goodman & Gilman's: The Pharmacological Basis of Therapeutics (11 ed.). New York: McGraw-Hill.
- ^ Silverthorn, D.U., ed. (2007). Human Physiology (4 ed.). San Francisco: Pearson. pp. 383–384.
- ^ Nutt DJ, Forshall S, Bell C, Rich A, Sandford J, Nash J, Argyropoulos S (July 1999). "Mechanisms of action of selective serotonin reuptake inhibitors in the treatment of psychiatric disorders". European Neuropsychopharmacology. 9 (Suppl 3): S81–S86. doi:10.1016/S0924-977X(99)00030-9. PMID 10523062. S2CID 23634771.
- ^ Santarsieri D, Schwartz TL (2015). "Antidepressant efficacy and side-effect burden: a quick guide for clinicians". Drugs in Context. 4: 212290. doi:10.7573/dic.212290. PMC 4630974. PMID 26576188.
- ^ Clevenger SS, Malhotra D, Dang J, Vanle B, IsHak WW (January 2018). "The role of selective serotonin reuptake inhibitors in preventing relapse of major depressive disorder". Therapeutic Advances in Psychopharmacology. 8 (1): 49–58. doi:10.1177/2045125317737264. PMC 5761909. PMID 29344343.
- ^ a b Zeind C, Carvalho MG (2018). Applied Therapeutics: The Clinical Use of Drugs, 11e. Wolters Kluwer. pp. 1813–1833. ISBN 9781496318299.
- ^ a b c d Boot J, Cases M, Clark BP, Findlay J, Gallagher PT, Hayhurst L, et al. (February 2005). "Discovery and structure-activity relationships of novel selective norepinephrine and dual serotonin/norepinephrine reuptake inhibitors". Bioorganic & Medicinal Chemistry Letters. 15 (3): 699–703. doi:10.1016/j.bmcl.2004.11.025. PMID 15664840.
- ^ a b c Mahaney PE, Vu AT, McComas CC, Zhang P, Nogle LM, Watts WL, et al. (December 2006). "Synthesis and activity of a new class of dual acting norepinephrine and serotonin reuptake inhibitors: 3-(1H-indol-1-yl)-3-arylpropan-1-amines". Bioorganic & Medicinal Chemistry. 14 (24): 8455–8466. doi:10.1016/j.bmc.2006.08.039. PMID 16973367.
- ^ Mahaney PE, Gavrin LK, Trybulski EJ, Stack GP, Vu TA, Cohn ST, et al. (July 2008). "Structure-activity relationships of the cycloalkanol ethylamine scaffold: discovery of selective norepinephrine reuptake inhibitors". Journal of Medicinal Chemistry. 51 (13): 4038–4049. doi:10.1021/jm8002262. PMID 18557608.
- ^ a b c Chen C, Dyck B, Fleck BA, Foster AC, Grey J, Jovic F, et al. (February 2008). "Studies on the SAR and pharmacophore of milnacipran derivatives as monoamine transporter inhibitors". Bioorganic & Medicinal Chemistry Letters. 18 (4): 1346–1349. doi:10.1016/j.bmcl.2008.01.011. PMID 18207394.
- ^ a b c Tamiya J, Dyck B, Zhang M, Phan K, Fleck BA, Aparicio A, et al. (June 2008). "Identification of 1S,2R-milnacipran analogs as potent norepinephrine and serotonin transporter inhibitors". Bioorganic & Medicinal Chemistry Letters. 18 (11): 3328–3332. doi:10.1016/j.bmcl.2008.04.025. PMID 18445525.
- ^ Vu AT, Cohn ST, Terefenko EA, Moore WJ, Zhang P, Mahaney PE, et al. (May 2009). "3-(Arylamino)-3-phenylpropan-2-olamines as a new series of dual norepinephrine and serotonin reuptake inhibitors". Bioorganic & Medicinal Chemistry Letters. 19 (9): 2464–2467. doi:10.1016/j.bmcl.2009.03.054. PMID 19329313.
- ^ Boot JR, Brace G, Delatour CL, Dezutter N, Fairhurst J, Findlay J, et al. (November 2004). "Benzothienyloxy phenylpropanamines, novel dual inhibitors of serotonin and norepinephrine reuptake". Bioorganic & Medicinal Chemistry Letters. 14 (21): 5395–5399. doi:10.1016/j.bmcl.2004.08.005. PMID 15454233.
- ^ Fish PV, Deur C, Gan X, Greene K, Hoople D, Mackenny M, et al. (April 2008). "Design and synthesis of morpholine derivatives. SAR for dual serotonin & noradrenaline reuptake inhibition". Bioorganic & Medicinal Chemistry Letters. 18 (8): 2562–2566. doi:10.1016/j.bmcl.2008.03.050. PMID 18387300.
- ^ a b Papakostas GI, Thase ME, Fava M, Nelson JC, Shelton RC (December 2007). "Are antidepressant drugs that combine serotonergic and noradrenergic mechanisms of action more effective than the selective serotonin reuptake inhibitors in treating major depressive disorder? A meta-analysis of studies of newer agents". Biological Psychiatry. 62 (11): 1217–1227. doi:10.1016/j.biopsych.2007.03.027. PMID 17588546. S2CID 45621773.
- ^ Nemeroff CB, Thase ME (2007). "A double-blind, placebo-controlled comparison of venlafaxine and fluoxetine treatment in depressed outpatients". Journal of Psychiatric Research. 41 (3–4): 351–359. doi:10.1016/j.jpsychires.2005.07.009. PMID 16165158.
- ^ Marks DM, Shah MJ, Patkar AA, Masand PS, Park GY, Pae CU (December 2009). "Serotonin-norepinephrine reuptake inhibitors for pain control: premise and promise". Current Neuropharmacology. 7 (4): 331–336. doi:10.2174/157015909790031201. PMC 2811866. PMID 20514212.
- ^ Beesdo K, Hartford J, Russell J, Spann M, Ball S, Wittchen HU (December 2009). "The short- and long-term effect of duloxetine on painful physical symptoms in patients with generalized anxiety disorder: results from three clinical trials". Journal of Anxiety Disorders. 23 (8): 1064–1071. doi:10.1016/j.janxdis.2009.07.008. PMID 19643572.
- ^ Sansone RA, Sansone LA (June 2011). "SNRIs pharmacological alternatives for the treatment of obsessive compulsive disorder?". Innovations in Clinical Neuroscience. 8 (6): 10–14. PMC 3140892. PMID 21779536.
- ^ Troy SM, Parker VP, Hicks DR, Pollack GM, Chiang ST (October 1997). "Pharmacokinetics and effect of food on the bioavailability of orally administered venlafaxine". Journal of Clinical Pharmacology. 37 (10): 954–961. doi:10.1002/j.1552-4604.1997.tb04270.x. PMID 9505987. S2CID 33518952.
- ^ Wichniak A, Wierzbicka A, Walęcka M, Jernajczyk W (August 2017). "Effects of Antidepressants on Sleep". Current Psychiatry Reports. 19 (9): 63. doi:10.1007/s11920-017-0816-4. PMC 5548844. PMID 28791566.
- ^ "Helpful for chronic pain in addition to depression". Mayo Clinic. Retrieved 2019-10-24.
- ^ Moncrieff, Joanna; Cooper, Ruth E.; Stockmann, Tom; Amendola, Simone; Hengartner, Michael P.; Horowitz, Mark A. (2022-07-20). "The serotonin theory of depression: a systematic umbrella review of the evidence". Molecular Psychiatry: 1–14. doi:10.1038/s41380-022-01661-0. ISSN 1476-5578. PMID 35854107. S2CID 250646781.
- ^ Nutt DJ (2008). "Relationship of neurotransmitters to the symptoms of major depressive disorder". The Journal of Clinical Psychiatry. 69 Suppl E1: 4–7. PMID 18494537.
- ^ Sindrup SH, Otto M, Finnerup NB, Jensen TS (June 2005). "Antidepressants in the treatment of neuropathic pain". Basic & Clinical Pharmacology & Toxicology. 96 (6): 399–409. doi:10.1111/j.1742-7843.2005.pto_96696601.x. PMID 15910402.
- ^ Shelton RC, Miller AH (2011). "Inflammation in depression: is adiposity a cause?". Dialogues in Clinical Neuroscience. 13 (1): 41–53. doi:10.31887/DCNS.2011.13.1/rshelton. PMC 3181969. PMID 21485745.
- ^ a b Tynan RJ, Weidenhofer J, Hinwood M, Cairns MJ, Day TA, Walker FR (March 2012). "A comparative examination of the anti-inflammatory effects of SSRI and SNRI antidepressants on LPS stimulated microglia". Brain, Behavior, and Immunity. 26 (3): 469–479. doi:10.1016/j.bbi.2011.12.011. PMID 22251606. S2CID 39281923.
- ^ "Cambridge University Press - Service Announcement".
- ^ Lambert O, Bourin M (November 2002). "SNRIs: mechanism of action and clinical features". Expert Review of Neurotherapeutics. 2 (6): 849–858. doi:10.1586/14737175.2.6.849. PMID 19810918. S2CID 37792842.
- ^ a b c d "Pristiq Extended-Release- desvenlafaxine succinate tablet, extended release". DailyMed. 25 March 2022. Retrieved 12 February 2023.
- ^ a b c d e "Effexor XR- venlafaxine hydrochloride capsule, extended release". DailyMed. 29 August 2022. Retrieved 12 February 2023.
- ^ a b c d e "Savella- milnacipran hydrochloride tablet, film coated Savella- milnacipran hydrochloride kit". DailyMed. 23 December 2022. Retrieved 12 February 2023.
- ^ a b Raouf M, Glogowski AJ, Bettinger JJ, Fudin J (August 2017). "Serotonin-norepinephrine reuptake inhibitors and the influence of binding affinity (Ki) on analgesia". Journal of Clinical Pharmacy and Therapeutics. 42 (4): 513–517. doi:10.1111/jcpt.12534. PMID 28503727.
- ^ a b c Upadhyaya HP, Desaiah D, Schuh KJ, Bymaster FP, Kallman MJ, Clarke DO, et al. (March 2013). "A review of the abuse potential assessment of atomoxetine: a nonstimulant medication for attention-deficit/hyperactivity disorder". Psychopharmacology. Springer Nature. 226 (2): 189–200. doi:10.1007/s00213-013-2986-z. PMC 3579642. PMID 23397050.
- ^ Roth BL, Driscol J (Dec 2012). "PDSP Ki Database". Psychoactive Drug Screening Program (PDSP). University of North Carolina at Chapel Hill and the United States National Institute of Mental Health. Retrieved 7 July 2018.
- ^ a b Boyer EW, Shannon M (March 2005). "The serotonin syndrome". The New England Journal of Medicine. 352 (11): 1112–1120. doi:10.1056/NEJMra041867. PMID 15784664. S2CID 37959124.
- ^ Zhong Z, Wang L, Wen X, Liu Y, Fan Y, Liu Z (November 2017). "A meta-analysis of effects of selective serotonin reuptake inhibitors on blood pressure in depression treatment: outcomes from placebo and serotonin and noradrenaline reuptake inhibitor controlled trials". Neuropsychiatric Disease and Treatment. 13: 2781–2796. doi:10.2147/NDT.S141832. PMC 5683798. PMID 29158677.
- ^ McIntyre RS et al. 둘록세틴의 간 안전성 프로필: 리뷰. 전문가 오피 드럭 메타톡시올. 2008;4(3):281–285.
- ^ Mladěnka P, Applová L, Patočka J, Costa VM, Remiao F, Pourová J, et al. (July 2018). "Comprehensive review of cardiovascular toxicity of drugs and related agents". Medicinal Research Reviews. 38 (4): 1332–1403. doi:10.1002/med.21476. PMC 6033155. PMID 29315692.
- ^ "SNRI Antidepressants". poison.org. Retrieved 2019-10-21.
- ^ Versiani M, Cassano G, Perugi G, Benedetti A, Mastalli L, Nardi A, Savino M (January 2002). "Reboxetine, a selective norepinephrine reuptake inhibitor, is an effective and well-tolerated treatment for panic disorder". The Journal of Clinical Psychiatry. 63 (1): 31–37. doi:10.4088/jcp.v63n0107. PMID 11838623.
- ^ Olivier JD, Olivier B (2019-09-01). "Antidepressants and Sexual Dysfunctions: a Translational Perspective". Current Sexual Health Reports. 11 (3): 156–166. doi:10.1007/s11930-019-00205-y.
- ^ Clayton AH, Montejo AL (2006). "Major depressive disorder, antidepressants, and sexual dysfunction". The Journal of Clinical Psychiatry. 67 (Suppl 6): 33–37. PMID 16848675.
- ^ a b Jing E, Straw-Wilson K (July 2016). "Sexual dysfunction in selective serotonin reuptake inhibitors (SSRIs) and potential solutions: A narrative literature review". The Mental Health Clinician. 6 (4): 191–196. doi:10.9740/mhc.2016.07.191. PMC 6007725. PMID 29955469.
- ^ "Serotonin syndrome: Preventing, recognizing, and treating it". www.mdedge.com. Retrieved 2019-11-21.
- ^ a b Frank C (July 2008). "Recognition and treatment of serotonin syndrome". Canadian Family Physician. 54 (7): 988–992. PMC 2464814. PMID 18625822.
- ^ "SNRI Antidepressants". poison.org. Retrieved 2019-10-23.
- ^ Tint A, Haddad PM, Anderson IM (May 2008). "The effect of rate of antidepressant tapering on the incidence of discontinuation symptoms: a randomised study". Journal of Psychopharmacology. 22 (3): 330–332. doi:10.1177/0269881107081550. PMID 18515448. S2CID 145217439.
- ^ a b Cochran KA, Cavallari LH, Shapiro NL, Bishop JR (August 2011). "Bleeding incidence with concomitant use of antidepressants and warfarin". Therapeutic Drug Monitoring. 33 (4): 433–438. doi:10.1097/FTD.0b013e318224996e. PMC 3212440. PMID 21743381.
- ^ Cheng YL, Hu HY, Lin XH, Luo JC, Peng YL, Hou MC, et al. (November 2015). "Use of SSRI, But Not SNRI, Increased Upper and Lower Gastrointestinal Bleeding: A Nationwide Population-Based Cohort Study in Taiwan". Medicine. 94 (46): e2022. doi:10.1097/MD.0000000000002022. PMC 4652818. PMID 26579809.
- ^ Curr Neurol, Neurosci Rep. (2022). "Visual Snow: Updates on Pathology". Current Neurology and Neuroscience Reports. National Institutes of Health. 22 (3): 209–217. doi:10.1007/s11910-022-01182-x. PMC 8889058. PMID 35235167.
- ^ "Duloxetine: Drug Information". UpToDate. Retrieved 28 June 2012.
- ^ Perahia DG, Pritchett YL, Kajdasz DK, Bauer M, Jain R, Russell JM, et al. (January 2008). "A randomized, double-blind comparison of duloxetine and venlafaxine in the treatment of patients with major depressive disorder". Journal of Psychiatric Research. 42 (1): 22–34. doi:10.1016/j.jpsychires.2007.01.008. PMID 17445831.
- ^ Wilson E, Lader M (December 2015). "A review of the management of antidepressant discontinuation symptoms". Therapeutic Advances in Psychopharmacology. 5 (6): 357–368. doi:10.1177/2045125315612334. PMC 4722507. PMID 26834969.
- ^ Fava GA, Benasi G, Lucente M, Offidani E, Cosci F, Guidi J (2018). "Withdrawal Symptoms after Serotonin-Noradrenaline Reuptake Inhibitor Discontinuation: Systematic Review". Psychotherapy and Psychosomatics. 87 (4): 195–203. doi:10.1159/000491524. PMID 30016772.
- ^ Fava GA, Benasi G, Lucente M, Offidani E, Cosci F, Guidi J (2018). "Withdrawal Symptoms after Serotonin-Noradrenaline Reuptake Inhibitor Discontinuation: Systematic Review". Psychotherapy and Psychosomatics. 87 (4): 195–203. doi:10.1159/000491524. hdl:2158/1132671. PMID 30016772. S2CID 51677365.
- ^ Taylor D, Lenox-Smith A, Bradley A (June 2013). "A review of the suitability of duloxetine and venlafaxine for use in patients with depression in primary care with a focus on cardiovascular safety, suicide and mortality due to antidepressant overdose". Therapeutic Advances in Psychopharmacology. 3 (3): 151–161. doi:10.1177/2045125312472890. PMC 3805457. PMID 24167687.
- ^ Simon LV, Hashmi MF, Keenaghan M (2019). "Serotonin Syndrome". StatPearls. StatPearls Publishing. PMID 29493999. Retrieved 2019-11-21.
- ^ "2009 Top 200 branded drugs by total prescriptions" (PDF). SDI/Verispan, VONA, full year 2009. www.drugtopics.com. Archived from the original (PDF) on 14 July 2011. Retrieved 6 April 2011.
- ^ Llorca PM, Fernandez JL (April 2007). "Escitalopram in the treatment of major depressive disorder: clinical efficacy, tolerability and cost-effectiveness vs. venlafaxine extended-release formulation". International Journal of Clinical Practice. 61 (4): 702–710. doi:10.1111/j.1742-1241.2007.01335.x. PMID 17394446.
- ^ a b Dubovicky M, Belovicova K, Csatlosova K, Bogi E (September 2017). "Risks of using SSRI / SNRI antidepressants during pregnancy and lactation". Interdisciplinary Toxicology. 10 (1): 30–34. doi:10.1515/intox-2017-0004. PMC 6096863. PMID 30123033.
- ^ a b Strawn JR, Mills JA, Sauley BA, Welge JA (April 2018). "The Impact of Antidepressant Dose and Class on Treatment Response in Pediatric Anxiety Disorders: A Meta-Analysis". Journal of the American Academy of Child and Adolescent Psychiatry. 57 (4): 235–244.e2. doi:10.1016/j.jaac.2018.01.015. PMC 5877120. PMID 29588049.
- ^ Emslie GJ, Heiligenstein JH, Wagner KD, Hoog SL, Ernest DE, Brown E, et al. (October 2002). "Fluoxetine for acute treatment of depression in children and adolescents: a placebo-controlled, randomized clinical trial". Journal of the American Academy of Child and Adolescent Psychiatry. 41 (10): 1205–1215. doi:10.1097/00004583-200210000-00010. PMID 12364842. S2CID 29031880.
- ^ Mulsant BH, Blumberger DM, Ismail Z, Rabheru K, Rapoport MJ (August 2014). "A systematic approach to pharmacotherapy for geriatric major depression". Clinics in Geriatric Medicine. 30 (3): 517–534. doi:10.1016/j.cger.2014.05.002. PMC 4122285. PMID 25037293.
- ^ Ferreira GE, Abdel-Shaheed C, Underwood M, Finnerup NB, Day RO, McLachlan A, et al. (February 2023). "Efficacy, safety, and tolerability of antidepressants for pain in adults: overview of systematic reviews". BMJ. 380: e072415. doi:10.1136/bmj-2022-072415. PMC 9887507. PMID 36725015.
