고리형 아데노신 일인산
Cyclic adenosine monophosphate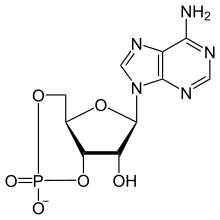 | |
 | |
| 이름 | |
|---|---|
| 우선 IUPAC 이름 (4aR, 6R, 7R, 7aS)-6-(6-아미노-9H-푸린-9-일)-2,7-디히드록시테트라히드로-2H,4H-2γ-푸로5[3,2-d][1,3,2] 다이옥사포스핀-2-온 | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 첸블 | |
| 켐스파이더 | |
| 드러그뱅크 | |
| ECHA 정보 카드 | 100.000.448 |
| 케그 | |
| 메쉬 | 사이클+AMP |
PubChem CID | |
| 유니 | |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| 동작하지101156 않다 | |
| 몰 질량 | 329.165g/140 |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
고리형 아데노신 일인산(cAMP, 고리형 AMP, 또는 3', 5'-고리형 아데노신 일인산)은 많은 생물학적 과정에서 중요한 두 번째 전달자이다.cAMP는 아데노신 삼인산(ATP)의 유도체로 많은 다른 유기체의 세포내 신호 전달에 사용되며 CAMP의존 경로를 전달한다.
역사
밴더빌트 대학의 얼 서덜랜드는 1971년 "호르몬, 특히 에피네프린의 작용 메커니즘에 관한 발견"으로 노벨 생리의학상을 받았다.
합성
고리형 AMP는 혈장막의 안쪽에 위치한 아데닐산환원효소에 의해 ATP로부터 합성되며 [1]세포 내부의 다양한 위치에 고정된다.아데닐산 시클라아제는 아데닐산 시클라아제 자극성 G(Gs)-단백질 결합 수용체의 활성화를 통해 일련의 시그널링 분자에 의해 활성화된다.아데닐산 시클라아제는 아데닐산 시클라아제 억제제 G(Gi)-단백질 결합 수용체의 작용제에 의해 억제된다.간 아데닐산 시클라아제는 글루카곤에 더 강하게 반응하고 근육 아데닐산 시클라아제는 아드레날린에 더 강하게 반응한다.
AMP로의 cAMP 분해는 포스포디에스테라아제 효소에 의해 촉매된다.
기능들
cAMP는 혈장막을 통과할 수 없는 글루카곤과 아드레날린과 같은 호르몬의 효과를 세포에 전달하는 것과 같은 세포 내 신호 전달에 사용되는 두 번째 메신저입니다.또한 단백질 키나아제 활성화에도 관여한다.또한 cAMP는 HCN 채널과 같은 이온 채널과 Epac1 및 RAPGEF2와 같은 몇 가지 다른 고리형 뉴클레오티드 결합 단백질에 결합하고 기능을 조절한다.
진핵세포에서의 역할
cAMP는 글리코겐, 당, 지질 [2]대사 조절을 포함한 여러 생화학 과정에서 키나아제 기능과 관련이 있다.
진핵생물에서, 고리형 AMP는 단백질 키나제 A(PKA, 또는 cAMP 의존성 단백질 키나제)를 활성화함으로써 작동한다.PKA는 일반적으로 2개의 촉매 및 2개의 조절 단위(CR)로22 구성된 4중합체 홀로엔자임으로 비활성화되며 조절 단위는 촉매 단위의 촉매 중심을 차단합니다.
고리형 AMP는 단백질 인산화효소의 조절 단위에서 특정 위치에 결합하고 조절 단위와 촉매 서브 단위 사이의 해리를 유발하여 이러한 촉매 단위들이 기질 단백질을 인산화시킬 수 있게 한다.
활성 서브유닛은 ATP에서 단백질 기질의 특정 세린 또는 트레오닌 잔기로의 인산염 전달을 촉매한다.인산화 단백질은 세포의 이온 채널에 직접 작용하거나 활성화되거나 억제된 효소가 될 수 있습니다.단백질 키나제 A는 또한 DNA의 프로모터 영역에 결합하는 특정 단백질을 인산화하여 전사의 증가를 야기할 수 있다.모든 단백질 키나아제들이 cAMP에 반응하는 것은 아니다. 단백질 키나아제 C를 포함한 여러 종류의 단백질 키나아제들은 cAMP에 의존하지 않는다.
추가 효과는 주로 cAMP 의존성 단백질 키나제에 의존하며, 이는 세포 유형에 따라 다르다.
그러나 성장호르몬 방출 호르몬이 성장호르몬의 분비를 일으키는 작은 경로를 제공하는 칼슘 채널의 활성화와 같은 몇 가지 사소한 PKA 비의존적 기능이 있다.
그러나 cAMP 효과의 대부분이 PKA에 의해 제어된다는 관점은 시대에 뒤떨어진 것이다.1998년 구아닌뉴클레오티드교환인자(GEF) 활성을 가진 cAMP 감수성 단백질군이 발견되었다.이들은 cAMP(Epac)에 의해 활성화된 교환 단백질이라고 불리며, Epac1과 Epac2로 구성된다.[3]활성화 메커니즘은 PKA와 비슷합니다.GEF 도메인은 보통 cAMP 바인딩 도메인을 포함하는 N 터미널 영역에 의해 마스크됩니다.cAMP가 결합하면 도메인은 현재 활성화된 GEF 도메인을 분리하여 노출하고 Epac은 Rap1과 같은 작은 Ras 유사 GTPase 단백질을 활성화할 수 있습니다.
사회적 아메바에서 분비되는 cAMP의 추가적인 역할
dictyostelium discoideum 종에서 cAMP는 세포 밖에서 분비 신호로 작용한다.세포의 화학적 집적은 수 센티미터의 거리에 걸쳐 세포 간에 전파되는 cAMP의 주기적인 파동에 의해 구성된다.파동은 세포외 cAMP의 조절된 생산과 분비의 결과이며 영역 [4]중심에서 파동을 일으키는 자발적인 생물학적 발진기의 결과입니다.
세균의 역할
박테리아에서 cAMP의 수치는 성장에 사용되는 배지에 따라 달라집니다.특히 포도당이 탄소원일 때 cAMP는 낮다.이는 세포 내 포도당 수송의 부작용으로 cAMP 생성 효소인 아데닐산 시클라아제의 억제를 통해 발생한다.CAP라고도 불리는 전사인자 cAMP수용체단백질(CRP)은 cAMP와 복합체를 형성하여 DNA와 결합하도록 활성화된다.CRP-cAMP는 포도당의 에너지 의존적인 공급을 할 수 있는 일부 암호화 효소를 포함하여 다수의 유전자의 발현을 증가시킨다.
예를 들어 cAMP는 lac 오퍼론의 양성 조절에 관여합니다.포도당 농도가 낮은 환경에서는 cAMP가 전사활성화단백질인 CRP(cAMP 수용체단백질)에 축적되어 알로스테릭 부위에 결합한다.단백질은 활성 형태를 띠며 래크 프로모터의 상류 특정 부위에 결합하며, RNA 중합효소가 래크 오퍼론의 전사를 시작하기 쉽게 하여 래크 오퍼론 전사의 속도를 증가시킨다.포도당 농도가 높으면 cAMP 농도가 감소하고 CRP가 lac operon에서 분리됩니다.
병리학
순환 AMP는 두 번째 전달자로 세포 신호 전달에 중요한 역할을 하기 때문에 다양한 장애에 관여하고 있지만 아래에 제시된 역할에 국한되지는 않습니다.
인간 암종에서의 역할
일부 연구는 cAMP 경로의 규제 완화와 cAMP 제어 유전자의 비정상적인 활성화가 일부 [5][6][7]암의 성장과 관련이 있다고 제안했다.
전전두피질 장애의 역할
최근의 연구는 cAMP가 과분극 활성화 순환 뉴클레오티드 게이트 채널(HCN)이라고 불리는 이온 채널의 조절을 통해 전전두엽 피질의 고차적 사고 기능에 영향을 미친다는 것을 시사한다.cAMP가 HCN을 자극하면 채널이 열리고 뇌세포가 통신에 닫혀 전전두엽 피질의 기능을 방해합니다.이 연구, 특히 노화와 관련된 질병과 ADHD의 인지결손은 [8]뇌를 연구하는 연구원들에게 흥미롭다.
cAMP는 신경성 염증을 유발하고 [citation needed]편두통을 일으키는 삼민경 계통의 활성화에 관여한다.
감염성 질환의 발생에 대한 역할
cAMP의 기능 장애는 여러 박테리아 엑소톡신의 메커니즘 중 하나로 알려져 있다.
이러한 카테고리는,[9] 다음의 2개의 카테고리로 분류할 수 있습니다.
- ADP-리보실전달효소 및 ADP-리보실전달효소를 방해하는 독소
- 침습성 아데닐산환가수분해효소.
- 콜레라 독소는 5개의 B 아핀트와 1개의 A 아유닛을 가진 AB 독소이다.독소는 다음과 같은 메커니즘으로 작용합니다.우선 콜레라 독소의 B 서브유닛 고리는 표적세포 표면의 GM1 간글리오시드에 결합한다.만약 어떤 세포에 GM1이 없다면, 독소는 [10][11][12][9]지질 대신 단백질에 부착된 루이스 Y와 루이스 X와 같은 다른 종류의 글리칸과 결합할 가능성이 높다.
사용하다
Forskolin은 세포 [13]생리학 연구와 연구에서 cAMP의 수준을 높이기 위해 생화학에서 도구로 흔히 사용됩니다.
「 」를 참조해 주세요.
- 고리형 구아노신1인산(cGMP)
- 8-브로모아데노신3',5'-환일인산(8-Br-cAMP)
- Dictyostelium discoideum에서 화학작용에 특화된 아크라신.
- cAMP를 분해하는 포스포디에스테라아제4(PDE4)
레퍼런스
- ^ Rahman N, Buck J, Levin LR (November 2013). "pH sensing via bicarbonate-regulated "soluble" adenylate cyclase (sAC)". Front Physiol. 4: 343. doi:10.3389/fphys.2013.00343. PMC 3838963. PMID 24324443.
- ^ Ali ES, Hua J, Wilson CH, Tallis GA, Zhou FH, Rychkov GY, Barritt GJ (2016). "The glucagon-like peptide-1 analogue exendin-4 reverses impaired intracellular Ca2+ signalling in steatotic hepatocytes". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1863 (9): 2135–46. doi:10.1016/j.bbamcr.2016.05.006. PMID 27178543.
- ^ Bos, Johannes L. (December 2006). "Epac proteins: multi-purpose cAMP targets". Trends in Biochemical Sciences. 31 (12): 680–686. doi:10.1016/j.tibs.2006.10.002. PMID 17084085.
- ^ Anderson, Peter A. V. (2013-11-11). Evolution of the First Nervous Systems. Springer Science & Business Media. ISBN 978-1-4899-0921-3.
- ^ Abramovitch, Rinat; Tavor, Einat; Jacob-Hirsch, Jasmine; Zeira, Evelyne; Amariglio, Ninette; Pappo, Orit; Rechavi, Gideon; Galun, Eithan; Honigman, Alik (15 February 2004). "American Association for Cancer Research (cAMP-responsive Genes and Tumor Progression)". Cancer Research. 64 (4): 1338–1346. doi:10.1158/0008-5472.CAN-03-2089. PMID 14973073. S2CID 14047485.
- ^ Dumaz, Nicolas; Hayward, Robert; Martin, Jan; Ogilvie, Lesley; Hedley, Douglas; Curtin, John A.; Bastian, Boris C.; Springer, Caroline; Marais, Richard (October 2006). "American Association for Cancer Research (cAMP Dysregulation and Melonoma)". Cancer Research. 66 (19): 9483–9491. doi:10.1158/0008-5472.CAN-05-4227. PMID 17018604.
- ^ Simpson, B. J.; Ramage, A. D.; Hulme, M. J.; Burns, D. J.; Katsaros, D.; Langdon, S. P.; Miller, W. R. (January 1996). "American Association for Cancer Research (cAMP-binding Proteins' Presence in Tumors)". Clinical Cancer Research. 2 (1): 201–206.
- ^ "ScienceDaily ::Brain Networks Strengthened By Closing Ion Channels, Research Could Lead To ADHD Treatment".
- ^ a b Kather, H; Aktories, K (November 15, 1983). "cAMP-System und bakterielle Toxine [The cAMP system and bacterial toxins]". Klin Wochenschr. doi:10.1007/BF01530837. PMID 6317939. Retrieved February 26, 2022.
- ^ Amberlyn M Wands; Akiko Fujita (October 2015). "Fucosylation and protein glycosylation create functional receptors for cholera toxin". eLife. doi:10.7554/eLife.09545.
- ^ Cervin J, Wands AM, Casselbrant A, Wu H, Krishnamurthy S, Cvjetkovic A, et al. (2018) GM1 간글리오시드 비의존성 콜레라 독소에 의한 중독.PLoS 패스 로그 14 (2): e1006862.https://doi.org/10.1371/journal.ppat.1006862
- ^ 푸코실화 분자는 숙주 세포에 결합하는 콜레라 독소를 경쟁적으로 방해한다; Amberlyn M.완즈, 제이콥 서빈, 허황, 예장, 윤규상, 차드 A.브루티감, 마리아 맷슨 제보, 페르 비외르클룬드, 빌 왈레니우스, 다니엘 K.똑똑해, 클레이 S.Bennett, Pernilla Wittung-Stafshede, Nicole S. Sampson, Ulf Yrlid 및 Jennifer J. Kohler; ACS 전염병 기사: 10.1021/acsinfec.7b00085
- ^ Alasbahi, RH; Melzig, MF (January 2012). "Forskolin and derivatives as tools for studying the role of cAMP". Die Pharmazie. 67 (1): 5–13. PMID 22393824.