화학 요법
Chemotherapy| 화학 요법 | |
|---|---|
 | |
| 기타 이름 | 화학요법, CTX, CTx |
화학요법(흔히 화학요법, 때로는 CTX 또는 CTx)은 표준화된 화학요법의 일부로 하나 이상의 항암제(화학요법제)를 사용하는 암 치료의 한 종류이다.화학요법은 치료의 목적으로 제공되거나(거의 항상 약물의 조합을 포함한다), 수명을 연장하거나 증상을 감소시키는 것을 목표로 할 수 있다(잠정 화학요법).화학요법은 암의 약물요법을 전문으로 하는 의학 분야의 주요 범주 중 하나인데, 이것은 [1][2]의학 종양학이라고 불린다.
화학요법이라는 용어는 유사분열을 억제하거나 DNA 손상을 유도하기 위해 세포 내 독의 비특이적 사용을 암시하게 되었고, 이것이 DNA 수복의 억제가 화학요법을 [3]증가시킬 수 있는 이유이다.화학요법이라는 단어의 함축적 의미는 세포 외 신호(신호 전달)를 차단하는 보다 선택적인 물질을 제외한다.고전적인 내분비 호르몬(주로 유방암의 경우 에스트로겐, 전립선암의 경우 안드로겐)의 성장 촉진 신호를 억제하는 특정 분자 또는 유전적 대상을 가진 치료법의 개발은 현재 호르몬 치료법이라고 불립니다.반면, 수용체 티로신 키나아제와 관련된 것과 같은 성장 신호의 다른 억제들은 표적 치료라고 한다.
중요한 것은 약물(화학요법, 호르몬요법 또는 표적요법)의 사용은 그것들이 혈류에 도입되어 원칙적으로 신체의 모든 해부학적 위치에서 암을 다룰 수 있다는 점에서 암의 전신요법을 구성한다.전신 치료는 방사선 치료, 수술 또는 온열 치료와 같은 암에 대한 국소 치료(즉, 효과가 적용되는 해부학적 영역에 국한된 치료)를 구성하는 다른 양식과 함께 종종 사용된다.
전통적인 화학 치료제는 세포 분열(유도증)을 방해함으로써 세포 독성이지만 암세포는 이러한 약물에 대한 감수성이 매우 다양하다.화학요법은 대체로 세포에 손상을 입히거나 스트레스를 주는 방법으로 생각될 수 있으며, 아포토시스가 시작되면 세포사멸로 이어질 수 있다.화학요법의 많은 부작용은 빠르게 분열되어 항유도제인 골수, 소화관, 모낭에 있는 세포에 대한 손상으로 추적될 수 있다.이것은 화학 요법의 가장 흔한 부작용을 낳는다: 골수 억제(혈구 생산 감소, 따라서 면역 억제), 점막염(소화관 내벽의 염증), 그리고 탈모증(탈모)면역 세포(특히 림프구)에 대한 영향 때문에, 화학 치료제는 종종 자신에 대한 면역 시스템의 해로운 과잉 활동에서 비롯되는 많은 질병에서 쓰입니다.류마티스 관절염, 전신성 홍반성 루푸스, 다발성 경화증, 혈관염 등이 이에 해당된다.
치료 전략
| 암의 종류 | 약품 | 약자 |
|---|---|---|
| 유방암 | 시클로포스파미드, 메토트렉세이트, 5-플루오로우라실, 비노렐빈 | CMF |
| 독소르비신, 시클로포스파미드 | AC | |
| 호지킨림프종 | 독소르비신, 시클로포스파미드 | TAC |
| 독소르비신, 블레오마이신, 빈블라스틴, 다카르바진 | ABVD | |
| 머스틴, 빈크리스틴, 프로카르바진, 프레드니솔론 | MOPP | |
| 비호지킨림프종 | 시클로포스파미드, 독소루비신, 빈크리스틴, 프레드니솔론 | 찹, R-CVP |
| 생식세포종양 | 블레오마이신, 에토포시드, 시스플라틴 | BEP |
| 위암[5] | 에피루비신, 시스플라틴, 5-플루오로우라실 | ECF |
| 에피루비신, 시스플라틴, 카페시타빈 | ECX | |
| 방광암 | 메토트렉세이트, 빈크리스틴, 독소르비신, 시스플라틴 | MVAC |
| 폐암 | 시클로포스파미드, 독소루비신, 빈크리스틴, 비노렐빈 | 캐비 |
| 대장암 | 5-글루아우라실, 폴리산, 옥살리플라틴 | FOLFOX |
| 췌장암 | 젬시타빈, 5-플루오로우라실 | FOLFOX |
| 뼈 암 | 독소루비신, 시스플라틴, 메토트렉세이트, 이포스파미드, 에토포시드 | 지도/지도 |
오늘날 사용되는 화학요법 약물의 투여에는 많은 전략이 있다.화학요법은 치료 목적으로 제공되거나 수명을 연장하거나 증상을 완화하는 것을 목표로 할 수 있다.
- 유도 화학요법은 화학요법 약물로 암을 치료하는 첫 번째 방법이다.이런 종류의 화학요법은 치료 [1][6]: 55–59 목적으로 사용된다.
- 복합형식화학요법은 수술, 방사선요법 또는 온열요법과 같은 다른 암치료와 함께 약물을 사용하는 것이다.
- 전반적인 무병 기간을 연장하고 전반적인 생존율을 높이기 위해 완치 후 강화화학요법을 시행한다.투여하는 약물은 [6]: 55–59 완화를 이룬 약물과 같다.
- 강화화학요법은 통합화학요법과 동일하지만 유도화학요법과는 다른 약물을 사용한다.[6]: 55–59
- 복합화학요법은 여러 가지 다른 약물로 사람을 동시에 치료하는 것을 포함한다.그 약들은 그 메커니즘과 부작용에 차이가 있다.가장 큰 장점은 한 에이전트에 대한 저항이 발생할 가능성을 최소화하는 것입니다.또한, 이 [6]: 55–59 [7]: 17–18 [5]약물은 종종 낮은 용량으로 사용되어 독성을 감소시킬 수 있다.
- Neoadjuvant 화학요법은 수술과 같은 국소적인 치료 전에 제공되며, 원발성 [6]: 55–59 종양을 수축시키기 위해 고안되었습니다.또한 미세암 [8]: 42 발병 위험이 높은 암에도 투여된다.
- 보조 화학요법은 국소 치료(방사선 치료 또는 수술) 후에 시행된다.암의 징후가 거의 없을 때 사용할 수 있지만 [6]: 55–59 재발 위험이 있습니다.그것은 또한 신체의 다른 부분으로 전이된 암세포를 죽이는 데 유용하다.이러한 마이크로메타아제들은 보조 화학요법으로 치료될 수 있고 이러한 확산된 [9]세포에 의해 야기되는 재발률을 감소시킬 수 있다.
- 항암화학요법은 [5][6]: 55–59 완화를 연장하기 위해 저용량 요법을 반복하는 것이다.
- 회수 화학요법이나 완화의 화학요법은 치료 목적 없이 단지 종양 부하를 줄이고 수명을 늘리기 위해 시행된다.이러한 요법의 경우 일반적으로 더 나은 독성 프로파일이 기대된다.[6]: 55–59
모든 화학요법 요법은 받는 사람이 치료를 받을 수 있어야 한다.성과 상태는 사람이 화학치료를 받을 수 있는지 또는 선량 감소가 필요한지 여부를 결정하는 척도로 종종 사용된다.각 치료(프랙셔널 킬)로 종양 내 세포의 일부만 사망하기 때문에 [10]종양의 크기를 계속 줄이기 위해 반복 투여해야 합니다.현재의 화학요법 요법은 [11]독성에 의해 치료 빈도와 기간이 제한되는 약물 치료를 주기적으로 적용한다.
효율성.
화학요법의 효율은 암의 종류와 단계에 따라 달라진다.전체적인 효과는 일부 백혈병과 [12][13]같은 일부 암을 치료하는 것에서부터 일부 [14]뇌종양과 같은 비효율적인 것, 그리고 대부분의 비흑색종 피부암과 [15]같은 다른 암에서는 불필요하게 되는 것까지 다양하다.
용량

화학요법의 복용량은 어려울 수 있다: 만약 그 복용량이 너무 낮으면, 종양에 대해 효과가 없는 반면, 과도한 복용량은 그것을 [4]받는 사람에게 견딜 수 없을 것이다.화학요법 용량을 결정하는 표준 방법은 계산된 BSA(Body Surface Area)를 기반으로 합니다.BSA는 일반적으로 신체 면적의 직접 측정이 아니라 수신자의 체중과 키를 사용하여 수학 공식이나 노모그램으로 계산됩니다.이 공식은 원래 1916년 연구에서 도출되었으며 실험실 동물과 설정된 약용량을 인간에 [16]대한 동등한 용량으로 변환하려고 시도했다.이번 연구에는 9명의 [17]피실험자만 포함됐다.1950년대에 화학요법이 도입되었을 때, BSA 공식은 더 나은 [18][19]선택지가 없다는 이유로 화학요법 투여의 공식 표준으로 채택되었다.
공식은 개인의 체중과 키만 고려하기 때문에 균일한 선량을 계산할 때 이 방법의 타당성에 의문이 제기되었다.약물 흡수 및 클리어런스는 연령, 성별, 대사, 질병 상태, 장기 기능, 약물 간 상호작용, 유전학 및 [18][20][21]비만을 포함한 여러 요인에 의해 영향을 받는다.그 결과, BSA에 의해 투여된 사람의 전신 화학요법 약물 농도는 높은 변동성이 있으며, 이 변동성은 많은 [17][22]약물에 대해 10배 이상인 것으로 입증되었다.즉, BSA에 근거해 2명이 같은 양의 약을 투여받는 경우, 한 사람의 혈류 중 그 약물의 농도는 다른 [22]사람에 비해 10배 이상 높거나 낮을 수 있다.이러한 변동성은 BSA에 의해 투여된 많은 화학요법 약물에 전형적이며, 아래와 같이 14개의 일반적인 화학요법 [17]약물에 대한 연구에서 입증되었다.
사람들 사이의 이러한 약동학적 변동의 결과는 많은 사람들이 독성 부작용을 최소화하면서 최적의 치료 효과를 얻기 위한 적절한 용량을 받지 못한다는 것이다.어떤 사람들은 과다복용되고 다른 사람들은 [18][20][21][23][24][25][26]과소복용된다.예를 들어, 무작위 임상 시험에서 연구자들은 5-플루오로라실(5-FU)로 치료된 전이성 대장암 환자의 85%가 BSA 표준에 의해 투여되었을 때 최적의 치료 용량을 받지 못했다는 것을 발견했다. 68%는 저투여되었고 17%는 과다 [23]투여되었다.
비만인 [27]사람들의 화학요법 선량을 계산하기 위해 BSA를 사용하는 것에 대해 논란이 있어왔다.BSA가 높기 때문에,[27] 임상의들은 종종 과다 복용을 우려하여 BSA 공식에 규정된 용량을 임의로 감소시킨다.대부분의 경우,[27] 이는 차선의 치료로 이어질 수 있습니다.
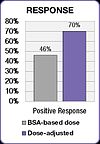
여러 임상 연구에서 화학요법 투여를 개별화하여 최적의 전신 약물 노출을 달성하면 치료 결과가 개선되고 독성 부작용이 [23][25]감소한다는 것이 입증되었다.앞서 인용한 5-FU 임상 연구에서 BSA에 [23]의해 투여된 환자보다 치료 응답률이 84% 향상되고 전체 생존(OS)이 6개월 향상되었습니다.

같은 연구에서 조사자는 선량 조정 대상자와 [23]BSA당 투여 대상자 사이의 일반적인 5-FU 관련 등급 3/4 독성 발생률을 비교했다.설사의 쇠약성 등급 발생률은 BSA 투여 그룹에서 18%에서 선량 조정 그룹에서 4%로 감소했고 심각한 혈액학적 부작용은 [23]제거되었다.독성이 감소했기 때문에 용량 조정 환자를 더 오랜 시간 [23]동안 치료할 수 있었다.BSA 투여자는 총 680개월 동안 치료를 받은 반면 선량 조정자 그룹은 총 791개월 [23]동안 치료를 받았다.치료 과정을 완료하는 것은 더 나은 치료 결과를 달성하는 데 중요한 요소입니다.
FOLFOX 요법으로 [25]치료를 받은 대장암 환자들에 대한 연구에서도 비슷한 결과가 발견되었다.심각한 설사 발병률은 BSA 투여 환자 그룹에서 12%에서 용량 조정 환자 그룹에서 1.7%로 감소했고, 심각한 점막염 발병률은 15%에서 [25]0.8%로 감소했다.
FOLFOX 연구는 또한 치료 [25]결과의 개선을 보여주었다.양성 반응은 BSA 투여 그룹에서 46%에서 선량 조정 그룹에서 70%로 증가했다.용량 조절 [25]그룹에서 중위수 진행 자유 생존(PFS)과 전체 생존(OS)이 모두 6개월 향상되었다.
임상의가 화학요법 투여를 개인화하는 데 도움이 될 수 있는 한 가지 접근법은 시간에 따른 혈장 내 약물 수준을 측정하고 최적의 노출을 달성하기 위해 공식 또는 알고리즘에 따라 선량을 조절하는 것이다.독성을 최소화하면서 치료 효과를 최적화하기 위해 설정된 목표 피폭을 통해 투여량을 개인화할 수 있으며 각 개인에 대한 목표 피폭과 최적의 결과를 달성할 수 있습니다.이러한 알고리즘은 위에서 언급한 임상시험에서 사용되었으며 치료 결과를 [citation needed]크게 향상시켰다.
종양학자들은 이미 노출을 기반으로 일부 암 약물의 투여량을 개인화하고 있다.카르보플라틴과[28]: 4 부술판[29][30] 투여는 혈액 검사 결과에 따라 각 개인에 대한 최적의 투여량을 계산한다.또한 메토트렉세이트,[31] 5-FU, 파클리탁셀 및 Docetaxel의 [32][33]선량 최적화를 위해 간단한 혈액 검사를 사용할 수 있습니다.
화학요법 투여 직전 혈청 알부민 수치는 다양한 암 [34]유형에서 생존에 대한 독립적인 예측 예측 변수이다.
종류들

알킬화제
알킬화제는 오늘날 사용되는 화학요법 중 가장 오래된 그룹이다.원래 제1차 세계대전에서 사용된 겨자 가스에서 유래된 알킬화제는 현재 [4]여러 종류가 사용되고 있다.그들은 단백질, RNA, DNA를 포함한 많은 분자들을 알킬화하는 능력 때문에 그렇게 이름 붙여졌다.그들의 알킬기를 통해 DNA에 공유 결합하는 이러한 능력은 그들의 항암 [36]효과의 주요 원인이다.DNA는 두 가닥으로 이루어지며 분자는 DNA의 한 가닥에 두 번 결합하거나 두 가닥에 한 번 결합할 수 있다(간선 교차 링크).만약 세포가 분열하는 동안 가교된 DNA를 복제하려고 시도하거나 복구하려고 하면, DNA 가닥이 끊어질 수 있습니다.이것은 [35][37]아포토시스라고 불리는 프로그램된 세포사멸의 형태로 이어진다.알킬화제는 세포 주기의 어느 지점에서나 작용하므로 세포 주기 비의존성 약물로 알려져 있다.이러한 이유로 세포에 대한 영향은 용량에 따라 달라지며, 죽은 세포의 비율은 [38]약물의 선량에 정비례한다.
알킬화제의 하위 유형은 질소 머스타드, 니트로소레아, 테트라진, 아지리딘,[39] 시스플라틴 및 유도체, 비고전적 알킬화제이다.질소 머스타드는 메클로로에타민, 시클로포스파미드, 멜파란, 클로람부실, 이포스파미드 및 부술판을 포함한다.N-니트로소-N-메틸우레아(MNU), 카르머스틴(BCNU), 로무스틴(CCNU) 및 세미스틴(MecCNU), 포테무스틴 및 스트렙토조토신을 포함한다.테트라진은 다카르바진, 미토졸로미드 및 테모졸로미드를 포함한다.아지리딘은 티오테파, 마이토마이신 및 디아지콘(AZQ)을 포함한다.시스플라틴 및 유도체는 시스플라틴, 카르보플라틴 [36][37]및 옥살리플라틴을 포함한다.그것들은 생물학적으로 중요한 [40]분자에서 아미노기, 카르복실기, 술프하이드릴기, 인산기와 공유 결합을 형성함으로써 세포 기능을 손상시킨다.비고전적 알킬화제는 프로카르바진 및 헥사메틸멜라민을 [36][37]포함한다.
대사 방지제
항대사물은 DNA와 RNA 합성을 방해하는 분자 그룹이다.그들 중 다수는 DNA와 RNA의 구성 요소와 유사한 구조를 가지고 있다.구성 요소는 뉴클레오티드이며, 핵염기, 당 및 인산염기로 구성된 분자입니다.핵산염기들은 퓨린과 피리미딘으로 나뉜다.항대사물은 핵염기 또는 뉴클레오사이드(인산염기가 없는 뉴클레오티드)와 유사하지만 화학군이 [41]변화한다.이들 약물은 DNA 합성에 필요한 효소를 차단하거나 DNA나 RNA에 결합함으로써 효과를 발휘하며, DNA 합성에 관여하는 효소를 억제함으로써 DNA가 복제되지 않기 때문에 유사분열을 예방한다.또, 분자가 DNA에 잘못 삽입된 후에는, DNA 손상이 발생할 가능성이 있어 프로그램 된 세포사망(아포토시스)이 유발된다.알킬화제와 달리 항대사물은 세포주기에 의존합니다.이것은 세포 주기의 특정 부분, 이 경우 S상(DNA 합성 단계)에서만 작동한다는 것을 의미합니다.이러한 이유로, 특정 용량에서 효과 평판과 비례적으로 선량이 증가하면 더 이상 세포사멸이 발생하지 않는다.항대사물의 아종은 항각질, 플루오로피리미딘, 디옥시뉴클레오시드 유사체 및 티오푸린이다.[36][41]
항각질제는 메토트렉세이트와 페메트렉세이트를 포함한다.메트렉세이트는 디히드로폴레이트로부터 테트라히드로폴산을 재생하는 효소인 디히드로폴산 환원효소(DHFR)를 억제한다.효소가 메토트렉세이트에 의해 억제되면 엽산 조효소의 세포 수준이 감소한다.이것들은 DNA 합성과 세포 [6]: 55–59 [7]: 11 분열을 위해 필수적인 티미딜산염과 푸린 생산에 필요하다.페메트렉스는 퓨린과 피리미딘 생산에 영향을 미쳐 DNA 합성을 저해하는 또 다른 항대사물입니다.티미딜레이트 합성효소를 주로 억제하지만 DHFR, 아미노이미다졸 카르복사미드 리보뉴클레오티드 포밀전달효소 및 글리신아미드 리보뉴클레오티드 [42]포밀전달효소에도 영향을 미친다.플루오로피리미딘은 플루오로우라실과 카페시타빈을 포함한다.플루오로우라실은 세포에서 대사되어 적어도 2개의 활성 생성물, 즉 5-플루오로-2'-디옥시우리딘 5'-인산(fdUMP)을 형성하는 핵염기 유사체이다.FUMP는 RNA에 통합되고 fdUMP는 티미딜산합성효소(tymidylate synthase)를 억제하며, 둘 다 세포사멸을 [7]: 11 초래한다.카페시타빈은 5-플루오로우라실의 프로드러그로서 세포에서 분해되어 활성 [43]약물을 생산합니다.디옥시뉴클레오시드 유사물은 시타라빈, 젬시타빈, 데시타빈, 아자시티딘, 플루다라빈, 넬라빈, 클래드리빈, 클로파라빈 및 펜토스타틴을 포함한다.티오푸린은 티오구아닌과 메르캅토푸린을 [36][41]포함한다.
항마이크로튜브제
항미소관제는 식물 유래 화학물질로 미세관 기능을 막아 세포 분열을 막는다.미세관은 α-튜브린과 β-튜브린의 두 가지 단백질로 구성된 중요한 세포 구조이다.그것들은 세포 분열과 다른 세포 [44]기능들에 필요한 속이 빈 막대 모양의 구조입니다.마이크로튜브는 동적인 구조이며, 이는 영구히 조립 및 분해 상태에 있음을 의미합니다.빈카 알칼로이드와 택산은 항미소관제의 두 가지 주요 그룹이며, 이 두 가지 약물 그룹이 모두 미소관 기능 장애를 유발하지만, 이들의 작용 메커니즘은 완전히 반대입니다.빈카 알칼로이드는 미세관 조립을 막는 반면, 택산은 미세관의 분해를 막는다.그렇게 함으로써, 그들은 암세포가 유사분열을 완성하는 것을 막는다.그 후 세포주기 정지가 일어나 프로그램된 세포사멸(아포토시스)[36][45]을 유도한다.이러한 약물은 또한 종양들이 자라고 [45]전이하기 위해 이용하는 필수적인 과정인 혈관 성장에 영향을 미칠 수 있습니다.
빈카 알칼로이드는 마다가스카르 근린클, 카타란투스 로제우스([46][47]이전에는 빈카 로제아로 알려져 있었다)에서 유래했다.그들은 튜브린의 특정 부위에 결합하여 튜브린이 미세관으로 모이는 것을 억제합니다.원래의 빈카 알칼로이드는 빈크리스틴과 빈블라스틴을 [48][49][50][51]포함한 천연 제품이다.이러한 약물의 성공에 따라 비노렐빈(비소세포 폐암[50][52][53] 치료에 사용), 빈데신, 빈플루닌 [45]등 반합성 빈카 알칼로이드가 생성되었다.이 약들은 세포주기에 따라 다르다.S상 Tubulin 분자에 결합하여 M상에 [38]필요한 적절한 미세관 형성을 방해한다.
택산은 천연 및 반합성 약품이다.그들 클래스의 첫 번째 약인 파클리탁셀은 원래 태평양 주목인 Taxus brevifolia에서 추출되었다.이 약과 이 클래스의 또 다른 약인 docetaxel은 다른 주목나무의 껍질에서 발견된 화학 물질로부터 반합성적으로 생산됩니다. Taxus baccata [citation needed]입니다.
포도필로톡신은 주로 미국산 마요플(Podophilum peltatum)과 히말라야 마요플(Sinopodophylum hexandrum)에서 얻은 항종양성 리그난이다.항미소관 활성을 가지며, 미세관 형성을 저해하는 점에서 빈카 알칼로이드와 메커니즘이 유사하다.포도필로톡신은 에토포시드와 테니포시드의 [54][55]서로 다른 작용 메커니즘을 가진 두 가지 다른 약물을 생산하는데 사용된다.
토포이소머라아제억제제
토포이소머라아제 억제제는 토포이소머라아제 I과 토포이소머라아제 II의 두 효소의 활성에 영향을 미치는 약물이다.DNA 이중 가닥 나선이 풀리면, 예를 들어, DNA 복제 또는 전사 중에, 인접한 열리지 않은 DNA는 꼬인 로프의 중앙을 여는 것처럼 더 조여집니다(슈퍼 코일).이 효과로 인한 스트레스는 부분적으로 토포이소머라아제 효소에 의해 도움을 받는다.그들은 DNA에 단일 또는 이중 가닥을 파괴하여 DNA 가닥의 장력을 감소시킵니다.이를 통해 복제 또는 전사 중에 DNA가 정상적으로 풀릴 수 있습니다.토포이소머라아제 I 또는 II의 억제는 이 두 [56][57]가지 과정을 모두 방해한다.
두 가지 토포이소머라아제 I 억제제인 이리노테칸과 토포테칸은 중국 관상수인 캄푸토테카 아쿠미나타에서 [38]얻은 캄푸토테신에서 반합성적으로 유도된다.토포이소머라아제 II를 표적으로 하는 약물은 두 그룹으로 나눌 수 있다.토포이소머라아제 II 독은 DNA에 결합하는 효소의 수치를 증가시킨다.이것은 DNA 복제와 전사를 방지하고, DNA 가닥의 파괴를 유발하며, 프로그램된 세포사멸(아포토시스)을 초래한다.이러한 약물은 에토포시드, 독소루비신, 미톡산트로네 및 테니포시드를 포함한다.두 번째 그룹인 촉매억제제는 토포이소머라아제 II의 활성을 차단하는 약물로 DNA가 제대로 풀리지 않기 때문에 DNA 합성과 번역을 방해한다.이 소분류는 노보비오신, 메르바론 및 아크라루비신을 포함하며, 이들은 또한 [58]다른 중요한 작용 메커니즘을 가지고 있다.
세포독성 항생제
세포독성 항생제는 다양한 작용 메커니즘을 가진 다양한 약품군이다.화학요법 적응증에서 공통되는 주제는 세포분열을 방해한다는 것이다.가장 중요한 하위 그룹은 안트라사이클린과 블레오마이신이다. 다른 두드러진 예로는 미토마이신 C와 악티노마이신이 [59]있다.
안트라사이클린 중 독소르비신 및 다우노르비신이 첫 번째이며, 스트렙토미세스페우세티우스균에서 얻은 것이다.[60]이들 화합물의 유도체에는 에피루비신 및 이다루비신이 포함된다.안트라사이클린 그룹에서 임상적으로 사용되는 다른 약물은 피라루비신, 아크라루비신 및 미톡산트론이다.[61]안트라사이클린의 메커니즘은 DNA 인터칼레이션(DNA의 두 가닥 사이에 분자가 삽입됨), 세포간 분자를 손상시키는 고반응성 유리기의 생성 및 토포이소머라아제 [62]억제를 포함합니다.
악티노마이신은 DNA를 중간 조정하고 RNA [63]합성을 방해하는 복합 분자입니다.
스트렙토마이세스 버티실러스로부터 분리된 글리코펩타이드인 블레오마이신은 또한 DNA를 중간 조정하지만, DNA를 손상시키는 활성산소를 생성한다.이것은 블레오마이신이 금속 이온에 결합하고 화학적으로 감소하며 [64][6]: 87 산소와 반응할 때 발생합니다.
미토마이신은 DNA를 [65]알킬화하는 능력을 가진 세포독성 항생제이다.
배달.
대부분의 화학 요법은 정맥 내 투여되지만, 많은 약물을 경구 투여할 수 있습니다(예: 멜팔란, 부술판, 카페시타빈).최근(2016년) 체계적 검토에 따르면, 구강 치료법은 환자와 치료 팀이 [66]치료 계획을 준수하고 지원해야 하는 추가적인 과제를 제시합니다.
혈관 접근 장치로 알려진 많은 정맥 내 약물 전달 방법이 있습니다.여기에는 날개 달린 주입 장치, 말초 정맥 카테터, 미드라인 카테터, 말초 삽입 중앙 카테터(PICC), 중앙 정맥 카테터 및 삽입식 포트가 포함됩니다.이 장치는 화학요법 치료 기간, 전달 방법 및 화학요법제의 종류에 [7]: 94–95 대해 다양한 용도로 사용됩니다.
사람에 따라 암, 암의 단계, 화학요법의 종류, 용량에 따라 정맥 화학요법을 입원 또는 외래에서 할 수 있다.지속적인, 빈번한 또는 장기적인 정맥 내 화학요법 투여를 위해 다양한 시스템을 혈관 구조에 외과적으로 삽입하여 [7]: 113–118 접근을 유지할 수 있습니다.일반적으로 사용되는 시스템은 Hickman 회선, Port-a-Cath 및 PICC 회선입니다.이것들은 감염 위험이 낮고 정맥염이나 삼출이 훨씬 덜하며 말초 캐뉴레를 [citation needed]반복적으로 삽입할 필요가 없다.
고립된 사지 관류([67]흔히 흑색종에서 사용됨) 또는[68] 간이나 폐에 화학 요법의 고립된 주입이 일부 종양을 치료하기 위해 사용되었습니다.이러한 접근법의 주된 목적은 과도한 전신 [69]손상을 일으키지 않고 매우 많은 양의 화학요법을 종양 부위에 전달하는 것입니다.이러한 접근법은 단독 전이 또는 제한 전이를 제어하는 데 도움이 될 수 있지만, 정의상 체계적이지 않기 때문에 분산 전이 또는 마이크로메타아제를 [citation needed]다루지 않는다.
5-플루오로우라실과 같은 국소 화학요법은 일부 비흑색종 피부암 [70]환자를 치료하기 위해 사용된다.
만약 암이 중추신경계에 관여하거나 뇌수막 질환과 함께 있다면, 뇌수막 내 화학요법을 [4]시행할 수 있다.
부작용
화학요법 기술은 사용되는 약의 종류에 따라 다양한 부작용을 가지고 있다.가장 흔한 약물은 주로 혈액 세포와 입, 위, 장에 늘어선 세포와 같은 신체의 빠른 분열 세포에 영향을 미친다.화학요법 관련 독성은 투여 후 몇 시간 또는 며칠 내에, 또는 만성적으로 몇 주에서 몇 [6]: 265 년 사이에 급격히 발생할 수 있습니다.
많은 경우, 치료 기간 동안 단식을 통해 부작용의 내성/감소 및 치료 효과의 증가가 사람과 동물 [71][72][73][74]실험 모두에서 관찰되었다.
면역억제 및 골수억제
사실상 모든 화학요법 요법은 종종 골수를 마비시키고 백혈구, 적혈구, 혈소판의 감소를 초래함으로써 면역체계의 저하를 야기할 수 있다.빈혈과 혈소판 감소는 수혈이 필요할 수 있다.호중구감소증(호중구 과립구수의 0.5x109/리터 이하 감소)은 합성 G-CSF(예를 들어 필라스팀, 레노그라팀)로 개선할 수 있다.
일부 요법에서 발생하는 매우 심각한 골수억제에서는 거의 모든 골수줄기세포(백혈구와 적혈구를 생산하는 세포)가 파괴되며, 이는 알로겐성 또는 자가 골수세포 이식이 필요하다는 것을 의미한다. (자기 BMT에서, 세포는 치료 전에 사람으로부터 제거되고 증식된 후 다시 주입된다.)fterward; 알로겐성 BMT에서는 공급원이 기증자이다.)하지만, 어떤 사람들은 골수에 [citation needed]대한 이러한 간섭 때문에 여전히 질병에 걸린다.
화학요법을 받는 사람들은 손을 씻고, 아픈 사람들을 피하고, 다른 감염을 줄이는 조치를 취하도록 권장되지만, 감염의 약 85%는 그 사람의 위장(구강 포함)과 [75]: 130 피부에 자연적으로 발생하는 미생물에 기인한다.이는 패혈증과 같은 전신 감염이나 단순 헤르페스, 대상포진 또는 헤르페스바이러스상 다른 [76]구성원과 같은 국소적 발병으로 나타날 수 있다.발열이나 감염 징후가 [77]나타나기 전에 퀴놀론이나 트리메토프림/술파메톡사졸과 같은 일반적인 항생제를 복용함으로써 질병과 사망 위험을 줄일 수 있습니다.퀴놀론은 주로 혈액암에 [77]효과적인 예방 효과를 보인다.그러나 일반적으로 항암화학요법으로 면역억제된 5명 중 항생제를 복용하는 5명당 1명의 발열을 예방할 수 있으며 항생제를 복용하는 34명당 1명의 사망을 [77]예방할 수 있다.면역체계가 매우 낮은 수준으로 억제되기 때문에 화학요법 치료가 연기되기도 한다.
일본에서는 화학요법을 [78]받는 사람들의 면역력 저하를 막기 위해 정부가 Trametes verscolor와 같은 약용 버섯의 사용을 승인했다.
트릴라시클리브는 화학요법에 의한 골수억제 예방을 위해 승인된 사이클린 의존성 키나제 4/6의 억제제이다.이 약은 [79]골수 기능을 보호하기 위해 화학요법 전에 투여된다.
호중구 감소성 장염
면역 억제 때문에, 호중구성 장염은 "화학 [80]요법의 생명을 위협하는 위장 합병증"이다.장티푸스는 메스꺼움, 구토, 설사, 팽창된 복부, 발열, 오한, 복통과 압통을 포함한 증상을 통해 나타날 수 있는 장내 감염이다.
장티푸스는 의학적 응급상황이다.그것은 매우 나쁜 예후를 가지고 있고 즉시 인지하고 적극적으로 [81]치료하지 않으면 종종 치명적이다.성공적인 치료는 높은 의심 지수를 제공하고 CT 스캔, 복잡하지 않은 경우에 대한 비수술적 치료, 그리고 때로는 [81]재발을 막기 위한 선택적인 우반맥전 절제술의 사용에 의해 제공되는 조기 진단에 달려 있습니다.
위장 장애
메스꺼움, 구토, 거식증, 설사, 복부경련, 변비는 빠르게 분열하는 세포를 [82]죽이는 화학요법 약물의 일반적인 부작용이다.영양실조와 탈수는 받는 사람이 충분히 먹거나 마시지 않거나 위장 손상으로 인해 자주 토할 때 발생할 수 있다.메스꺼움이나 속쓰림을 완화하기 위해 너무 많이 먹으면 체중이 급격히 감소하거나 때때로 체중이 증가할 수 있습니다.체중 증가는 또한 몇몇 스테로이드 약물에 의해 야기될 수 있다.이러한 부작용은 구토 방지 약물로 종종 감소하거나 없앨 수 있다.또한 저확도 증거는 프로바이오틱스가 화학요법 단독 [83]및 방사선요법과 관련된 설사의 예방 및 치료 효과가 있을 수 있음을 시사한다.그러나 설사와 붓기도 장티푸스의 증상이기 때문에 높은 의심지수는 적절하다. 이는 즉각적인 [citation needed]치료가 필요한 매우 심각하고 잠재적으로 생명을 위협할 수 있는 응급상황이다.
빈혈
빈혈은 골수 억제 화학 요법과 출혈, 혈구 파괴(용혈), 유전병, 신장 기능 장애, 영양 결핍 또는 만성 질환의 빈혈과 같은 가능한 암 관련 원인에 의해 야기되는 복합적인 결과일 수 있다.빈혈을 완화하는 치료법에는 혈액 생성을 촉진하는 호르몬(에스트로포이에틴),[84][85][86] 철분 보충제, 수혈 등이 있다.골수 억제 요법은 출혈을 쉽게 일으켜 빈혈로 이어질 수 있습니다.빠르게 분열하는 세포나 혈구를 죽이는 약물은 피 속의 혈소판의 수를 줄일 수 있으며, 이는 멍과 출혈을 일으킬 수 있다.혈소판 수혈을 통해 혈소판 수가 일시적으로 증가할 수 있으며 화학요법 중 혈소판 수를 증가시키는 새로운 약이 [87][88][89][90]개발되고 있다.때때로 혈소판 수치가 회복될 수 있도록 화학요법 치료가 연기되기도 한다.
피로는 암이나 그 치료의 결과일 수 있으며 치료 후 몇 개월에서 몇 년 동안 지속될 수 있습니다.피로의 한 가지 생리적인 원인은 빈혈로 화학요법, 수술, 방사선요법, 1차 및 전이성 질환 또는 영양 [91][92]고갈에 의해 발생할 수 있다.유산소 운동은 단단한 [93]종양을 가진 사람들의 피로를 줄이는데 이로운 것으로 밝혀졌다.
메스꺼움과 구토
메스꺼움과 구토는 암에 걸린 사람들과 그 가족들에게 가장 두려운 암 치료와 관련된 부작용 중 두 가지이다.1983년 코츠 외 연구진은 화학요법을 받은 사람들이 메스꺼움과 구토를 각각 가장 심각한 부작용 1위와 2위로 꼽은 것을 발견했다.이 시대에 고구토 유발제를 복용하는 사람들 중 20%가 치료를 [94]연기하거나 심지어 치료제를 거부했습니다.화학요법으로 인한 메스꺼움과 구토(CINV)는 많은 치료와 어떤 형태의 암에서 흔히 볼 수 있다.1990년대 이후, 몇 가지 새로운 종류의 구토학이 개발되고 상용화되었으며, 화학요법 요법의 거의 보편적인 표준이 되었고, 많은 사람들의 이러한 증상들을 성공적으로 관리하는데 도움을 주었다.이러한 불쾌하고 때로는 움츠러드는 증상을 효과적으로 조정하면 내성이 향상되고 전반적인 건강이 개선되어 치료 중단이 줄어들기 때문에 받는 사람의 삶의 질이 향상되고 치료 주기가 더욱 효율화됩니다.
탈모
탈모는 빠르게 분열하는 세포를 죽이는 화학 요법에 의해 야기될 수 있다; 다른 약물들은 머리카락을 가늘게 만들 수 있다.이것들은 대부분 일시적인 영향이다: 머리카락은 보통 마지막 치료 후 몇 주 후에 다시 자라기 시작하지만, 때로는 색깔, 질감, 두께 또는 스타일이 변화한다.때때로 머리카락은 다시 자란 후에 컬이 되는 경향이 있어 "화학적 컬"을 일으킨다.심각한 탈모는 독소루비신, 다우노루비신, 파클리탁셀, 도세탁셀, 시클로포스파미드, 이포스파미드, 에토포시드와 같은 약물과 함께 가장 자주 발생한다.영구적인 얇음이나 탈모는 일부 표준 화학요법 요법에 의해 발생할 수 있다.
화학요법으로 인한 탈모는 비안드로겐 메커니즘에 의해 발생하며, 탈모, 텔로겐 유출, 또는 그보다 더 자주 탈모증으로 나타날 수 있다.[95]그것은 보통 모낭의 높은 유사분열률로 인한 전신 치료와 관련이 있으며, 영구적인 경우가 [98]발생할 수 있지만 안드로겐성 [96][97]탈모보다 더 가역적이다.화학요법은 [99]남성보다 여성에게서 탈모를 더 자주 유발한다.
두피 냉각은 영구적인 탈모와 일시적인 탈모 모두를 예방하는 수단을 제공하지만, 이 방법에 대한 우려가 [100][101]제기되어 왔다.
이차 종양
항암화학요법이나 방사선요법에 성공한 후 2차 종양이 발생할 수 있다.가장 일반적인 2차 종양은 2차 급성 골수성 백혈병으로, 알킬화제 또는 토포이소머라아제 억제제를 [102]사용한 치료 후에 주로 발병한다.소아암 생존자는 치료 후 30년간 2차 [103]종양에 걸릴 확률이 일반인보다 13배 이상 높다.이 증가의 모든 것이 화학요법에 기인하는 것은 아니다.
불임
어떤 화학요법들은 생식선 독성이며 [104]불임의 원인이 될 수 있다.고위험 화학요법으로는 프로카르바진 및 시클로포스파미드, 이포스파미드, 부술판, 멜파란, 클로람부실, 클로르메틴 [104]등의 기타 알킬화 약물이 있다.중간 위험성이 있는 약물에는 시스플라틴 및 카르보플라틴과 [104]같은 독소르비신과 백금 유사체가 포함된다.한편 성선독성의 위험이 낮은 치료법에는 빈크리스틴, 빈블라스틴 등의 식물유도체, 브레오마이신, 닥티노마이신 등의 항생제, 메토렉세이트, 메르캅토푸린, 5-플루오로우라실 [104]등의 항대사물이 포함된다.
화학요법에 의한 여성 불임은 원시 모낭의 [105]상실에 의한 조기 난소 기능 상실보다 이차적인 것으로 보인다.이러한 손실은 반드시 화학요법제의 직접적인 영향은 아니지만 손상된 발육 [105]모낭을 대체하기 위한 성장 개시 속도가 증가했기 때문일 수 있다.
사람들은 화학요법 전에 정액, 난소 조직, 난모세포 또는 [106]배아의 저온 보존을 포함한 여러 가지 불임 보존 방법 중에서 선택할 수 있다.암 환자의 절반 이상이 노인이기 때문에, 이 부작용은 소수의 환자들에게만 관련이 있다.1999~2011년 프랑스의 한 연구에 따르면 여성에게 성선독성제를 투여하기 전 배아 동결은 34%의 환자에서 치료가 지연되고 27%의 생존자가 임신을 원하는 경우에서 정상 출산이 발생하며 추적 기간은 1년에서 [107]13년 사이이다.
잠재적 보호제 또는 감쇠제로는 GnRH 아날로그가 있으며, 여러 연구에서 인체 생체 내 보호 효과가 나타났지만 일부 연구에서는 그러한 효과가 나타나지 않는다.스핑고신-1-인산(S1P)도 유사한 효과를 보였지만 스핑고신-1-인산(S1P)의 스핑고신 아포토시스 경로를 억제하는 메커니즘은 화학요법 약물의 [108]아포토시스 작용을 방해할 수 있다.
조혈모세포이식의 컨디셔닝 요법인 화학요법에서는 중증 재생불량성 빈혈에 대해 시클로포스파미드만으로 컨디셔닝한 사람을 대상으로 한 연구결과, 이식 당시 26세 미만 모든 여성에서 난소 회복이 이루어졌으나 26세 [109]이상 여성 16명 중 5명만 난소 회복이 이루어졌다.
기형성
화학요법은 임신 중, 특히 임신 초기 3개월 동안 기형적이어서 화학요법 [110]중 이 기간의 임신이 발견되면 낙태가 권장된다.임신 2기와 3기 피폭은 일반적으로 기형성 위험과 인지 발달에 대한 역효과를 증가시키지 않지만, 임신과 태아 골수 [110]억제의 다양한 합병증의 위험을 증가시킬 수 있다.
이전에 화학요법이나 방사선요법을 받은 남성의 경우 치료 [110]후 임신한 자녀의 유전적 결함이나 선천적 기형이 증가하지 않는 것으로 보인다.보조 생식 기술 및 미세 조절 기술의 사용은 [110]이러한 위험을 증가시킬 수 있다.이전에 화학요법을 받은 여성에서는 유산 및 선천성 기형이 후속 [110]개념에서 증가하지 않는다.그러나 시험관내 수정과 배아 저온 보존이 치료 사이 또는 치료 직후에 시행될 경우 난모세포의 성장에 대한 유전적 위험이 존재하므로 아기를 [110]선별할 것을 권고하고 있다.
말초신경장애
화학요법을 받는 사람들의 30~40%가 화학요법으로 인한 말초신경병증(CIPN)을 경험하는데, 이는 진행성, 지속성, 종종 돌이킬 수 없는 질환으로, 손발에서 시작하여 때때로 팔과 [111]다리로 진행되는 통증, 따끔찍한 통증, 따끔거림, 저림, 추위를 유발한다.CIPN과 관련된 화학치료제는 탈리도마이드, 에피틸론, 빈카알칼로이드, 타키산, 프로테아솜 억제제 및 백금계 약물을 포함한다.[111][112]CIPN이 발생하는지, 어느 정도 발생하는지 여부는 약물의 선택, 사용기간, 총 섭취량 및 말초신경장애가 있는지 여부에 따라 결정됩니다.주로 감각적인 증상이지만, 운동 신경이나 자율 신경계에 영향을 [113]주는 경우도 있습니다.CIPN은 종종 첫 번째 화학요법 용량에 따르고 치료가 계속됨에 따라 심각도가 증가하지만, 이러한 진행은 대개 치료 완료 시 진정된다.백금을 기반으로 하는 약물은 예외입니다;[114] 이 약물을 사용하면 치료 종료 후 몇 달 동안 감각이 계속 저하될 수 있습니다.일부 CIPN은 되돌릴 [114]수 없는 것으로 보입니다.통증은 종종 약물이나 다른 치료로 다스릴 수 있지만 저림은 대개 [115]치료에 저항력이 있다.
인지 장애
화학요법을 받은 일부 사람들은 피로감이나 집중력이 떨어지는 것과 같은 비특이적인 신경인지 문제를 보고한다; 이것은 대중적 그리고 소셜 [116]미디어에서 "화학요법 후 인지 장애"라고 언급되기도 한다.
종양용해증후군
림프종, 기형종 및 일부 백혈병처럼 특히 큰 종양과 백혈구 수가 많은 암에서 일부 사람들은 종양 용융 증후군에 걸린다.암세포의 급속한 붕괴는 세포 내부에서 화학물질이 방출되는 원인이 된다.그 후 혈중 요산, 칼륨, 인산염이 많이 검출된다.높은 수준의 인산염은 2차 부갑상선 기능 저하증을 유발하여 혈액 내 칼슘 수치를 낮춥니다.이것은 신장 손상을 일으키고 높은 수준의 칼륨은 심장 부정맥을 일으킬 수 있다.예방이 가능하고 종종 큰 종양이 있는 사람들에게서 시작되지만,[7]: 202 이것은 치료하지 않고 방치하면 사망에 이를 수 있는 위험한 부작용이다.
장기 손상
강독성(심장 손상)은 안트라사이클린 약물(독소르비신, 에피루비신, 이다루비신 및 리포좀 독소르비신)의 사용으로 특히 두드러진다.이것의 원인은 세포 내의 활성산소의 생성과 그에 따른 DNA 손상 때문일 가능성이 높다.심장독성을 일으키지만 발병률이 낮은 다른 화학요법제로는 시클로포스파미드, 독세탁셀 및 클로파라빈이 [117]있다.
간독성(간 손상)은 많은 세포독성 약물에 의해 발생할 수 있다.간 손상에 대한 개인의 민감성은 암 자체, 바이러스성 간염, 면역 억제 및 영양 결핍과 같은 다른 요인에 의해 바뀔 수 있다.간 손상은 간세포 손상, 간정현파증후군(간정맥의 폐색), 담즙증(간에서 장으로 담즙이 흐르지 않는 곳), 간섬유증으로 [118][119]구성될 수 있다.
신독성(신장 손상)은 종양 용해 증후군에 의해 발생할 수 있으며 신장에 의한 약물 제거의 직접적인 영향도 있을 수 있습니다.다른 약물은 신장의 다른 부분에 영향을 미치며 독성은 증상이 없거나(피나 소변 검사에서만 볼 수 있음) 급성 신장 손상을 [120][121]일으킬 수 있습니다.
이독성(내이 손상)은 현기증, [122][123]현기증 등의 증상을 일으킬 수 있는 백금 약물의 일반적인 부작용이다.백금 유사체로 치료된 아이들은 [124][125][126]난청이 생길 위험이 있는 것으로 밝혀졌다.
기타 부작용
덜 흔한 부작용으로는 붉은 피부, 건조한 피부, 손상된 손톱, 건조한 입, 수분 유지, 그리고 성적 발기부전이 있다.일부 약물은 알레르기 또는 유사알레르기 반응을 일으킬 수 있다.
특정 화학 치료제는 심혈관 질환(예: 독소르비신), 간질성 폐 질환(예: 블레오마이신), 그리고 때때로 2차 신생물(예: 호지킨병에 대한 MOPP 치료)을 포함한 장기 특이적 독성과 관련이 있다.
손발 증후군은 세포독성 화학요법의 또 다른 부작용이다.
영양 문제는 또한 암환자의 진단과 화학요법을 통해 자주 나타난다.연구는 암 치료를 받고 있는 어린이와 젊은이들에게, 비경구 영양이 장 [127]영양에 비해 체중 증가와 칼로리 및 단백질 섭취 증가로 이어질 수 있음을 시사한다.
제한 사항
화학요법이 항상 효과가 있는 것은 아니며, 그것이 유용하다고 해도 암을 완전히 파괴하지는 않을 수도 있다.사람들은 종종 그것의 한계를 이해하지 못한다.난치병인 4기 암을 새로 진단받은 사람들을 대상으로 한 한 한 연구에서 폐암 환자의 3분의 2 이상과 대장암 환자의 5분의 4 이상이 여전히 화학요법이 [128]암을 치료할 수 있다고 믿었다.
혈액-뇌 장벽은 뇌에 화학요법을 전달하는 데 장애가 된다.이것은 뇌가 해로운 화학물질로부터 보호하기 위한 광범위한 시스템을 가지고 있기 때문입니다.약물 수송기는 뇌와 뇌혈관 세포에서 뇌척수액과 혈액순환으로 약물을 퍼낼 수 있다.이 수송기들은 대부분의 화학요법 약물을 배출하는데, 이것은 뇌종양 치료에 대한 그들의 효과를 감소시킨다.로무스틴이나 테모졸로마이드와 같은 작은 친유성 알킬화제만이 이 혈액-뇌 [129][130][131]장벽을 통과할 수 있다.
종양의 혈관은 정상 조직과 매우 다르다.종양이 자라면서 혈관에서 가장 멀리 떨어진 종양 세포는 산소 함량이 낮아진다.이것을 상쇄하기 위해 그들은 새로운 혈관이 자라나도록 신호를 보낸다.새로 형성된 종양 혈관 구조는 제대로 형성되지 않았고 종양의 모든 부위에 충분한 혈액을 공급하지 못한다.이것은 많은 약물이 [132]순환계에 의해 종양으로 전달되기 때문에 약물 전달과 관련된 문제로 이어진다.
저항
내성이 화학요법 약물의 치료 실패의 주요 원인이다.암에는 저항성의 몇 가지 가능한 원인이 있는데, 그 중 하나는 암세포 표면에 화학요법을 활발하게 세포 내부에서 외부로 이동시키는 작은 펌프의 존재이다.암세포는 화학요법으로부터 자신들을 보호하기 위해 p-글리코프로틴으로 알려진 많은 양의 펌프를 생산한다.p-글리코프로틴과 다른 화학요법 배출 펌프에 대한 연구는 현재 진행 중이다.p당단백질의 기능을 억제하는 약물에 대한 연구가 진행 중이지만 독성과 항암제와의 상호작용으로 인해 개발에 [133][134]어려움을 겪고 있다.저항의 또 다른 메커니즘은 유전자 증폭인데, 이것은 암세포에 의해 유전자의 여러 복사가 만들어지는 과정이다.이것은 복제에 관여하는 유전자의 발현을 감소시키는 약물의 효과를 극복한다.유전자의 더 많은 복제로, 그 약은 유전자의 모든 발현을 막을 수 없고, 따라서 세포는 그것의 증식 능력을 회복할 수 있다.암세포는 또한 아포토시스의 세포 경로에 결함을 일으킬 수 있다.대부분의 화학요법 약물이 이런 방식으로 암세포를 죽이기 때문에, 결함이 있는 아포토시스는 이러한 세포들의 생존을 가능하게 하여, 암세포들이 내성을 갖도록 한다.많은 화학요법 약품들은 또한 DNA 손상을 일으키는데, 이것은 DNA 복구를 수행하는 세포 내의 효소에 의해 회복될 수 있다.이 유전자들의 상향 조절은 DNA 손상을 극복하고 아포토시스의 유도를 막을 수 있다.튜불린과 같은 약물 표적 단백질을 생성하는 유전자의 돌연변이는 이러한 종류의 [135]약물에 대한 내성을 이끌어내면서 약물이 단백질에 결합하는 것을 막는 것이 발생할 수 있다.화학 요법에 사용되는 약물은 암세포를 죽일 수 있는 세포 스트레스를 유도할 수 있다; 하지만, 특정 조건 하에서, 세포 스트레스는 여러 종류의 [136]약물에 대한 내성을 가능하게 하는 유전자 발현 변화를 유도할 수 있다.폐암에서 전사인자 NFbB는 염증 [137][138][139]경로를 통해 화학요법에 대한 내성에 관여하는 것으로 생각된다.
세포독소제 및 표적치료제
표적 치료법은 세포독소의 사용으로 보이는 많은 문제들을 극복할 수 있는 비교적 새로운 종류의 암 치료제이다.그들은 두 그룹으로 나뉜다: 작은 분자와 항체.세포독소제의 사용으로 나타나는 엄청난 독성은 약물의 세포특이성 결여 때문이다.그들은 빠르게 분열하는 세포나 종양, 정상세포를 모두 죽일 것이다.표적 치료법은 암세포에 의해 이용되는 세포단백질이나 과정에 영향을 미치도록 고안되었다.이것은 다른 조직에 대한 상대적으로 낮은 선량과 함께 암 조직에 대한 높은 선량을 허용한다.부작용은 세포독성 화학요법에서 볼 수 있는 것보다 종종 덜 심각하지만 생명을 위협하는 효과가 발생할 수 있다.처음에, 표적 치료제는 하나의 단백질에 대해서만 선택되어야 했다.이제 그 약이 결합할 수 있는 단백질 표적이 종종 있다는 것은 명백하다.표적 치료의 예로는 만성 골수성 백혈병 및 일부 급성 림프아구성 백혈병 환자에게서 흔히 발견되는 유전적 병변인 필라델피아 염색체에서 생성된 BCR-ABL1 단백질이 있다.이 융합 단백질은 작은 분자 [140][141][142][143]약물인 이마티닙에 의해 억제될 수 있는 효소 활성을 가지고 있다.
작용 메커니즘
암은 악성 행동과 결합된 세포의 통제되지 않는 성장이다: 침입과 전이(다른 [144]특징들 중에서.그것은 유전적 민감성과 환경적 [145][146]요인 사이의 상호작용에 의해 발생한다.이러한 인자는 종양유전자(세포의 성장률을 조절하는 유전자)와 종양억제유전자(암 예방에 도움이 되는 유전자)에 유전자 돌연변이가 축적되어 암세포가 통제되지 않는 [147]: 93–94 성장과 같은 악성 특성을 갖게 한다.
넓은 의미에서, 대부분의 화학요법 약물은 빠르게 분열하는 세포를 효과적으로 목표로 하는 유사분열(세포 분열)을 손상시킴으로써 작용한다.이 약들은 세포에 손상을 주기 때문에 세포독성이라고 불린다.그것들은 DNA 손상과 세포 [38][148]분열에 관여하는 세포 조직의 억제를 포함한 다양한 메커니즘에 의해 유사분열을 예방한다.왜 이 약들이 암세포를 죽이는지에 대한 한 가지 이론은 그들이 [149]아포토시스라고 알려진 프로그램된 형태의 세포사멸을 유도한다는 것이다.
화학요법이 세포분열에 영향을 미치기 때문에 성장률이 높은 종양(예: 급성 골수성 백혈병, Hodgkin병을 포함한 공격성 림프종)은 항시 세포분열이 진행되기 때문에 화학요법에 더 민감하다.게으른 림프종과 같이 성장률이 느린 악성종양은 화학요법에 훨씬 [4]더 완만한 반응을 보이는 경향이 있다.이종 종양은 종양 내 하위 집단에 따라 화학요법제에 다양한 민감성을 보일 수도 있다.
면역체계의 세포들은 또한 화학요법의 [150]항종양 효과에 결정적인 기여를 한다.예를 들어, 화학 치료제 옥살리플라틴과 시클로포스파미드는 항종양 기능을 [151]가진 면역 세포를 동원하는 면역 체계에 의해 감지되는 방식으로 종양 세포를 죽게 할 수 있습니다.암 면역 유발 종양 세포 사멸을 일으키는 화학 요법 약물은 면역 [152]검사점 치료에 반응하지 않는 종양을 민감하게 만들 수 있습니다.
기타 용도
자가 면역 장애나 [153]비암성 혈장 세포 이상증 등 암 이외의 질환에 사용되는 화학 요법 약도 있습니다.어떤 경우에는 더 낮은 용량으로 사용되는 경우가 많은데, 이는 부작용이 [153]최소화되는 것을 의미하며, 다른 경우에는 암 치료에 사용되는 용량과 유사한 용량으로 사용된다.메트렉세이트는 류마티스 관절염(RA),[154] 건선,[155] 강직성 척추염[156] 및 다발성 경화증 [157][158]치료에 사용된다.RA에서 보이는 항염증 반응은 면역 억제를 일으키는 아데노신의 증가, 면역 조절 시클로옥시게나아제-2 효소 경로에 대한 영향, 소염성 사이토카인의 감소, 항증식 [154]특성 등에 기인하는 것으로 생각된다.메토트렉세이트는 다발성 경화증과 강직성 척추염을 치료하기 위해 사용되지만, 이러한 질병에서 그 효과는 아직 [156][157][158]불확실하다.시클로포스파미드는 전신성 홍반성 [159]낭창의 흔한 증상인 낭창 신염을 치료하기 위해 가끔 사용된다.덱사메타손은 보르테조미브 또는 멜파란과 함께 AL 아밀로이드증 치료제로 흔히 사용된다.최근에는 시클로포스파미드, 덱사메타손과 함께 보르테조미드가 AL 아밀로이드증 치료제로도 유망하다.레날리도마이드와 같은 골수종 치료에 사용되는 다른 약들은 AL 아밀로이드증 [160]치료에 가능성을 보여왔다.
화학요법 약물은 골수이식(조혈모세포이식) 전 조절요법에도 사용된다.컨디셔닝 요법은 이식을 가능하게 하기 위해 수용자의 면역체계를 억제하는 데 사용된다.시클로포스파미드는 이러한 방식으로 사용되는 일반적인 세포독성 약물이며 전신 조사와 함께 종종 사용된다.화학요법 약물은 수용자의 골수 세포를 영구적으로 제거하기 위해 고용량(골수 조절) 또는 영구적인 골수 손실을 방지하기 위해 낮은 용량(골수 조절 및 강도 조절)[161]으로 사용될 수 있다.비암 환경에서 사용되는 경우, 이 치료는 여전히 "화학 요법"이라고 불리며, 종종 암에 걸린 사람들에게 사용되는 것과 같은 치료 센터에서 이루어집니다.
직업상 노출 및 안전한 취급
1970년대에 항종양제(화학요법) 약물이 유해한 것으로 확인되었고, 이후 미국 건강 시스템 약사 협회(ASHP)는 1983년 유해 약물의 취급에 관한 권고안을 발표한 후 유해 약물의 개념을 도입하였다.연방규제의 적용은 미국 산업안전보건국(OSHA)이 1986년에 지침을 처음 발표한 후 1996년, 1999년, 그리고 가장 최근에는 [162]2006년에 지침을 업데이트했을 때 이루어졌다.
이후 미국 국립산업안전보건연구소(NIOSH)는 직장 내에서 이들 약물에 대한 평가를 실시하고 있다.항종양제에 대한 직업적 노출은 불임과 가능한 발암적 영향을 포함한 여러 건강상의 영향과 관련이 있다.NIOSH 경보 보고서에서는 여성 약사가 유두 전이 세포암 진단을 받은 사례와 같은 몇 가지 사례가 보고되었다.그 약사가 이 병을 진단받기 12년 전, 그녀는 병원에서 20개월 동안 여러 개의 [163]항종양제를 조제하는 일을 담당했다.그 약사는 암에 대한 다른 위험 인자를 가지고 있지 않았고, 따라서 그녀의 암은 문헌에서 인과 관계가 확립되지 않았지만 항종양제에 노출되었기 때문이라고 한다.또 다른 케이스는 생체안전장치 오작동으로 인해 간호요원들이 항종양제에 노출되었다고 생각되는 경우이다.조사 결과 유전독성 바이오마커의 증거는 피폭 후 2개월과 9개월 후에 밝혀졌다.
노출 경로
항종양제는 보통 정맥주사, 근육내, 경막내 또는 피하 투여를 통해 투여된다.대부분의 경우 환자에게 약을 투여하기 전에 여러 명의 작업자가 약을 준비하고 처리해야 합니다.약물의 취급, 조제 또는 투여 또는 항종양제와 접촉한 세척물에 관여하는 모든 근로자는 잠재적으로 위험한 약물에 노출될 수 있습니다.의료 종사자는 약사와 약국 기술자가 항종양제를 준비하고 취급하는 경우, 간호사와 의사가 환자에게 약을 투여하는 경우 등 다양한 상황에서 약물에 노출된다.또한, 항종양제를 의료 시설에서 폐기할 책임이 있는 사람도 [164]노출될 위험이 있습니다.
피부 노출은 상당량의 항종양제가 제조, 취급 및 투여하는 의료 종사자가 착용하는 장갑에서 발견되었기 때문에 노출의 주요 경로로 생각됩니다.또 다른 주목할 만한 노출 경로는 약물의 증기를 흡입하는 것이다.여러 연구가 흡입을 피폭 경로로 조사했으며, 공기 샘플링이 위험 수준을 나타내지 않았지만 여전히 잠재적 피폭 경로이다.손으로 입으로 섭취하는 것은 보건 기관의 위생 기준이 엄격하기 때문에 다른 사람에 비해 덜 노출되는 경로이다.하지만, 이것은 여전히 잠재적인 경로이며, 특히 보건 기관 외부의 직장에서는 더욱 그렇습니다.주사 바늘로 주사하면 위험한 약물에 노출될 수도 있다.이 지역에서 수행된 연구는 의료 [165]종사자의 여러 소변 샘플에서 증거를 조사함으로써 직업상 노출이 발생한다는 것을 밝혀냈다.
위험 요소
위험한 약물은 의료 종사자들을 심각한 건강 위험에 노출시킨다.많은 연구들은 항종양제가 태아 손실, 선천성 기형, 불임과 같은 생식 시스템에 많은 부작용을 일으킬 수 있다는 것을 보여준다.항종양제에 자주 노출되는 의료 종사자들은 자발적 낙태, 사산, 선천적 기형 등 생식능력이 좋지 않다.게다가 이러한 약물에 노출되면 생리주기가 불규칙해진다는 연구결과가 나왔다.항종양제는 또한 이러한 위험 물질에 노출된 의료 종사자 자녀들 사이에서 학습 장애의 위험을 증가시킬 수 있다.
게다가 이 약들은 발암 효과가 있다.지난 50년 동안 여러 연구에서 항종양제 노출의 발암 효과가 나타났다.비슷하게, 알킬화제와 백혈병이 발병하는 인간을 연관짓는 연구들이 있었다.연구에 따르면 이 약물에 노출된 간호사들 사이에서 유방암, 비흑색종 피부암, 직장암의 위험이 높아졌다고 한다.다른 조사에서는 항종양제로부터 의료 환경에 [163]종사하는 근로자들에게 잠재적인 유전독성 효과가 있는 것으로 밝혀졌다.
의료 환경에서 안전한 취급
2018년 현재, OSHA나 미국정부산업위생사회의(ACGIH)는 작업장 안전 [166]지침을 설정하지 않았다.
준비
NIOSH는 작업자의 노출을 줄이도록 설계된 환기 캐비닛을 사용할 것을 권장합니다.또한 모든 직원의 교육, 캐비닛 사용, 안전 프로그램의 기술에 대한 초기 평가 실시, 의약품 포장 개봉, 약병 취급 또는 라벨 부착 시 보호 장갑과 가운 착용을 권고한다.개인 보호 장비를 착용할 때는 장갑을 착용하기 전에 신체적인 결함이 없는지 점검하고 항상 이중 장갑과 보호복을 착용해야 한다.또한 의료 종사자는 항종양제 사용 전후에 물과 비누로 손을 씻고 30분마다 또는 구멍이 날 때마다 장갑을 교체한 후 즉시 화학요법 폐기물 [167]용기에 버려야 합니다.
가운은 폴리에틸렌 코팅 폴리프로필렌으로 만든 일회용 가운이어야 한다.가운을 입을 때, 개인은 가운이 닫혀 있고 소매가 긴지 확인해야 한다.준비가 완료되면 최종 제품을 비닐봉지에 완전히 밀봉해야 합니다.
또한 의료 종사자는 환기된 캐비닛 내의 모든 폐기물 용기를 캐비닛에서 제거하기 전에 닦아야 합니다.마지막으로, 작업자는 모든 보호복을 제거하고 환기가 [164]되는 캐비닛 안에서 폐기할 수 있도록 봉투에 넣어야 합니다.
행정부.
약물은 바늘 목록과 같은 보호 의료 장치와 밀폐된 시스템 및 환기가 있는 캐비닛 내의 약국 직원이 IV 튜브를 프라이밍하는 등의 기술을 사용하여만 투여해야 한다.작업자는 환자에게 약을 전달하기 위해 외부 가방을 열고 배송 시스템을 조립할 때, 그리고 [166]약물의 투여에 사용된 모든 물질을 폐기할 때 항상 이중 장갑, 보안경 및 보호복과 같은 개인 보호 장비를 착용해야 합니다.
병원 근무자는 항종양제가 들어 있는 링거 백에서 튜브를 제거해서는 안 되며 시스템의 튜브를 분리할 때 튜브가 완전히 세척되었는지 확인해야 합니다.작업자는 링거 백을 제거한 후 뚜껑을 닫은 상태에서 노란색 화학요법 폐기물 용기에 다른 일회용 물품과 함께 직접 넣어야 한다.보호장비는 분리하여 일회용 화학요법 폐기물 용기에 넣어야 합니다.화학요법 폐기물은 장갑을 벗기 전후에 이중으로 포장해야 한다.또 약물 투여 현장을 떠나기 [168]전에 반드시 비누와 물로 손을 씻어야 한다.
사원 교육
의료 시설에서 일하는 모든 직원은 위험 약물에 노출되는 교육을 받아야 한다.훈련에는 항종양제 운반 및 보관에 관여하는 모든 개인, 가정부, 약사, 보조자, 운송 및 수령 직원 등이 포함되어야 한다.이러한 개인은 자신의 작업 영역에 존재하는 약물의 위험성을 알리기 위한 정보와 훈련을 받아야 한다.위험과 마주칠 수 있는 작업 영역의 운영과 절차, 위험 약물의 존재와 위험 발생 방법 및 위험 발생 가능성을 포함하여 위험 약물의 물리적 및 건강 위험에 대한 정보를 제공하고 훈련을 받아야 한다.또한 이러한 위험으로부터 자신을 보호하고 회피하기 위해 취해야 할 조치에 대한 정보를 제공하고 훈련을 받아야 한다.이 정보는 의료 종사자가 약물과 접촉할 때 제공되어야 한다. 즉, 위험 약물이 있는 작업 영역에서 초기 할당을 수행해야 한다.또한 새로운 위험이 발생할 때뿐만 아니라 새로운 약물, 절차 또는 장비가 [166]도입될 때 훈련도 제공해야 한다.
하우스키핑 및 폐기물 처리
항종양제를 사용하는 작업장의 세척 및 오염제거를 실시할 때에는 공기 중의 약물농도가 높아지지 않도록 충분한 환기가 확보되어야 한다.작업대를 청소할 때 병원 근무자는 각 작업 전과 후에, 그리고 교대 근무가 끝날 때 비활성화 및 세정제를 사용해야 합니다.청소는 항상 이중 보호 장갑과 일회용 가운을 사용하여 수행해야 합니다.청소가 끝난 후에는 보호장갑을 착용한 채로 노란색 화학요법 폐기물 용기에 넣어 폐기해야 한다.장갑을 벗은 후에는 비누와 물로 손을 깨끗이 씻어야 한다.주사기, 빈 약병, 주사기, 가운, 장갑과 같이 항종양제가 접촉하거나 흔적이 있는 것은 화학요법 폐기물 [169]용기에 넣어야 합니다.
유출 제어
항종양제 제품이 유출될 경우 서면 규정이 필요합니다.정책은 다양한 크기의 유출물 가능성뿐만 아니라 각 크기에 필요한 절차 및 개인 보호 장비도 다루어야 한다.훈련을 받은 작업자는 대량 유출을 처리해야 하며 항상 노란색 화학요법 폐기물 [170]용기가 아닌 EPA 규정에 따라 화학 폐기물 용기에 모든 정화 물질을 폐기해야 합니다.
직업 감시
의료 감시 프로그램을 수립해야 한다.노출의 경우, 직업 건강 전문가들은 상세한 이력을 요청하고 정밀 신체 검사를 해야 합니다.일부 항종양제가 방광 [163]손상을 일으키는 것으로 알려져 있기 때문에, 그들은 소변 딥스틱이나 주로 혈액을 찾는 현미경 검사를 통해 잠재적으로 노출될 수 있는 노동자의 소변을 검사해야 한다.
요로 변이원성은 1979년 팔크와 동료들에 의해 처음 사용되었고 세균 변이원성 분석을 사용한 항종양제에 대한 노출의 지표이다.테스트는 비특이적일 뿐만 아니라 식이 섭취 및 흡연과 같은 외부 요인에 의해 영향을 받을 수 있으므로 적게 사용합니다.그러나 종양의약품 제조 과정에서 수평류 캐비닛의 사용을 수직류 생물학적 안전 캐비닛으로 바꾸는 데 중요한 역할을 했다. 왜냐하면 이전의 의료 종사자들이 높은 수준의 약물에 노출되었기 때문이다.이것은 약물의 취급을 변화시켰고 항종양제에 대한 [163]근로자들의 노출을 효과적으로 줄였다.
항종양제 피폭의 바이오마커는 일반적으로 요로 백금, 메토트렉세이트, 요로 시클로포스파미드 및 ifospamide, 5-플루오로우라실의 요로 대사물을 포함한다.이 외에도 소변에서 직접 약물을 측정하는 약물은 거의 사용되지 않지만, 다른 약물이 있다.이러한 약물을 소변에서 직접 측정하는 것은 높은 노출 수치의 신호이며 약물의 흡수가 흡입 [163]또는 피부에서 일어나고 있다는 것이다.
이용 가능한 에이전트
항종양제에 대한 광범위한 목록이 있다.암에 사용되는 약을 여러 가지 다른 [171][172]유형으로 세분화하기 위해 여러 분류 체계가 사용되었다.
역사
암을 치료하기 위해 소분자 약을 처음 사용한 것은 20세기 초였지만, 처음 사용된 특정 화학 물질은 원래 그러한 목적을 위한 것이 아니었다.겨자 가스는 제1차 세계대전 당시 화학전제로 사용돼 조혈(혈액 생산)[173] 억제 효과가 있는 것으로 밝혀졌다.질소 머스타드로 알려진 유사한 화합물 패밀리는 2차 세계대전 동안 예일 [174]의과대학에서 더 많이 연구되었다.빠르게 성장하는 백혈구를 손상시키는 물질이 [174]암에도 비슷한 영향을 미칠 수 있다는 논리가 나왔다.따라서 1942년 12월, 진행성 림프종(림프계와 림프절의 콘서)을 가진 몇몇 사람들에게 자극성 가스를 [174]흡입하는 대신 정맥을 통해 약을 투여했다.그들의 개선은 일시적이긴 했지만 주목할 [175]만했다.동시에 제2차 세계대전 중 독일의 이탈리아 바리항 공습 이후 수백 명의 사람들이 화학전 사용에 대비해 연합군에 의해 운반된 겨자 가스에 우연히 노출되었다.생존자들은 나중에 백혈구 [176]수가 매우 적은 것으로 밝혀졌다.제2차 세계대전이 끝나고 보고서가 기밀 해제된 후, 그 경험들은 수렴되어 연구자들이 암에 비슷한 영향을 미칠 수 있는 다른 물질을 찾게 되었다.이 연구 라인에서 개발된 최초의 화학요법 약은 머스틴이었다.그 이후로 많은 다른 약들이 암을 치료하기 위해 개발되었고, 비록 초기 연구자들에 의해 발견된 화학 요법의 원리와 한계가 여전히 [177]적용되기는 하지만, 약 개발은 수 십억 달러 규모의 산업으로 폭발적으로 증가하였다.
화학요법이라는 용어
화학요법이란 수식어가 없는 것은 보통 암 치료를 의미하지만, 그 역사적 의미는 더 넓었다.이 용어는 1900년대 초에 Paul Ehrlich에 의해 항생제(항균 화학요법)[178]의 사용과 같은 어떤 질병(화학요법)을 치료하기 위한 화학약품의 사용을 의미하는 것으로 만들어졌습니다.Ehrlich는 [178]암 치료에 효과적인 화학요법 약이 발견될 것이라고 낙관하지 않았다.최초의 현대 화학 치료제는 1907년 발견되어 매독 [179]치료에 사용되는 비소 화합물인 아르스페나민이었다.이것은 나중에 술폰아미드와 페니실린이 뒤따랐다.오늘날에는 "약물에 의한 질병의 모든 치료"라는 의미가 약리치료라는 단어로 종종 표현된다.
판매의
2013년 [180]가장 많이 팔린 암 치료제 상위 10개:
| 아니요. | 2013년 글로벌 세일즈 | 인 | 상호 | 판매권한자 | 표시 |
|---|---|---|---|---|---|
| 1 | 77억8천만달러 | 리턱시마브 | 마브테라 주 리투산 | Roche, Pharmacstandard | 비호지킨림프종, CLL |
| 2 | 67억 5천만 달러 | 베바시주맙 | 아바스틴 | 로체 | 대장암, 폐암, 난소암, 뇌암 |
| 3 | 65억 6천만 달러 | 트라스투주맙 | 허셉틴 | 로체 | 유방암, 식도, 위암 |
| 4 | 46억9천만달러 | 이마티닙 | 글리벡 | 노바티스 | 백혈병, GI암 |
| 5 | 10억 9천만 달러 | 레날리도마이드 | 리브리미드 | Celgene, Pharmac Standard | 다발성 골수종, 맨틀 세포 림프종 |
| 6 | 27억달러 | 페메트렉스 | 알림타 | 엘리 릴리 | 폐암 |
| 7 | 26억달러 | 보르테조미브 | 벨케이드 | 존슨앤드존슨, 다케다, 파마 스탠다드 | 다발성 골수종 |
| 8 | 18억 7000만달러 | Cetuximab | Erbitux | Merck KGaA, Bristol-Myers Squibb | 대장암, 두경부암 |
| 9 | 17억 3천만 달러 | 루프로렐린 | 루프론 | ABBVIE와 Takeda, 사노피와 아스텔라스 파마 | 전립선암과 난소암 |
| 10 | 17억달러 | 아비라테론 | 지티가 | 존슨앤드존슨 | 전립선암 |
조사.
대상 치료법
특수 표적 전달기는 종양 세포에 대한 화학 요법의 유효 수준을 높이고 다른 세포에 대한 유효 수준을 낮추는 것을 목표로 한다.이로 인해 종양 사망률이 증가하거나 독성이 감소하거나 둘 [181]다 발생할 수 있습니다.
항체-약물 결합체
항체-약물결합체(ADC)는 항체, 약물 및 이들 사이의 링커를 포함한다.항체는 종양 세포에서 우선적으로 발현되는 단백질(종양 항원으로 알려져 있음) 또는 혈관 내피 세포와 같이 종양이 이용할 수 있는 세포를 대상으로 할 것입니다.그것들은 종양 항원과 결합하고 내부화되어 링커가 약물을 세포로 방출한다.이러한 특수 표적 전달 매체는 안정성, 선택성 및 표적 선택에서 다양하지만, 본질적으로는 종양 [182]세포에 전달될 수 있는 최대 유효 용량을 증가시키는 것을 목표로 한다.전신 독성의 감소는 또한 그들이 더 아픈 사람들에게 사용될 수 있고, 그들은 전통적인 전신 [citation needed]접근법으로 전달하기에는 너무 독성이 강했을 새로운 화학 치료제를 운반할 수 있다는 것을 의미한다.
이러한 유형의 첫 번째 승인된 약은 Wyeth(현 화이자)가 출시한 Gemtuzumab ozogamicin(Mylotarg)이었다.그 약은 급성 골수성 [183]백혈병을 치료하도록 승인되었다.다른 두 가지 약물인 트라스트주맙 엠탄신과 브렌턱시맙 베도틴은 모두 임상시험 후기에 있으며, 후자는 난치성 호지킨 림프종과 전신성 과민성 대세포 림프종의 치료에 [182]대한 신속한 승인을 받았다.
나노 입자
나노 입자는 1~1000나노미터 크기의 입자로 종양 선택성을 촉진하고 저용해성 약물을 전달하는 데 도움이 됩니다.나노 입자는 수동적 또는 능동적으로 표적이 될 수 있다.수동적 타겟팅은 종양 혈관과 정상 혈관의 차이를 이용합니다.종양의 혈관은 나노 입자가 종양으로 빠져나갈 수 있는 200~2000nm의 틈이 있기 때문에 "유출"되어 있다.활성 표적은 생물학적 분자(항체, 단백질, DNA 및 수용체 배위자)를 사용하여 나노 입자를 우선적으로 종양 세포에 표적화한다.나노 입자 전달 시스템에는 실리카, 폴리머, 리포좀[184], 자분자 등 많은 종류가 있습니다.자성 재료로 만든 나노입자는 외부에서 인가된 자기장을 [181]이용해 종양 부위에 약제를 농축하는 데도 사용할 수 있다.그들은 파클리탁셀과 같은 [185]용해성이 낮은 약물을 위한 자성 약물 전달에 유용한 매개체로 떠올랐다.
전기요법
전기요법은 화학요법 약물을 주입한 후 고압 전기 펄스를 종양에 국소적으로 적용하는 복합 치료법이다.이 치료법은 다른 방법으로는 세포막을 통과할 수 없거나 거의 통과하지 못하는 화학요법 약물이 암세포로 들어갈 수 있게 한다.따라서 항종양 치료의 효과가 더욱 높아진다.
임상 전기화학요법은 조직학적 [186][187][188][189][190][191]기원에 관계없이 피부종양과 피하종양의 치료에 성공적으로 사용되어 왔다.이 방법은 전기화학요법의 임상적 사용에 대한 모든 보고서에서 안전하고 단순하며 매우 효과적이라고 보고되었다.ESOPE 프로젝트(European Standard Operating Procedures of Electrochemaaty)에 따라 유럽 주요 암 센터의 전기화학치료 [188][192]경험을 바탕으로 전기화학요법 표준운영절차(SOP)가 마련되었습니다.최근에는 치료 [193][194]부위에 접근하기 위한 외과적 시술, 내시경 경로 또는 경피적 접근 방법을 사용하여 내부 종양을 치료하기 위한 새로운 전기 화학 요법이 개발되었습니다.
온열 요법
온열요법은 다양한 암의 제어를 위해 화학요법(온열화학요법)이나 방사선요법과 함께 사용하면 강력한 도구가 될 수 있는 암의 열치료법이다.열은 종양 부위에 국소적으로 가해질 수 있으며, 종양으로 가는 혈관을 확장시켜 더 많은 화학요법 약물이 종양으로 들어갈 수 있게 합니다.또한, 종양 세포막은 더 많은 화학 치료제가 종양 세포로 들어갈 수 있도록 더 많은 다공성을 갖게 될 것이다.
온열은 또한 "화학 저항성"을 예방하거나 되돌리는데 도움을 주는 것으로 나타났다.항암화학요법 내성은 종양이 적응함에 따라 시간이 지남에 따라 생기기도 하며 항암치료제의 독성을 극복할 수 있다.화학반응의 극복은 특히 CDDP 내성 세포를 사용하여 과거 광범위하게 연구되어 왔습니다.화학요법과 온열요법을 결합함으로써 효과적인 치료를 위해 약물 내성 세포를 모집할 수 있다는 잠재적 이익과 관련하여 CDDP를 포함한 여러 항암제(예: 미토마이신 C, 안트라사이클린, BCNU, 멜파란)에 대한 화학저항이 적어도 부분적으로 역전될 수 있음을 보여주는 것이 중요했다.에 [195]있습니다.
기타 동물
화학요법은 수의학에서 [196]인간의 의학에서 사용되는 방법과 유사하게 사용된다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b Alfarouk KO, Stock CM, Taylor S, Walsh M, Muddathir AK, Verduzco D, et al. (15 July 2015). "Resistance to cancer chemotherapy: failure in drug response from ADME to P-gp". Cancer Cell International. 15 (1): 71. doi:10.1186/s12935-015-0221-1. PMC 4502609. PMID 26180516.
- ^ Johnstone RW, Ruefli AA, Lowe SW (January 2002). "Apoptosis: a link between cancer genetics and chemotherapy". Cell. 108 (2): 153–64. doi:10.1016/S0092-8674(02)00625-6. PMID 11832206. S2CID 7429296.
- ^ Rajman L, Chwalek K, Sinclair DA (2018). "Therapeutic Potential of NAD-Boosting Molecules: The In Vivo Evidence". Cell Metabolism. 27 (3): 529–547. doi:10.1016/j.cmet.2018.02.011. PMC 6342515. PMID 29514064.
- ^ a b c d e f Corrie PG, Pippa G. (2008). "Cytotoxic chemotherapy: clinical aspects". Medicine. 36 (1): 24–28. doi:10.1016/j.mpmed.2007.10.012.
- ^ a b c Wagner AD, Syn NL, Moehler M, Grothe W, Yong WP, Tai BC, Ho J, Unverzagt S (August 2017). "Chemotherapy for advanced gastric cancer". The Cochrane Database of Systematic Reviews. 8: CD004064. doi:10.1002/14651858.cd004064.pub4. PMC 6483552. PMID 28850174.
- ^ a b c d e f g h i j k Rachel Airley (2009). Cancer chemotherapy. Wiley-Blackwell. ISBN 978-0-470-09254-5.
- ^ a b c d e f Wood M, Brighton D (2005). The Royal Marsden Hospital handbook of cancer chemotherapy: a guide for the multidisciplinary team. St. Louis, Mo: Elsevier Churchill Livingstone. ISBN 978-0-443-07101-0.
- ^ Perry, Michael J. (2008). The Chemotherapy source book. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. ISBN 978-0-7817-7328-7.
- ^ Epstein RJ (August 2005). "Maintenance therapy to suppress micrometastasis: the new challenge for adjuvant cancer treatment". Clinical Cancer Research. 11 (15): 5337–41. doi:10.1158/1078-0432.CCR-05-0437. PMID 16061845.
- ^ Skeel RT (2003). Handbook of Cancer Chemotherapy (paperback) (6th ed.). Lippincott Williams & Wilkins. ISBN 978-0-7817-3629-9.
- ^ Chabner B, Longo DL (2005). Cancer Chemotherapy and Biotherapy: Principles and Practice (4th ed.). Philadelphia: Lippincott Willians & Wilkins. ISBN 978-0-7817-5628-0.
- ^ Nastoupil LJ, Rose AC, Flowers CR (May 2012). "Diffuse large B-cell lymphoma: current treatment approaches". Oncology. 26 (5): 488–95. PMID 22730604.
- ^ Freedman A (October 2012). "Follicular lymphoma: 2012 update on diagnosis and management". American Journal of Hematology. 87 (10): 988–95. doi:10.1002/ajh.23313. PMID 23001911. S2CID 35447562.
- ^ Rampling R, James A, Papanastassiou V (June 2004). "The present and future management of malignant brain tumours: surgery, radiotherapy, chemotherapy". Journal of Neurology, Neurosurgery, and Psychiatry. 75 Suppl 2 (Suppl 2): ii24-30. doi:10.1136/jnnp.2004.040535. PMC 1765659. PMID 15146036.
- ^ Madan V, Lear JT, Szeimies RM (February 2010). "Non-melanoma skin cancer". Lancet. 375 (9715): 673–85. doi:10.1016/S0140-6736(09)61196-X. PMC 3339125. PMID 20171403.
- ^ Du Bois D, Du Bois EF (1989). "A formula to estimate the approximate surface area if height and weight be known. 1916". Nutrition. 5 (5): 303–11, discussion 312–3. PMID 2520314.
- ^ a b c Felici A, Verweij J, Sparreboom A (September 2002). "Dosing strategies for anticancer drugs: the good, the bad and body-surface area". European Journal of Cancer. 38 (13): 1677–84. doi:10.1016/s0959-8049(02)00151-x. PMID 12175683.
- ^ a b c Kaestner SA, Sewell GJ (February 2007). "Chemotherapy dosing part I: scientific basis for current practice and use of body surface area" (PDF). Clinical Oncology. 19 (1): 23–37. doi:10.1016/j.clon.2006.10.010. hdl:10026.1/3714. PMID 17305252.
- ^ Pinkel D (August 1958). "The use of body surface area as a criterion of drug dosage in cancer chemotherapy". Cancer Research. 18 (7): 853–6. PMID 13573353.
- ^ a b Gurney H (April 2002). "How to calculate the dose of chemotherapy". British Journal of Cancer. 86 (8): 1297–302. doi:10.1038/sj.bjc.6600139. PMC 2375356. PMID 11953888.
- ^ a b Beumer JH, Chu E, Salamone SJ (November 2012). "Body-surface area-based chemotherapy dosing: appropriate in the 21st century?". Journal of Clinical Oncology. 30 (31): 3896–7. doi:10.1200/JCO.2012.44.2863. PMID 22965963.
- ^ a b Baker SD, Verweij J, Rowinsky EK, Donehower RC, Schellens JH, Grochow LB, Sparreboom A (December 2002). "Role of body surface area in dosing of investigational anticancer agents in adults, 1991-2001". Journal of the National Cancer Institute. 94 (24): 1883–8. doi:10.1093/jnci/94.24.1883. PMID 12488482.
- ^ a b c d e f g h i j Gamelin E, Delva R, Jacob J, Merrouche Y, Raoul JL, Pezet D, Dorval E, Piot G, Morel A, Boisdron-Celle M (May 2008). "Individual fluorouracil dose adjustment based on pharmacokinetic follow-up compared with conventional dosage: results of a multicenter randomized trial of patients with metastatic colorectal cancer". Journal of Clinical Oncology. 26 (13): 2099–105. doi:10.1200/jco.2007.13.3934. PMID 18445839. S2CID 9557055.
- ^ Saam J, Critchfield GC, Hamilton SA, Roa BB, Wenstrup RJ, Kaldate RR (September 2011). "Body surface area-based dosing of 5-fluoruracil results in extensive interindividual variability in 5-fluorouracil exposure in colorectal cancer patients on FOLFOX regimens". Clinical Colorectal Cancer. 10 (3): 203–6. doi:10.1016/j.clcc.2011.03.015. PMID 21855044.
- ^ a b c d e f g Capitain O, Asevoaia A, Boisdron-Celle M, Poirier AL, Morel A, Gamelin E (December 2012). "Individual fluorouracil dose adjustment in FOLFOX based on pharmacokinetic follow-up compared with conventional body-area-surface dosing: a phase II, proof-of-concept study". Clinical Colorectal Cancer. 11 (4): 263–7. doi:10.1016/j.clcc.2012.05.004. PMID 22683364.
- ^ Kaldate RR, Haregewoin A, Grier CE, Hamilton SA, McLeod HL (2012). "Modeling the 5-fluorouracil area under the curve versus dose relationship to develop a pharmacokinetic dosing algorithm for colorectal cancer patients receiving FOLFOX6". The Oncologist. 17 (3): 296–302. doi:10.1634/theoncologist.2011-0357. PMC 3316912. PMID 22382460.
- ^ a b c Hunter RJ, Navo MA, Thaker PH, Bodurka DC, Wolf JK, Smith JA (February 2009). "Dosing chemotherapy in obese patients: actual versus assigned body surface area (BSA)". Cancer Treatment Reviews. 35 (1): 69–78. doi:10.1016/j.ctrv.2008.07.005. PMID 18922643.
- ^ Hanna, Louise; Crosby, Tom; Fergus Macbeth, eds. (2008). Practical clinical oncology. Cambridge, UK: Cambridge University Press. ISBN 978-0-521-61816-8.
- ^ Buffery PJ, Allen KM, Chin PK, Moore GA, Barclay ML, Begg EJ (February 2014). "Thirteen years' experience of pharmacokinetic monitoring and dosing of busulfan: can the strategy be improved?". Therapeutic Drug Monitoring. 36 (1): 86–92. doi:10.1097/FTD.0b013e31829dc940. PMID 24299921. S2CID 28646787.
- ^ Bartelink IH, Bredius RG, Belitser SV, Suttorp MM, Bierings M, Knibbe CA, et al. (2014). "Association Between Busulfan Exposure and Outcome in Children Receiving Intravenous Busulfan Before Hematopoietic Stem Cell Transplantation". Ther Drug Monit. 36 (1): 93–99. doi:10.1097/FTD.0b013e3182a04fc7. PMID 24061446. S2CID 21072472.
- ^ "ARK Methotrexate Assay". Ark Diagnostics. Archived from the original on 28 April 2014. Retrieved 28 April 2014.
- ^ "Customizing Chemotherapy for Better Cancer Care". My Care Diagnostics. Archived from the original on 28 April 2014. Retrieved 25 November 2018.
- ^ "A Brief History of BSA Dosing". My Care Diagnostics.
- ^ Asher V, Lee J, Bali A (September 2012). "Preoperative serum albumin is an independent prognostic predictor of survival in ovarian cancer". Medical Oncology. 29 (3): 2005–9. doi:10.1007/s12032-011-0019-5. PMID 21735143. S2CID 19558612.
- ^ a b Siddik ZH (2005). "Mechanisms of Action of Cancer Chemotherapeutic Agents: DNA-Interactive Alkylating Agents and Antitumour Platinum-Based Drugs". The Cancer Handbook. John Wiley & Sons, Ltd. doi:10.1002/0470025077.chap84b. ISBN 978-0470025062.
- ^ a b c d e f Lind M.J., M.J. (2008). "Principles of cytotoxic chemotherapy". Medicine. 36 (1): 19–23. doi:10.1016/j.mpmed.2007.10.003.
- ^ a b c Damia G, D'Incalci M (September 1998). "Mechanisms of resistance to alkylating agents". Cytotechnology. 27 (1–3): 165–73. doi:10.1023/A:1008060720608. PMC 3449574. PMID 19002790.
- ^ a b c d Malhotra V, Perry MC (2003). "Classical chemotherapy: mechanisms, toxicities and the therapeutic window". Cancer Biology & Therapy. 2 (4 Suppl 1): S2-4. doi:10.4161/cbt.199. PMID 14508075.
- ^ Giorgi-Renault S, Renault J, Baron M, Gebel-Servolles P, Delic J, Cros S, Paoletti C (1988). "Heterocyclic quinones XIII. Dimerization in the series of 5,8-quinazolinediones: Synthesis and anti tumor effects of bis(4-amino-5,8-quinazolinediones)". Chem. Pharm. Bull. 36 (10): 3933–3947. doi:10.1248/cpb.36.3933. PMID 3245973.
- ^ Takimoto CH, Calvo E (2008). "Principles of Oncologic Pharmacotherapy". In Pazdur R, Wagman LD, Camphausen KA, Hoskins WJ (eds.). Cancer Management: A Multidisciplinary Approach (11th ed.). Archived from the original on 15 May 2009. Retrieved 18 June 2009.
- ^ a b c Parker WB (July 2009). "Enzymology of purine and pyrimidine antimetabolites used in the treatment of cancer". Chemical Reviews. 109 (7): 2880–93. doi:10.1021/cr900028p. PMC 2827868. PMID 19476376.
- ^ Adjei AA (June 2004). "Pemetrexed (ALIMTA), a novel multitargeted antineoplastic agent". Clinical Cancer Research. 10 (12 Pt 2): 4276s–4280s. doi:10.1158/1078-0432.CCR-040010. PMID 15217974. S2CID 31467685.
- ^ Wagstaff AJ, Ibbotson T, Goa KL (2003). "Capecitabine: a review of its pharmacology and therapeutic efficacy in the management of advanced breast cancer". Drugs. 63 (2): 217–36. doi:10.2165/00003495-200363020-00009. PMID 12515569.
- ^ Rowinsky EK, Donehower RC (October 1991). "The clinical pharmacology and use of antimicrotubule agents in cancer chemotherapeutics". Pharmacology & Therapeutics. 52 (1): 35–84. doi:10.1016/0163-7258(91)90086-2. PMID 1687171.
- ^ a b c Yue QX, Liu X, Guo DA (August 2010). "Microtubule-binding natural products for cancer therapy". Planta Medica. 76 (11): 1037–43. doi:10.1055/s-0030-1250073. PMID 20577942.
- ^ Hirata K, Miyamoto K, Miura Y (1994). "Catharanthus roseus L. (Periwinkle): Production of Vindoline and Catharanthine in Multiple Shoot Cultures". In Bajaj YP (ed.). Biotechnology in Agriculture and Forestry 26. Medicinal and Aromatic Plants. Vol. VI. Springer-Verlag. pp. 46–55. ISBN 9783540563914.
- ^ van Der Heijden R, Jacobs DI, Snoeijer W, Hallard D, Verpoorte R (March 2004). "The Catharanthus alkaloids: pharmacognosy and biotechnology". Current Medicinal Chemistry. 11 (5): 607–28. doi:10.2174/0929867043455846. PMID 15032608.
- ^ Gansäuer A, Justicia J, Fan CA, Worgull D, Piestert F (2007). "Reductive C—C bond formation after epoxide opening via electron transfer". In Krische MJ (ed.). Metal Catalyzed Reductive C—C Bond Formation: A Departure from Preformed Organometallic Reagents. Topics in Current Chemistry. Vol. 279. Springer Science & Business Media. pp. 25–52. doi:10.1007/128_2007_130. ISBN 9783540728795.
- ^ Cooper R, Deakin JJ (2016). "Africa's gift to the world". Botanical Miracles: Chemistry of Plants That Changed the World. CRC Press. pp. 46–51. ISBN 9781498704304.
- ^ a b Keglevich P, Hazai L, Kalaus G, Szántay C (May 2012). "Modifications on the basic skeletons of vinblastine and vincristine". Molecules. 17 (5): 5893–914. doi:10.3390/molecules17055893. PMC 6268133. PMID 22609781.
- ^ Raviña, Enrique (2011). "Vinca alkaloids". The evolution of drug discovery: From traditional medicines to modern drugs. John Wiley & Sons. pp. 157–159. ISBN 9783527326693.
- ^ Faller BA, Pandit TN (2011). "Safety and efficacy of vinorelbine in the treatment of non-small cell lung cancer". Clinical Medicine Insights: Oncology. 5: 131–44. doi:10.4137/CMO.S5074. PMC 3117629. PMID 21695100.
- ^ Ngo QA, Roussi F, Cormier A, Thoret S, Knossow M, Guénard D, Guéritte F (January 2009). "Synthesis and biological evaluation of vinca alkaloids and phomopsin hybrids". Journal of Medicinal Chemistry. 52 (1): 134–42. doi:10.1021/jm801064y. PMID 19072542.
- ^ Damayanthi Y, Lown JW (June 1998). "Podophyllotoxins: current status and recent developments". Current Medicinal Chemistry. 5 (3): 205–52. doi:10.2174/0929867305666220314204426. PMID 9562603. S2CID 247493530.
- ^ Liu YQ, Yang L, Tian X (2007). "Podophyllotoxin: current perspectives". Current Bioactive Compounds. 3 (1): 37–66. doi:10.1016/j.jallcom.2006.06.070.
- ^ Lodish H, Berk A, Zipursky SL, et al. (2000). Molecular Cell Biology. 4th edition. The Role of Topoisomerases in DNA Replication. New York: W. H. Freeman.
- ^ Goodsell DS (2002). "The molecular perspective: DNA topoisomerases". Stem Cells. 20 (5): 470–1. doi:10.1634/stemcells.20-5-470. PMID 12351817. S2CID 9257158.
- ^ Nitiss JL (May 2009). "Targeting DNA topoisomerase II in cancer chemotherapy". Nature Reviews. Cancer. 9 (5): 338–50. doi:10.1038/nrc2607. PMC 2748742. PMID 19377506.
- ^ Offermanns S, Rosenthal W (14 August 2008). Encyclopedia of Molecular Pharmacology. Springer Science & Business Media. p. 155. ISBN 9783540389163.
- ^ Offermanns S, Rosenthal W (14 August 2008). Encyclopedia of Molecular Pharmacology. Springer Science & Business Media. pp. 91ff. ISBN 9783540389163.
- ^ Koeller J, Eble M (1988). "Mitoxantrone: A novel anthracycline derivative". Clinical Pharmacy. 7 (8): 574–81. PMID 3048848.
- ^ Minotti G, Menna P, Salvatorelli E, Cairo G, Gianni L (June 2004). "Anthracyclines: molecular advances and pharmacologic developments in antitumor activity and cardiotoxicity". Pharmacological Reviews. 56 (2): 185–229. doi:10.1124/pr.56.2.6. PMID 15169927. S2CID 13138853.
- ^ Sobell HM (August 1985). "Actinomycin and DNA transcription". Proceedings of the National Academy of Sciences of the United States of America. 82 (16): 5328–31. Bibcode:1985PNAS...82.5328S. doi:10.1073/pnas.82.16.5328. PMC 390561. PMID 2410919.
- ^ Dorr RT (April 1992). "Bleomycin pharmacology: mechanism of action and resistance, and clinical pharmacokinetics". Seminars in Oncology. 19 (2 Suppl 5): 3–8. PMID 1384141.
- ^ Verweij J, Pinedo HM (October 1990). "Mitomycin C: mechanism of action, usefulness and limitations". Anti-Cancer Drugs. 1 (1): 5–13. doi:10.1097/00001813-199010000-00002. PMID 2131038.
- ^ Greer JA, Amoyal N, Nisotel L, Fishbein JN, MacDonald J, Stagl J, et al. (March 2016). "A Systematic Review of Adherence to Oral Antineoplastic Therapies". The Oncologist. 21 (3): 354–76. doi:10.1634/theoncologist.2015-0405. PMC 4786357. PMID 26921292.
- ^ Moreno-Ramirez D, de la Cruz-Merino L, Ferrandiz L, Villegas-Portero R, Nieto-Garcia A (2010). "Isolated limb perfusion for malignant melanoma: systematic review on effectiveness and safety". The Oncologist. 15 (4): 416–27. doi:10.1634/theoncologist.2009-0325. PMC 3227960. PMID 20348274.
- ^ Verhoef C, de Wilt JH, ten Hagen TL, Eggermont AM (October 2008). "Isolated hepatic perfusion for the treatment of liver tumors: sunset or sunrise?". Surgical Oncology Clinics of North America. 17 (4): 877–94, xi. doi:10.1016/j.soc.2008.04.007. PMID 18722924.
- ^ Hendriks JM, Van Schil PE (1998). "Isolated lung perfusion for the treatment of pulmonary metastases". Surgical Oncology. 7 (1–2): 59–63. doi:10.1016/S0960-7404(98)00028-0. PMID 10421507.
- ^ Chitwood K, Etzkorn J, Cohen G (September 2013). "Topical and intralesional treatment of nonmelanoma skin cancer: efficacy and cost comparisons". Dermatologic Surgery. 39 (9): 1306–16. doi:10.1111/dsu.12300. PMID 23915332. S2CID 597295.
- ^ De Groot, Stefanie; Lugtenberg, Rieneke T.; Cohen, Danielle; Welters, Marij J. P.; Ehsan, Ilina; Vreeswijk, Maaike P. G.; Smit VTHBM; De Graaf, Hiltje; Heijns, Joan B.; Portielje, Johanneke E. A.; Van De Wouw, A. J.; Imholz, Alex L. T.; Kessels, Lonneke W.; Vrijaldenhoven, Suzan; Baars, Arnold; Kranenbarg, Elma Meershoek-Klein; Carpentier, Marjolijn Duijm-de; Putter, Hein; van der Hoeven JJM; Nortier, Johan W. R.; Longo, Valter D.; Pijl, Hanno; Kroep, Judith R.; Dutch Breast Cancer Research Group (BOOG) (23 June 2020). "Fasting mimicking diet as an adjunct to neoadjuvant chemotherapy for breast cancer in the multicentre randomized phase 2 DIRECT trial". Nature. 11 (1): 3083. Bibcode:2020NatCo..11.3083D. doi:10.1038/s41467-020-16138-3. PMC 7311547. PMID 32576828.
- ^ De Groot, S.; Pijl, H.; Van Der Hoeven, J. J.; Kroep, J. R. (22 May 2019). "Effects of short-term fasting on cancer treatment". Journal of Experimental & Clinical Cancer Research. 38 (1): 209. doi:10.1186/s13046-019-1189-9. PMC 6530042. PMID 31113478.
- ^ Sadeghian, Mehdi; Rahmani, Sepideh; Khalesi, Saman; Hejazi, Ehsan (April 2021). "A review of fasting effects on the response of cancer to chemotherapy". Clinical Nutrition. 40 (4): 1669–1681. doi:10.1016/j.clnu.2020.10.037. PMID 33153820. S2CID 226271213.
- ^ Plotti, Francesco; Terranova, Corrado; Luvero, Daniela; Bartolone, Martina; Messina, Giuseppe; Feole, Laura; Cianci, Stefano; Scaletta, Giuseppe; Marchetti, Claudia; Di Donato, Violante; Fagotti, Anna; Scambia, Giovanni; Benedetti Panici, Pierluigi; Angioli, Roberto (December 2020). "Diet and Chemotherapy: The Effects of Fasting and Ketogenic Diet on Cancer Treatment". Chemotherapy. 65 (3–4): 77–84. doi:10.1159/000510839. PMID 33197913. S2CID 226990769.
- ^ Huang ES (2000). Internal medicine: handbook for clinicians, resident survival guide. Arlington, VA: Scrub Hill Press. p. 130. ISBN 978-0-9645467-5-2.
- ^ Elad S, Zadik Y, Hewson I, Hovan A, Correa ME, Logan R, Elting LS, Spijkervet FK, Brennan MT (August 2010). "A systematic review of viral infections associated with oral involvement in cancer patients: a spotlight on Herpesviridea". Supportive Care in Cancer. 18 (8): 993–1006. doi:10.1007/s00520-010-0900-3. PMID 20544224. S2CID 2969472.
- ^ a b c Gafter-Gvili A, Fraser A, Paul M, Vidal L, Lawrie TA, van de Wetering MD, Kremer LC, Leibovici L (January 2012). "Antibiotic prophylaxis for bacterial infections in afebrile neutropenic patients following chemotherapy". The Cochrane Database of Systematic Reviews. 1: CD004386. doi:10.1002/14651858.CD004386.pub3. PMC 4170789. PMID 22258955.
- ^ "Coriolus Versicolor". Cancer.org. 10 June 2008. Archived from the original on 25 June 2010. Retrieved 7 August 2012.
- ^ Commissioner, Office of the (12 February 2021). "FDA Approves Drug to Reduce Bone Marrow Suppression Caused by Chemotherapy". FDA. Retrieved 9 March 2021.
- ^ Davila ML (January 2006). "Neutropenic enterocolitis". Current Opinion in Gastroenterology. 22 (1): 44–7. doi:10.1097/01.mog.0000198073.14169.3b. PMID 16319675. S2CID 25479771.
- ^ a b Keidan RD, Fanning J, Gatenby RA, Weese JL (March 1989). "Recurrent typhlitis. A disease resulting from aggressive chemotherapy". Diseases of the Colon and Rectum. 32 (3): 206–9. doi:10.1007/BF02554529. PMID 2920627. S2CID 46090832.
- ^ Gibson RJ, Keefe DM (September 2006). "Cancer chemotherapy-induced diarrhoea and constipation: mechanisms of damage and prevention strategies". Supportive Care in Cancer. 14 (9): 890–900. doi:10.1007/s00520-006-0040-y. PMID 16604351. S2CID 109778.
- ^ Wei D, Heus P, van de Wetering FT, van Tienhoven G, Verleye L, Scholten RJ (August 2018). "Probiotics for the prevention or treatment of chemotherapy- or radiotherapy-related diarrhoea in people with cancer". The Cochrane Database of Systematic Reviews. 2018 (8): CD008831. doi:10.1002/14651858.cd008831.pub3. PMC 6513393. PMID 30168576.
- ^ Groopman JE, Itri LM (October 1999). "Chemotherapy-induced anemia in adults: incidence and treatment". Journal of the National Cancer Institute. 91 (19): 1616–34. doi:10.1093/jnci/91.19.1616. PMID 10511589.
- ^ Henry DH (July 2006). "The role of intravenous iron in cancer-related anemia". Oncology. 20 (8 Suppl 6): 21–4. PMID 16925107.
- ^ Rodgers GM, Becker PS, Bennett CL, Cella D, Chanan-Khan A, Chesney C, Cleeland C, Coccia PF, Djulbegovic B, Garst JL, Gilreath JA, Kraut EH, Lin WC, Matulonis U, Millenson M, Reinke D, Rosenthal J, Sabbatini P, Schwartz RN, Stein RS, Vij R (July 2008). "Cancer- and chemotherapy-induced anemia". Journal of the National Comprehensive Cancer Network. 6 (6): 536–64. doi:10.6004/jnccn.2008.0042. PMID 18597709.
- ^ Vadhan-Raj S (January 2009). "Management of chemotherapy-induced thrombocytopenia: current status of thrombopoietic agents". Seminars in Hematology. 46 (1 Suppl 2): S26-32. doi:10.1053/j.seminhematol.2008.12.007. PMID 19245931.
- ^ Sekhon SS, Roy V (May 2006). "Thrombocytopenia in adults: A practical approach to evaluation and management". Southern Medical Journal. 99 (5): 491–8, quiz 499–500, 533. doi:10.1097/01.smj.0000209275.75045.d4. PMID 16711312. S2CID 16527763.
- ^ Estcourt L, Stanworth S, Doree C, Hopewell S, Murphy MF, Tinmouth A, Heddle N, et al. (Cochrane Haematological Malignancies Group) (May 2012). "Prophylactic platelet transfusion for prevention of bleeding in patients with haematological disorders after chemotherapy and stem cell transplantation". The Cochrane Database of Systematic Reviews (5): CD004269. doi:10.1002/14651858.CD004269.pub3. PMID 22592695.
- ^ Estcourt LJ, Stanworth SJ, Doree C, Hopewell S, Trivella M, Murphy MF, et al. (Cochrane Haematological Malignancies Group) (November 2015). "Comparison of different platelet count thresholds to guide administration of prophylactic platelet transfusion for preventing bleeding in people with haematological disorders after myelosuppressive chemotherapy or stem cell transplantation". The Cochrane Database of Systematic Reviews. 2015 (11): CD010983. doi:10.1002/14651858.CD010983.pub2. PMC 4717525. PMID 26576687.
- ^ Berger AM, Abernethy AP, Atkinson A, Barsevick AM, Breitbart WS, Cella D, Cimprich B, Cleeland C, Eisenberger MA, Escalante CP, Jacobsen PB, Kaldor P, Ligibel JA, Murphy BA, O'Connor T, Pirl WF, Rodler E, Rugo HS, Thomas J, Wagner LI (August 2010). "NCCN Clinical Practice Guidelines Cancer-related fatigue". Journal of the National Comprehensive Cancer Network. 8 (8): 904–31. doi:10.6004/jnccn.2010.0067. PMID 20870636. S2CID 70400559.
- ^ Franklin DJ, Packel L (March 2006). "Cancer-related fatigue". Archives of Physical Medicine and Rehabilitation. 87 (3 Suppl 1): S91–3, quiz S94–5. doi:10.1016/j.apmr.2005.12.015. PMID 16500197.
- ^ Cramp F, Byron-Daniel J (November 2012). Cramp F (ed.). "Exercise for the management of cancer-related fatigue in adults" (PDF). The Cochrane Database of Systematic Reviews. 11 (9): CD006145. doi:10.1002/14651858.CD006145.pub3. PMC 8480137. PMID 23152233.
- ^ Gill P, Grothey A, Loprinzi C (2006). Nausea and Vomiting in the Cancer Patient. Oncology. pp. 1482–1496. doi:10.1007/0-387-31056-8_83. ISBN 978-0-387-24291-0.
Nausea and vomiting are two of the most feared cancer treatment-related side effects for cancer patients and their families.
- ^ Chadha V, Shenoi SD (2003). "Hair loss in cancer chemotherapeutic patients". Indian Journal of Dermatology, Venereology and Leprology. 69 (2): 131–2. PMID 17642856.
- ^ Lemieux J (October 2012). "Reducing chemotherapy-induced alopecia with scalp cooling". Clinical Advances in Hematology & Oncology. 10 (10): 681–2. PMID 23187775.
- ^ Shapiro J, Price VH (April 1998). "Hair regrowth. Therapeutic agents". Dermatologic Clinics. 16 (2): 341–56. doi:10.1016/S0733-8635(05)70017-6. PMID 9589208.
- ^ Al-Mohanna H, Al-Khenaizan S (2010). "Permanent alopecia following cranial irradiation in a child". Journal of Cutaneous Medicine and Surgery. 14 (3): 141–3. doi:10.2310/7750.2010.09014. PMID 20487675. S2CID 43583651.
- ^ Can G, Demir M, Erol O, Aydiner A (June 2013). "A comparison of men and women's experiences of chemotherapy-induced alopecia". European Journal of Oncology Nursing. 17 (3): 255–60. doi:10.1016/j.ejon.2012.06.003. PMID 22901547.
- ^ Trüeb RM (March 2009). "Chemotherapy-induced alopecia". Seminars in Cutaneous Medicine and Surgery. 28 (1): 11–4. doi:10.1016/j.sder.2008.12.001. PMID 19341937.
- ^ Chon SY, Champion RW, Geddes ER, Rashid RM (July 2012). "Chemotherapy-induced alopecia". Journal of the American Academy of Dermatology. 67 (1): e37-47. doi:10.1016/j.jaad.2011.02.026. PMID 22178150.
- ^ Secondary neoplasias following chemotherapy, radiotherapy and immunosuppression. Vol. 55. Basel: Karger. 2000. ISBN 9783318006155. OCLC 606559421.
- ^ Hijiya N, Hudson MM, Lensing S, Zacher M, Onciu M, Behm FG, Razzouk BI, Ribeiro RC, Rubnitz JE, Sandlund JT, Rivera GK, Evans WE, Relling MV, Pui CH (March 2007). "Cumulative incidence of secondary neoplasms as a first event after childhood acute lymphoblastic leukemia". JAMA. 297 (11): 1207–15. doi:10.1001/jama.297.11.1207. PMID 17374815.
- ^ a b c d Brydøy M, Fosså SD, Dahl O, Bjøro T (2007). "Gonadal dysfunction and fertility problems in cancer survivors". Acta Oncologica. 46 (4): 480–9. doi:10.1080/02841860601166958. PMID 17497315. S2CID 20672988.
- ^ a b Morgan S, Anderson RA, Gourley C, Wallace WH, Spears N (2012). "How do chemotherapeutic agents damage the ovary?". Human Reproduction Update. 18 (5): 525–35. doi:10.1093/humupd/dms022. PMID 22647504.
- ^ Gurgan T, Salman C, Demirol A (October 2008). "Pregnancy and assisted reproduction techniques in men and women after cancer treatment". Placenta. 29 Suppl B: 152–9. doi:10.1016/j.placenta.2008.07.007. PMID 18790328.
- ^ Courbiere B, Decanter C, Bringer-Deutsch S, Rives N, Mirallié S, Pech JC, De Ziegler D, Carré-Pigeon F, May-Panloup P, Sifer C, Amice V, Schweitzer T, Porcu-Buisson G, Poirot C (September 2013). "Emergency IVF for embryo freezing to preserve female fertility: a French multicentre cohort study". Human Reproduction. 28 (9): 2381–8. doi:10.1093/humrep/det268. PMID 23832792.
- ^ Roness H, Kalich-Philosoph L, Meirow D (2014). "Prevention of chemotherapy-induced ovarian damage: possible roles for hormonal and non-hormonal attenuating agents". Human Reproduction Update. 20 (5): 759–74. doi:10.1093/humupd/dmu019. PMID 24833728.
- ^ Tichelli A, Rovó A (August 2013). "Fertility issues following hematopoietic stem cell transplantation". Expert Review of Hematology. 6 (4): 375–88. doi:10.1586/17474086.2013.816507. PMID 23991924. S2CID 25139582.
결국:샌더스 엔리케즈, 홀리 J, 레비 W, Gooley T, 버크너 CD, Deeg 암호 재개, Doney K, Storb R, 설리번 K위더스푼은 R, Appelbaum FR(1996년 4월)이유로."high-dose busulfan 또는 total-body 조사량과 골수 이식과 상관 없이high-dose cyclophosphamide 따른 임신은".피는. 87(7):3045–52. doi:10.1182/blood.V87.7.3045.bloodjournal8773045.PMID 8639928. - ^ a b c d e f Arnon J, Meirow D, Lewis-Roness H, Ornoy A (2001). "Genetic and teratogenic effects of cancer treatments on gametes and embryos". Human Reproduction Update. 7 (4): 394–403. doi:10.1093/humupd/7.4.394. PMID 11476352. [1]
- ^ a b del Pino BM (23 February 2010). "Chemotherapy-induced Peripheral Neuropathy". NCI Cancer Bulletin. 7 (4): 6.
- ^ Grisold W, Oberndorfer S, Windebank AJ (2012). "Chemotherapy and polyneuropathies" (PDF). European Association of Neurooncology Magazine. 12 (1).
- ^ Beijers AJ, Jongen JL, Vreugdenhil G (January 2012). "Chemotherapy-induced neurotoxicity: the value of neuroprotective strategies". The Netherlands Journal of Medicine. 70 (1): 18–25. PMID 22271810. Archived from the original on 3 December 2013.
- ^ a b Windebank AJ, Grisold W (March 2008). "Chemotherapy-induced neuropathy". Journal of the Peripheral Nervous System. 13 (1): 27–46. doi:10.1111/j.1529-8027.2008.00156.x. PMID 18346229. S2CID 20411101.
- ^ Savage L (July 2007). "Chemotherapy-induced pain puzzles scientists". Journal of the National Cancer Institute. 99 (14): 1070–1. doi:10.1093/jnci/djm072. PMID 17623791.
- ^ Tannock IF, Ahles TA, Ganz PA, Van Dam FS (June 2004). "Cognitive impairment associated with chemotherapy for cancer: report of a workshop". Journal of Clinical Oncology. 22 (11): 2233–9. doi:10.1200/JCO.2004.08.094. PMID 15169812. Archived from the original on 17 September 2012.
- ^ Shaikh AY, Shih JA (June 2012). "Chemotherapy-induced cardiotoxicity". Current Heart Failure Reports. 9 (2): 117–27. doi:10.1007/s11897-012-0083-y. PMID 22382639. S2CID 35723897.
- ^ Thatishetty AV, Agresti N, O'Brien CB (November 2013). "Chemotherapy-induced hepatotoxicity". Clinics in Liver Disease. 17 (4): 671–86, ix–x. doi:10.1016/j.cld.2013.07.010. PMID 24099024.
- ^ King PD, Perry MC (2001). "Hepatotoxicity of chemotherapy". The Oncologist. 6 (2): 162–76. doi:10.1634/theoncologist.6-2-162. PMID 11306728. S2CID 39518402.
- ^ de Jonge MJ, Verweij J (February 2006). "Renal toxicities of chemotherapy". Seminars in Oncology. 33 (1): 68–73. doi:10.1053/j.seminoncol.2005.11.011. PMID 16473645.
- ^ Humphreys BD, Soiffer RJ, Magee CC (January 2005). "Renal failure associated with cancer and its treatment: an update". Journal of the American Society of Nephrology. 16 (1): 151–61. doi:10.1681/ASN.2004100843. PMID 15574506.
- ^ Brock PR, Knight KR, Freyer DR, Campbell KC, Steyger PS, Blakley BW, et al. (July 2012). "Platinum-induced ototoxicity in children: a consensus review on mechanisms, predisposition, and protection, including a new International Society of Pediatric Oncology Boston ototoxicity scale". Journal of Clinical Oncology. 30 (19): 2408–17. doi:10.1200/JCO.2011.39.1110. PMC 3675696. PMID 22547603.
- ^ Rybak LP, Mukherjea D, Jajoo S, Ramkumar V (November 2009). "Cisplatin ototoxicity and protection: clinical and experimental studies". The Tohoku Journal of Experimental Medicine. 219 (3): 177–86. doi:10.1620/tjem.219.177. PMC 2927105. PMID 19851045.
- ^ van As JW, van den Berg H, van Dalen EC (January 2020). "Different infusion durations for preventing platinum-induced hearing loss in children with cancer". The Cochrane Database of Systematic Reviews. 1: CD010885. doi:10.1002/14651858.CD010885.pub5. PMC 6984653. PMID 31961948.
- ^ van As JW, van den Berg H, van Dalen EC (August 2016). "Platinum-induced hearing loss after treatment for childhood cancer". The Cochrane Database of Systematic Reviews. 2019 (8): CD010181. doi:10.1002/14651858.cd010181.pub2. PMC 6466671. PMID 27486906.
- ^ van As JW, van den Berg H, van Dalen EC (May 2019). "Medical interventions for the prevention of platinum-induced hearing loss in children with cancer". The Cochrane Database of Systematic Reviews. 2019 (5): CD009219. doi:10.1002/14651858.cd009219.pub5. PMC 6504134. PMID 31063591.
- ^ Ward EJ, Henry LM, Friend AJ, Wilkins S, Phillips RS (August 2015). "Nutritional support in children and young people with cancer undergoing chemotherapy". The Cochrane Database of Systematic Reviews. 2015 (8): CD003298. doi:10.1002/14651858.cd003298.pub3. PMC 8752126. PMID 26301790.
- ^ Weeks JC, Catalano PJ, Cronin A, Finkelman MD, Mack JW, Keating NL, Schrag D (October 2012). "Patients' expectations about effects of chemotherapy for advanced cancer". The New England Journal of Medicine. 367 (17): 1616–25. doi:10.1056/NEJMoa1204410. PMC 3613151. PMID 23094723.
- ^ Deeken JF, Löscher W (March 2007). "The blood-brain barrier and cancer: transporters, treatment, and Trojan horses". Clinical Cancer Research. 13 (6): 1663–74. doi:10.1158/1078-0432.CCR-06-2854. PMID 17363519.
- ^ Agarwala SS, Kirkwood JM (2000). "Temozolomide, a novel alkylating agent with activity in the central nervous system, may improve the treatment of advanced metastatic melanoma". The Oncologist. 5 (2): 144–51. doi:10.1634/theoncologist.5-2-144. PMID 10794805.
- ^ Gerstner ER, Fine RL (June 2007). "Increased permeability of the blood-brain barrier to chemotherapy in metastatic brain tumors: establishing a treatment paradigm". Journal of Clinical Oncology. 25 (16): 2306–12. doi:10.1200/JCO.2006.10.0677. PMID 17538177.
- ^ Minchinton AI, Tannock IF (August 2006). "Drug penetration in solid tumours". Nature Reviews. Cancer. 6 (8): 583–92. doi:10.1038/nrc1893. PMID 16862189. S2CID 42818461.
- ^ Goldman B (February 2003). "Multidrug resistance: can new drugs help chemotherapy score against cancer?". Journal of the National Cancer Institute. 95 (4): 255–7. doi:10.1093/jnci/95.4.255. PMID 12591977.
- ^ Crowley E, McDevitt CA, Callaghan R (2009). Multidrug Resistance in Cancer. Generating Inhibitors of P-Glycoprotein: Where to, Now?. Springer Protocols. pp. 405–432.
- ^ Luqmani YA (2005). "Mechanisms of drug resistance in cancer chemotherapy". Medical Principles and Practice. 14 Suppl 1: 35–48. doi:10.1159/000086183. PMID 16103712.
- ^ Moschovi M, Critselis E, Cen O, Adamaki M, Lambrou GI, Chrousos GP, Vlahopoulos S (2015). "Drugs acting on homeostasis: challenging cancer cell adaptation". Expert Review of Anticancer Therapy. 15 (12): 1405–17. doi:10.1586/14737140.2015.1095095. PMID 26523494. S2CID 28992964.
- ^ Heavey S, Godwin P, Baird AM, Barr MP, Umezawa K, Cuffe S, et al. (October 2014). "Strategic targeting of the PI3K-NFκB axis in cisplatin-resistant NSCLC". Cancer Biology & Therapy. 15 (10): 1367–77. doi:10.4161/cbt.29841. PMC 4130730. PMID 25025901.
- ^ Ryan SL, Beard S, Barr MP, Umezawa K, Heavey S, Godwin P, et al. (September 2019). "Targeting NF-κB-mediated inflammatory pathways in cisplatin-resistant NSCLC" (PDF). Lung Cancer. 135: 217–227. doi:10.1016/j.lungcan.2019.07.006. PMID 31446998. S2CID 199025494.
- ^ Godwin P, Baird AM, Heavey S, Barr MP, O'Byrne KJ, Gately K (2013). "Targeting nuclear factor-kappa B to overcome resistance to chemotherapy". Frontiers in Oncology. 3: 120. doi:10.3389/fonc.2013.00120. PMC 3655421. PMID 23720710.
- ^ Gerber DE (February 2008). "Targeted therapies: a new generation of cancer treatments". American Family Physician. 77 (3): 311–9. PMID 18297955.
- ^ Allen TM (October 2002). "Ligand-targeted therapeutics in anticancer therapy". Nature Reviews. Cancer. 2 (10): 750–63. doi:10.1038/nrc903. PMID 12360278. S2CID 21014917.
- ^ Chen HX, Cleck JN (August 2009). "Adverse effects of anticancer agents that target the VEGF pathway". Nature Reviews. Clinical Oncology. 6 (8): 465–77. doi:10.1038/nrclinonc.2009.94. PMID 19581909. S2CID 30482752.
- ^ Zhang J, Yang PL, Gray NS (January 2009). "Targeting cancer with small molecule kinase inhibitors". Nature Reviews. Cancer. 9 (1): 28–39. doi:10.1038/nrc2559. PMID 19104514. S2CID 17934366.
- ^ Hanahan D, Weinberg RA (January 2000). "The hallmarks of cancer". Cell. 100 (1): 57–70. doi:10.1016/S0092-8674(00)81683-9. PMID 10647931. S2CID 1478778.
- ^ Hodgson S (January 2008). "Mechanisms of inherited cancer susceptibility". Journal of Zhejiang University Science B. 9 (1): 1–4. doi:10.1631/jzus.B073001. PMC 2170461. PMID 18196605.
- ^ Perera FP (November 1997). "Environment and cancer: who are susceptible?". Science. 278 (5340): 1068–73. Bibcode:1997Sci...278.1068P. doi:10.1126/science.278.5340.1068. PMID 9353182.
- ^ Hoskins WJ, Perez CA, Young RC, Barakat RR, Markman M, Randall ME, eds. (2005). Principles and practice of gynecologic oncology (4th ed.). Baltimore, Md.: Lippincott Williams & Wilkins. ISBN 978-0-7817-4689-2.
- ^ Kehe K, Balszuweit F, Steinritz D, Thiermann H (September 2009). "Molecular toxicology of sulfur mustard-induced cutaneous inflammation and blistering". Toxicology. 263 (1): 12–9. doi:10.1016/j.tox.2009.01.019. PMID 19651324.
- ^ Makin G, Hickman JA (July 2000). "Apoptosis and cancer chemotherapy". Cell and Tissue Research. 301 (1): 143–52. Bibcode:1994RSPTB.345..319H. doi:10.1007/s004419900160. PMID 10928287. S2CID 22909070.
- ^ Zitvogel L, Apetoh L, Ghiringhelli F, Kroemer G (January 2008). "Immunological aspects of cancer chemotherapy". Nature Reviews. Immunology. 8 (1): 59–73. doi:10.1038/nri2216. PMID 18097448. S2CID 205490545.
- ^ Galluzzi L, Buqué A, Kepp O, Zitvogel L, Kroemer G (February 2017). "Immunogenic cell death in cancer and infectious disease". Nature Reviews. Immunology. 17 (2): 97–111. doi:10.1038/nri.2016.107. PMID 27748397. S2CID 4045072.
- ^ Pfirschke C, Engblom C, Rickelt S, Cortez-Retamozo V, Garris C, Pucci F, Yamazaki T, Poirier-Colame V, Newton A, Redouane Y, Lin YJ, Wojtkiewicz G, Iwamoto Y, Mino-Kenudson M, Huynh TG, Hynes RO, Freeman GJ, Kroemer G, Zitvogel L, Weissleder R, Pittet MJ (February 2016). "Immunogenic Chemotherapy Sensitizes Tumors to Checkpoint Blockade Therapy". Immunity. 44 (2): 343–54. doi:10.1016/j.immuni.2015.11.024. PMC 4758865. PMID 26872698.
- ^ a b Ben-Ari ET (April 2004). "Dual purpose: some cancer therapies used to treat autoimmune diseases" (PDF). Journal of the National Cancer Institute. 96 (8): 577–9. doi:10.1093/jnci/96.8.577. PMID 15100330.
- ^ a b Cutolo M, Sulli A, Pizzorni C, Seriolo B, Straub RH (August 2001). "Anti-inflammatory mechanisms of methotrexate in rheumatoid arthritis". Annals of the Rheumatic Diseases. 60 (8): 729–35. doi:10.1136/ard.60.8.729. PMC 1753808. PMID 11454634.
- ^ Montaudié H, Sbidian E, Paul C, Maza A, Gallini A, Aractingi S, Aubin F, Bachelez H, Cribier B, Joly P, Jullien D, Le Maître M, Misery L, Richard MA, Ortonne JP (May 2011). "Methotrexate in psoriasis: a systematic review of treatment modalities, incidence, risk factors and monitoring of liver toxicity". Journal of the European Academy of Dermatology and Venereology. 25 Suppl 2: 12–8. doi:10.1111/j.1468-3083.2011.03991.x. PMID 21388454. S2CID 13015911.
- ^ a b Chen J, Veras MM, Liu C, Lin J (February 2013). Chen J (ed.). "Methotrexate for ankylosing spondylitis". The Cochrane Database of Systematic Reviews. 2 (2): CD004524. doi:10.1002/14651858.CD004524.pub4. PMID 23450553.
- ^ a b Gray O, McDonnell GV, Forbes RB (2004). Gray O (ed.). "Methotrexate for multiple sclerosis". The Cochrane Database of Systematic Reviews. 2010 (2): CD003208. doi:10.1002/14651858.CD003208.pub2. PMC 9006525. PMID 15106195.
- ^ a b Gray OM, McDonnell GV, Forbes RB (August 2006). "A systematic review of oral methotrexate for multiple sclerosis". Multiple Sclerosis. 12 (4): 507–10. doi:10.1191/1352458506ms1299oa. PMID 16900766. S2CID 46120577.
- ^ Ntali S, Bertsias G, Boumpas DT (June 2011). "Cyclophosphamide and lupus nephritis: when, how, for how long?". Clinical Reviews in Allergy & Immunology. 40 (3): 181–91. doi:10.1007/s12016-009-8196-0. PMID 20107927. S2CID 11902371.
- ^ "NCCN Guidelines: Systemic Light Chain Amyloidosis" (PDF). National Comprehensive Cancer Network. Archived from the original (PDF) on 25 June 2021. Retrieved 25 February 2015.
- ^ Bacigalupo A, Ballen K, Rizzo D, Giralt S, Lazarus H, Ho V, Apperley J, Slavin S, Pasquini M, Sandmaier BM, Barrett J, Blaise D, Lowski R, Horowitz M (December 2009). "Defining the intensity of conditioning regimens: working definitions". Biology of Blood and Marrow Transplantation. 15 (12): 1628–33. doi:10.1016/j.bbmt.2009.07.004. PMC 2861656. PMID 19896087.
- ^ Sorsa M, Hämeilä M, Järviluoma E (September 2006). "Handling anticancer drugs: from hazard identification to risk management?". Annals of the New York Academy of Sciences. 1076 (1): 628–34. Bibcode:2006NYASA1076..628S. doi:10.1196/annals.1371.008. PMID 17119240. S2CID 7081365.
- ^ a b c d e Thomas h. Connor, PhD (March 2014). "Chemotherapy: Biomarkers of Exposure, Effect, Reproductive Hazards, and Cancer". The Oncology Pharmacist.
- ^ a b "Personal protective equipment for health care workers who work with hazardous drugs". 2008. doi:10.26616/NIOSHPUB2009106.
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ Antineoplastic drugs: Occupational exposure and health risks. 2006. ISBN 978-90-393-4331-9.
- ^ a b c "preventing occupational exposure to antineoplastic and other hazardous drugs in health care settings" (PDF).
- ^ "Hazardous Drugs Program Guides". lni.wa.gov. Archived from the original on 27 October 2019. Retrieved 22 November 2018.
- ^ Reinhardt, Peter A. (29 November 2017). Infectious and Medical Waste Management. ISBN 9781315894430.[페이지 필요]
- ^ "Safe management of wastes from health-care activities" (PDF). WHO.
- ^ DeJoy DM, Smith TD, Woldu H, Dyal MA, Steege AL, Boiano JM (July 2017). "Effects of organizational safety practices and perceived safety climate on PPE usage, engineering controls, and adverse events involving liquid antineoplastic drugs among nurses". Journal of Occupational and Environmental Hygiene. 14 (7): 485–493. doi:10.1080/15459624.2017.1285496. PMID 28326998. S2CID 3879822.
- ^ Ian Olver (19 October 2010). The MASCC Textbook of Cancer Supportive Care and Survivorship. Springer Science & Business Media. p. 351. ISBN 978-1-4419-1225-1.
- ^ Holland JF, Pollock RE (2010). Holland-Frei Cancer Medicine 8. PMPH-USA. p. 1758. ISBN 978-1-60795-014-1.
- ^ Krumbhaar EB (1919). "Role of the blood and the bone marrow in certain forms of gas poisoning". JAMA. 72: 39–41. doi:10.1001/jama.1919.26110010018009f.
- ^ a b c Fenn JE, Udelsman R (March 2011). "First use of intravenous chemotherapy cancer treatment: rectifying the record". Journal of the American College of Surgeons. 212 (3): 413–7. doi:10.1016/j.jamcollsurg.2010.10.018. PMID 21247779.
- ^ Chabner BA, Roberts TG (January 2005). "Timeline: Chemotherapy and the war on cancer". Nature Reviews. Cancer. 5 (1): 65–72. doi:10.1038/nrc1529. PMID 15630416. S2CID 205467419.
- ^ Faguet GB (2005). The War on Cancer. Springer. p. 71. ISBN 978-1-4020-3618-7.
- ^ Joensuu H (March 2008). "Systemic chemotherapy for cancer: from weapon to treatment". The Lancet. Oncology. 9 (3): 304. doi:10.1016/S1470-2045(08)70075-5. PMID 18308256.
- ^ a b DeVita VT, Chu E (November 2008). "A history of cancer chemotherapy". Cancer Research. 68 (21): 8643–53. doi:10.1158/0008-5472.CAN-07-6611. PMID 18974103.
- ^ Nichols HJ, Walker JE (March 1923). "Experimental Observations on the Prophylaxis and Treatment of Syphilis". The Journal of Experimental Medicine. 37 (4): 525–42. doi:10.1084/jem.37.4.525. PMC 2128372. PMID 19868743.
- ^ "Top 10 best-selling cancer drugs of 2013". FiercePharma. 29 May 2014.
- ^ a b Chidambaram M, Manavalan R, Kathiresan K (2011). "Nanotherapeutics to overcome conventional cancer chemotherapy limitations". Journal of Pharmacy & Pharmaceutical Sciences. 14 (1): 67–77. doi:10.18433/J30C7D. PMID 21501554.
- ^ a b Teicher BA, Chari RV (October 2011). "Antibody conjugate therapeutics: challenges and potential". Clinical Cancer Research. 17 (20): 6389–97. doi:10.1158/1078-0432.CCR-11-1417. PMID 22003066.
- ^ Sievers EL, Linenberger M (November 2001). "Mylotarg: antibody-targeted chemotherapy comes of age". Current Opinion in Oncology. 13 (6): 522–7. doi:10.1097/00001622-200111000-00016. PMID 11673694. S2CID 27827980.
- ^ Taléns-Visconti R, Díez-Sales O, de Julián-Ortiz JV, Nácher A (April 2022). "Nanoliposomes in Cancer Therapy: Marketed Products and Current Clinical Trials". International Journal of Molecular Sciences. 23 (8): 4249. doi:10.3390/ijms23084249. PMC 9030431. PMID 35457065.
- ^ Vines T, Faunce T (May 2009). "Assessing the safety and cost-effectiveness of early nanodrugs". Journal of Law and Medicine. 16 (5): 822–45. PMID 19554862.
- ^ Heller R, Gilbert R, Jaroszeski MJ (January 1999). "Clinical applications of electrochemotherapy". Advanced Drug Delivery Reviews. 35 (1): 119–129. doi:10.1016/S0169-409X(98)00067-2. PMID 10837693.
- ^ Larkin JO, Collins CG, Aarons S, Tangney M, Whelan M, O'Reily S, Breathnach O, Soden DM, O'Sullivan GC (March 2007). "Electrochemotherapy: aspects of preclinical development and early clinical experience". Annals of Surgery. 245 (3): 469–79. doi:10.1097/01.sla.0000250419.36053.33. PMC 1877027. PMID 17435555.
- ^ a b Marty M, Sersa G, Garbay JR, Gehl J, Collins CG, Snoj M, Billard V, Geertsen PF, Larkin JO, Miklavcic D, Pavlovic I, Paulin-Kosir SM, Cemazar M, Morsli N, Soden DM, Rudolf Z, Robert C, O'Sullivan GC, Mir LM (2006). "Electrochemotherapy – An easy, highly effective and safe treatment of cutaneous and subcutaneous metastases". Eur J Cancer Suppl. 4 (11): 3–13. doi:10.1016/j.ejcsup.2006.08.002.
- ^ Möller MG, Salwa S, Soden DM, O'Sullivan GC (November 2009). "Electrochemotherapy as an adjunct or alternative to other treatments for unresectable or in-transit melanoma". Expert Review of Anticancer Therapy. 9 (11): 1611–30. doi:10.1586/era.09.129. PMID 19895245. S2CID 1630835.
- ^ Testori A, Tosti G, Martinoli C, Spadola G, Cataldo F, Verrecchia F, Baldini F, Mosconi M, Soteldo J, Tedeschi I, Passoni C, Pari C, Di Pietro A, Ferrucci PF (2010). "Electrochemotherapy for cutaneous and subcutaneous tumor lesions: a novel therapeutic approach". Dermatologic Therapy. 23 (6): 651–61. doi:10.1111/j.1529-8019.2010.01370.x. PMID 21054709. S2CID 46534637.
- ^ Hampton T (February 2011). "Electric pulses help with chemotherapy, may open new paths for other agents". JAMA. 305 (6): 549–51. doi:10.1001/jama.2011.92. PMID 21304073.
- ^ Mir LM, Gehl J, Sersa G, Collins CG, Garbay JR, Billard V, Geertsen PF, Rudolf Z, O'Sullivan GC, Marty M (2006). "Standard operating procedures of the electrochemotherapy: Instructions for the use of bleomycin or cisplatin administered either systemically or locally and electric pulses delivered by the Cliniporator™ by means of invasive or non-invasive electrodes". Eur J Cancer Suppl. 4 (11): 14–25. doi:10.1016/j.ejcsup.2006.08.003.
- ^ Soden DM, Larkin JO, Collins CG, Tangney M, Aarons S, Piggott J, Morrissey A, Dunne C, O'Sullivan GC (February 2006). "Successful application of targeted electrochemotherapy using novel flexible electrodes and low dose bleomycin to solid tumours". Cancer Letters. 232 (2): 300–10. doi:10.1016/j.canlet.2005.03.057. PMID 15964138.
- ^ Miklavcic D, Snoj M, Zupanic A, Kos B, Cemazar M, Kropivnik M, Bracko M, Pecnik T, Gadzijev E, Sersa G (February 2010). "Towards treatment planning and treatment of deep-seated solid tumors by electrochemotherapy". BioMedical Engineering OnLine. 9 (1): 10. doi:10.1186/1475-925X-9-10. PMC 2843684. PMID 20178589.
- ^ Issels R (1999). "Hyperthermia Combined with Chemotherapy – Biological Rationale, Clinical Application, and Treatment Results" (PDF). Onkologie. 22 (5): 374–381. doi:10.1159/000026986. S2CID 37581171.
- ^ McKnight JA (May 2003). "Principles of chemotherapy". Clinical Techniques in Small Animal Practice. 18 (2): 67–72. doi:10.1053/svms.2003.36617. PMID 12831063. S2CID 39060053.