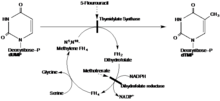티미딜산합성효소
Thymidylate synthase| 티미딜산합성효소 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 티미딜산합성효소 호모디머, 인간 | |||||||||
| 식별자 | |||||||||
| EC 번호 | 2.1.1.45 | ||||||||
| CAS 번호 | 9031-61-2 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 엔트리 | ||||||||
| ExPASy | NiceZyme 뷰 | ||||||||
| 케그 | KEGG 엔트리 | ||||||||
| 메타사이크 | 대사 경로 | ||||||||
| 프라이머리 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBum | ||||||||
| 진 온톨로지 | AmiGO / QuickGO | ||||||||
| |||||||||
| 티미딜산합성효소 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| 기호. | Tymidylat_synt | ||||||||
| 팜 | PF00303 | ||||||||
| 인터프로 | IPR000398 | ||||||||
| 프로 사이트 | PDOC00086 | ||||||||
| SCOP2 | 1ty/SCOPe/SUPFAM | ||||||||
| |||||||||
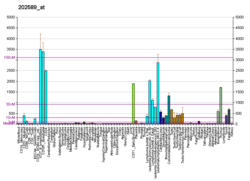
티미딜산합성효소(TS)(EC 2.1.1.45)[5]는 디옥시우리딘 일인산(dUMP)을 디옥시티미딘 일인산(dTMP)으로 변환하는 것을 촉매하는 효소이다.티미딘은 DNA에 있는 뉴클레오티드 중 하나이다.TS의 억제와 함께 디옥시뉴클레오티드의 불균형과 dUMP의 수치가 증가한다.둘 다 DNA [6][7]손상을 일으킵니다.
기능.
티미딜산합성효소에 의해 다음과 같은 반응이 촉매된다.
- 5,10-메틸렌테트라히드로폴레이트 + dUMP { \ 디히드로폴레이트 + dTMP
환원메틸화에 의해 디옥시우리딘1인산(dUMP)과 N5, N10-메틸렌테트라히드로폴산염을 2차 생성물로 하여 dTMP를 형성한다.
이것은 dTMP 생성을 위한 유일한 de novo 경로를 제공하며, 엽산 대사에서 5,10-메틸렌테트라히드로폴산이 1탄소 [8]이동 중에 산화되는 유일한 효소이다.이 효소는 정상적인 DNA 복제에서 4개의 DNA 전구체의 균형 있는 공급을 조절하는데 필수적이다: 조절 과정에 영향을 미치는 효소 활성의 결함은 흉선 없는 [9]죽음과 같은 다양한 생물학적, 유전적 이상을 일으킨다.그 효소는 특정 화학요법 약물의 중요한 표적이다.티미딜산합성효소는 원생동물과 식물을 제외한 대부분의 종에서 약 30~35kDa의 효소이며, 디히드로폴산 환원효소 [8]도메인을 포함하는 2관능성 효소로 존재한다.시스테인 잔기는 촉매 메커니즘에 관여한다(5,6-dihydro-dUMP 중간체를 공유 결합).이 효소의 활성 부위 주변의 배열은 파지에서 척추 동물로 보존됩니다.
티미딜산합성효소는 전사인자 LSF/TFCP2에 의해 유도되며 LSF는 간세포암의 종양유전자이다.LSF와 티미딜레이트 합성효소는 간암의 증식과 진행 및 약물 [10]내성에 중요한 역할을 한다.
임상적 의의
티미딜산합성효소(TS)는 DNA 생합성 [11]초기 단계에서 중요한 역할을 한다.DNA 손상 또는 결실은 내인성 및 환경적 요인 둘 다의 결과로 매일.자외선 피해와 각종 발암물질이 [12]함유된 담배 연기 등이 환경적 요인이다.따라서 건강한 DNA의 합성과 삽입은 정상적인 신체 기능과 암 활동 회피를 위해 필수적이다.또한 세포 성장에 필요한 중요한 뉴클레오티드의 합성 억제가 중요하다.이 때문에 TS는 화학요법에 의한 암 치료의 중요한 표적이 되고 있다.TS의 TS 억제제에 대한 감수성은 대장암, 췌장암, 난소암,[11] 위암, 유방암 치료 성공 비결이다.
TS를 약물 표적으로 사용
TS 억제제의 사용은 TS를 약물 표적으로 사용하는 주요 초점이 되었다.가장 널리 사용되는 억제제는 5-플루오로우라실(5-FU)로, 경쟁 [13][14]결합에 의해 TS를 불가역적으로 억제하는 대사물 역할을 한다.그러나 많은 환자에게서 발견되는 낮은 수준의 5-FU로 인해, 5-FU는 류코보린(LV)과 함께 종양 진행 메커니즘을 낮추고 면역 체계 활동을 [15]증가시키는데 더 큰 성공을 거두는 것으로 밝혀졌다.
실험적으로 TS 발현 수준이 낮으면 5-FU에 대한 반응이 개선되고 대장암 [11]및 간암 환자의 성공률과 생존율이 높아지는 것으로 나타났다.그러나 추가 실험에서는 폐선암 환자의 질병 단계, 세포 증식 및 종양 분화와 관련된 TS의 수준이 있을 수 있지만 낮은 수치가 반드시 높은 성공을 나타내는 것은 아니다.TS mRNA의 발현 수준은 특정 암세포의 악성 가능성을 예측하는 데 도움이 될 수 있으며, 따라서 암 치료 대상을 개선하고 암 환자들 사이에서 더 높은 생존율을 산출할 수 있다[하시모토].
TS의 세포 주기와의 관계도 암 치료에서의 사용에 기여한다.여러 세포 주기 의존성 키나아제 및 전사 인자는 세포 주기의 TS 수준에 영향을 미치며, 이는 S기 동안 활성을 증가시키지만 세포가 [11]더 이상 증식하지 않는 동안 활성을 감소시킨다.자동 조절 방식으로 TS는 자신의 번역뿐만 아니라 돌연변이를 통해 많은 종양 증식의 근원이 되는 p53과 같은 다른 단백질의 번역도 제어합니다.TS는 그 번역을 통해 암세포와 종양에서 다양한 발현을 보이며, 이는 [14]조기 세포사로 이어진다.
인터랙티브 패스 맵
아래의 유전자, 단백질 및 대사물을 클릭하여 각각의 기사와 연결하세요.[§ 1]
- ^ 대화형 경로 맵은 WikiPathways에서 편집할 수 있습니다."FluoropyrimidineActivity_WP1601".
메커니즘 설명
제안된 기구에서 TS는 시스테인 친핵체를 포함한 1,4-첨가를 통해 기판 dUMP에 공유결합을 형성한다.기질 테트라히드로폴레이트는 dUMP의 새로운 메틸기를 환원하여 dTMP를 [16]형성하면서 α카본에 메틸기를 공여한다.
THF 및 dUMP와의 반응을 통해 형성되는 이미인은 메커니즘의 완료를 저해하는 TS 구조의 돌연변이를 통해 dUMP와의 반응의 중간체임이 확인되었다.양쪽 서브유닛에서 C 말단 발린이 결실된 돌연변이 V316Am TS는 위에서 설명한 메커니즘에 앞서 BrdUMP의 탈할로겐화와 THF 및 dUMP에 대한 공유 결합의 촉매를 가능하게 한다. 돌연변이 TS는 다음과 같이 DMP를 형성하기 위해 공유 결합을 파괴하기 위해 필요한 C 말단 구성 변화를 달성할 수 없다.사실이 될 수 있는 메커니즘입니다.이 구조는 V316Am TS의 X선 결정학을 통해 추론되어 완전한 호모디머 TS 구조를 보여줍니다(그림 1).또한 175Arg와 174Arg의 이합체 간 상호작용이 가능한 것으로 나타났다.이러한 아르기닌은 인산기에 수소 결합을 생성함으로써 활성 부위 내의 UMP 구조를 안정화시키는 것으로 생각된다(그림2).[부드럽고 미세한 무어][citation needed]5-FU는 TS의 억제제입니다세포에 들어가면 5-플루오로라실(5-FU)은 세포 내에서 다양한 활성 대사물로 전환됩니다.이러한 대사물 중 하나는 FdUMP이며, 이는 α 탄소 위의 수소 대신 불소로 dUMP와 다르다.FdUMP는 dUMP의 뉴클레오티드 결합 부위에 결합함으로써 TS를 억제할 수 있으며, 이 경쟁 결합은 dUMP[Longley][citation needed]로부터의 dTMP 합성의 정상적인 기능을 억제한다.따라서 dUMP는 제거 반응을 가질 수 없으며 THF로부터의 메틸기증을 완료할 수 없다.
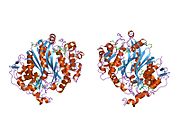
그림 1이 그림은 TS라는 호모디머를 나타내고 있습니다.보시다시피 주황색과 청록색의 백본은 연결되거나 얽히지 않지만, 다이머 사이에는 사이드 체인이 상호 작용합니다.주황색 단백질에서는 청록색 단백질로 들어가는 두 개의 긴 사이드 체인을 눈에 띄게 검출할 수 있습니다(이것은 노란색 원 안에 있습니다).다른 베이지색 부품은 활성 부위 내에서 상호 작용하는 사이드 체인입니다.노란색 원 바로 아래에 동일한 패턴의 사이드 체인 및 구성을 볼 수 있습니다.
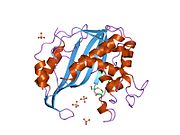
그림 2이 그림은 티미딜산합성효소의 활성 부위에서 아르기닌과 UMP 사이의 가능한 H-결합 상호작용을 보여준다.이것은 파란색 끝과 빨간색 끝 사이의 희미한 선으로 알 수 있습니다.이들 아르기닌은 상호작용이 올바르게 이루어지도록 UMP 분자의 위치를 유지하는 데 사용됩니다.오른쪽 위 구석에 있는 두 개의 아르기닌은 사실 이합체 효소의 다른 단백질로부터 나온 것입니다.이 상호작용은 이 두 개의 3차 구조를 함께 유지하는 분자간 힘 중 하나입니다.상단-중간 영역의 노란색 스탠드는 시스테인 측 체인과 UMP 사이에 형성되는 유황 결합을 나타내며, UMP가 반응하여 TMP가 생성될 때까지 UMP를 활성 부위 내에 공유적으로 유지합니다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c GRCh38: 앙상블 릴리즈 89: ENSG00000176890 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리즈 89: ENSMUSG000025747 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Entrez Gene: TYMS thymidylate synthetase".
- ^ "DNA: Form and Function" (PDF).
- ^ "DNA Synthesis".
- ^ a b Stroud RM, Santi DV, Hardy LW, Montfort WR, Jones MO, Finer-Moore JS (1987). "Atomic structure of thymidylate synthase: target for rational drug design". Science. 235 (4787): 448–455. Bibcode:1987Sci...235..448H. doi:10.1126/science.3099389. PMID 3099389.
- ^ Gotoh O, Shimizu K, Kaneda S, Nalbantoglu J, Takeishi K, Seno T, Ayusawa D (1990). "Structural and functional analysis of the human thymidylate synthase gene". J. Biol. Chem. 265 (33): 20277–20284. doi:10.1016/S0021-9258(17)30501-X. PMID 2243092.
- ^ Santhekadur PK, Rajasekaran D, Siddiq A, Gredler R, Chen D, Schaus SE, Hansen U, Fisher PB, Sarkar D (2012). "The transcription factor LSF: a novel oncogene for hepatocellular carcinoma" (PDF). Am J Cancer Res. 2 (3): 269–85. PMC 3365805. PMID 22679558.
- ^ a b c d Peters GJ, Backus HH, Freemantle S, van Triest B, Codacci-Pisanelli G, van der Wilt CL, Smid K, Lunec J, Calvert AH, Marsh S, McLeod HL, Bloemena E, Meijer S, Jansen G, van Groeningen CJ, Pinedo HM (2002). "Induction of thymidylate synthase as a 5-fluorouracil resistance mechanism". Biochim. Biophys. Acta. 1587 (2–3): 194–205. doi:10.1016/S0925-4439(02)00082-0. PMID 12084461.
- ^ "Leucovorin". MedlinePlus Drug Information. U.S. National Library of Medicine.
- ^ Papamichael D (2000). "The Use of Thymidylate Synthase Inhibitors in the Treatment of Advanced Colorectal Cancer: Current Status". The Oncologist. 4 (6): 478–87. doi:10.1634/theoncologist.4-6-478. PMID 10631692.
- ^ a b Papamichael D (1999). "The use of thymidylate synthase inhibitors in the treatment of advanced colorectal cancer: current status". Oncologist. 4 (6): 478–87. doi:10.1634/theoncologist.4-6-478. PMID 10631692.
- ^ Nicolini A, Conte M, Rossi G, Ferrari P, Duffy M, Barak V, Carpi A, Miccoli P (2011). "Additional 5-FU-LV significantly increases survival in gastrointestinal cancer". Front Biosci. 3: 1475–82. doi:10.2741/348. PMID 21622151.
- ^ Carreras CW, Santi DV (1995). "The catalytic mechanism and structure of thymidylate synthase". Annu. Rev. Biochem. 64: 721–62. doi:10.1146/annurev.bi.64.070195.003445. PMID 7574499.
추가 정보
- Carreras CW, Santi DV (1995). "The Catalytic Mechanism and Structure of Thymidylate Synthase". Annual Review of Biochemistry. 64 (1): 721–762. doi:10.1146/annurev.bi.64.070195.003445. PMID 7574499.
- Banerjee D, Mayer-Kuckuk P, Capiaux G, et al. (2002). "Novel aspects of resistance to drugs targeted to dihydrofolate reductase and thymidylate synthase". Biochim. Biophys. Acta. 1587 (2–3): 164–73. doi:10.1016/S0925-4439(02)00079-0. PMID 12084458.
- Liu J, Schmitz JC, Lin X, et al. (2002). "Thymidylate synthase as a translational regulator of cellular gene expression". Biochim. Biophys. Acta. 1587 (2–3): 174–82. doi:10.1016/s0925-4439(02)00080-7. PMID 12084459.
- Chu J, Dolnick BJ (2002). "Natural antisense (rTSalpha) RNA induces site-specific cleavage of thymidylate synthase mRNA". Biochim. Biophys. Acta. 1587 (2–3): 183–93. doi:10.1016/s0925-4439(02)00081-9. PMID 12084460.
- Peters GJ, Backus HH, Freemantle S, et al. (2002). "Induction of thymidylate synthase as a 5-fluorouracil resistance mechanism". Biochim. Biophys. Acta. 1587 (2–3): 194–205. doi:10.1016/S0925-4439(02)00082-0. PMID 12084461.
- Costi MP, Tondi D, Rinaldi M, et al. (2002). "Structure-based studies on species-specific inhibition of thymidylate synthase". Biochim. Biophys. Acta. 1587 (2–3): 206–14. doi:10.1016/s0925-4439(02)00083-2. PMID 12084462.
- Lin D, Li H, Tan W, et al. (2007). Genetic polymorphisms in folate- metabolizing enzymes and risk of gastroesophageal cancers: a potential nutrient-gene interaction in cancer development. Forum of Nutrition. Vol. 60. pp. 140–5. doi:10.1159/000107090. ISBN 978-3-8055-8216-2. PMID 17684410.