면역 요법
Immunotherapy| 면역 요법 | |
|---|---|
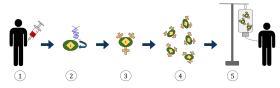 위 그림은 키메라 항원 수용체 T세포 치료(CAR)의 과정을 나타낸 것으로, 암 치료에서 증가하고 있는 면역 치료법이다.최종 결과는 몸 안의 감염된 암세포를 인식하고 싸울 수 있는 장비를 갖춘 T세포의 생산이다.
| |
| 메쉬 | D007167 |
| OPS-301 코드 | 8-03 |
면역요법 또는 생물학적 치료는 면역체계를 활성화하거나 억제하여 질병을 치료하는 것이다.면역반응을 유도 또는 증폭시키기 위해 설계된 면역요법은 활성화 면역요법으로 분류되며, 감소 또는 억제하는 면역요법은 억제 면역요법으로 분류된다.면역 요법은 다양한 형태의 [1][2][3][4]암을 치료할 수 있는 가능성에 대한 예비 연구가 진행 중이다.
세포에 의한 면역요법은 일부 암에 효과적이다.림프구, 대식세포, 수지상세포, 천연킬러세포, 세포독성T림프구 등 면역이펙터세포가 함께 작용해 종양세포 표면에 발현되는 이상항원을 노려 암을 예방한다.COVID-19에 대한 백신 유도 면역은 대부분 면역 조절 T 세포 [5]반응에 의존한다.
과립구 콜로니 자극인자(G-CSF), 간섭자, 이미퀴모드 및 박테리아로부터의 세포막 분율 등의 치료법이 의학용으로 허가된다.IL-2, IL-7, IL-12, 다양한 케모카인, 합성 시토신 인산구아노신(CpG) 올리고데옥시뉴클레오티드 및 글루칸을 포함한 다른 것들은 임상 및 임상 전 연구에 관여한다.
면역조절제
면역조절제는 면역요법의 활성제이다.그것들은 재조합, 합성 및 [6]천연 제제의 다양한 배열이다.
| 학급 | 샘플 에이전트 |
|---|---|
| 인터류킨 | IL-2, IL-7, IL-12 |
| Cytokines | 간섭기, G-CSF |
| 케모카인 | CCL3, CCL26, CXCL7 |
| 면역조절이미드제(IMiD) | 탈리도마이드 및 그 유사체(레날리도마이드, 포말리도마이드 및 아프리마스트), BCG [7][8]백신 및 Covid[9][10][5] 백신 |
| 다른. | 시토신인산염-글루코신, 올리고데옥시뉴클레오티드, 글루칸 |
활성화 면역요법
암
암 치료는 암세포와 종양을 죽이거나 제거하는 데 초점이 맞춰져 있었으며, 화학요법이나 수술이나 방사선 치료를 받았다.이러한 치료법은 매우 효과적일 수 있으며 많은 경우 여전히 사용되고 있습니다.2018년 노벨 생리의학상은 제임스 P.에게 수여되었다. 앨리슨과 혼조 타스쿠 "부정 면역 조절 억제에 의한 암 치료 발견"암 면역 요법은 면역 체계를 자극하여 종양을 파괴하려고 시도한다.다양한 전략이 사용 중이거나 조사 및 테스트 중입니다.서로 다른 암에서 무작위 대조군 연구로[2] 생존 기간과 무병 기간이 크게 증가했으며 세포 기반 면역 치료를 기존 치료 [2]방법과 결합하면 그 효과가 20-30% 향상되었다.
암 면역 요법의 가장 오래된 형태 중 하나는 BCG 백신을 사용하는 것인데, BCG 백신은 원래 결핵 예방 접종을 위한 것이었고 나중에 방광암 [11]치료에 유용한 것으로 밝혀졌다.BCG 면역요법은 국소 면역반응과 전신 면역반응을 유도한다.BCG 면역요법이 종양 면역을 매개하는 메커니즘은 널리 연구되어 왔지만 아직 완전히 이해되지는 [12]않았다.
암 치료에 모노클로널 항체를 사용하는 것은 1997년 B세포 림프종 [13]치료를 위한 항CD20 항체인 리턱시맙과 함께 처음 도입되었다.그 이후로 여러 모노클로널 항체는 다양한 혈액학적 악성종양의 치료뿐만 아니라 고형 [14][15]종양에 대해서도 승인되었다.
적절한 자극성 사이토카인을 세포에 재주입하기 전에 혈액에서 G-CSF 림프구를 추출하고 종양 항원에 대해 체외로 확장하는 것.그 후 세포는 [16]항원을 발현하는 종양세포를 파괴한다.국소면역요법은 인터페론을 생성하는 면역강화크림(이미퀴모드)을 이용해 사마귀,[17] 방선각화증,[18] 기저세포암, 질상피내종,[22] 편평세포암,[19][20] 피부림프종,[21] 표피악성흑색종을 파괴한다.주사면역요법("intralesional" 또는 "intratumoural")은 사마귀(HPV 유도 종양)를 치료하기 위해[23][24] 유행성 이하선염, 칸디다, HPV 백신 또는 트리코피틴 항원 주사를 사용한다.
입양 세포 이식은 폐암과 다른 암에 대해[25] 테스트되었으며 흑색종에서 가장 큰 성공을 거두었다.
수지상 세포 기반 펌프 프라이밍 또는 백신 접종
수지상세포(DC)는 항원에 대한 세포독성반응을 활성화하기 위해 자극될 수 있다.항원제시세포의 일종인 수지상세포는 면역치료를 필요로 하는 사람으로부터 채취된다.그런 다음 이 세포들은 항원 또는 종양 용해액으로 펄스되거나 바이러스 벡터로 트랜스펙트되어 항원을 표시하게 된다.사람에게 수혈하면, 이러한 활성화된 세포는 이펙터 림프구(CD4+ 도우미 T 세포, 세포독성 CD8+ T 세포 및 B 세포)에 항원을 제공합니다.이것은 항원을 발현하는 종양 세포에 대한 세포독성 반응을 개시한다(적응 반응은 이제 준비되었다).FDA가 승인한 최초의 세포 기반 면역 [26]치료제인 암 백신 Sipuleucel-T가 이 접근법의 [27]한 예이다.IRC(Immune Response Corporation[28])는 이 면역요법을 개발해 Dendreon에 이 기술을 허가했고, Dendreon은 FDA 승인을 받았다.
DC 기반 예방접종에 대한 현재 접근법은 주로 단구 또는 CD34+ 세포에서 체외로 생성된 DC에 항원 부하를 적용하여 서로 다른 TLR 배위자, 사이토카인 조합으로 활성화하고 환자에게 다시 주입한다.생체내 표적화 접근법은 특정 사이토카인(예: Flt3L, GM-CSF)을 투여하고 관심 항원과 결합된 C형 렉틴 수용체에 대한 항체 또는 작용제 항체(예: 항CD40)를 가진 DC를 표적화한다.향후 접근법은 특이적으로 발현되는 C-타입 렉틴 수용체 또는 케모카인 수용체에 기초한 DC 서브셋을 목표로 할 수 있다.또 다른 잠재적 접근법은 유도 다능성 줄기세포로부터 유전적으로 조작된 DC를 생성하고 더 나은 [29]임상 결과를 유도하기 위해 네오안티겐을 탑재한 DC를 사용하는 것이다.
T세포 입양 전이
시험관내 세포이식은 나중에 [30]수혈하기 위해 추출된 자가 T세포를 배양한다.
또는 T세포를 채취하여 종양항원을 인식하도록 특화된 T세포수용체(TCR) 유전자의 복사본을 포함하는 레트로바이러스에 의해 T세포를 감염시킴으로써 유전공학적 T세포가 생성된다.바이러스는 T세포의 게놈에 수용체를 통합한다.세포는 비특이적으로 확장되거나 자극됩니다.그 세포들은 다시 주입되고 종양 [31]세포에 대한 면역 반응을 일으킨다.이 기술은 난치성 4기 전이성[30] 흑색종과 진행성 [32][33][34]피부암에서 테스트되었다.FDA가 승인한 첫 번째 CAR-T 약물인 Kymriah는 이 접근법을 사용했다.노바티스는 이 CAR-T의 임상 및 상용 공급을 얻기 위해 제조 공장인 유통 시스템을 매입하고 Dendreon과 Immune Response [35]Corporation이 개발한 Sipuleucel-T를 생산하는 생산팀을 고용했다.
T세포가 유전자 조작되었는지 여부에 관계없이, 재투입 전에, 항상성 사이토카인을 [30][36][37][38]위해 전달된 세포와 경쟁하는 조절 T세포뿐만 아니라 변형되지 않은 내인성 림프구를 제거하기 위해 수용체의 림프 결핍이 필요하다.림프절제술은 골수성 화학요법에 의해 달성될 수 있으며, 이 화학요법에 전신 방사선이 더해져 더 [39]큰 효과를 얻을 수 있다.전달된 세포는 체내 증식하여 많은 사람의 말초혈액에서 지속되었으며,[40] 주입 후 6-12개월에 전체 CD8+ T 세포의 75% 수준을 나타내기도 했다.2012년 현재[update], 전이성 흑색종에 대한 임상시험이 여러 [41]부위에서 진행 중이다.T세포의 입양 전이에 대한 임상 반응은 다중 면역치료에 [42]내성이 있는 전이성 흑색종 환자에서 관찰되었다.
체크포인트 억제제
항PD-1/PD-L1 항체와 항CTLA-4 항체는 현재 환자에게 제공되는 두 가지 유형의 체크포인트 억제제이다.인체 사용을 위한 항세포독성 T림프구 관련 단백질 4(CTLA-4) 및 항프로그램 세포사망 단백질 1(PD-1) 항체의 승인으로 다양한 [43]암에 대한 질병 결과가 유의미하게 개선되었습니다.
이 분자들은 원래 T세포 활성화 또는 아포토시스에 역할을 하는 분자로 발견되었지만, 후속 임상 전 연구는 말초 면역 내성을 [44]유지하는 데 있어 중요한 역할을 보여주었다.
면역 검사점 억제제는 흑색종, 유방암, 방광암, 자궁경부암, 대장암, 두경부암 또는 호지킨 림프종을 [45]포함한 다양한 종류의 암 환자를 치료하도록 승인되었습니다.
이러한 치료법은 암 면역 치료에 혁명을 일으켰습니다. 전이성 흑색종 연구는 가장 면역성이 높은 인간 암 중 하나로 여겨지며, 이러한 [44]치료법으로부터 장기간에 걸쳐 혜택을 받는 환자 그룹이 증가하고 있습니다.
면역력 강화 요법
자가면역증강요법은 사람 자신의 말초혈액 유래 자연살해세포, 세포독성 T림프구, 상피세포 및 기타 관련 면역세포를 체외에서 확장한 후 재주입한다.[46]이 [47][48][49]치료법은 C형 간염[50][51], 만성피로증후군, HHV6 [52]감염에 대한 테스트를 거쳤다.
억제 면역 요법
면역 억제는 자가면역질환의 이상 면역반응을 약화시키거나 정상적인 면역반응을 감소시켜 이식된 장기나 세포의 거부반응을 예방한다.
면역억제제
면역억제제는 장기이식과 자가면역질환 관리에 도움이 된다.면역반응은 림프구 증식에 따라 달라진다.세포진통제들은 면역억제제이다.글루코콜티코이드는 림프구 활성화의 억제제이며, 면역호필린의 억제제는 T림프구 활성화를 더 구체적으로 목표로 한다.면역 억제 항체는 면역 반응의 단계를 목표로 한다.다른 약들은 면역 반응을 조절하고 면역 조절을 유도하는 데 사용될 수 있다.비타민 D, 덱사메타손, 커큐민과 같은 작은 면역억제 분자에 의한 면역계 조절이 저용량 요법으로 투여되고 피하에 투여되는 것이 만성 [53][54]염증을 예방하거나 치료하는 데 도움이 될 수 있다는 것이 임상 전 실험에서 관찰되었다.
면역 내성
신체는 자연적으로 자신의 조직에 면역 체계 공격을 가하지 않는다.모델은 일반적으로 자가 면역 반응의 중심에서 CD4+ T 셀을 식별합니다.T세포 내성 상실은 B세포와 다른 면역 이펙터 세포를 표적 조직으로 방출한다.이상적인 내성 치료는 자가면역 [55]공격을 조정하는 특정 T세포 클론을 목표로 할 것이다.
면역내성 요법은 자가면역질환에 걸린 자신의 장기나 세포를 잘못 공격하거나 장기이식 [56]시 이물질을 받아들이는 것을 막기 위해 면역체계를 재설정하는 것이다.최근의 치료적 접근법은[when?] 이식 대상자에게 조절 면역 세포를 주입하는 것이다.조절 면역 세포의 전달은 [57][58]이펙터의 활동을 억제할 가능성이 있다.
면역 내성을 만드는 것은 평생 면역 억제와 부수적인 부작용의 필요성을 줄이거나 없앱니다.그것은 이식, 류마티스 관절염, 제1형 당뇨병 및 기타 자가면역 장애에 대해 테스트되었다.
| 촬영장비 | 세부 사항 | ||
| 비항원 고유 | • 모노클로널 항체 | 삭제하다 안티CD52 안티 CD4 안티LFA2 | 소비하지 않다 안티 CD4 안티 CD3 안티LFA-1 CTLA4-Ig 안티 CD25 |
| • 조혈모세포 이식 | 비골수성 | 골수성 | |
| • 간엽 줄기세포 이식 | |||
| • 조절 T 세포 치료 | 비항원 고유 | 항원 특이적 | |
| • 조절 T세포 확장을 위한 저선량 IL-2 | |||
| • 마이크로바이옴 조작 | |||
| 항원특이성 | • 펩타이드 치료 | 피하, 피하, 피하, 점막(구강, 흡입) 내성 수지상 세포, 리포좀 및 나노 입자 | |
| • 변경된 펩타이드 배위자 | |||
알레르기
면역요법은 또한 알레르기를 치료하는데 사용될 수 있다.알레르기 치료제(항히스타민제나 코르티코스테로이드제 등)는 알레르기 증상을 치료하지만 면역요법은 알레르겐에 대한 민감도를 감소시켜 심각도를 낮출 수 있습니다.
면역 요법은 장기적인 [61]이익을 가져올 수 있다.면역요법은 어떤 사람들에게는 부분적으로 효과적이고 다른 사람들에게는 효과적이지 않지만, 알레르기가 있는 사람들은 [citation needed]그들의 증상을 줄이거나 멈출 수 있는 기회를 제공한다.
알레르기가 심하거나 특정 알레르겐을 피할 수 없는 사람들을 대상으로 한다.
IgE 매개 식품 알레르기는 수백만 명의 사람들에게 영향을 미치고 [62]환자의 삶의 모든 측면에 영향을 미치는 세계적인 건강 문제입니다.음식 알레르기를 치료하기 위한 유망한 접근법은 구강 면역 요법의 사용이다.OIT는 알레르겐의 증가에 대한 점진적인 노출로 구성되며, 대부분의 피험자는 우발적인 [63]노출에 대한 반응을 방지하기에 충분한 양의 음식을 허용하게 된다.사람이 둔감해지면 복용량은 시간이 지남에 따라 증가한다.이 기술은 땅콩 [64]알레르기를 예방하기 위해 유아들에게 시험되었다.
알레르겐 특이 면역 요법(ASIT)은 다양한 알레르겐의 IgE 매개 알레르기 질환 원인 치료의 황금 기준이 되었다.알레르기 메커니즘에 대한 우리의 이해를 더욱 높이고 차세대 [65]환자와 의사의 ASIT를 개선할 수 있는 새로운 개발을 호기심 있게 기다릴 수도 있다.
구충 요법
회충란(Trichuris suis)과 후크웜(Necator Americanus)은 면역학적 질병과 알레르기에 대한 검사를 받았다.다발성[66] 경화증인 크론병,[67][68][69] 알레르기, [70]천식을 재발시키는 치료법으로 헬민틱 요법이 연구되고 있다.헬민스가 면역 반응을 조절하는 메커니즘은 알려지지 않았다.가설화된 메커니즘에는 Th1/Th2[71] 반응의 재분극과 수지상 세포 기능의 [72][73]변조가 포함된다.헬민스 다운은 IL-10, IL-5와 같은 조절 Th2 사이토카인의 생산을 촉진하면서 소염성 Th1 사이토킨, 인터류킨-12(IL-12), 인터페론-감마(IFN-γ), 종양 괴사인자-알파(TNF-α)를 조절한다.
구충과의 공진화는 크론병, 궤양성 대장염, 소아지방병 등 인터류킨 발현과 면역 장애와 관련된 유전자 중 일부를 형성했다.Helminth의 숙주로서의 인간관계는 상호주의적 또는 [75]공생적으로 분류되어야 한다.
「 」를 참조해 주세요.
레퍼런스
- ^ "Immunotherapy Memorial Sloan Kettering Cancer Center". mskcc.org. Retrieved 2017-07-27.
- ^ a b c Syn NL, Teng MW, Mok TS, Soo RA (December 2017). "De-novo and acquired resistance to immune checkpoint targeting". The Lancet. Oncology. 18 (12): e731–e741. doi:10.1016/s1470-2045(17)30607-1. PMID 29208439.
- ^ Conforti L (February 2012). "The ion channel network in T lymphocytes, a target for immunotherapy". Clinical Immunology. 142 (2): 105–106. doi:10.1016/j.clim.2011.11.009. PMID 22189042.
- ^ Wang, S., Zimmermann, S., Parikh, K., Mansfield, A.S., Adjei, A.A.(2019).소세포 폐암의 현재 진단 및 관리.Mayo Clinic Procedures, 94 (8) , 1599 - 1622 .https://doi.org/10.1016/j.mayocp.2019.01.034
- ^ a b Geers D, Shamier MC, Bogers S, den Hartog G, Gommers L, Nieuwkoop NN, et al. (May 2021). "SARS-CoV-2 variants of concern partially escape humoral but not T-cell responses in COVID-19 convalescent donors and vaccinees". Science Immunology. 6 (59): eabj1750. doi:10.1126/sciimmunol.abj1750. PMID 34035118.
- ^ Rizk JG, Kalantar-Zadeh K, Mehra MR, Lavie CJ, Rizk Y, Forthal DN (September 2020). "Pharmaco-Immunomodulatory Therapy in COVID-19". Drugs. 80 (13): 1267–1292. doi:10.1007/s40265-020-01367-z. PMC 7372203. PMID 32696108.
- ^ "Immunomodulators and Their Side Effects". www.cancer.org. Retrieved 2021-06-06.
- ^ Martino A, Casetti R, Poccia F (January 2007). "Enhancement of BCG-induced Th1 immune response through Vgamma9Vdelta2 T cell activation with non-peptidic drugs". Vaccine. 25 (6): 1023–1029. doi:10.1016/j.vaccine.2006.09.070. PMID 17118497.
- ^ Sahin U, Muik A, Derhovanessian E, Vogler I, Kranz LM, Vormehr M, et al. (October 2020). "COVID-19 vaccine BNT162b1 elicits human antibody and TH1 T cell responses". Nature. 586 (7830): 594–599. Bibcode:2020Natur.586..594S. doi:10.1038/s41586-020-2814-7. PMID 32998157.
- ^ Woldemeskel BA, Garliss CC, Blankson JN (May 2021). "SARS-CoV-2 mRNA vaccines induce broad CD4+ T cell responses that recognize SARS-CoV-2 variants and HCoV-NL63". The Journal of Clinical Investigation. 131 (10). doi:10.1172/JCI149335. PMC 8121504. PMID 33822770.
- ^ Fuge O, Vasdev N, Allchorne P, Green JS (2015). "Immunotherapy for bladder cancer". Research and Reports in Urology. 7: 65–79. doi:10.2147/RRU.S63447. PMC 4427258. PMID 26000263.
- ^ Pettenati C, Ingersoll MA (October 2018). "Mechanisms of BCG immunotherapy and its outlook for bladder cancer". Nature Reviews. Urology. 15 (10): 615–625. doi:10.1038/s41585-018-0055-4. PMID 29991725. S2CID 49670901.
- ^ Salles G, Barrett M, Foà R, Maurer J, O'Brien S, Valente N, et al. (October 2017). "Rituximab in B-Cell Hematologic Malignancies: A Review of 20 Years of Clinical Experience". Advances in Therapy. 34 (10): 2232–2273. doi:10.1007/s12325-017-0612-x. PMC 5656728. PMID 28983798.
- ^ Hoos A (April 2016). "Development of immuno-oncology drugs - from CTLA4 to PD1 to the next generations". Nature Reviews. Drug Discovery. 15 (4): 235–247. doi:10.1038/nrd.2015.35. PMID 26965203. S2CID 54550859.
- ^ Pento JT (November 2017). "Monoclonal Antibodies for the Treatment of Cancer". Anticancer Research. 37 (11): 5935–5939. doi:10.21873/anticanres.12040. PMID 29061772.
- ^ Simpson RJ, Bigley AB, Agha N, Hanley PJ, Bollard CM (July 2017). "Mobilizing Immune Cells With Exercise for Cancer Immunotherapy". Exercise and Sport Sciences Reviews. 45 (3): 163–172. doi:10.1249/JES.0000000000000114. PMC 6814300. PMID 28418996.
- ^ van Seters M, van Beurden M, ten Kate FJ, Beckmann I, Ewing PC, Eijkemans MJ, et al. (April 2008). "Treatment of vulvar intraepithelial neoplasia with topical imiquimod". The New England Journal of Medicine. 358 (14): 1465–1473. doi:10.1056/NEJMoa072685. PMID 18385498.
- ^ Buck HW, Guth KJ (October 2003). "Treatment of vaginal intraepithelial neoplasia (primarily low grade) with imiquimod 5% cream". Journal of Lower Genital Tract Disease. 7 (4): 290–293. doi:10.1097/00128360-200310000-00011. PMID 17051086. S2CID 44649376.
- ^ Järvinen R, Kaasinen E, Sankila A, Rintala E (August 2009). "Long-term efficacy of maintenance bacillus Calmette-Guérin versus maintenance mitomycin C instillation therapy in frequently recurrent TaT1 tumours without carcinoma in situ: a subgroup analysis of the prospective, randomised FinnBladder I study with a 20-year follow-up". European Urology. 56 (2): 260–265. doi:10.1016/j.eururo.2009.04.009. PMID 19395154.
- ^ Davidson HC, Leibowitz MS, Lopez-Albaitero A, Ferris RL (September 2009). "Immunotherapy for head and neck cancer". Oral Oncology. 45 (9): 747–751. doi:10.1016/j.oraloncology.2009.02.009. PMC 8978306. PMID 19442565.
- ^ Dani T, Knobler R (January 2009). "Extracorporeal photoimmunotherapy-photopheresis". Frontiers in Bioscience. 14 (14): 4769–4777. doi:10.2741/3566. PMID 19273388.
- ^ Eggermont AM, Schadendorf D (June 2009). "Melanoma and immunotherapy". Hematology/Oncology Clinics of North America. 23 (3): 547–64, ix–x. doi:10.1016/j.hoc.2009.03.009. PMID 19464602.
- ^ Chuang CM, Monie A, Wu A, Hung CF (May 2009). "Combination of apigenin treatment with therapeutic HPV DNA vaccination generates enhanced therapeutic antitumor effects". Journal of Biomedical Science. 16 (1): 49. doi:10.1186/1423-0127-16-49. PMC 2705346. PMID 19473507.
- ^ Pawlita M, Gissmann L (April 2009). "[Recurrent respiratory papillomatosis: indication for HPV vaccination?]". Deutsche Medizinische Wochenschrift (in German). 134 Suppl 2: S100–S102. doi:10.1055/s-0029-1220219. PMID 19353471.
- ^ Kang N, Zhou J, Zhang T, Wang L, Lu F, Cui Y, et al. (August 2009). "Adoptive immunotherapy of lung cancer with immobilized anti-TCRgammadelta antibody-expanded human gammadelta T-cells in peripheral blood". Cancer Biology & Therapy. 8 (16): 1540–1549. doi:10.4161/cbt.8.16.8950. PMID 19471115.
- ^ Cheever MA, Higano CS (June 2011). "PROVENGE (Sipuleucel-T) in prostate cancer: the first FDA-approved therapeutic cancer vaccine". Clinical Cancer Research. 17 (11): 3520–3526. doi:10.1158/1078-0432.CCR-10-3126. PMID 21471425. S2CID 135120.
- ^ Di Lorenzo G, Buonerba C, Kantoff PW (May 2011). "Immunotherapy for the treatment of prostate cancer". Nature Reviews. Clinical Oncology. 8 (9): 551–561. doi:10.1038/nrclinonc.2011.72. PMID 21606971. S2CID 5337484.
- ^ "Sipuleucel-T: APC 8015, APC-8015, prostate cancer vaccine--Dendreon". Drugs in R&D. 7 (3): 197–201. 2006. doi:10.2165/00126839-200607030-00006. PMID 16752945.
- ^ Sabado RL, Balan S, Bhardwaj N (January 2017). "Dendritic cell-based immunotherapy". Cell Research. 27 (1): 74–95. doi:10.1038/cr.2016.157. PMC 5223236. PMID 28025976.
- ^ a b c Rosenberg SA, Restifo NP, Yang JC, Morgan RA, Dudley ME (April 2008). "Adoptive cell transfer: a clinical path to effective cancer immunotherapy". Nature Reviews. Cancer. 8 (4): 299–308. doi:10.1038/nrc2355. PMC 2553205. PMID 18354418.
- ^ Morgan RA, Dudley ME, Wunderlich JR, Hughes MS, Yang JC, Sherry RM, et al. (October 2006). "Cancer regression in patients after transfer of genetically engineered lymphocytes". Science. 314 (5796): 126–129. Bibcode:2006Sci...314..126M. doi:10.1126/science.1129003. PMC 2267026. PMID 16946036.
- ^ Hunder NN, Wallen H, Cao J, Hendricks DW, Reilly JZ, Rodmyre R, et al. (June 2008). "Treatment of metastatic melanoma with autologous CD4+ T cells against NY-ESO-1". The New England Journal of Medicine. 358 (25): 2698–2703. doi:10.1056/NEJMoa0800251. PMC 3277288. PMID 18565862.
- ^ "2008 Symposium Program & Speakers". Cancer Research Institute. Archived from the original on 2008-10-15.
- ^ Highfield R (18 June 2008). "Cancer patient recovers after injection of immune cells". The Telegraph. Archived from the original on 12 September 2008. Retrieved 22 December 2019.
- ^ "UPDATED: Novartis buys Dendreon New Jersey plant". FiercePharma. 20 December 2012. Retrieved 2021-12-09.
- ^ Antony PA, Piccirillo CA, Akpinarli A, Finkelstein SE, Speiss PJ, Surman DR, et al. (March 2005). "CD8+ T cell immunity against a tumor/self-antigen is augmented by CD4+ T helper cells and hindered by naturally occurring T regulatory cells". Journal of Immunology. 174 (5): 2591–2601. doi:10.4049/jimmunol.174.5.2591. PMC 1403291. PMID 15728465.
- ^ Gattinoni L, Finkelstein SE, Klebanoff CA, Antony PA, Palmer DC, Spiess PJ, et al. (October 2005). "Removal of homeostatic cytokine sinks by lymphodepletion enhances the efficacy of adoptively transferred tumor-specific CD8+ T cells". The Journal of Experimental Medicine. 202 (7): 907–912. doi:10.1084/jem.20050732. PMC 1397916. PMID 16203864.
- ^ Dummer W, Niethammer AG, Baccala R, Lawson BR, Wagner N, Reisfeld RA, Theofilopoulos AN (July 2002). "T cell homeostatic proliferation elicits effective antitumor autoimmunity". The Journal of Clinical Investigation. 110 (2): 185–192. doi:10.1172/JCI15175. PMC 151053. PMID 12122110.
- ^ Dudley ME, Yang JC, Sherry R, Hughes MS, Royal R, Kammula U, et al. (November 2008). "Adoptive cell therapy for patients with metastatic melanoma: evaluation of intensive myeloablative chemoradiation preparative regimens". Journal of Clinical Oncology. 26 (32): 5233–5239. doi:10.1200/JCO.2008.16.5449. PMC 2652090. PMID 18809613.
- ^ Dudley ME, Wunderlich JR, Robbins PF, Yang JC, Hwu P, Schwartzentruber DJ, et al. (October 2002). "Cancer regression and autoimmunity in patients after clonal repopulation with antitumor lymphocytes". Science. 298 (5594): 850–854. Bibcode:2002Sci...298..850D. doi:10.1126/science.1076514. PMC 1764179. PMID 12242449.
- ^ Pilon-Thomas S, Kuhn L, Ellwanger S, Janssen W, Royster E, Marzban S, et al. (October 2012). "Efficacy of adoptive cell transfer of tumor-infiltrating lymphocytes after lymphopenia induction for metastatic melanoma". Journal of Immunotherapy. 35 (8): 615–620. doi:10.1097/CJI.0b013e31826e8f5f. PMC 4467830. PMID 22996367.
- ^ Andersen R, Borch TH, Draghi A, Gokuldass A, Rana MA, Pedersen M, et al. (July 2018). "T cells isolated from patients with checkpoint inhibitor-resistant melanoma are functional and can mediate tumor regression". Annals of Oncology. 29 (7): 1575–1581. doi:10.1093/annonc/mdy139. PMID 29688262.
- ^ Seidel JA, Otsuka A, Kabashima K (2018-03-28). "Anti-PD-1 and Anti-CTLA-4 Therapies in Cancer: Mechanisms of Action, Efficacy, and Limitations". Frontiers in Oncology. 8: 86. doi:10.3389/fonc.2018.00086. PMC 5883082. PMID 29644214.
- ^ a b Haanen JB, Robert C (2015). "Immune Checkpoint Inhibitors". Progress in Tumor Research. 42: 55–66. doi:10.1159/000437178. ISBN 978-3-318-05589-4. PMID 26382943.
- ^ "Immune Checkpoint Inhibitors - National Cancer Institute". National Cancer Institute. 2019-09-24. Retrieved 2020-08-24.
- ^ Manjunath SR, Ramanan G, Dedeepiya VD, Terunuma H, Deng X, Baskar S, et al. (January 2012). "Autologous immune enhancement therapy in recurrent ovarian cancer with metastases: a case report". Case Reports in Oncology. 5 (1): 114–118. doi:10.1159/000337319. PMC 3364094. PMID 22666198.
- ^ Li Y, Zhang T, Ho C, Orange JS, Douglas SD, Ho WZ (December 2004). "Natural killer cells inhibit hepatitis C virus expression". Journal of Leukocyte Biology. 76 (6): 1171–1179. doi:10.1189/jlb.0604372. PMID 15339939.
- ^ Doskali M, Tanaka Y, Ohira M, Ishiyama K, Tashiro H, Chayama K, Ohdan H (March 2011). "Possibility of adoptive immunotherapy with peripheral blood-derived CD3−CD56+ and CD3+CD56+ cells for inducing antihepatocellular carcinoma and antihepatitis C virus activity". Journal of Immunotherapy. 34 (2): 129–138. doi:10.1097/CJI.0b013e3182048c4e. PMID 21304407. S2CID 26385818.
- ^ Terunuma H, Deng X, Dewan Z, Fujimoto S, Yamamoto N (2008). "Potential role of NK cells in the induction of immune responses: implications for NK cell-based immunotherapy for cancers and viral infections". International Reviews of Immunology. 27 (3): 93–110. doi:10.1080/08830180801911743. PMID 18437601. S2CID 27557213.
- ^ See DM, Tilles JG (1996). "alpha-Interferon treatment of patients with chronic fatigue syndrome". Immunological Investigations. 25 (1–2): 153–164. doi:10.3109/08820139609059298. PMID 8675231.
- ^ Ojo-Amaize EA, Conley EJ, Peter JB (January 1994). "Decreased natural killer cell activity is associated with severity of chronic fatigue immune dysfunction syndrome". Clinical Infectious Diseases. 18 Suppl 1: S157–S159. doi:10.1093/clinids/18.Supplement_1.S157. PMID 8148445.
- ^ Kida K, Isozumi R, Ito M (December 2000). "Killing of human Herpes virus 6-infected cells by lymphocytes cultured with interleukin-2 or -12". Pediatrics International. 42 (6): 631–636. doi:10.1046/j.1442-200x.2000.01315.x. PMID 11192519. S2CID 11297558.
- ^ Ospina-Quintero L, Jaramillo JC, Tabares-Guevara JH, Ramírez-Pineda JR (24 April 2020). "Reformulating Small Molecules for Cardiovascular Disease Immune Intervention: Low-Dose Combined Vitamin D/Dexamethasone Promotes IL-10 Production and Atheroprotection in Dyslipidemic Mice". Frontiers in Immunology. 11: 743. doi:10.3389/fimmu.2020.00743. PMC 7197409. PMID 32395119.
- ^ Tabares-Guevara JH, Jaramillo JC, Ospina-Quintero L, Piedrahíta-Ochoa CA, García-Valencia N, Bautista-Erazo DE, et al. (8 July 2021). "IL-10-Dependent Amelioration of Chronic Inflammatory Disease by Microdose Subcutaneous Delivery of a Prototypic Immunoregulatory Small Molecule". Frontiers in Immunology. 12: 708955. doi:10.3389/fimmu.2021.708955. PMC 8297659. PMID 34305950.
- ^ a b Rayner F, Isaacs JD (December 2018). "Therapeutic tolerance in autoimmune disease". Seminars in Arthritis and Rheumatism. 48 (3): 558–562. doi:10.1016/j.semarthrit.2018.09.008. PMID 30348449. S2CID 53034800.
- ^ Rotrosen D, Matthews JB, Bluestone JA (July 2002). "The immune tolerance network: a new paradigm for developing tolerance-inducing therapies". The Journal of Allergy and Clinical Immunology. 110 (1): 17–23. doi:10.1067/mai.2002.124258. PMID 12110811. S2CID 30884739.
- ^ Stolp J, Zaitsu M, Wood KJ (2019). "Immune Tolerance and Rejection in Organ Transplantation". Immunological Tolerance. Methods in Molecular Biology. Vol. 1899. pp. 159–180. doi:10.1007/978-1-4939-8938-6_12. ISBN 978-1-4939-8936-2. PMID 30649772. S2CID 58542057.
- ^ McMurchy AN, Bushell A, Levings MK, Wood KJ (August 2011). "Moving to tolerance: clinical application of T regulatory cells". Seminars in Immunology. Advances in Transplantation. 23 (4): 304–313. doi:10.1016/j.smim.2011.04.001. PMC 3836227. PMID 21620722.
- ^ Baker KF, Isaacs JD (March 2014). "Prospects for therapeutic tolerance in humans". Current Opinion in Rheumatology. 26 (2): 219–227. doi:10.1097/BOR.0000000000000029. PMC 4640179. PMID 24378931.
- ^ Cooles FA, Isaacs JD (August 2010). "Treating to re-establish tolerance in inflammatory arthritis - lessons from other diseases". Best Practice & Research. Clinical Rheumatology. Pharmacotherapy: Concepts of Pathogenesis and Emerging Treatments. 24 (4): 497–511. doi:10.1016/j.berh.2010.01.007. PMID 20732648.
- ^ Durham SR, Walker SM, Varga EM, Jacobson MR, O'Brien F, Noble W, et al. (August 1999). "Long-term clinical efficacy of grass-pollen immunotherapy". The New England Journal of Medicine. 341 (7): 468–475. doi:10.1056/NEJM199908123410702. PMID 10441602. S2CID 14629112.
- ^ Jones SM, Burks AW, Dupont C (February 2014). "State of the art on food allergen immunotherapy: oral, sublingual, and epicutaneous". The Journal of Allergy and Clinical Immunology. 133 (2): 318–323. doi:10.1016/j.jaci.2013.12.1040. PMID 24636471.
- ^ MacGinnitie AJ, Rachid R, Gragg H, Little SV, Lakin P, Cianferoni A, et al. (March 2017). "Omalizumab facilitates rapid oral desensitization for peanut allergy". The Journal of Allergy and Clinical Immunology. 139 (3): 873–881.e8. doi:10.1016/j.jaci.2016.08.010. PMC 5369605. PMID 27609658. S2CID 3626708.
- ^ "Oral immunotherapy for peanut allergy in young children". National Institutes of Health (NIH). 2022-02-07. Retrieved 2022-06-06.
- ^ Ring J, Gutermuth J (June 2011). "100 years of hyposensitization: history of allergen-specific immunotherapy (ASIT)". Allergy. 66 (6): 713–724. doi:10.1111/j.1398-9995.2010.02541.x. PMID 21320133. S2CID 19390006.
- ^ Correale J, Farez M (February 2007). "Association between parasite infection and immune responses in multiple sclerosis". Annals of Neurology. 61 (2): 97–108. doi:10.1002/ana.21067. PMID 17230481. S2CID 1033417.
- ^ Croese J, O'neil J, Masson J, Cooke S, Melrose W, Pritchard D, Speare R (January 2006). "A proof of concept study establishing Necator americanus in Crohn's patients and reservoir donors". Gut. 55 (1): 136–137. doi:10.1136/gut.2005.079129. PMC 1856386. PMID 16344586.
- ^ Reddy A, Fried B (January 2009). "An update on the use of helminths to treat Crohn's and other autoimmunune diseases". Parasitology Research. 104 (2): 217–221. doi:10.1007/s00436-008-1297-5. PMID 19050918. S2CID 19279688.
- ^ Laclotte C, Oussalah A, Rey P, Bensenane M, Pluvinage N, Chevaux JB, et al. (December 2008). "[Helminths and inflammatory bowel diseases]". Gastroenterologie Clinique et Biologique (in French). 32 (12): 1064–1074. doi:10.1016/j.gcb.2008.04.030. PMID 18619749.
- ^ Zaccone P, Fehervari Z, Phillips JM, Dunne DW, Cooke A (October 2006). "Parasitic worms and inflammatory diseases". Parasite Immunology. 28 (10): 515–523. doi:10.1111/j.1365-3024.2006.00879.x. PMC 1618732. PMID 16965287.
- ^ a b Brooker S, Bethony J, Hotez PJ (2004). "Human hookworm infection in the 21st century". Advances in Parasitology. 58: 197–288. doi:10.1016/S0065-308X(04)58004-1. ISBN 9780120317585. PMC 2268732. PMID 15603764.
- ^ Fujiwara RT, Cançado GG, Freitas PA, Santiago HC, Massara CL, Dos Santos Carvalho O, et al. (2009). "Necator americanus infection: a possible cause of altered dendritic cell differentiation and eosinophil profile in chronically infected individuals". PLOS Neglected Tropical Diseases. 3 (3): e399. doi:10.1371/journal.pntd.0000399. PMC 2654967. PMID 19308259.
- ^ Carvalho L, Sun J, Kane C, Marshall F, Krawczyk C, Pearce EJ (January 2009). "Review series on helminths, immune modulation and the hygiene hypothesis: mechanisms underlying helminth modulation of dendritic cell function". Immunology. 126 (1): 28–34. doi:10.1111/j.1365-2567.2008.03008.x. PMC 2632707. PMID 19120496.
- ^ Fumagalli M, Pozzoli U, Cagliani R, Comi GP, Riva S, Clerici M, et al. (June 2009). "Parasites represent a major selective force for interleukin genes and shape the genetic predisposition to autoimmune conditions". The Journal of Experimental Medicine. 206 (6): 1395–1408. doi:10.1084/jem.20082779. PMC 2715056. PMID 19468064.
- ^ Reynolds LA, Finlay BB, Maizels RM (November 2015). "Cohabitation in the Intestine: Interactions among Helminth Parasites, Bacterial Microbiota, and Host Immunity". Journal of Immunology. 195 (9): 4059–4066. doi:10.4049/jimmunol.1501432. PMC 4617609. PMID 26477048.
- ^ Hong CH, Tang MR, Hsu SH, Yang CH, Tseng CS, Ko YC, et al. (September 2019). "Enhanced early immune response of leptospiral outer membrane protein LipL32 stimulated by narrow band mid-infrared exposure". Journal of Photochemistry and Photobiology. B, Biology. 198: 111560. doi:10.1016/j.jphotobiol.2019.111560. PMID 31336216. S2CID 198191485.
- ^ Chang HY, Li MH, Huang TC, Hsu CL, Tsai SR, Lee SC, et al. (February 2015). "Quantitative proteomics reveals middle infrared radiation-interfered networks in breast cancer cells". Journal of Proteome Research. 14 (2): 1250–1262. doi:10.1021/pr5011873. PMID 25556991.
- ^ Nagaya T, Okuyama S, Ogata F, Maruoka Y, Choyke PL, Kobayashi H (May 2019). "Near infrared photoimmunotherapy using a fiber optic diffuser for treating peritoneal gastric cancer dissemination". Gastric Cancer. 22 (3): 463–472. doi:10.1007/s10120-018-0871-5. PMC 7400986. PMID 30171392.
- ^ Mitsunaga M, Ogawa M, Kosaka N, Rosenblum LT, Choyke PL, Kobayashi H (November 2011). "Cancer cell-selective in vivo near infrared photoimmunotherapy targeting specific membrane molecules". Nature Medicine. 17 (12): 1685–1691. doi:10.1038/nm.2554. PMC 3233641. PMID 22057348.
- ^ Sato K, Sato N, Xu B, Nakamura Y, Nagaya T, Choyke PL, et al. (August 2016). "Spatially selective depletion of tumor-associated regulatory T cells with near-infrared photoimmunotherapy". Science Translational Medicine. 8 (352): 352ra110. doi:10.1126/scitranslmed.aaf6843. PMC 7780242. PMID 27535621.
- ^ Nagaya T, Nakamura Y, Sato K, Harada T, Choyke PL, Kobayashi H (June 2016). "Improved micro-distribution of antibody-photon absorber conjugates after initial near infrared photoimmunotherapy (NIR-PIT)". Journal of Controlled Release. 232: 1–8. doi:10.1016/j.jconrel.2016.04.003. PMC 4893891. PMID 27059723.
- ^ Zhen Z, Tang W, Wang M, Zhou S, Wang H, Wu Z, et al. (February 2017). "Protein Nanocage Mediated Fibroblast-Activation Protein Targeted Photoimmunotherapy To Enhance Cytotoxic T Cell Infiltration and Tumor Control". Nano Letters. 17 (2): 862–869. Bibcode:2017NanoL..17..862Z. doi:10.1021/acs.nanolett.6b04150. PMID 28027646.
외부 링크
- Langreth R (12 February 2009). "Cancer Miracles". Forbes.
- 국제 암 생물학적 치료 학회
- 암연구소 연례 국제암면역요법 심포지엄 시리즈
- 면역치료의 혁신적인 세포 항해에 대한 이야기


