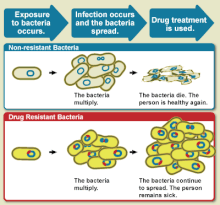
약물 저항성
Drug resistance약물 내성은 질병이나 상태를 치료할 때 항균제나 항소포화성 물질과 같은 약물의 효과가 감소하는 것이다.[1] 이 용어는 병원균이나 암이 "획득했다", 즉 저항이 진화했다는 저항의 맥락에서 사용된다. 항균저항과 항비소성저항은 임상치료에 도전하고 연구를 추진한다. 유기체가 한 가지 이상의 약물에 내성이 있을 때는 다약에 내성이 있다고 한다.
특히 항생제 내성의 발달은 특정한 박테리아 분자(대부분 항상 단백질)만을 대상으로 하는 약에서 비롯된다. 그 약물은 매우 구체적이기 때문에, 이들 분자의 어떤 돌연변이도 그 파괴 효과를 방해하거나 부정하여 항생제 내성을 야기할 것이다.[2] 게다가, 가축의 농사에 항생제가 남용되는 것에 대한 우려가 높아지고 있는데, 이는 유럽연합에서만 인간에게 분배된 양의 3배를 차지하기 때문에, 초저항성 박테리아의 발육으로 이어지고 있다.[3][4]
박테리아는 항생제가 표적이 된 효소를 변경할 뿐만 아니라 효소를 사용하여 항생제 자체를 변형시켜 중화시킬 수 있다. 표적 변화 병원균의 예로는 포도상구균 아우레우스, 반코마이신 내성 장내성, 마크로라이드 내성 스트렙토코쿠스가 있으며, 항생제 변형 미생물의 예로는 필로모나스 에어로기노사와 아미노글리코박터 내성 아시네토박터 바우만니가 있다.[5]
요컨대, 정부와 제약업계의 협력적인 노력이 부족하고, 신약의 개발을 앞지르는 속도로 저항력을 개발할 미생물의 선천적인 역량과 함께, 생존 가능한 장기적 항미생물 치료제 개발을 위한 기존 전략이 결국 실패할 수밖에 없음을 시사한다. 대체 전략이 없다면, 병원성 미생물에 의한 약물 내성의 획득은 21세기에 인류가 직면한 가장 중요한 공중 보건 위협 중 하나로 떠오를 것이다.[6] 항생제 내성의 가능성을 줄일 수 있는 가장 좋은 대체 공급원으로는 프로바이오틱스, 프리바이오틱스, 식이섬유, 효소, 유기산, 식물유전학 등이 있다.[7][8]
종류들
약물, 독소 또는 화학적 저항은 진화의 결과물이며 모든 살아있는 유기체에 가해지는 압력에 대한 반응이다. 개별 유기체는 사용되는 약물에 대한 민감도가 다양하며, 어떤 유기체는 약물 치료에서 살아남을 수 있을 것이다. 따라서 약물 내성이 있는 특성은 후속 자손에 의해 유전되어 더 약물에 내성이 있는 집단을 낳는다. 사용된 약물이 전체 표적 모집단에서 성 생식이나 세포분열 또는 수평 유전자 전이를 불가능하게 하지 않는 한 약물에 대한 저항은 필연적으로 뒤따를 것이다. 이것은 일부 세포가 화학요법에 사용되는 약물에 대한 내성을 발달시킬 수 있는 암종양에서 볼 수 있다.[9] 화학요법은 종양 근처에 있는 섬유질 덩어리가 많은 양의 WNT16B 단백질을 생성하게 한다. 이 단백질은 약물에 강한 암세포의 성장을 촉진한다.[10] 마이크로RNA는 또한 암세포의 후천적 약물 내성에 영향을 미치는 것으로 밝혀졌으며 이는 치료 목적으로 사용될 수 있다.[11] 2012년 말라리아는 동남 아시아와 사하라 이남 아프리카에서 다시 위협이 되고 있으며, 플라스토듐 팔시파룸의 내성균종은 보건당국에 엄청난 문제를 제기하고 있다.[12][13] 나병은 댑손에 대한 저항력이 증가하는 것을 보여 왔다.
단일 세포 유기체들 사이에 저항력을 공유하는 빠른 과정이 존재하며, 특히 바이오필름 상태에서 유전자의 직접 교환이 이루어지는 수평적 유전자 전이라고 불린다.[14] 이와 유사한 무성법을 균류에서 사용하며 "기생성"이라고 부른다. 약물 내성 균주의 예는 박테리아와 바이러스, 내성균과 외성균, 식물, 곰팡이, 절지동물,[16][17] 포유류,[18] 조류,[19] 파충류,[20] 물고기, 양서류 등의 미생물에서[15] 발견된다.[20]
가정 환경에서, 유기체의 내성이 생긴 변종 bleach,[21]tooth-brushing의 사용과 같이 외관상으로는 안전한 활동과에서 일어날지도 모르mouthwashing,[22]항생제, 살균제, 세제, 샴푸, 비누, 특히 항균 soaps,[23][24]hand-washing,[25]표면 스프레이, deodorants,의 응용 프로그램의 사용.sunblocks고 c오스메틱 또는 건강 관리 제품, 살충제 및 딥.[26] 이러한 준비물에 포함된 화학물질은 유익한 유기체를 해치는 것 외에도, 의도적으로 또는 부주의하게 저항력을 개발할 가능성이 있는 유기체를 목표로 삼을 수 있다.[27]
메커니즘
미생물이 항균제에 대한 내성을 보이는 네 가지 주요 메커니즘은 다음과 같다.[28][29]
- 약물 불활성화 또는 개조: 예: β-락타마제 생산을 통한 일부 페니실린 내성 박테리아에서 페니실린 G의 효소 불활성화.
- 대상 사이트 변경: 예를 들어, MRSA 및 기타 페니실린 내성 박테리아에서 페니실린 결합 대상 사이트인 PBP 변경.
- 대사 경로의 변경: 예를 들어, 일부 설포나미드에 내성이 있는 박테리아는 설포나미드에 의해 억제된 박테리아에서 엽산과 핵산을 합성하기 위한 중요한 전구체인 파라아미노벤조산(PABA)을 필요로 하지 않는다. 대신에, 포유류 세포와 마찬가지로, 그들은 미리 형성된 엽산을 이용하는 쪽으로 방향을 튼다.
- 약물 축적 감소: 약물 투과성을 감소시키고/또는 세포 표면 전체에 걸쳐 약물의 활성 유출(펌핑 아웃)을 증가시킴
획득한 약물 내성의 메커니즘:[30]
| 메커니즘 | 항균제 | 약물 작용 | 저항의 메커니즘 |
|---|---|---|---|
| 약물을 파괴 | 아미노글리코사이드 베타락탐 항생제(페니실린 및 세팔로스포린) 클로로페니콜
| 30S 리보솜 서브유닛에 바인딩하여 단백질 합성을 억제 페니실린 결합 단백질에 결합, 펩티도글리칸 합성 억제 50S 리보솜 서브 유닛에 바인딩하여 펩타이드 결합 형성 억제 | 플라스미드는 약물을 화학적으로 변화시키는 효소(예: 아세틸화 또는 인산화)를 암호화하여 비활성화시킨다. 플라스미드는 베타락탐 링을 여는 베타락타마아제를 인코딩하여 비활성화한다. 플라스미드는 약물을 아세틸화하는 효소를 암호화하여 비활성화시킨다. |
| 약물 목표 변경 | 아미노글리코사데스 베타락탐 항생제(페니실린 및 세팔로스포린) 에리트로마이신 퀴놀로네 리팜핀 트리메토프림 | 30S 리보솜 서브유닛에 바인딩하여 단백질 합성을 억제 페니실린 결합 단백질에 결합, 펩티도글리칸 합성 억제 50S 리보솜 서브유닛에 바인딩하여 단백질 합성을 억제 DNA 합성에 필수적인 효소인 DNA topoisomerase에 결합 RNA 중합효소에 결합, RNA 합성 시작 억제 디하이드로폴레이트 효소가 감소하여 엽산 경로를 차단함 | 박테리아는 그 약에 속박되지 않는 변형된 30S 리보솜을 만든다. 박테리아는 그 약에 속박되지 않는 변형된 페니실린 결합 단백질을 만든다. 박테리아는 약물에 결합되지 않는 50S 리보솜의 형태를 만든다. 박테리아는 약물에 결합되지 않는 변형 DNA 토포아세포를 만든다. 박테리아는 약물에 결합되지 않는 변형된 중합효소를 만든다. 박테리아는 약물에 결합하지 않는 변형 효소를 만든다. |
| 약물 입력을 억제하거나 약물 제거 | 페니실린 에리트로마이신 테트라사이클린 | 페니실린 결합 단백질에 결합, 펩티도글리칸 합성 억제 50S 리보솜 서브유닛에 바인딩하여 단백질 합성을 억제 30S 리보솜 서브유닛에 바인딩, tRNA 차단으로 단백질 합성을 억제 | 박테리아는 외부 막 포린 단백질의 형상을 바꾸어 약물이 세포 안으로 들어가는 것을 막는다. 새로운 막 운반 시스템은 약물이 세포 안으로 들어가는 것을 막는다. 새로운 막 운반 시스템은 세포에서 약물을 펌프질한다. |
대사비
생물학적 비용은 기능 달성에 필요한 에너지 신진대사의 증가를 측정하는 척도다.
약물 내성은 이 개념과 관련이 있는 병원균(박테리아,[33] 내포자충, 종양 세포)에서 대사 가격이[32] 높다. 바이러스에서 동등한 "비용"은 게놈의 복잡성이다. 대사 비용이 높다는 것은 항생제가 없을 때 내성 병원균이 취약한 병원균에 비해 진화적 적합성을 떨어뜨린다는 것을 의미한다.[34] 항생제가 없는 환경에서는 약물 내성 적응이 거의 보이지 않는 이유 중 하나이다. 그러나 항생제가 있는 상황에서 생존의 이점은 높은 신진대사 비용을 상쇄하고 저항성 균주의 증식을 가능하게 했다.
치료
인간의 경우, ABCB1 유전자는 세포 수준의 핵심 의약품 운반체인 MDR1(p-glycoprotein)을 암호화하고 있다. MDR1이 과압되면 약물 내성이 높아진다.[35] 따라서 ABCB1 수준은 모니터링할 수 있다.[35] ABCB1 발현 수준이 높은 환자의 경우 메트포민 같은 2차 치료제를 1차 약물 치료와 함께 사용하면서 어느 정도 성공을 거두고 있다.[35]
오늘날 널리 퍼진 문제를 나타내는 항생제 내성을 위해, 박테리아 항생제 내성의 메커니즘을 차단하기 위해 고안된 약물이 사용된다. 예를 들어 베타락탐 항생제(페니실린, 세팔로스포린 등)에 대한 박테리아 저항성은 특정 베타락타마제(베타락탐을 분해하는 효소군)에 의해 파괴되기 쉬운 나프실린과 같은 항생제를 사용함으로써 우회할 수 있다.[36] 베타락탐 박테리아 저항성 역시 클라불란산 등 베타락타마제를 차단하는 약물과 함께 베타락탐 항생제를 투여해 항생제가 먼저 파괴되지 않고 효과를 볼 수 있도록 하는 방법으로 대처할 수 있다.[37] 최근, 연구원들은 박테리아 배출 펌프를 억제하는 새로운 약의 필요성을 인식했다. 박테리아 세포에서 항생제의 분자를 내보내 베타 락탐, 퀴놀론, 클로로페니콜, 트리메토프림과 같은 여러 항생제에 대한 내성을 유발한다.[38][39] 때때로 다른 종류의 항생제 조합이 시너지 효과를 발휘하기도 한다; 즉, 항생제 하나에만 내성이 있을 수 있는 박테리아와 효과적으로 싸우기 위해 함께 작용한다.[40]
내성균의 파괴는 특정 박테리오파지(세균을 죽이는 바이러스)를 사용하는 페이지 요법으로도 달성할 수 있다.[41]
참고 항목
참조
- ^ Alfarouk, KO; Stock, CM; Taylor, S; Walsh, M; Muddathir, AK; Verduzco, D; Bashir, AH; Mohammed, OY; Elhassan, GO; Harguindey, S; Reshkin, SJ; Ibrahim, ME; Rauch, C (2015). "Resistance to cancer chemotherapy: failure in drug response from ADME to P-gp". Cancer Cell International. 15: 71. doi:10.1186/s12935-015-0221-1. PMC 4502609. PMID 26180516.
- ^ "Antibiotic Resistance and Evolution". detectingdesign.com.[필요하다]
- ^ Harvey, Fiona (16 October 2016). "Use of strongest antibiotics rises to record levels on European farms". the Guardian. Retrieved 1 October 2018.[필요하다]
- ^ Duckenfield, Joan (2011-12-30). "Antibiotic Resistance Due to Modern Agricultural Practices: An Ethical Perspective". Journal of Agricultural and Environmental Ethics. 26 (2): 333–350. doi:10.1007/s10806-011-9370-y. ISSN 1187-7863. S2CID 55736918.[필요하다]
- ^ Fisher, Jed F.; Mobashery, Shahriar (2010). "Enzymology of Bacterial Resistance". Comprehensive Natural Products II. Volume 8: Enzymes and Enzyme Mechanisms. Elsevier. pp. 443–201. doi:10.1016/B978-008045382-8.00161-1. ISBN 978-0-08-045382-8.[필요하다]
- ^ Institute of Medicine (US) Forum on Emerging Infections; Knobler, S. L.; Lemon, S. M.; Najafi, M.; Burroughs, T. (2003). Reading: The Resistance Phenomenon in Microbes and Infectious Disease Vectors: Implications for Human Health and Strategies for Containment -- Workshop Summary - The National Academies Press. nap.edu. doi:10.17226/10651. ISBN 978-0-309-08854-1. PMID 22649806.[필요하다]
- ^ Jha, Rajesh; Das, Razib; Oak, Sophia; Mishra, Pravin (2020). "Probiotics (Direct-Fed Microbials) in Poultry Nutrition and Their Effects on Nutrient Utilization, Growth and Laying Performance, and Gut Health: A Systematic Review". Animals. 10 (10): 1863. doi:10.3390/ani10101863. PMC 7602066. PMID 33066185.
- ^ Jha, Rajesh; Mishra, Pravin (2021-04-19). "Dietary fiber in poultry nutrition and their effects on nutrient utilization, performance, gut health, and on the environment: a review". Journal of Animal Science and Biotechnology. 12 (1): 51. doi:10.1186/s40104-021-00576-0. ISSN 2049-1891. PMC 8054369. PMID 33866972.
- ^ "Tolerance and Resistance to Drugs". Merck Manuals Consumer Version.
- ^ 2012년 8월 5일, BBC 뉴스 "Chemo 'Undermines Ofself Through Response, BBC News.
- ^ Ghasabi M, Mansoori B, Mohammadi A, Duijf PH, Shomali N, Shirafkan N, Mokhtarzadeh A, Baradaran B (2019). "MicroRNAs in cancer drug resistance: Basic evidence and clinical applications". Journal of Cellular Physiology. x (3): 2152–2168. doi:10.1002/jcp.26810. PMID 30146724. S2CID 52092652.
- ^ McGrath, Matt (2012-04-05). "Resistance spread 'compromising' fight against malaria". BBC News.
- ^ Morelle R (20 October 2015). "Drug-resistant malaria can infect African mosquitoes". BBC News. Retrieved 21 October 2015.
- ^ Molin S, Tolker-Nielsen T (June 2003). "Gene transfer occurs with enhanced efficiency in biofilms and induces enhanced stabilisation of the biofilm structure". Current Opinion in Biotechnology. 14 (3): 255–61. doi:10.1016/S0958-1669(03)00036-3. PMID 12849777.
- ^ "Mechanisms of drug action and resistance". tulane.edu.
- ^ Brun LO, Wilson JT, Daynes P (March 1983). "Ethion resistance in the cattle tick (Boophilus microplus) in New Caledonia" (PDF). International Journal of Pest Management. 29 (1): 16–22. doi:10.1080/09670878309370763.
- ^ "Review Article on Colorado Potato Beetle Resistance to Insecticides". potatobeetle.org. Retrieved 1 October 2018.
- ^ Lund M (1972). "Rodent resistance to the anticoagulant rodenticides, with particular reference to Denmark". Bulletin of the World Health Organization. 47 (5): 611–8. PMC 2480843. PMID 4540680.
- ^ Shefte N, Bruggers RL, Schafer EW (April 1982). "Repellency and toxicity of three bird control chemicals to four species of African grain-eating birds". The Journal of Wildlife Management. 46 (2): 453–7. doi:10.2307/3808656. JSTOR 3808656.
- ^ a b "Reptiles Magazine, your source for reptile and herp care, breeding, and enthusiast articles". reptilechannel.com. Archived from the original on 2011-01-03.
- ^ "How household bleach works to kill bacteria". physorg.com.
- ^ "Compete50 The complete mouth care products". Archived from the original on 2010-04-03. Retrieved 2010-07-18.
- ^ "The Dirt on Clean: Antibacterial Soap v Regular Soap". CBC News. Archived from the original on 6 August 2011.
- ^ "Should antibacterial soap be outlawed?". HowStuffWorks. 2007-11-07.
- ^ Weber DJ, Rutala WA (October 2006). "Use of germicides in the home and the healthcare setting: is there a relationship between germicide use and antibiotic resistance?". Infection Control and Hospital Epidemiology. 27 (10): 1107–19. doi:10.1086/507964. PMID 17006819. S2CID 20734025.
- ^ Yoon KS, Kwon DH, Strycharz JP, Hollingsworth CS, Lee SH, Clark JM (November 2008). "Biochemical and molecular analysis of deltamethrin resistance in the common bed bug (Hemiptera: Cimicidae)". Journal of Medical Entomology. 45 (6): 1092–101. doi:10.1603/0022-2585(2008)45[1092:BAMAOD]2.0.CO;2. PMID 19058634.
- ^ "Antibacterial cleaning products". Australian Department of Health & Human Services. Archived from the original on 4 March 2015. Retrieved 1 October 2018.
- ^ Li XZ, Nikaido H (August 2009). "Efflux-mediated drug resistance in bacteria: an update". Drugs. 69 (12): 1555–623. doi:10.2165/11317030-000000000-00000. PMC 2847397. PMID 19678712.
- ^ Sandhu P, Akhter Y (January 2018). "Evolution of structural fitness and multifunctional aspects of mycobacterial RND family transporters". Archives of Microbiology. 200 (1): 19–31. doi:10.1007/s00203-017-1434-6. PMID 28951954. S2CID 13656026.
- ^ Catherine A. Ingraham, John L. Ingraham (2000). Introduction to Microbiology second edition.
- ^ Catherine A. Ingraham, John L. Ingraham (2000). Introduction to Microbiology.
- ^ Gillespie SH, McHugh TD (September 1997). "The biological cost of antimicrobial resistance". Trends in Microbiology. 5 (9): 337–9. doi:10.1016/S0966-842X(97)01101-3. PMID 9294886.
- ^ Wichelhaus TA, Böddinghaus B, Besier S, Schäfer V, Brade V, Ludwig A (November 2002). "Biological cost of rifampin resistance from the perspective of Staphylococcus aureus". Antimicrobial Agents and Chemotherapy. 46 (11): 3381–5. doi:10.1128/AAC.46.11.3381-3385.2002. PMC 128759. PMID 12384339.
- ^ Händel, Nadine; Schuurmans, J. Merijn; Brul, Stanley; ter Kuile, Benno H. (August 2013). "Compensation of the Metabolic Costs of Antibiotic Resistance by Physiological Adaptation in Escherichia coli". Antimicrobial Agents and Chemotherapy. 57 (8): 3752–3762. doi:10.1128/AAC.02096-12. ISSN 0066-4804. PMC 3719774. PMID 23716056.
- ^ a b c Ramos-Peñafiel C, Olarte-Carrillo I, Cerón-Maldonado R, Rozen-Fuller E, Kassack-Ipiña JJ, Meléndez-Mier G, Collazo-Jaloma J, Martínez-Tovar A (September 2018). "Effect of metformin on the survival of patients with ALL who express high levels of the ABCB1 drug resistance gene". Journal of Translational Medicine. 16 (1): 245. doi:10.1186/s12967-018-1620-6. PMC 6122769. PMID 30176891.
- ^ Barber M, Waterworth PM (August 1964). "Penicillinase-resistant Penicillins and Cephalosporins". British Medical Journal. 2 (5405): 344–9. doi:10.1136/bmj.2.5405.344. PMC 1816326. PMID 14160224.
- ^ Bush K (January 1988). "Beta-lactamase inhibitors from laboratory to clinic". Clinical Microbiology Reviews. 1 (1): 109–23. doi:10.1128/CMR.1.1.109. PMC 358033. PMID 3060240.
- ^ Webber MA, Piddock LJ (January 2003). "The importance of efflux pumps in bacterial antibiotic resistance". The Journal of Antimicrobial Chemotherapy. 51 (1): 9–11. doi:10.1093/jac/dkg050. PMID 12493781.
- ^ Tegos GP, Haynes M, Strouse JJ, Khan MM, Bologa CG, Oprea TI, Sklar LA (2011). "Microbial efflux pump inhibition: tactics and strategies". Current Pharmaceutical Design. 17 (13): 1291–302. doi:10.2174/138161211795703726. PMC 3717411. PMID 21470111.
- ^ Glew RH, Millering RS, Wennersten C (June 1975). "Comparative synergistic activity of nafcillin, oxacillin, and methicillin in combination with gentamicin against". Antimicrobial Agents and Chemotherapy. 7 (6): 828–32. doi:10.1128/aac.7.6.828. PMC 429234. PMID 1155924.
- ^ Lin, Derek M; Koskella, Britt; Lin, Henry C (2017). "Phage therapy: An alternative to antibiotics in the age of multi-drug resistance". World Journal of Gastrointestinal Pharmacology and Therapeutics. 8 (3): 162–173. doi:10.4292/wjgpt.v8.i3.162. ISSN 2150-5349. PMC 5547374. PMID 28828194.
외부 링크
- 유럽 국가의 내성 및 질병 부담—유럽 병원 내 항생제 내성의 재정적 부담을 추정하기 위한 EU 프로젝트
- Merck - 공차 및 저항
- 코스메틱 데이터베이스
- HCMV 약물 내성 돌연변이 도구
- 약물 저항성 퇴치 - 다중 약물 저항성에 대한 유용한 기사
- 벅스 전투: 항생제 저항성 퇴치
- MDRIpred : 약물 내성 M에 대한 억제제를 예측하기 위한 웹 서버. 화학 중앙 저널에 게재된 결핵
- CancerDR: Cancer Drug Resistance Database. 과학 보고서 3, 1445