뇌종양
Brain tumor| 뇌종양 | |
|---|---|
| 기타이름 | 두개내 신생물, 뇌종양 |
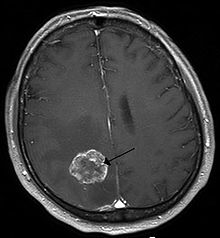 | |
| 자기공명영상에서 폐암으로 인한 우뇌 반구의 뇌 전이 소견 | |
| 전문 | 신경외과, 신경종양학 |
| 증상 | 관련된 뇌의 부위, 두통, 발작, 시력 문제, 구토, 정신적[1][2] 변화에 따라 다름 |
| 종류들 | 악성, 양성[2] |
| 원인들 | 보통[2] 알 수 없음 |
| 위험요소 | 신경섬유종증, 염화비닐 노출, 엡스타인-바 바이러스, 이온화 방사선[1][2][3] |
| 진단방법 | 컴퓨터단층촬영, 자기공명영상, 조직생검[1][2] |
| 치료 | 수술, 방사선치료, 화학요법[1] |
| 약 | 항경련제, 덱사메타손, 푸로세미드[1] |
| 예후 | 평균 5년 생존율 33%(미국)[4] |
| 빈도수. | 120만개의 신경계 암 (2015)[5] |
| 죽음 | 228,800 (worldwide, 2015)[6] |
뇌종양은 뇌 안에 비정상적인 세포가 형성될 때 발생합니다.[2] 종양에는 크게 악성(암성) 종양과 양성(비암성) 종양 두 가지가 있습니다.[2] 뇌 내에서 시작되는 원발성 종양과 뇌 전이 종양으로 알려진 뇌 외부에 위치한 종양에서 가장 흔하게 퍼진 이차성 종양으로 더 분류할 수 있습니다.[1] 모든 종류의 뇌종양은 종양의 크기와 관련된 뇌 부위에 따라 다른 증상을 일으킬 수 있습니다.[2] 증상이 있는 곳에는 두통, 발작, 시력 문제, 구토, 정신적 변화가 포함될 수 있습니다.[1][2][7] 다른 증상으로는 걷기, 말하기, 감각, 의식 불명 등이 있을 수 있습니다.[1][3]
대부분의 뇌종양의 원인은 알려지지 않았지만 뇌암의 최대 4%는 CT 스캔 방사선에 의해 발생할 수 있습니다.[2][8] 흔하지 않은 위험 요소로는 염화비닐, 엡스타인-바 바이러스, 이온화 방사선, 신경섬유종증, 결핵성 경화증, 폰 히펠-린다우 병과 같은 유전성 증후군에 노출되는 것이 있습니다.[1][2][3] 휴대폰 노출에 대한 연구들은 뚜렷한 위험성을 보여주지 못하고 있습니다.[3] 성인에서 가장 흔한 원발성 종양의 종류는 뇌수막종(보통 양성)과 교모세포종과 같은 성상세포종입니다.[1] 소아에서 가장 흔한 유형은 악성 수모세포종입니다.[3] 진단은 대개 컴퓨터단층촬영(CT)이나 자기공명영상(MRI)과 함께 건강검진으로 이루어집니다.[2] 그 결과는 종종 조직검사로 확인됩니다. 발견된 결과에 따라 종양은 다른 등급의 중증도로 구분됩니다.[1]
치료에는 수술, 방사선 치료 및 화학 요법의 일부 조합이 포함될 수 있습니다.[1] 발작이 발생하면 항경련제 투약이 필요할 수 있습니다.[1] 덱사메타손과 푸로세미드는 종양 주변의 부종을 줄이는 데 사용될 수 있는 약물입니다.[1] 일부 종양은 점진적으로 증가하여 모니터링만 필요하며 추가 개입이 필요하지 않을 수 있습니다.[1] 사람의 면역 체계를 사용하는 치료법이 연구되고 있습니다.[2] 악성 종양의 결과는 종양의 종류와 진단 시 얼마나 멀리 퍼졌는지에 따라 상당히 다릅니다.[3] 양성 종양은 한 부위에서만 자라지만 크기와 위치에 따라 생명을 위협할 수 있습니다.[9] 악성 교모세포종은 대개 결과가 매우 좋지 않은 반면 양성 수막종은 대개 좋은 결과를 보입니다.[3] 미국의 모든 (악성) 뇌암의 평균 5년 생존율은 33%[4]입니다.
이차성 또는 전이성 뇌종양은 일차성 뇌종양에 비해 약 4배 정도 [2][10]흔하며 전이의 절반 정도가 폐암에서 발생합니다.[2] 원발성 뇌종양은 전 세계적으로 연간 약 25만 명에서 발생하며 암의 2% 미만을 차지합니다.[3] 15세 미만의 어린이에서 뇌종양은 급성 림프구성 백혈병 다음으로 가장 흔한 형태의 암입니다.[11] 2005년 뉴사우스웨일스 주에서 뇌암 환자 한 명의 평균 평생 경제적 비용은 190만 호주 달러로 모든 종류의 암 중에서 가장 높았습니다.[12]
징후 및 증상
뇌종양의 징후와 증상은 광범위합니다. 사람들은 종양이 양성인지(암이 아닌) 암인지에 관계없이 증상을 경험할 수 있습니다.[13] 1차 및 2차 뇌종양은 종양의 위치, 크기 및 성장 속도에 따라 유사한 증상으로 나타납니다.[14] 예를 들어 전두엽에 종양이 커지면 사고력에 변화가 생길 수 있습니다. 그러나 Wernicke의 영역(언어 이해를 담당하는 작은 영역)과 같은 영역의 종양이 작으면 더 큰 기능 상실을 초래할 수 있습니다.[15]
두통
두개내압 상승으로 인한 두통은 뇌암의 초기 증상이 될 수 있습니다.[16] 하지만 다른 증상이 없는 고립된 두통은 드물고, 두통이 흔해지기 전에 시각적 이상을 비롯한 다른 증상이 나타날 수도 있습니다.[16] 두통에 대한 특정 경고 신호가 존재하여 두통이 뇌암과 연관될 가능성이 더 높습니다.[16] 미국 신경학 아카데미에서 정의한 "비정상적인 신경학적 검사, 발살바 조작에 의해 악화된 두통, 수면에서 각성을 일으키는 두통, 노인 인구의 새로운 두통, 점진적으로 악화되는 두통, 비정형적인 두통 특징 또는 편두통에 대한 엄격한 정의를 충족하지 못하는 환자"입니다.[16] 다른 연관된 징후는 아침에 더 심해지거나 구토 후 가라앉는 두통입니다.[17]
위치별 증상

뇌는 엽으로 나뉘며 각각의 엽이나 영역은 고유의 기능을 가지고 있습니다.[18][19] 이 로브의 종양은 이 부위의 성능에 영향을 미칠 수 있습니다. 경험하는 증상은 종종 종양의 위치와 연결되지만, 사람마다 다른 것을 경험할 수 있습니다.[20]
- 전두엽: 종양은 잘못된 추론, 부적절한 사회적 행동, 성격 변화, 잘못된 계획, 낮은 억제 및 음성 생산 감소의 원인이 될 수 있습니다(Broca's area).[20]
- 측두엽: 이 로브에 종양이 생기면 기억력이 떨어지고 청력이 떨어지며 언어 이해가 어려워질 수 있습니다(Wernicke의 부위는 이 로브에 위치합니다).[19]
- 두정엽: 여기에 종양이 생기면 언어 해석이 잘 안되고, 말하기, 쓰기, 그리기, 이름 짓기, 인식이 어렵고, 공간적, 시각적 인식이 잘 되지 않을 수 있습니다.[21]
- 후두엽: 이 엽이 손상되면 시력이 떨어지거나 시력을 잃을 수 있습니다.[22]
- 소뇌: 이 부위에 종양이 생기면 균형, 근육 움직임, 자세 등이 좋지 않을 수 있습니다.[23]
- 뇌간: 뇌간의 종양은 발작, 내분비 문제, 호흡 변화, 시각 변화, 두통, 부분 마비를 일으킬 수 있습니다.[23]
행동변화
사람의 성격은 뇌의 종양을 손상시키는 엽 때문에 바뀔 수 있습니다. 전두엽, 측두엽 및 두정엽은[14] 억제, 감정, 기분, 판단, 추론 및 행동을 제어하기 때문에 해당 부위의 종양은 부적절한 사회적 행동,[24] 짜증,[24] 웃음을 주지 않는 것에 대한 웃음,[24] 심지어 우울증 및 불안과 같은 심리적 증상을 유발할 수 있습니다.[20] 뇌종양 환자의 우울증 치료제의 효과와 안전성에 대한 더 많은 연구가 필요합니다.[25]
성격 변화는 실업, 불안정한 관계, 통제력 부족과 같은 해로운 영향을 미칠 수 있습니다.[18]
원인
뇌암의 가장 잘 알려진 원인은 이온화 방사선입니다.[8][26] 일반인 뇌암의 약 4%는 CT 스캔 방사선에 의해 발생합니다.[8] 2년 이상 시차를 두고 CT 촬영을 하는 뇌암의 경우 40%가 CT 촬영 방사선에 기인하는 것으로 추정됐습니다.[8] 이온화 방사선과 뇌암 사이의 관계는 방사선 발암과 종양 발생의 전통적인 모델로 가장 잘 설명될 수 있습니다. 이온화 방사선의 확률적 효과는 발생 확률에 대한 선량-반응 관계를 보여주지만 질병의 중증도에 대한 선량-반응 관계는 없습니다. 방사선에 의한 뇌암의 대부분은 CT 스캔과 같은 의료원에서 발생하는 이온화 방사선에 의해 발생합니다.
P53과 같은 종양 억제 유전자의 돌연변이와 삭제는 일부 형태의 뇌종양의 원인으로 생각됩니다.[27] 폰 히펠-린다우병, 결핵성 경화증, 다발성 내분비 종양, 신경섬유종증 제2형과 같은 유전 질환은 뇌종양의 발병 위험이 높습니다.[1][28][29] 셀리악병에 걸린 사람들은 뇌종양에 걸릴 위험이 조금 더 높아집니다.[30] 흡연은 위험을 증가시키는 것으로 제안되었지만 증거는 여전히 불분명합니다.[31]
비록 연구들이 휴대전화나 휴대전화 방사선과 뇌종양의 발생 사이에 어떠한 연관성도 보여주지 못했지만,[32] 세계보건기구는 IARC 등급의 휴대전화 방사선을 발암 가능성이 있는 그룹 2B로 분류했습니다.[33] 휴대전화 사용이 뇌암을 유발할 수 있다는 주장은 무선 전화를 많이 사용하는 사람들 사이에서 교종 위험이 약간 증가하는 것을 관찰한 역학 연구에 근거한 것일 가능성이 높습니다. 이러한 연구가 수행되었을 때 GSM(2G) 전화가 사용되고 있었습니다. 현대의 3세대(3G) 전화기는 평균적으로 GSM(2G) 전화기에서 방출되는 에너지의 약 1%를 방출하므로 휴대폰 사용과 뇌암 위험 증가 사이의 연관성을 발견하는 것은 현재 전화기 사용을 기반으로 하지 않습니다.[3]
병태생리학
뇌수막

인간의 뇌는 뇌와 두개골을 분리하는 뇌수막이라고 불리는 결합 조직막으로 둘러싸여 있습니다. 이 3겹의 덮개는 (외부에서) 경막, 경막, 피아재로 구성되어 있습니다. 거미막과 피아는 물리적으로 연결되어 있기 때문에 종종 단일 층인 렙토메네스로 간주됩니다. 지주막과 피아막 사이에는 뇌척수액(CSF)을 포함하는 지주막하 공간이 있습니다. 이 유체는 뇌 조직을 지지하고 보호하기 위해 세포 사이의 좁은 공간과 뇌실이라는 뇌의 공동을 순환합니다. 혈관은 피아미터 위의 혈관주위 공간을 통해 중추신경계로 들어갑니다. 혈관 벽에 있는 세포들은 단단히 결합되어 혈액을 통해 들어올지도 모르는 독소로부터 뇌를 보호하는 혈액-뇌 장벽을 형성합니다.[34]
뇌수막의 종양은 뇌수막종이며 종종 양성입니다. 엄밀히 따지면 뇌 조직의 종양은 아니지만 뇌가 있는 공간으로 돌출돼 증상을 유발하기 때문에 뇌종양으로 간주되는 경우가 많습니다. 보통 느리게 성장하는 종양이기 때문에 증상이 나타날 때까지 수막종이 상당히 클 수 있습니다.[35]
뇌질
인간과 다른 척추동물의 뇌는 매우 부드러운 조직으로 구성되어 있으며 젤라틴 같은 질감을 가지고 있습니다. 살아있는 뇌 조직은 겉은 분홍색이고(회색 물질), 속은 거의 완전한 흰색이며(흰색 물질), 색의 미묘한 차이가 있습니다. 뇌의 세 가지 가장 큰 부분은 다음과 같습니다.
이 영역들은 뉴런과 신경교세포라는 두 가지 광범위한 부류의 세포로 구성되어 있습니다. 이 두 가지 유형은 뇌 전체적으로 마찬가지로 많지만, 대뇌피질에서는 신경교 세포가 뉴런보다 약 4 대 1로 많습니다. 글리아는 구조적 지지, 대사적 지지, 절연 및 발달 유도를 포함한 여러 가지 중요한 기능을 수행하는 여러 가지 유형이 있습니다.[36] 신경교세포의 원발성 종양은 신경교종으로 불리며 진단될 때까지 악성인 경우가 많습니다.[37]
시상과 시상하부는 뇌하수체와 송과체가 아래에 붙어 있는, 뇌하수체와 송과체의 종양은 양성인 경우가 많습니다.[citation needed]
뇌간은 대뇌 피질과 척수 사이에 위치합니다. 중뇌, 중뇌, 연수, 연수로 나뉩니다.[34]
척수
척수는 중추신경계의 한 부분으로 여겨집니다.[38] 그것은 뇌와 같은 세포, 즉 신경세포와 신경교세포로 이루어져 있습니다.[34]
진단.

특이하거나 특이한 증상이나 징후는 없지만, 여러 증상이 복합적으로 존재하고 다른 원인에 대한 적응증이 부족하다는 것은 뇌종양의 가능성에 대한 조사의 지표가 될 수 있습니다. 뇌종양은 신체의 다른 곳에 위치한 종양을 이용한 진단과 치료에 있어서도 비슷한 특성과 장애물을 가지고 있습니다. 그러나 그들은 자신이 속한 기관의 속성에 밀접하게 따르는 특정 문제를 만듭니다.[39]
진단은 종종 의학적인 선행 및 현재 증상을 기록한 병력을 사용하는 것으로 시작됩니다. 임상 및 실험실 조사는 증상의 원인으로 감염을 배제하는 역할을 할 것입니다. 이 단계의 검사에는 눈, 이비인후과(또는 ENT) 및 전기 생리학적 검사가 포함될 수 있습니다. 뇌종양 진단에는 뇌파검사(EEG)를 이용하는 것이 종종 역할을 합니다.[40]
뇌종양은 신체의 다른 부위의 종양과 비교했을 때 진단에 어려움이 있습니다. 일반적으로, 방사성 추적기는 종양 세포의 높은 활성으로 인해 종양에서 대량으로 흡수되어 종양의 방사성 영상을 촬영할 수 있습니다. 그러나 뇌의 대부분은 혈액-뇌 장벽(BBB)에 의해 혈액에서 분리되는데, 이 막은 어떤 물질이 뇌로 전달되도록 엄격하게 통제합니다. 따라서 신체의 다른 부위의 종양에 쉽게 도달할 수 있는 많은 추적자는 종양에 의해 BBB가 중단될 때까지 뇌종양에 도달할 수 없을 것입니다. BBB의 파괴는 MRI 또는 CT 스캔을 통해 잘 영상화되므로 악성 교종, 수막종 및 뇌 전이의 주요 진단 지표로 간주됩니다.[39]
뇌에서 뇌척수액(CSF)의 통과가 막히거나 팽창하면 두개내 압력이 증가하여 두통, 구토, 의식 상태의 변화가 나타날 수 있으며, 어린이의 경우 두개골의 직경과 음경의 팽만감으로 변화할 수 있습니다. 내분비 기능 장애와 같은 더 복잡한 증상은 뇌종양을 배제하지 않도록 의사에게 경고해야 합니다.[citation needed]
(시골의 압박으로 인한) 양측 시간 시야 결함(시골의 압박으로 인한) 또는 동공의 확장, 인지 및 행동 장애(판단 장애, 기억 상실, 인식 부족, 공간 방향 장애 포함)와 같은 점진적으로 진화하거나 갑자기 초점 신경 증상이 시작되는 경우 성격 또는 감정의 변화, 반신불수, 저감각, 실어증, 운동실조, 시야장애, 후각장애, 청력장애, 안면마비, 이중시력 또는 뇌전증에 대한 부정적인 병력이 있는 환자의 떨림, 신체의 한쪽 마비, (epile)발작과 같은 중증 증상, 뇌종양의 가능성을 높일 [citation needed]수 있을 겁니다
이미징

의료 영상은 뇌종양 진단에 중심적인 역할을 합니다. MRI는 [38]일반적으로 사용되는 참조 표준이지만, 비침습적인 고해상도 기술, 특히 자기 공명 영상(MRI) 및 컴퓨터 단층 촬영(CT) 스캔을 선호하여 침습적이고 때로는 위험한 초기 영상 방법을 포기했습니다.[41] CT 또는 MRI 결과에서 신생물은 종종 색이 다른 종괴(프로세스라고도 함)를 보여줍니다.[citation needed]
- 양성 뇌종양은 CT 촬영에서 저밀도(뇌 조직보다 어두운) 질량 병변으로 나타나는 경우가 많습니다. MRI에서는 T1 강조 스캔에서 저밀도 또는 등각(뇌 조직과 동일한 강도) 또는 T2 강조 MRI에서 초강도(뇌 조직보다 밝은)로 나타나지만 외관은 다양합니다.
- 조영제 흡수는 때때로 특징적인 패턴으로 대부분의 악성 원발성 및 전이성 뇌종양에서 CT 또는 MRI 스캔에서 입증될 수 있습니다.
- 종양에 의해 뇌 조직이 압축된 압력 영역도 T2 강조 스캔에서 매우 강렬하게 나타나며 윤곽이 불분명하기 때문에 확산성 신생물의 존재를 나타낼 수 있습니다. 종양 주위 부종으로 알려진 종양 주변의 부종도 비슷한 결과를 보일 수 있습니다. 이러한 종양이 BBB의 정상적인 기능을 방해하고 투과성을 증가시키기 때문입니다.
보다 최근에는 진단 및 예후를 알려주는 데 도움이 될 수 있는 생리학적 데이터를 제공하는 데 MRI의 유용성을 높이는 발전이 이루어졌습니다. MRI 자체로도 뇌종양의 위치와 형태를 파악할 수 있지만 그 위에 MRA, MRS, pMRI, fMRI, DWI 등 다른 종류의 MRI를 사용할 수도 있습니다. 이러한 영상 기술은 의사와 외과의사가 종양의 종류를 진단하고 수술 계획을 세우고 치료와 방사선/화학요법을 평가하는 데 도움이 됩니다.
다양한 유형의 MRI 검사
자기공명혈관조영술(MRA) – 뇌의 혈관을 관찰합니다. 뇌종양 진단에서 MRA는 일반적으로 외과의사가 종양 혈관 구조를 더 잘 이해할 수 있도록 수술 전에 수행됩니다. 예를 들어, 외과의사들이 MRA에서 추출한 혈관의 모양을 분석함으로써 양성 뇌종양과 악성 뇌종양을 분리할 수 있는 연구가 수행되었습니다.[42] 필요하지는 않지만 일부 MRA는 조영제인 가돌리늄을 환자에게 주입하여 향상된 영상을 얻을 수 있습니다
자기 공명 분광법(MRS) – 종양 내부의 대사 변화 또는 화학적 변화를 측정합니다. 가장 일반적인 MRS는 양성자 분광법이며 주파수는 ppm(ppm) 단위로 측정됩니다. 신경교종이나 악성 뇌종양은 콜린 수치가 더 높고 N-아세틸 아스파르테이트(NAA) 신호가 더 낮다는 점에서 정상적인 뇌조직과 다른 스펙트럼을 가지고 있습니다.[43] 뇌종양 진단에 MRS를 사용하면 의사가 종양의 종류와 공격성을 식별하는 데 도움이 될 수 있습니다. 예를 들어, 양성 뇌종양이나 뇌수막종은 알라닌 수치가 증가했습니다. 또한 뇌종양이 가지고 있는 콜린 수치가[44] 증가하지 않은 이전 방사선 치료로 인한 흉터 조직이나 죽은 조직, 종기나 경색과 같은 종양 모방 병변으로부터 뇌종양을 구별하는 데 도움이 될 수 있습니다.
관류 자기공명영상(pMRI) – 뇌와 뇌종양의 다양한 부분의 혈액량과 혈류량을 평가합니다. pMRI는 조영제, 일반적으로 가도펜테테이트 디메글루민(Gd-DTPA)을 정맥에 주입하여 조영제를 강화해야 합니다. pMRI는 종양 혈관 및 혈관 신생을 보여주는 뇌혈량 지도를 제공합니다. 뇌종양은 더 큰 혈액 공급을 필요로 하기 때문에 pMRI 지도에서 높은 뇌 혈액량을 보여줍니다. pMRI에서 혈관 형태와 혈관 신생의 정도는 뇌종양의 등급과 악성도를 결정하는 데 도움이 됩니다. 뇌종양 진단을 위해 pMRI는 조직검사를 시행할 최적 부위를 결정하고 표본오차를 줄이는데 유용합니다. pMRI는 치료 후 이상 부위가 잔존 종양인지 흉터 조직인지 판단하는 데에도 유용합니다. 항혈관신생 암 치료를 받고 있는 환자의 경우 pMRI는 종양 대뇌 혈액량을 모니터링함으로써 치료에 대한 더 나은 효과를 의사에게 제공할 수 있습니다.[45]
기능 MRI(fMRI) – 환자가 작업을 수행하는 동안 뇌의 활성 부위에서 혈류 변화를 측정하고 특정 기능을 담당하는 뇌의 특정 위치를 제공합니다. 신경외과 의사들은 환자에게 뇌종양 수술을 하기 전에 fMRI를 사용하여 종양을 절제하면서 중요한 뇌 기능에 해당하는 뇌의 구조가 손상되는 것을 피할 수 있었습니다. 수술 전 fMRI는 종양 주변 부위를 왜곡시키기 때문에 종양 근처의 해부학적 구조를 구별하기 어려운 경우가 많기 때문에 중요합니다. 신경외과 의사들은 fMRI를 이용해 종양을 가능한 한 수술적으로 제거하는 절제술을 시행할지, 진단을 위해 수술 샘플량을 채취할지, 아니면 수술을 전혀 받지 않을지 계획하게 됩니다. 예를 들어, 신경외과 의사는 환자의 움직임에 영향을 미칠 수 있는 운동 피질 근처의 종양을 절제하는 것에 반대할 수 있습니다. 수술 전 fMRI가 없으면 신경외과 의사는 종양 제거가 중요한 뇌 기능에 영향을 미치는지 확인하기 위해 개방 수술 중 환자와 상호 작용해야 하는 깨어있는 두개 절제술을 수행해야 합니다.[46]
확산 가중 영상(DWI) – 자기장 기울기를 따라 물 분자의 무작위 브라운 운동을 측정하는 MRI의 한 형태입니다. 뇌종양 진단을 위해 뇌종양의 겉보기 확산 계수(ADC)를 측정하면 의사가 종양 유형을 분류할 수 있습니다. 대부분의 뇌종양은 정상적인 뇌조직보다 높은 ADC를 가지고 있으며 의사는 환자의 뇌종양에서 관찰된 ADC를 수용된 ADC 목록과 일치시켜 종양 유형을 식별할 수 있습니다. DWI는 약물, 방사선 또는 유전자 치료에 반응하여 확산의 변화를 분석할 수 있는 치료 및 치료 목적에도 유용합니다. 성공적인 반응은 세포 사멸을 초래하고 확산을 증가시키는 반면 치료에 실패하면 확산 값은 변하지 않습니다.[47]
다른 유형의 이미징 기술
컴퓨터 단층 촬영(CT) 스캔 – X선을 사용하여 다양한 각도에서 사진을 촬영하고 컴퓨터 처리를 사용하여 사진을 3D 이미지로 결합합니다. 일반적으로 폐쇄공포증이나 심박조율기로 인해 환자가 MRI를 찍을 수 없는 경우에는 CT 스캔이 MRI의 대안 역할을 합니다. CT 스캔은 MRI와 비교하여 종양 근처의 뼈 구조를 더 자세히 보여주며 종양의 크기를 측정하는 데 사용할 수 있습니다.[48] MRI와 마찬가지로 조영제를 정맥에 주입하거나 CT 스캔 전에 입으로 섭취하여 존재할 수 있는 종양의 윤곽을 더 잘 나타낼 수도 있습니다. CT 스캔은 요오드 기반 및 황산바륨 화합물인 조영제를 사용합니다. MRI와 달리 CT 촬영을 할 경우 일부 뇌종양은 축내 종괴가 희미하고 정상적인 뇌조직과 유사하기 때문에 CT 촬영에서 잘 나타나지 않는 단점이 있습니다. 일부 시나리오에서는 CT 스캔에서 뇌종양이 경색, 감염 및 탈수초로 오인될 수 있습니다. 축내 종괴가 다른 가능성 대신 뇌종양이라고 의심하려면 뇌에 설명할 수 없는 석회화, 피질의 보존, 불균형한 종괴 효과가 있어야 합니다.[49]
CT 혈관 조영 (CTA) – X선을 사용하여 뇌의 혈관에 대한 정보를 제공합니다. CT 스캐너의 환자에게 조영제를 항상 주입해야 합니다. CTA는 MRA의 대안 역할을 합니다.
양전자 방출 단층 촬영(PET) 스캔 – 방사성 물질을 사용하며, 가장 일반적인 것은 FDG로 알려진 당이며, 교종에 대한 보다 구체적인 추적기가 등장하고 있습니다. [50] 이 주입된 물질은 활발하게 분열하는 세포에 의해 흡수됩니다. 종양 세포는 분열에 더 적극적이어서 방사성 물질을 더 많이 흡수합니다. 주사 후 스캐너를 사용하여 뇌의 방사성 영역 이미지를 만듭니다. PET 스캔은 낮은 등급의 종양보다 높은 등급의 종양에 더 자주 사용됩니다. MRI 영상의 이상 부위가 잔존 종양인지 흉터 조직인지 의사가 판단할 수 있도록 치료 후 유용합니다. 흉터 조직은 PET 스캔에서 나타나지 않지만 종양은 나타나지 않습니다.[48]
그러나 이러한 기술만으로는 고등급 대 저등급 교종을 진단할 수 없으므로 뇌종양의 최종 진단은 뇌생검 또는 개복 수술을 통해 얻은 종양 조직 샘플의 조직학적 검사로만 확인해야 합니다. 조직학적 검사는 적절한 치료와 정확한 예후를 결정하는 데 필수적입니다. 병리학자가 시행하는 이 검사는 일반적으로 신선 조직의 상호 검사, 준비된 조직의 예비 현미경 검사, 면역조직화학염색 또는 유전자 분석 후 준비된 조직의 추적 검사의 세 단계로 이루어집니다.[citation needed]
병리학

종양은 악성 여부와 어떻게 진화할지를 판단할 수 있는 특성이 있는데, 이런 특성을 판단하면 의료진이 관리 계획을 결정할 수 있습니다.[citation needed]
역형성(Anaplasia) 또는 탈분화(differentiation): 세포의 분화 및 서로에 대한 방향의 손실과 혈관, 역형성 종양 조직의 특징. 역형성 세포는 정상적인 기능을 완전히 제어할 수 없게 되었고 많은 세포들이 악화된 세포 구조를 가지고 있습니다. 역형성 세포는 종종 비정상적으로 높은 핵 대 세포질 비율을 가지며, 많은 세포가 다핵입니다. 또한 역형성 세포의 핵은 대개 부자연스럽게 형성되거나 지나치게 큽니다. 세포는 두 가지 방법으로 역형성이 될 수 있습니다: 종양 세포가 역분화되어 역분화(역분화로 인해 세포가 정상적인 구조/기능을 모두 잃게 됨) 또는 암 줄기 세포가 증식 능력을 증가시킬 수 있습니다(즉, 분화 실패로 인해 통제할 수 없는 성장).[citation needed]
비정형: 세포의 이상 징후(악성을 나타낼 수 있음). 이상의 중요성은 상황에 따라 크게 좌우됩니다.[51]
신생물: 세포의 (통제되지 않는) 분열. 이와 같이, 종양은 문제가 되지 않지만, 그 결과는 다음과 같습니다: 세포의 조절되지 않은 분열은 종양의 질량이 크기가 증가한다는 것을 의미하고, 두개강과 같은 제한된 공간에서는 덩어리가 뇌를 밀어내는 공간을 침범하기 때문에 이것이 빠르게 문제가 됩니다. 뇌 조직의 압박과 두개내 압력의 증가 및 뇌 실질의 파괴로 이어집니다. 두개내압(ICP)의 증가는 종양의 직접적인 질량 효과, 혈액량의 증가 또는 뇌척수액(CSF)의 증가에 기인할 수 있으며, 이는 결과적으로 2차 증상을 가질 수 있습니다.[citation needed]
괴사: 감염, 독소 또는 외상과 같은 외부 요인에 의해 발생하는 세포의 (조기) 사망. 괴사된 세포는 잘못된 화학적 신호를 보내 식세포가 죽은 세포를 처리하는 것을 방해하여, 괴사된[52] 세포의 부위 또는 근처에 죽은 조직, 세포 잔해 및 독소가 축적됩니다.
동맥·정맥 저산소증, 즉 뇌의 특정 부위에 충분한 산소가 공급되지 않는 현상은 종양이 혈액 공급을 위해 인근 혈관을 이용하고 신생물이 주변 뇌 조직과 영양분 경쟁을 할 때 발생합니다.[53] 보다 일반적으로 신생물은 대사 최종 생성물(예: 활성산소, 변경된 전해질, 신경전달물질)의 방출 및 정상적인 실질 기능을 방해하는 세포 매개체(예: 사이토카인)의 방출 및 모집을 유발할 수 있습니다.[citation needed][54]
분류
종양은 양성 또는 악성일 수 있으며 뇌의 여러 부위에서 발생할 수 있으며 원발성 또는 이차성으로 분류될 수 있습니다. 원발성 종양은 뇌에서 시작된 종양이며, 전이성 종양은 신체의 다른 부위에서 뇌로 전이된 종양입니다.[55] 전이성 종양의 발생률은 원발성 종양보다 약 4배 더 높습니다.[10] 종양은 증상이 있을 수도 있고 없을 수도 있습니다. 어떤 종양은 환자가 증상이 있기 때문에 발견되고, 다른 종양은 영상 스캔이나 부검에서 우연히 나타납니다.[citation needed]
중추신경계 종양의 등급은 1993년 세계보건기구가 만든 4점 척도(I-IV)에서 흔히 발생합니다. I등급 종양은 가장 덜 심각하고 일반적으로 장기 생존과 관련이 있으며 등급이 증가함에 따라 중증도와 예후가 악화됩니다. 낮은 등급의 종양은 양성인 경우가 많은 반면, 높은 등급은 공격적으로 악성이거나 전이성입니다. 다른 등급 척도가 존재하며, 많은 등급이 WHO 등급과 동일한 기준에 기반하고 I-IV 등급에서 등급이 매겨집니다.[56]
기본적인

가장 흔한 원발성 뇌종양은 다음과 같습니다.[57]
이러한 일반적인 종양은 아래와 같이 기원 조직에 따라 조직화될 수도 있습니다.[59]
| 원산지조직 | 아이들. | 어른들 |
|---|---|---|
| 성상세포 | 필로시틱 아스트로사이토마 (PCA) | Glioblastoma |
| 올리고덴드로사이트 | 올리고덴드롤글리오마 | |
| 에펜디마 | 뇌실막종 | |
| 뉴런 | 수질아세포종 | |
| 뇌수막 | 뇌수막종 |
이차적인
뇌의 2차 종양은 전이성이고 다른 장기에서 기원한 암으로부터 뇌를 침범했습니다. 즉, 암성 신생물이 체내 다른 기관에서 발생했고, 그 원발성 종양에서 암세포가 새어나와 림프계와 혈관으로 들어갔다는 것입니다. 그리고 나서 그들은 혈류를 통해 순환하고 뇌에 축적됩니다. 거기서 이 세포들은 계속해서 성장하고 분열하면서 원발암 조직의 또 다른 침습적인 신생물이 됩니다. 뇌의 2차 종양은 불치의 전이암 환자들의 말기 단계에서 매우 흔하며, 뇌의 2차 종양을 일으키는 가장 흔한 종류의 암은 폐암, 유방암, 악성 흑색종, 신장암, 대장암(빈도가 감소하는 순서)입니다.[citation needed]
이차성 뇌종양은 일차성 뇌종양보다 더 흔합니다. 미국에서는 매년 약 17만 명의 새로운 환자가 발생합니다. 이차성 뇌종양은 두개강내 종양의 가장 흔한 원인입니다. 두개골 뼈 구조는 또한 본질적으로 두개강 내의 부피를 감소시키고 뇌를 손상시킬 수 있는 신생물의 영향을 받을 수 있습니다.[60]
행동별로
뇌종양 또는 두개내 신생물은 암성(악성) 또는 비암성(양성)일 수 있습니다. 그러나 악성 또는 양성 신생물의 정의는 신체의 다른 종류의 암성 또는 비암성 신생물에서 일반적으로 사용되는 정의와 다릅니다. 신체의 다른 곳에 있는 암에서, 세 가지 악성 특성이 양성 종양과 악성 형태의 암을 구별합니다: 양성 종양은 자기 제한적이고 침범하거나 전이되지 않습니다. 악성 종양의 특징은 다음과 같습니다.[61]
- 조절되지 않는 유사분열(정상 한계를 넘어 분열에 의한 성장)
- 역형성: 신생물의 세포는 분명히 다른 형태(크기와 모양)를 가지고 있습니다. 역형성 세포는 현저한 다형성을 나타냅니다. 세포핵은 특징적으로 극도로 과색성(진하게 염색됨)이고 확대됩니다. 핵은 세포의 세포질과 동일한 크기를 가질 수 있습니다(핵-세포질 비율은 정상적인 1:4 또는 1:6 비율이 아니라 1:1에 접근할 수 있습니다). 이웃보다 상당히 큰 거대한 세포는 하나의 거대한 핵 또는 여러 개의 핵을 형성하고 보유할 수 있습니다. 역형성 핵은 크기와 모양이 다양하고 특이합니다.
- 침습 또는 침습(의학 문헌에서는 이러한 용어를 동의어로 사용함). 그러나 명확한 설명을 위해 다음 조항은 약간 다른 것을 의미한다는 협약을 준수합니다. 이 협약은 이 조항 이외에는 준수되지 않습니다.)
- 침습 또는 침습은 종양이 인접 조직이 차지하는 공간을 침범하여 다른 조직을 밀어내고 결국 조직을 압박한다는 의미에서 조절되지 않은 유사분열을 통해 종양의 공간적 확장입니다. 종종 이러한 종양은 영상에서 명확하게 윤곽이 잡힌 종양과 관련이 있습니다.
- 침윤( tumor infilt, )은 종양이 주변 조직으로 침투하는 촉수를 키우거나(종종 종양의 윤곽을 정의하지 못하거나 확산시키는) 종양 세포를 종양 덩어리의 둘레를 넘어 조직으로 "씨앗"하도록 하는 행동을 말합니다. 이것은 침윤성 종양이 공간을 차지하지 않는다는 것을 의미하지 않습니다. 자라면서 주변 조직을 압박하는 것은 아니지만, 종양이 어디서 끝나고 건강한 조직이 어디서 시작되는지는 잘 알 수 없습니다.
- 전이(림프나 혈액을 통해 신체의 다른 위치로 전이).
위의 악성 특징 중 일부 요소는 뇌의 원발성 신생물에 적용되지 않습니다.
- 원발성 뇌종양은 다른 장기로 전이되는 경우가 거의 없습니다. 일부 형태의 원발성 뇌종양은 전이될 수 있지만 두개강 내 또는 중추 척추관 외부로 전이되지는 않습니다. BBB는 원발성 신생물의 암세포가 혈류로 유입되어 체내의 다른 위치로 옮겨질 수 없음을 알려줍니다. (가끔 격리된 사례 보고에 따르면 특정 뇌종양이 중추신경계 밖으로 전이된 경우, 예를 들어 교모세포종의 뼈 전이가 있음을 시사합니다.)[62]
- 원발성 뇌종양은 일반적으로 침습적이지만(즉, 공간적으로 확장되어 다른 뇌조직이 차지하는 공간으로 침입하여 해당 뇌조직을 압박합니다), 그러나 더 악성인 원발성 뇌종양 중 일부는 주변 조직으로 침투합니다.
유전학적으로
2016년 WHO는 종양 유형, 예후 및 치료 반응을 구별하는 데 유용한 별개의 유전적 돌연변이를 포함하도록 교종의 일부 범주 분류를 재구성했습니다. 유전자 돌연변이는 일반적으로 염색을 통해 표적 단백질의 존재 여부를 시각화하는 기술인 면역조직화학을 통해 검출됩니다.[41]
- IDH1 및 IDH2 유전자의 돌연변이는 저등급 교종에서 흔히 발견됩니다
- 두 IDH 유전자의 손실과 염색체 팔의 손실 1p 및 19q가 합쳐지면 종양이 과립선종임을[63] 나타냅니다
- TP53 및 ATRX의 손실은 성상세포종을 특징으로 합니다.
- EGFR, TERT 및 PTEN 유전자는 교종에서 일반적으로 변경되며 종양 등급 및 생물학을[41] 구별하는 데 유용합니다.
특정유형
역형성 성상세포종, 역형성 올리고덴드롤글리종, 성상세포종, 중추신경세포종, 맥락막신경세포종, 맥락막신경세포종, 콜로이드낭종, Dyembryloplastic 신경상피종양, Ependymal종양, 섬유성 성상세포종, 거대세포교세포종, 교모세포종, 교모세포종, 교모세포종, 교모세포종, 뇌척수종, 혈관육종, 혈관주위세포종, 수질세포종, 수질피세포종, 수막암종, 신경세포종, 신경세포종, 올리고아스트로세포종, 올리고덴드롤리종, 시신경 수막종, 소아 뇌실막종, 필로사이틱 성상세포종, 송과세포종, 송과세포종, 다형성 역형성 신경세포종, 다형성 산토아스트로세포종, 원발성 중추신경계 림프종, 구상 날개 수막종, 상피하 거대 세포 성상세포종, 상피하 세포종, 상피하 세포종, 삼변 망막 세포종.
치료
의료진은 일반적으로 치료 옵션을 평가하여 해당 환자와 가족에게 제공합니다. 종양 유형 및 위치에 따라 다양한 유형의 치료가 가능하며, 최적의 생존 가능성을 제공하기 위해 결합될 수 있습니다.[58]
- 수술:[58] 종양 세포를 가능한 한 많이 제거하기 위한 목적으로 종양을 완전히 또는 부분적으로 절제합니다.
- 방사선 치료:[58] 뇌종양에 가장 일반적으로 사용되는 치료법으로 종양에 베타선, x선 또는 감마선을 조사합니다.
- 항암치료:[58] 그러나 혈액-뇌 장벽이 일부 약물이 암세포에 도달하는 것을 막을 수 있기 때문에 항상 뇌종양을 치료하는 데 사용되는 것은 아닙니다.
- 임상 시험을 통해 다양한 실험 요법을 이용할 수 있습니다.
원발성 뇌종양의 생존율은 종양의 종류, 연령, 환자의 기능 상태, 수술적 제거의 범위 및 각 사례에 특정한 기타 요인에 따라 달라집니다.[64]
역형성 과립선교종 및 역형성 과립선세포종에 대한 표준 치료는 수술 후 방사선 치료를 거칩니다. 한 연구에서는 방사선 치료 단독 요법에 비해 수술 후 방사선 치료에 화학 요법을 추가하는 것이 생존 이점이 있음을 발견했습니다.[65]
수술.
의료 문헌에 설명된 가장 기본적이고 가장 원하는 작업 과정은 개두술을 통한 외과적 제거(절제)입니다.[58] 최소 침습 기술은 신경 외과 종양학에서 지배적인 추세가 되고 있습니다.[66] 수술의 주요 목표는 가능한 한 많은 종양 세포를 제거하는 것이며, 완전한 제거는 최상의 결과이고 그렇지 않으면 종양의 세포 감소("debulking")입니다. 종양의 모든 가시적인 징후가 제거되고 이후 스캔에서 명백한 종양이 나타나지 않으면 GTR(Gross Total Resection)이 발생합니다.[67] 경우에 따라 종양에 접근할 수 없고 수술을 방해하거나 금지합니다.
두개골 기저부에 위치한 일부 종양을 제외한 많은 수막종은 수술로 성공적으로 제거될 수 있습니다. 대부분의 뇌하수체 선종은 외과적으로 제거될 수 있으며, 종종 비강과 두개골 기저부를 통한 최소 침습적 접근법(비강 횡단, 척추 횡단 접근법)을 사용합니다. 큰 뇌하수체 선종은 제거를 위해 개두술(두개골의 개두술)이 필요합니다. 수술이 불가능한 경우를 위해 정위 접근법을 포함한 방사선 치료가 예약되어 있습니다.[68]
현재 여러 연구 연구는 종양 세포에 형광을 유발하는 5-아미노레불린산을 표지하여 뇌종양의 수술적 제거를 개선하는 것을 목표로 합니다.[69] 수술 후 방사선 치료와 화학 요법은 악성 종양에 대한 치료 표준의 필수적인 부분입니다.[70][71]
다발성 전이성 종양은 일반적으로 수술보다는 방사선 치료와 화학 요법으로 치료하며, 이러한 경우 예후는 원발 종양에 의해 결정되며, 일반적으로 좋지 않습니다.
방사선치료
방사선 치료의 목표는 정상적인 뇌 조직을 손상시키지 않은 채 종양 세포를 죽이는 것입니다. 표준 외부 빔 방사선 치료에서는 표준 선량의 방사선 "분획"을 여러 번 처리하여 뇌에 적용합니다. 이 과정은 종양의 종류에 따라 총 10~30회에 걸쳐 반복됩니다. 이 추가적인 치료는 일부 환자들에게 개선된 결과와 더 긴 생존율을 제공합니다.[citation needed]
방사선 수술은 주변 뇌에 대한 방사선량을 최소화하면서 컴퓨터 계산을 통해 종양 부위에 방사선을 집중시키는 치료법입니다. 방사선 수술은 다른 치료법의 부수적인 것일 수도 있고, 일부 종양에 대한 일차적인 치료 기술일 수도 있습니다. 사용되는 형태에는 Gamma knife, Cyberknife 또는 Novalis Tx 방사선 수술과 같은 정위 방사선 수술이 포함됩니다.[72][unreliable medical source?]
방사선 치료는 2차 뇌종양의 가장 일반적인 치료법입니다. 방사선 치료의 양은 암의 영향을 받는 뇌 부위의 크기에 따라 다릅니다. 향후 다른 2차 종양이 발생할 위험이 있는 경우 기존의 외부 빔 "전뇌 방사선 치료"(WBRT) 또는 "전뇌 방사선 조사"가 제안될 수 있습니다.[73] 입체 방사선 치료는 보통 3개 미만의 작은 이차 뇌종양을 동반하는 경우에 권장됩니다. 방사선 치료는 종양을 절제한 후 또는 경우에 따라 사용될 수 있습니다. 뇌암에 사용되는 방사선 치료의 형태로는 가장 일반적인 외부 빔 방사선 치료와 특히 어린이에게 사용되는 마지막 방사선 치료인 근접 치료와 양성자 치료가 있습니다.
전이성 뇌종양 치료를 위해 정위방사선수술(SRS)과 전뇌방사선치료(WBRT)를 받은 사람은 SRS 단독으로 치료받은 사람보다 학습과 기억력 문제가 발생할 위험이 2배 이상 높습니다.[74][75] 2021년 체계적 검토 결과, 초기 치료로 SRS를 사용했을 때 뇌 전이와 관련된 생존 또는 사망이 WBRT를 사용한 SRS보다 크지 않은 것으로 나타났습니다.[76]
수술 후 전통적인 일일 방사선 치료는 수술 후 방사선 치료를 하지 않는 것에 비해 기능적 웰빙과 높은 등급의 교종을 가진 성인의 생존을 향상시킵니다. 저분획 방사선 치료는 특히 교모세포종이 있는 60세 이상의 사람들에게 기존 방사선 치료와 비교하여 생존에 유사한 효과를 갖습니다.[77]
화학요법
항암 치료를 받는 환자들은 종양 세포를 죽이기 위해 고안된 약물을 투여 받습니다.[58] 화학요법은 가장 악성인 원발성 뇌종양 환자들의 전반적인 생존율을 향상시킬 수 있지만, 약 20%의 환자들에게서만 그렇게 합니다. 방사선은 발달 중인 뇌에 부정적인 영향을 미칠 수 있기 때문에, 화학요법은 방사선 대신 어린 아이들에게 자주 사용됩니다. 이 치료법을 처방하는 결정은 환자의 전반적인 건강, 종양의 종류 및 암의 정도에 따라 결정됩니다. 약물의 독성과 많은 부작용, 그리고 뇌종양에서 화학요법의 불확실한 결과로 인해 이 치료법은 수술과 방사선 치료를 선호하는 치료 옵션의 범위를 더욱 좁힙니다.[78]
UCLA Neuro-Oncology는 교모세포종 진단 환자의 실시간 생존 데이터를 발표합니다. 뇌종양 환자들이 현재 치료법에 대해 어떻게 수행하고 있는지를 보여주는 미국의 유일한 기관입니다. 그들은 또한 고등급 교종 종양을 치료하는 데 사용되는 화학 요법제 목록을 보여줍니다.[79]
유전자 돌연변이는 화학요법의 효과에 상당한 영향을 미칩니다. IDH1 또는 IDH2 돌연변이가 있는 교종은 돌연변이가 없는 교종보다 화학요법에 더 잘 반응합니다. 염색체 팔 1p 및 19q의 손실은 또한 화학 방사선에 대한 더 나은 반응을 나타냅니다.[41]
다른.
션트를 사용하여 뇌척수액의 자유 흐름이 차단되어 발생하는 유체(수두증) 축적을 줄임으로써 두개내 압력으로 인한 증상을 완화할 수 있습니다.[80]
예후
뇌암의 예후는 진단받은 암의 종류에 따라 다릅니다. 연수모세포종은 항암치료, 방사선치료, 수술적 절제 등으로 예후가 좋은 반면 교모세포종은 공격적인 항암방사선치료와 수술을 하더라도 중앙생존기간이 15개월에 불과합니다.[81] 뇌간신경교종은 어떤 형태의 뇌암에서도 가장 예후가 좋지 않으며, 일반적으로 코르티코스테로이드와 함께 종양에 대한 방사선으로 구성된 치료법을 사용하더라도 대부분의 환자가 1년 이내에 사망합니다. 그러나 한 가지 유형인 소아의 초점 뇌간 교종은 예외적인 예후에 열려 있는 것으로 보이며 장기 생존이 자주 보고되었습니다.[82]
예후 또한 유전자 돌연변이의 발현에 영향을 받습니다. 특정 돌연변이는 다른 돌연변이보다 더 나은 예후를 제공합니다. 교종의 IDH1 및 IDH2 돌연변이와 염색체 팔 1p 및 19q의 결손은 일반적으로 더 나은 예후를 나타냅니다. TP53, ATRX, EGFR, PTEN, TERT 돌연변이도 예후 판정에 유용합니다.[41]
Glioblastoma
교모세포종은 악성 원발성 뇌종양의 가장 공격적이고(4등급) 가장 흔한 형태입니다. 방사선 치료, 화학 요법, 외과적 절제로 구성된 공격적인 다중 양식 요법을 사용하더라도 중앙 생존 기간은 15-18개월에 불과합니다.[81] 교모세포종에 대한 표준 치료는 종양을 최대로 외과적으로 절제한 후 수술 절차 후 2주에서 4주 사이에 방사선 치료를 하여 암을 제거하고 테모졸로마이드와 같은 화학 요법으로 이루어집니다.[83] 교모세포종 환자들은 대부분 증상을 완화하기 위해 질병 중에 코르티코스테로이드, 일반적으로 덱사메타손을 복용합니다. 실험적 치료법으로는 표적치료제, 감마나이프 방사선 수술,[84] 붕소 중성자 포획 치료제, 유전자 치료제, 케모웨이퍼 임플란트 등이 있습니다.[85][86]
올리고덴드롤교종
올리고덴드롤글리오마는 치료할 수 없지만 천천히 진행하는 악성 뇌종양입니다. 외과적 절제술, 화학 요법, 방사선 요법 또는 조합으로 치료할 수 있습니다. 일부 저등급(II등급) 종양으로 의심되는 경우 주의 깊게 기다리는 과정과 대증요법만 선택됩니다. 이 종양들은 각각 1번 염색체와 19번 염색체의 p와 q 팔의 공동 결손(1p19q 공동 결손)을 보이며, 특히 화학 감수성이 높은 종양 중 하나라고 주장하는 한 보고에서 발견되었습니다.[81][87] II등급 과립선종의 경우 최대 16.7년의 중앙 생존이 보고되었습니다.[88]
음향신경종
음향 신경종은 비암성 종양입니다.[89] 수술, 방사선 치료 또는 관찰로 치료할 수 있습니다. 진행성 난청을 예방하기 위해서는 수술이나 방사선으로 조기에 개입하는 것이 좋습니다.[90]
역학
뇌의 암 발생률 수치는 더 많이 개발된 국가와 덜 개발된 국가 사이에 상당한 차이를 보여줍니다(저개발 국가는 뇌의 종양 발생률이 더 낮습니다).[91] 이것은 진단되지 않은 종양 관련 사망으로 설명될 수 있습니다(극도로 열악한 상황에 있는 환자는 진단을 받지 않습니다). 뇌종양을 진단하는 데 필요한 현대적인 진단 시설에 접근할 수 없기 때문에) 그리고 종양이 발생하거나 종양이 생명을 위협하기 전에 환자의 생명을 선점하는 다른 빈곤과 관련된 원인에 의한 사망으로 인한 것입니다. 그럼에도 불구하고, 통계에 따르면 특정 형태의 원발성 뇌종양이 특정 인구 사이에서 더 흔합니다.[92]
저등급 성상세포종의 발생률은 국적에 따라 크게 차이가 없는 것으로 나타났습니다. 그러나 악성 중추신경계(CNS) 종양의 발병률을 조사한 연구에 따르면 국가 기원에 따라 약간의 차이가 있습니다. 일부 고등급 병변은 저등급 종양에서 발생하기 때문에 이러한 경향은 언급할 가치가 있습니다. 구체적으로 미국, 이스라엘, 북유럽 국가의 CNS 종양 발생률이 상대적으로 높은 반면 일본, 아시아 국가는 발생률이 낮습니다. 이러한 차이는 아마도 병리학적 진단 및 보고의 차이뿐만 아니라 일부 생물학적 차이를 반영할 것입니다.[93] 암 발생률에 대한 전 세계적인 데이터는 WHO(세계보건기구)에서 확인할 수 있으며 프랑스에 위치한 IARC(국제암연구기관)에서 담당합니다.[94]
미국
2015년 미국에서는 약 166,039명이 뇌나 기타 중추신경계 종양을 앓고 있었습니다. 그 결과 2018년에는 뇌종양 환자가 23,880명, 사망자는 16,830명으로 [92]전체 암의 1.4%, 전체 암 사망자의 2.8%를 차지할 것으로 예측되었습니다.[95] 진단 연령의 중앙값은 58세, 사망 연령의 중앙값은 65세였습니다. 진단은 남성이 10만 명당 약 7.5명으로 약간 더 많았고, 여성은 5.4명으로 2명이 더 적었습니다. 뇌암으로 인한 사망자는 남성이 10만 명당 5.3명, 여성이 10만 명당 3.6명으로 미국에서 뇌암 사망률 10위를 기록했습니다. 뇌암 발병의 전체 평생 위험은 남성과 여성의 경우 약 0.6%로 추정됩니다.[92][96]
영국
뇌, 기타 중추신경계 또는 두개내 종양은 영국에서 9번째로 흔한 암이며(2013년에 약 10,600명이 진단되었으며), 암 사망의 8번째로 흔한 원인입니다(2012년에 약 5,200명이 사망했습니다).[97] 뇌종양을 앓고 있는 영국 백인 환자들은 진단 후 1년 안에 사망할 가능성이 다른 인종의 환자들에 비해 30%나 높습니다. 그 이유는 알려지지 않았습니다.[98]
아이들.
미국에서는 20세 미만의 28,000명 이상의 사람들이 뇌종양을 가지고 있는 것으로 추정됩니다.[99] 2019년에는 15세 미만에서 약 3,720명의 뇌종양 환자가 새로 진단될 것으로 예상됩니다.[100] 1975-1983년보다 1985-1994년에 더 높은 비율이 보고되었습니다. 그 이유에 대해서는 약간의 논쟁이 있는데, MRI가 널리 보급되면서 동시에 점프가 발생했고, 사망률도 우연한 점프가 없었기 때문에 그 경향은 진단과 보고가 개선된 결과라는 이론이 있습니다. 중추신경계 종양은 소아암의 20-25%를 차지합니다.[101][95][102]
소아의 모든 원발성 뇌암의 평균 생존율은 74%[99]입니다. 뇌암은 19세 이하 어린이에게 가장 흔한 암으로 백혈병보다 이 그룹에서 더 많은 사망을 초래합니다.[103] 젊은 사람들은 덜 잘해요.[104]
소아(0-14)에서 가장 흔한 뇌종양의 종류는 필로시틱 성상세포종, 악성교종, 연수모세포종, 신경세포종 및 혼합 신경교종, 뇌실막종입니다.[105]
2세 이하 소아에서는 뇌종양의 약 70%가 연수아세포종, 뇌실막종, 저등급 교종입니다. 덜 흔하며, 보통 유아에게서 볼 수 있는 것은 기형종과 비정형 기형종 횡문근 종양입니다.[106] 소아 원발성 뇌종양은 기형종을 포함한 생식세포종양이 3%에 불과하지만, 전 세계적으로 발병률은 크게 차이가 납니다.[107]
영국에서는 매년 평균 14세 이하 어린이 429명이 뇌종양 진단을 받고 있으며, 19세 이하 어린이와 청년 563명이 진단을 받고 있습니다.[108]
조사.
면역요법
암 면역 요법에 대한 연구가 활발히 진행되고 있습니다. 악성 교종의 경우 2015년 현재 기대수명을 향상시키는 치료법은 없습니다.[109]
수포성 구내염 바이러스
2000년, 연구원들은 건강한 세포에 영향을 주지 않고 암세포를 감염시키고 죽이기 위해 수포성 구내염 바이러스, 즉 VSV를 사용했습니다.[110][111]
레트로바이러스 복제 벡터

교수님 주도로. 현재 UCLA에 있는 USC의 연구원 카사하라 노리(Kasahara Nori)는 2001년 고형 종양에서 유래한 세포주를 형질도입하는 데 레트로바이러스 복제 벡터의 사용을 적용한 첫 번째 성공 사례를 보고했습니다.[112] 이 초기 연구를 바탕으로 연구진은 이 기술을 생체 내 암 모델에 적용했으며 2005년 실험적인 뇌종양 동물 모델에서 장기 생존 이익을 보고했습니다.[113][unreliable medical source?] 이후 인체 임상시험에 대비해 토카젠(뇌암 치료제 위주의 제약사)이 병용치료제(토카 511 & 토카FC)로 이 기술을 추가 개발했습니다. 이는 교모세포종 및 역형성 성상교세포종을 포함한 재발성 고등급 교종의 잠재적 치료를 위한 I/II상 임상시험에서 2010년부터 조사 중입니다. 아직 결과가 발표되지 않았습니다.[114]
비침습적 탐지
혈액, 뇌척수액 또는 소변에서 액체생검으로 뇌종양의 발생 및 치료반응을 감지하고 모니터링하는 노력은 개발 초기 단계에 있습니다.[115][116]
참고 항목
참고문헌
- ^ a b c d e f g h i j k l m n o p "Adult Brain Tumors Treatment". NCI. 28 February 2014. Archived from the original on 5 July 2014. Retrieved 8 June 2014.
- ^ a b c d e f g h i j k l m n o "General Information About Adult Brain Tumors". NCI. 14 April 2014. Archived from the original on 5 July 2014. Retrieved 8 June 2014.
- ^ a b c d e f g h i "Chapter 5.16". World Cancer Report 2014. World Health Organization. 2014. ISBN 978-9283204299. Archived from the original on 19 September 2016.
- ^ a b "Cancer of the Brain and Other Nervous System – Cancer Stat Facts". SEER. Retrieved 22 July 2019.
- ^ Vos T, Allen C, Arora M, Barber RM, Bhutta ZA, Brown A, et al. (GBD 2015 Disease and Injury Incidence and Prevalence Collaborators) (October 2016). "Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. 388 (10053): 1545–1602. doi:10.1016/S0140-6736(16)31678-6. PMC 5055577. PMID 27733282.
- ^ Wang H, Naghavi M, Allen C, Barber RM, Bhutta ZA, Carter A, et al. (GBD 2015 Mortality and Causes of Death Collaborators) (October 2016). "Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. 388 (10053): 1459–1544. doi:10.1016/S0140-6736(16)31012-1. PMC 5388903. PMID 27733281.
- ^ Longo DL (2012). "369 Seizures and Epilepsy". Harrison's principles of internal medicine (18th ed.). McGraw-Hill. p. 3258. ISBN 978-0-07-174887-2.
- ^ a b c d 스몰 NR, 브래디 Z, 스쿠라 KJ, 리 C, 베링턴 데 곤살레스 A, 매튜스 JD. 컴퓨터 단층 촬영 스캔 방사선과 뇌암 발생률. 신경종양학. 2023년 1월 14일 https://doi.org/10.1093/neuonc/noad012
- ^ "Benign brain tumour (non-cancerous)". nhs.uk. 20 October 2017. Retrieved 29 July 2019.
- ^ a b Merrell RT (December 2012). "Brain tumors". Disease-a-Month. 58 (12): 678–89. doi:10.1016/j.disamonth.2012.08.009. PMID 23149521.
- ^ World Cancer Report 2014. World Health Organization. 2014. pp. Chapter 1.3. ISBN 978-9283204299.
- ^ "Brain Tumour Facts 2011" (PDF). Brain Tumour Alliance Australia. Archived from the original (PDF) on 25 January 2014. Retrieved 9 June 2014.
- ^ "Brain Tumors". Archived from the original on 12 August 2016. Retrieved 2 August 2016.
- ^ a b "Mood Swings and Cognitive Changes American Brain Tumor Association". abta.org. Archived from the original on 2 August 2016. Retrieved 3 August 2016.
- ^ "Coping With Personality & Behavioral Changes". brainsciencefoundation.org. Archived from the original on 30 July 2016. Retrieved 3 August 2016.
- ^ a b c d Kahn K, Finkel A (June 2014). "It IS a tumor -- current review of headache and brain tumor". Current Pain and Headache Reports. 18 (6): 421. doi:10.1007/s11916-014-0421-8. PMID 24760490. S2CID 5820118.
- ^ "Nosebleeds & Headaches: Do You Have Brain Cancer?". Advanced Neurosurgery Associates. 19 November 2020. Retrieved 26 November 2020.
- ^ a b Gregg N, Arber A, Ashkan K, Brazil L, Bhangoo R, Beaney R, et al. (November 2014). "Neurobehavioural changes in patients following brain tumour: patients and relatives perspective" (PDF). Supportive Care in Cancer. 22 (11): 2965–72. doi:10.1007/s00520-014-2291-3. PMID 24865878. S2CID 2072277.
- ^ a b "Coping With Personality & Behavioral Changes". brainsciencefoundation.org. Archived from the original on 30 July 2016. Retrieved 27 July 2016.
- ^ a b c "Mood Swings and Cognitive Changes American Brain Tumor Association". abta.org. Archived from the original on 15 August 2016. Retrieved 27 July 2016.
- ^ Warnick R (August 2018). "Brain Tumors: an introduction". Mayfield Brain and Spine Clinic.
- ^ "Changes in Vision – Brain Tumour Symptoms". thebraintumourcharity.org. Archived from the original on 10 February 2018. Retrieved 9 February 2018.
- ^ a b "Brain Tumors". Children's Hospital of Wisconsin. 6 March 2019.
- ^ a b c Jones C. "Brain Tumor Symptoms Miles for Hope Brain Tumor Foundation". milesforhope.org. Archived from the original on 14 August 2016. Retrieved 3 August 2016.
- ^ Beevers Z, Hussain S, Boele FW, Rooney AG (July 2020). "Pharmacological treatment of depression in people with a primary brain tumour". The Cochrane Database of Systematic Reviews. 2020 (7): CD006932. doi:10.1002/14651858.CD006932.pub4. PMC 7388852. PMID 32678464.
- ^ 스몰 NR, 브래디 Z, 스쿠라 K, 매튜스 JD. 이온화 방사선 노출 및 뇌암 발생률: 수명 연구 코호트. 암 역학. 2016년 6월 42:60–5.
- ^ Kleihues P, Ohgaki H, Eibl RH, Reichel MB, Mariani L, Gehring M, Petersen I, Höll T, von Deimling A, Wiestler OD, Schwab M (1994). "Type and frequency of p53 mutations in tumors of the nervous system and its coverings". Molecular Neuro-oncology and Its Impact on the Clinical Management of Brain Tumors. Recent results in cancer research. Vol. 135. Springer. pp. 25–31. ISBN 978-3540573517.
- ^ Hodgson TS, Nielsen SM, Lesniak MS, Lukas RV (September 2016). "Neurological Management of Von Hippel-Lindau Disease". The Neurologist (Review). 21 (5): 73–8. doi:10.1097/NRL.0000000000000085. PMID 27564075. S2CID 29232748.
- ^ Rogers L, Barani I, Chamberlain M, Kaley TJ, McDermott M, Raizer J, et al. (January 2015). "Meningiomas: knowledge base, treatment outcomes, and uncertainties. A RANO review". Journal of Neurosurgery (Review). 122 (1): 4–23. doi:10.3171/2014.7.JNS131644. PMC 5062955. PMID 25343186.
- ^ Hourigan CS (June 2006). "The molecular basis of coeliac disease". Clinical and Experimental Medicine (Review). 6 (2): 53–9. doi:10.1007/s10238-006-0095-6. PMID 16820991. S2CID 12795861.
- ^ "Brain Cancer Causes, Symptoms, Stages & Life Expectancy". MedicineNet. Retrieved 24 February 2020.
- ^ Frei P, Poulsen AH, Johansen C, Olsen JH, Steding-Jessen M, Schüz J (October 2011). "Use of mobile phones and risk of brain tumours: update of Danish cohort study". BMJ. 343: d6387. doi:10.1136/bmj.d6387. PMC 3197791. PMID 22016439.
- ^ "IARC classifies radiofrequency electromagnetic fields as possibly carcinogenic to humans" (PDF). World Health Organization press release N° 208 (Press release). International Agency for Research on Cancer. 31 May 2011. Archived (PDF) from the original on 1 June 2011. Retrieved 2 June 2011.
- ^ a b c d Moore KL, Agur AM, Dalley II AF (September 2017). Clinically oriented anatomy (Eighth ed.). Philadelphia: Lippincott Williams and Wilkins. ISBN 9781496347213. OCLC 978362025.
- ^ "Meningioma Brain Tumor". neurosurgery.ucla.edu. Retrieved 29 July 2019.
- ^ "Neurons & Glial Cells SEER Training". training.seer.cancer.gov. Retrieved 29 July 2019.
- ^ Ostrom QT, Gittleman H, Farah P, Ondracek A, Chen Y, Wolinsky Y, et al. (November 2013). "CBTRUS statistical report: Primary brain and central nervous system tumors diagnosed in the United States in 2006-2010". Neuro-Oncology. 15 (Suppl 2): ii1-56. doi:10.1093/neuonc/not151. PMC 3798196. PMID 24137015.
- ^ a b "Adult Central Nervous System Tumors Treatment (PDQ®)–Patient Version – National Cancer Institute". cancer.gov. 11 May 2020. Retrieved 29 January 2021.
- ^ a b Herholz K, Langen KJ, Schiepers C, Mountz JM (November 2012). "Brain tumors". Seminars in Nuclear Medicine. 42 (6): 356–70. doi:10.1053/j.semnuclmed.2012.06.001. PMC 3925448. PMID 23026359.
- ^ Brandes AA, Pasetto LM, Lumachi F, Monfardini S (March 2000). "Endocrine dysfunctions in patients treated for brain tumors: incidence and guidelines for management". Journal of Neuro-Oncology. 47 (1): 85–92. doi:10.1023/a:1006471405435. PMID 10930105. S2CID 37522684.
- ^ a b c d e Iv M, Yoon BC, Heit JJ, Fischbein N, Wintermark M (January 2018). "Current Clinical State of Advanced Magnetic Resonance Imaging for Brain Tumor Diagnosis and Follow Up". Seminars in Roentgenology. 53 (1): 45–61. doi:10.1053/j.ro.2017.11.005. PMID 29405955.
- ^ Bullitt E, Jung I, Muller K, Gerig G, Aylward S, Joshi S, et al. (2004). Determining Malignancy of Brain Tumors by Analysis of Vessel Shape. Medical Image Computing and Computer-Assisted Intervention – MICCAI 2004. Berlin, Heidelberg: Springer Berlin Heidelberg. pp. 645–653. doi:10.1007/978-3-540-30136-3_79. ISBN 978-3-540-22977-3.
- ^ Horská A, Barker PB (August 2010). "Imaging of brain tumors: MR spectroscopy and metabolic imaging". Neuroimaging Clinics of North America. 20 (3): 293–310. doi:10.1016/j.nic.2010.04.003. PMC 2927327. PMID 20708548.
- ^ "MRI (magnetic resonance imaging)". mayfieldclinic.com. Retrieved 28 November 2022.
- ^ Cha S (October 2004). "Perfusion MR imaging of brain tumors". Topics in Magnetic Resonance Imaging. 15 (5): 279–289. doi:10.1097/00002142-200410000-00002. PMID 15627003. S2CID 25773559.
- ^ Bogomolny DL, Petrovich NM, Hou BL, Peck KK, Kim MJ, Holodny AI (October 2004). "Functional MRI in the brain tumor patient". Topics in Magnetic Resonance Imaging. 15 (5): 325–335. doi:10.1097/00002142-200410000-00005. PMID 15627006. S2CID 45995537.
- ^ Maier SE, Sun Y, Mulkern RV (August 2010). "Diffusion imaging of brain tumors". NMR in Biomedicine. 23 (7): 849–864. doi:10.1002/nbm.1544. PMC 3000221. PMID 20886568.
- ^ a b "Tests for Brain and Spinal Cord Tumors in Adults". cancer.org. Retrieved 28 November 2022.
- ^ "Recognizing intra-axial tumors on brain computed tomography (CT) Medmastery". public-nuxt.frontend.prod.medmastery.io. Retrieved 28 November 2022.
- ^ Wollring, Michael M.; [additional authors] (2023). "Prediction of response to lomustine-based chemotherapy in glioma patients at recurrence using MRI and FET PET". Neuro-oncology. 25 (5): 984–994. doi:10.1093/neuonc/noac229. PMC 10158105. PMID 36215231.
- ^ Watson AN (1 January 2007). "Significance of "Atypia" Found on Needle Biopsy of the Breast: Correlation with Surgical Outcome". Yale Medicine Thesis Digital Library.
- ^ MedlinePlus 백과사전: 괴사
- ^ Emami Nejad A, Najafgholian S, Rostami A, Sistani A, Shojaeifar S, Esparvarinha M, et al. (January 2021). "The role of hypoxia in the tumor microenvironment and development of cancer stem cell: a novel approach to developing treatment". Cancer Cell International. 21 (1): 62. doi:10.1186/s12935-020-01719-5. PMC 7816485. PMID 33472628.
- ^ Krishna V (2004). Textbook of Pathology. Chennai: Orient Longman. p. 1029. ISBN 8125026959.
- ^ "What you need to know about brain tumors". National Cancer Institute. Archived from the original on 27 January 2012. Retrieved 25 February 2012.
- ^ Gupta A, Dwivedi T (October 2017). "A Simplified Overview of World Health Organization Classification Update of Central Nervous System Tumors 2016". Journal of Neurosciences in Rural Practice. 8 (4): 629–641. doi:10.4103/jnrp.jnrp_168_17. PMC 5709890. PMID 29204027.
- ^ Park BJ, Kim HK, Sade B, Lee JH (2009). "Epidemiology". In Lee JH (ed.). Meningiomas: Diagnosis, Treatment, and Outcome. Springer. p. 11. ISBN 978-1-84882-910-7.
- ^ a b c d e f g h i "Brain Tumors – Classifications, Symptoms, Diagnosis and Treatments". aans.org. Retrieved 29 January 2021.
- ^ "Classifications of Brain Tumors". AANS. American Association of Neurological Surgeons. Archived from the original on 24 April 2017. Retrieved 23 April 2017.
- ^ MedlinePlus 백과사전: 전이성 뇌종양
- ^ Louis DN, Perry A, Wesseling P, Brat DJ, Cree IA, Figarella-Branger D, et al. (August 2021). "The 2021 WHO Classification of Tumors of the Central Nervous System: a summary". Neuro-Oncology. 23 (8): 1231–1251. doi:10.1093/neuonc/noab106. PMC 8328013. PMID 34185076.
- ^ Frappaz D, Mornex F, Saint-Pierre G, Ranchere-Vince D, Jouvet A, Chassagne-Clement C, et al. (1999). "Bone metastasis of glioblastoma multiforme confirmed by fine needle biopsy". Acta Neurochirurgica. 141 (5): 551–2. doi:10.1007/s007010050342. PMID 10392217. S2CID 40327650.
- ^ "Oligodendroglioma". The Lecturio Medical Concept Library. Retrieved 21 August 2021.
- ^ Nicolato A, Gerosa MA, Fina P, Iuzzolino P, Giorgiutti F, Bricolo A (September 1995). "Prognostic factors in low-grade supratentorial astrocytomas: a uni-multivariate statistical analysis in 76 surgically treated adult patients". Surgical Neurology. 44 (3): 208–21, discussion 221–3. doi:10.1016/0090-3019(95)00184-0. PMID 8545771.
- ^ Lecavalier-Barsoum M, Quon H, Abdulkarim B (May 2014). "Adjuvant treatment of anaplastic oligodendrogliomas and oligoastrocytomas". The Cochrane Database of Systematic Reviews. 2014 (5): CD007104. doi:10.1002/14651858.cd007104.pub2. PMC 7388823. PMID 24833028.
- ^ Spetzler RF, Sanai N (February 2012). "The quiet revolution: retractorless surgery for complex vascular and skull base lesions". Journal of Neurosurgery. 116 (2): 291–300. doi:10.3171/2011.8.JNS101896. PMID 21981642.
- ^ "Brain & Spinal Tumors: Surgery & Recovery Advanced Neurosurgery". Advanced Neurosurgery Associates. Retrieved 8 October 2020.
- ^ Gheorghiu ML, Fleseriu M (2017). "Stereotactic Radiation Therapy in Pituitary Adenomas, is it Better than Conventional Radiation Therapy?". Acta Endocrinologica. 13 (4): 476–490. doi:10.4183/aeb.2017.476. PMC 6516550. PMID 31149219.
- ^ Brennan P (4 August 2008). "Introduction to brain cancer". cliniclog.com. Archived from the original on 17 February 2012. Retrieved 19 December 2011.
- ^ Penoncello GP, Gagneur JD, Vora SA, Mrugala MM, Bendok BR, Rong Y (5 February 2022). "Comprehensive commissioning and clinical implementation of GammaTiles STaRT for intracranial brain tumors". Advances in Radiation Oncology. 7 (4): 100910. doi:10.1016/j.adro.2022.100910. ISSN 2452-1094. PMC 9010698. PMID 35434425. S2CID 246623373.
- ^ DeAngelis LM (January 2001). "Brain tumors". The New England Journal of Medicine. 344 (2): 114–23. doi:10.1056/NEJM200101113440207. ISSN 0028-4793. PMID 11150363.
- ^ "Radiosurgery treatment comparisons – Cyberknife, Gamma knife, Novalis Tx". Archived from the original on 20 May 2007. Retrieved 22 July 2014.
- ^ "Treating secondary brain tumours with WBRT". Cancer Research UK. Archived from the original on 25 October 2007. Retrieved 5 June 2012.
- ^ "Whole Brain Radiation increases risk of learning and memory problems in cancer patients with brain metastases". MD Anderson Cancer Center. Archived from the original on 5 October 2008. Retrieved 5 June 2012.
- ^ "Metastatic brain tumors". International RadioSurgery Association. Archived from the original on 16 June 2012. Retrieved 5 June 2012.
- ^ Garsa A, Jang JK, Baxi S, Chen C, Akinniranye O, Hall O, et al. (9 June 2021). Radiation Therapy for Brain Metasases. doi:10.23970/ahrqepccer242. PMID 34152714. S2CID 236256085.
- ^ Khan L, Soliman H, Sahgal A, Perry J, Xu W, Tsao MN (May 2020). "External beam radiation dose escalation for high grade glioma". The Cochrane Database of Systematic Reviews. 5 (8): CD011475. doi:10.1002/14651858.CD011475.pub3. PMC 7389526. PMID 32437039.
- ^ Perkins A, Liu G (February 2016). "Primary Brain Tumors in Adults: Diagnosis and Treatment". American Family Physician. 93 (3): 211–217. PMID 26926614.
- ^ "How Our Patients Perform: Glioblastoma Multiforme". UCLA Neuro-Oncology Program. Archived from the original on 9 June 2012. Retrieved 5 June 2012.
- ^ Dalvi A. "Normal Pressure Hydrocephalus Causes, Symptoms, Treatment". eMedicineHealth. Emedicinehealth.com. Archived from the original on 22 February 2012. Retrieved 17 February 2012.
- ^ a b c Central Nervous System Tumours. International Agency for Research on Cancer. 2021. pp. 39 ff. ISBN 9789283245087.
- ^ "Brain Stem Gliomas in Childhood". Childhoodbraintumor.org. Archived from the original on 9 March 2012. Retrieved 17 February 2012.
- ^ Sasmita AO, Wong YP, Ling AP (February 2018). "Biomarkers and therapeutic advances in glioblastoma multiforme". Asia-Pacific Journal of Clinical Oncology. 14 (1): 40–51. doi:10.1111/ajco.12756. PMID 28840962.
- ^ "GBM Guide – MGH Brain Tumor Center". Brain.mgh.harvard.edu. Archived from the original on 16 February 2012. Retrieved 17 February 2012.
- ^ Tai CK, Kasahara N (January 2008). "Replication-competent retrovirus vectors for cancer gene therapy" (PDF). Frontiers in Bioscience. 13 (13): 3083–95. doi:10.2741/2910. PMID 17981778. Archived from the original (PDF) on 19 March 2012.
- ^ Murphy AM, Rabkin SD (April 2013). "Current status of gene therapy for brain tumors". Translational Research. 161 (4): 339–54. doi:10.1016/j.trsl.2012.11.003. PMC 3733107. PMID 23246627.
- ^ Ty AU, See SJ, Rao JP, Khoo JB, Wong MC (January 2006). "Oligodendroglial tumor chemotherapy using "decreased-dose-intensity" PCV: a Singapore experience". Neurology. 66 (2): 247–9. doi:10.1212/01.wnl.0000194211.68164.a0. PMID 16434664. S2CID 31170268. Archived from the original on 20 July 2008.
- ^ "Neurology". Neurology. Archived from the original on 19 February 2012. Retrieved 17 February 2012.
- ^ "Acoustic Neuroma (Vestibular Schwannoma)". hopkinsmedicine.org. Retrieved 19 July 2019.
- ^ "UpToDate". uptodate.com. Retrieved 19 July 2019.
- ^ Bondy ML, Scheurer ME, Malmer B, Barnholtz-Sloan JS, Davis FG, Il'yasova D, et al. (October 2008). "Brain tumor epidemiology: consensus from the Brain Tumor Epidemiology Consortium". Cancer. 113 (7 Suppl): 1953–68. doi:10.1002/cncr.23741. PMC 2861559. PMID 18798534.
- ^ a b c "Cancer Stat Facts: Brain and Other Nervous System Cancer". National Cancer Institute. 31 March 2019.
- ^ Jallo GI, Benardete EA (January 2010). "Low-Grade Astrocytoma". Archived from the original on 27 July 2010.
- ^ "CANCERMondial". International Agency for Research on Cancer. Archived from the original on 17 February 2012. Retrieved 17 February 2012.
- ^ a b "What are the key statistics about brain and spinal cord tumors?". American Cancer Society. 1 May 2012. Archived from the original on 2 July 2012.
- ^ "2018 CBTRUS Fact Sheet". Central Brain Tumor Registry of the United States. 31 March 2019. Archived from the original on 14 February 2019. Retrieved 14 February 2019.
- ^ "Brain, other CNS and intracranial tumours statistics". Cancer Research UK. Archived from the original on 16 October 2014. Retrieved 27 October 2014.
- ^ 영국 백인 뇌종양 환자 "1년 안에 사망 가능성 높아" 가디언
- ^ a b "Quick Brain Tumor Facts". National Brain Tumor Society. Retrieved 14 February 2019.
- ^ "CBTRUS – 2018 CBTRUS Fact Sheet". cbtrus.org. Archived from the original on 14 February 2019. Retrieved 14 February 2019.
- ^ Hoda SA, Cheng E (6 November 2017). "Robbins Basic Pathology". American Journal of Clinical Pathology. 148 (6): 557. doi:10.1093/ajcp/aqx095.
- ^ Chamberlain MC, Kormanik PA (February 1998). "Practical guidelines for the treatment of malignant gliomas". The Western Journal of Medicine. 168 (2): 114–120. PMC 1304839. PMID 9499745.
- ^ "Childhood Brain Cancer Now Leads to More Deaths than Leukemia". Fortune. Retrieved 14 February 2019.
- ^ Gurney JG, Smith MA, Bunin GR. "CNS and Miscellaneous Intracranial and Intraspinal Neoplasms" (PDF). SEER Pediatric Monograph. National Cancer Institute. pp. 51–57. Archived (PDF) from the original on 17 December 2008. Retrieved 4 December 2008.
In the US, approximately 2,200 children and adolescents younger than 20 years of age are diagnosed with malignant central nervous system tumors each year. More than 90 percent of primary CNS malignancies in children are located within the brain.
- ^ "Ependymoma". The Lecturio Medical Concept Library. Retrieved 19 July 2021.
- ^ Rood BR. "Infantile Brain Tumors". The Childhood Brain Tumor Foundation. Archived from the original on 11 November 2012. Retrieved 23 July 2014.
- ^ Echevarría ME, Fangusaro J, Goldman S (June 2008). "Pediatric central nervous system germ cell tumors: a review". The Oncologist. 13 (6): 690–9. doi:10.1634/theoncologist.2008-0037. PMID 18586924. S2CID 8114229.
- ^ "About childhood brain tumours". Archived from the original on 7 August 2016. Retrieved 16 June 2016.
- ^ Bloch O (2015). "Immunotherapy for Malignant Gliomas". Current Understanding and Treatment of Gliomas. Cancer Treatment and Research. Vol. 163. pp. 143–158. doi:10.1007/978-3-319-12048-5_9. ISBN 978-3-319-12047-8. PMID 25468230.
- ^ Auer R, Bell JC (January 2012). "Oncolytic viruses: smart therapeutics for smart cancers". Future Oncology. 8 (1): 1–4. doi:10.2217/fon.11.134. PMID 22149027.
- ^ Garber K (March 2006). "China approves world's first oncolytic virus therapy for cancer treatment". Journal of the National Cancer Institute. 98 (5): 298–300. doi:10.1093/jnci/djj111. PMID 16507823.
- ^ Logg CR, Tai CK, Logg A, Anderson WF, Kasahara N (May 2001). "A uniquely stable replication-competent retrovirus vector achieves efficient gene delivery in vitro and in solid tumors". Human Gene Therapy. 12 (8): 921–32. doi:10.1089/104303401750195881. PMC 8184367. PMID 11387057.
- ^ Tai CK, Wang WJ, Chen TC, Kasahara N (November 2005). "Single-shot, multicycle suicide gene therapy by replication-competent retrovirus vectors achieves long-term survival benefit in experimental glioma". Molecular Therapy. 12 (5): 842–51. doi:10.1016/j.ymthe.2005.03.017. PMC 8185609. PMID 16257382.
- ^ "A Study of a Retroviral Replicating Vector Administered to Subjects With Recurrent Malignant Glioma". Clinical Trials.gov. July 2014. Archived from the original on 26 November 2011.
- ^ van der Pol Y, Mouliere F (October 2019). "Toward the Early Detection of Cancer by Decoding the Epigenetic and Environmental Fingerprints of Cell-Free DNA". Cancer Cell. 36 (4): 350–368. doi:10.1016/j.ccell.2019.09.003. PMID 31614115.
- ^ Eibl RH, Schneemann M (October 2021). "Liquid Biopsy and Primary Brain Tumors". Cancers (Basel). 13 (21): 5429. doi:10.3390/cancers13215429. PMC 8582521. PMID 34771592.


