물.
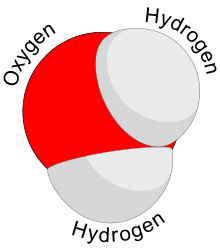
Water물(화학식2 HO)은 무기, 투명, 무미, 무취, 무색에 가까운 화학 물질로, 지구 수구와[1] 알려진 모든 살아있는 유기체의 액체 성분이다.그것은 음식, 에너지, 유기 미량 영양소를 제공하지 않지만 알려진 모든 형태의 생명체에 필수적입니다.이것의 화학식인2 HO는 각각의 분자가 공유 결합으로 연결된 하나의 산소와 두 개의 수소 원자를 포함하고 있음을 나타냅니다.수소 원자는 산소 원자에 104.45°[2]의 각도로 부착되어 있습니다."물"은 표준 온도와 압력에서 HO의 액체 상태를2 나타내는 이름이기도 합니다.
물의 많은 자연 상태가 존재한다.그것은 비의 형태로 강수량을 형성하고 안개의 형태로 에어로졸을 형성한다.구름은 물방울과 얼음방울, 즉 고체 상태로 이루어져 있다.잘게 쪼개지면 결정성 얼음이 눈의 형태로 침전될 수 있다.물의 기체 상태는 증기 또는 수증기입니다.
물은 지구 표면의 약 71%를 덮고 있으며, 대부분 바다와 바다에 있다.[3]물의 작은 부분은 지하수(1.7%), 남극 대륙과 그린란드의 빙하와 만년설(1.7%), 그리고 공기 중 수증기, 구름(공기에 떠 있는 얼음과 액체 물로 구성됨), 강수량(0.001%)[4][5]으로 발생한다.물은 증발, 증산, 응축, 강수, 유출의 물 순환을 통해 계속 이동하며, 보통 바다에 도달합니다.
물은 세계 경제에 중요한 역할을 한다.인간이 사용하는 담수의 약 70%가 [6]농업에 사용된다.소금과 민물에서의 낚시는 전 [7]세계 단백질의 6.5%를 제공하는 세계 많은 지역의 주요 식량 공급원입니다.석유, 천연 가스 및 공산품과 같은 상품들의 장거리 무역의 대부분은 배를 통해 바다, 강, 호수, 운하를 통해 운반된다.많은 양의 물, 얼음, 수증기가 산업과 가정에서 냉난방에 사용됩니다.물은 광물과 유기물의 다양한 물질에 대한 뛰어난 용매입니다. 따라서 물은 산업 공정, 요리 및 세척에 널리 사용됩니다.물, 얼음, 눈은 또한 수영, 유람선, 보트 경주, 서핑, 스포츠 낚시, 다이빙, 아이스 스케이트, 스키와 같은 많은 스포츠와 다른 형태의 오락의 중심이다.
어원학
water라는 단어는 고대 영어 wéter에서 유래한 것으로, *watar 원어 독일어(watar, frisian wetir, 네덜란드 물, 고대 하이 독일어 wazzar, 독일어 wasser, vatn, 고딕어 wato, wod-wed 형식의 어원)에서 유래했다.Also cognate, through the Indo-European root, with Greek ύδωρ (ýdor), Russian вода́ (vodá), Irish uisce, and Albanian ujë.
역사
특성.
물(HO
2)은 상온에서 맛이 없고 냄새가 나지 않는 액체인 극성 무기 화합물이며, 파란색의 기미가 있는 거의 무색입니다.이 가장 단순한 수소 칼코게니드는 지금까지 가장 많이 연구된 화합물이며 많은 물질을 [9][10]녹일 수 있는 능력으로 "보편적 용매"로 묘사됩니다.이것은 그것이 [11]"생명의 해결책"이 될 수 있게 한다: 사실, 자연에서 발견되는 물은 거의 항상 다양한 용해 물질을 포함하고 있으며, 화학적으로 순수한 물을 얻기 위해서는 특별한 단계가 필요하다.물은 정상적인 지상 [12]조건에서 고체, 액체, 기체로 존재하는 유일한 흔한 물질이다.
미국.
물은 산화산과 함께 화합물 [13]HO의
2 두 가지 공식 명칭 중 하나이며 [14]HO의 액상이기도
2 합니다.물의 다른 두 가지 일반적인 상태는 고체상인 얼음과 기체상인 수증기 또는 증기이다.열의 추가 또는 제거는 상전이를 일으킬 수 있습니다: 동결(물 대 얼음), 용융(물 대 얼음), 증발(물 대 증기), 응축(증기 대 물), 승화(얼음 대 증기) 및 증착(증기 [15]대 얼음).
밀도
물은 [17]얼면 밀도가 낮아진다는 점에서 대부분의 액체와 다르다.1atm 압력에서는 3.98°C(39.16°F)[18]에서 최대 밀도 1,000kg/m3(62.43lb/cuft)에 도달합니다.얼음의 밀도는 917 kg/m3(57.25 lb/cu ft)로 9%[19][20] 확장됩니다.이 팽창은 파이프 파열과 암석 [21]균열 등 엄청난 압력을 가할 수 있다.
호수나 바다에서는 4°C(39.2°F)의 물이 바닥으로 가라앉고 표면에 얼음이 형성되어 액체 상태의 물 위에 떠다닌다.이 얼음은 아래 물을 단열시켜 고체가 얼지 않도록 한다.이러한 보호가 없다면, 대부분의 수생 생물들은 겨울 [22]동안 멸종할 것이다.
자기
물은 반자성 [23]물질이다.상호작용은 약하지만, 초전도 자석과 함께 주목할 만한 상호작용을 [23]얻을 수 있습니다.
상전이
1기압(atm)에서 얼음 또는 물은 0°C(32°F)에서 녹고 물은 100°C(212°F)에서 응축됩니다.그러나 끓는점 이하에서도 물은 증발에 의해 표면에서 증기로 변할 수 있습니다(액체 전체의 증발은 끓는 것으로 알려져 있습니다).표면에서도 [15]승화 및 증착이 발생합니다.예를 들어, 서리는 차가운 표면에 퇴적되고 눈송이는 에어로졸 입자 또는 얼음 [24]핵에 퇴적됨으로써 형성된다.동결건조 과정에서 식품을 냉동 보관하고, 그 표면의 얼음을 [25]승화시킨다.
녹는점과 끓는점은 압력에 따라 달라집니다.압력에 따른 용해 온도 변화율에 대한 근사치는 Clausius-Clapeyron 관계에 의해 제공됩니다.
서 v L 및 {\은 액상과 고상의 몰 부피이며, f{\는 용해 시 몰 잠열이다.대부분의 물질에서 용융이 발생하면 부피가 증가하므로 압력에 따라 용융 온도가 높아집니다.그러나 얼음은 물보다 밀도가 낮기 때문에 녹는 온도는 [16]낮아진다.빙하에서, 압력 용융은 충분히 두꺼운 얼음 부피 아래에서 일어날 수 있고, 그 결과 빙하 아래 [26][27]호수가 생길 수 있다.
Clausius-Clapeyron 관계는 비등점에도 적용되지만, 액체/기체의 전이에서는 기상 밀도가 액상보다 훨씬 낮기 때문에 압력에 [28]따라 비등점이 증가합니다.물은 깊은 바다나 지하에서 높은 온도에서 액체 상태를 유지할 수 있다.예를 들어, 옐로스톤 국립공원의 간헐천인 [29]올드 페이스풀의 온도는 205°C(401°F)를 넘습니다.열수 환기구에서는 온도가 400°C(752°F)[30]를 초과할 수 있습니다.
해수면에서 물의 비등점은 100°C(212°F)입니다.기압이 고도에 따라 감소하면 비등점은 274m마다 1°C씩 감소한다.높은 곳에서 요리하는 것은 해수면 요리보다 시간이 오래 걸린다.예를 들어 1,524m(5,000ft)에서 원하는 결과를 [31]얻으려면 조리시간을 4분의 1로 늘려야 한다(반대로 압력솥을 사용하면 끓는 온도를 높여 조리시간을 줄일 수 있다).[32]진공상태에서 물은 실온에서 [33]끓는다.
트리플 포인트와 크리티컬 포인트
압력/온도상도(그림 참조)에는 고체와 증기와 액체, 그리고 액체와 고체를 분리하는 곡선이 있다.이것들은 트리플 포인트라고 불리는 단일 포인트에서 만나며, 여기서 3개의 위상이 모두 공존할 수 있습니다.트리플 포인트는 273.16K(0.01°C)의 온도와 611.657 파스칼(0.00604atm)[34]의 압력에서 액체 물이 존재할 수 있는 가장 낮은 압력입니다.2019년까지 삼중점은 켈빈 [35][36]온도 척도를 정의하는 데 사용되었다.
물/증기 위상 곡선은 647.096K(373.946°C; 705.103°F) 및 22.064메가파스칼(3,200.1psi; 217.75atm)[37]에서 끝납니다.이것이 임계점으로 알려져 있습니다.높은 온도와 압력에서 액상과 증기상은 초임계 유체라고 불리는 연속상을 형성합니다.기체와 액체 같은 밀도 사이에서 서서히 압축되거나 확장될 수 있으며, 그 특성(주변 물의 특성과는 상당히 다르다)은 밀도에 민감합니다.예를 들어 적절한 압력과 온도에 따라 대부분의 유기 화합물을 포함한 비극성 화합물과 자유롭게 혼합될 수 있습니다.이를 통해 고온 전기화학 및 유기화합물과 관련된 화학반응에서 생태학적으로 양성인 용제 또는 촉매로서 다양한 용도에 유용하게 됩니다.지구의 맨틀에서는 광물의 형성, 용해, 퇴적 과정에서 [38][39]용매 역할을 한다.
얼음과 물의 위상
지구 표면에 있는 얼음의 일반적인 형태는 얼음 Ih로, 육각형 대칭의 결정을 형성하는 상이다.입방정체 대칭을 가진 또 다른 Ice Ic는 상층 [40]대기에서 발생할 수 있다.압력이 증가함에 따라 얼음은 다른 결정 구조를 형성합니다.2019년 현재 17개가 실험적으로 확인되었으며 이론적으로 [41]몇 개가 더 예측된다.18번째 형태의 얼음인 얼음 XVII는 얼굴 중심-입방체, 초이온 얼음 단계인데, 물방울이 충격파에 노출되어 물의 압력을 수백만 대기로 끌어올리고 온도를 수천 도까지 끌어올려 수소 원자가 [42][43]자유롭게 흐르는 단단한 산소 원자의 구조를 만들었을 때 발견되었다.그래핀 층 사이에 끼이면 얼음은 정사각형 [44]격자를 형성합니다.
액체 상태의 물의 화학적 성질에 대한 자세한 내용은 잘 알려져 있지 않습니다. 일부 이론은 물의 특이한 행동이 두 가지 액체 [18][45][46][47]상태의 존재에 기인한다고 주장합니다.
맛과 냄새
인간은 입안에 [48][49]물의 존재를 느낄 수 있는 특정한 센서를 가지고 있고 개구리는 [50]냄새를 맡을 수 있다고 알려져 있지만 순수한 물은 보통 맛이 없고 냄새가 없다고 묘사된다.그러나 일반 소스(생수병 포함)의 물은 보통 다양한 맛과 냄새를 주는 많은 용해 물질을 가지고 있습니다.인간과 다른 동물들은 너무 짜거나 [51]썩은 물을 피하기 위해 물의 음용성을 평가할 수 있는 감각을 발달시켰다.
색상과 외관
순수한 물은 영역 ca의 빛 흡수 때문에 눈에 띄게 파란색이다.600 nm ~800 [52]nm이 색은 낮에는 순백색 바탕에 놓인 수돗물 잔에서 쉽게 관찰할 수 있다.색상의 주요 흡수 대역은 O–H 스트레칭 진동의 함축이다.색상의 겉보기 강도는 맥주의 법칙에 따라 물기둥의 깊이에 따라 증가합니다.예를 들어 광원이 수영장의 흰색 타일에서 반사된 햇빛인 수영장에도 해당됩니다.
자연계에서는 부유물 또는 조류의 존재로 인해 색상이 파란색에서 녹색으로 변경될 수도 있다.
산업에서는 물의 낮은 함축의 강도가 높으면 경로 길이가 짧은 유리 큐벳을 사용할 수 있기 때문에 근적외선 분광법이 수용액과 함께 사용된다.약 3,500−1 cm(2.85 [53]μm) 지역에서 물 또는 수용액의 기초 신장 흡수 스펙트럼을 관찰하려면 약 25 μm의 경로 길이가 필요하다.또한 큐벳은 약 3500cm의−1 투명하고 물에 녹지 않아야 합니다. 불화칼슘은 수용액이 있는 큐벳 창문에 일반적으로 사용되는 재료 중 하나입니다.
예를 들어 1cm 샘플 셀을 사용하여 라만 활성 기본 진동을 관찰할 수 있습니다.
수생 식물, 조류, 그리고 다른 광합성 생물들은 햇빛이 그들에게 도달할 수 있기 때문에 수백 미터 깊이의 물에서 살 수 있다.실질적으로 수심 1,000미터 이하의 바다 부분에는 햇빛이 닿지 않는다.
액체 상태의 물(20°C(68°F)에서 굴절률)은 공기(1.0)보다 훨씬 높지만, 글리세롤(1.473), 벤젠(1.51), 이황화탄소(1.627), 일반 유리(1.4~1.6)보다는 낮다.얼음의 굴절률(1.31)은 액체 상태의 물보다 낮다.
극성 분자
물 분자에서 수소 원자는 산소 원자와 104.5°의 각도를 형성한다.수소 원자는 산소를 중심으로 한 사면체의 두 모서리에 가깝다.다른 두 모서리에는 결합에 참여하지 않는 원자가 전자쌍이 있습니다.완벽한 사면체에서 원자는 109.5°의 각도를 형성하지만, 단독 쌍 사이의 반발력은 수소 [54][55]원자 사이의 반발력보다 크다.O-H 결합 길이는 약 0.096 [56]nm입니다.
다른 물질들은 예를
4 들어 메탄(CH)과 황화수소(HS
2)와 같은 사면체 분자 구조를 가지고 있다.하지만, 산소는 대부분의 다른 원소들보다 더 전기음성적이기 때문에, 수소 원자가 양전하를 띠는 동안 산소 원자는 음전하를 유지합니다.구부러진 구조와 함께, 이것은 분자에게 전기적 쌍극자 모멘트를 주며, 극성 [57]분자로 분류된다.
물은 많은 소금과 설탕과 같은 친수성 유기 분자와 에탄올과 같은 단순한 알코올을 녹이는 좋은 극성 용매입니다.물은 또한 산소와 이산화탄소와 같은 많은 가스를 녹입니다. 탄산음료, 스파클링 와인, 맥주의 거품을 냅니다.게다가, 단백질, DNA, 다당류 같은 살아있는 유기체의 많은 물질들이 물에 용해된다.물과 이러한 생체 고분자의 소단위 사이의 상호작용은 단백질 접힘, DNA 염기쌍, 그리고 생명에 중요한 다른 현상들을 형성합니다.
많은 유기 물질(지방, 기름, 알칸 등)은 소수성, 즉 물에 녹지 않습니다.대부분의 금속 산화물, 황화물 및 규산염을 포함한 많은 무기 물질도 용해되지 않습니다.
수소 결합
극성 때문에 액체나 고체 상태의 물 분자는 이웃 분자와 최대 4개의 수소 결합을 형성할 수 있다.수소 결합은 대부분의 액체에서 분자를 서로 끌어당기는 반데르발스 힘보다 약 10배 더 강하다.이것이 물의 녹는점과 끓는점이 황화수소와 같은 다른 유사 화합물보다 훨씬 높은 이유입니다.또한 예외적으로 높은 비열 용량(약 4.2J/g/K), 융해 열(약 333J/g), 기화 열(2257J/g), 열 전도율(0.561~0.679W/m/K)도 설명됩니다.이러한 특성들은 열을 저장하고 해양과 대기 사이에서 물을 운반함으로써 지구의 기후를 조절하는데 더 효과적이게 만든다.물의 수소 결합은 약 23 kJ/mol이다(492 kJ/mol에서의 공유가 O-H 결합과 비교).이 중 90%는 정전기에 기인하는 것으로 추정되며,[58] 나머지 10%는 부분적으로 공유된다.
이러한 결합은 물의 높은 표면[59] 장력과 모세관력의 원인이다.모세관 작용은 물이 중력에 대항해 좁은 관 위로 이동하는 경향을 말한다.이 속성은 [60]나무와 같은 모든 혈관 식물에 의존합니다.

자가 이온화
물은 하이드로늄 수산화물의 약한 용액이다. - 생성된 하이드로늄 이온의 용매화와 함께 평형
2 2HO
3+
oh HO−
+ OH가 있다.
전기 전도율 및 전기 분해
순수한 물은 낮은 전기 전도율을 가지고 있는데, 이는 일반 소금과 같은 소량의 이온 물질이 용해되면서 증가한다.
액체 상태의 물은 전류를 흘려 수소와 산소로 나눌 수 있는데, 이를 전기 분해라고 합니다.분해에는 역공정(285.8 kJ/mol 또는 15.9 MJ/kg)[62]에 의해 방출되는 열보다 더 많은 에너지 입력이 필요합니다.
기계적 특성
액체 상태의 물은 대부분의 용도로 압축할 수 없는 것으로 가정할 수 있다. 일반 조건에서 [63]압축성은 4.4 ~ 5.1×10Pa이다−10−1.수심 4km의 바다에서도 압력이 400atm인 물은 [64]부피가 1.8% 감소하는 데 그쳤다.
물의 점도는 20°C(68°F)에서 약−3 10Pa·s 또는 0.01포이즈이며, 액체 상태의 물 속 음속은 온도에 따라 초당 1,400~1,540m(4,600~5,100ft/s)이다.소리는 특히 낮은 주파수(1kHz의 경우 약 0.03dB/km)에서 거의 감쇠되지 않은 채 물 속에서 먼 거리를 이동하며, 이는 고래와 사람에 의해 통신 및 환경 감지(소음파)[65]를 위해 이용된다.
반응성
수소보다 전기 양성이 강한 금속 원소, 특히 리튬, 나트륨, 칼슘, 칼륨, 세슘과 같은 알칼리 토류 금속과 알칼리 토류 금속은 수소를 물에서 치환하여 수산화물을 형성하고 수소를 방출합니다.고온에서 탄소는 증기와 반응하여 일산화탄소와 수소를 형성한다.
온 어스
수문학은 지구 전체의 물의 이동, 분포, 수질을 연구하는 학문이다.물의 분포에 대한 연구는 수로학이다.지하수의 분포와 이동에 대한 연구는 수문 지질학, 빙하는 빙하학, 내해는 림놀로지, 해양학이다.수문학과 관련된 생태학적 과정이 생태수문학에 초점이 맞춰져 있다.
행성의 표면 위, 아래, 그리고 표면 위에서 발견되는 물의 집합 덩어리는 수권이라고 불립니다.지구의 대략적인 물의 부피(세계의 총 물 공급량)는 1.386 × 109 입방 킬로미터(3.33 × 108 입방 마일)[4]이다.
액체 상태의 물은 바다, 바다, 호수, 강, 개울, 운하, 연못, 웅덩이 같은 수역에서 발견됩니다.지구에 있는 물의 대부분은 바닷물이다.물은 또한 고체, 액체, 그리고 증기 상태로 대기 중에 존재한다.그것은 또한 대수층에 지하수로 존재한다.
물은 많은 지질학적 과정에서 중요하다.지하수는 대부분의 암석에 존재하며, 이 지하수의 압력은 단층 패턴에 영향을 미친다.맨틀에 있는 물은 침강 지대에서 화산을 생성하는 녹는 원인이 된다.지구 표면에서 물은 화학적, 물리적 풍화 과정 모두에서 중요하다.물과 더 적지만 여전히 중요한 얼음은 또한 지구 표면에서 발생하는 많은 양의 침전물 수송의 원인이 된다.운반된 침전물의 퇴적물은 많은 종류의 퇴적암을 형성하는데, 이것은 지구 역사의 지질학적 기록을 구성한다.
물의 순환
물 순환(과학적으로 수문 순환으로 알려져 있음)은 대기, 토양 물, 지표수, 지하수, 식물 사이의 수권 내의 지속적인 물 교환을 의미합니다.
물은 다음과 같은 이동 과정으로 구성된 물 순환에서 이러한 각 영역을 통해 지속적으로 이동한다.
- 해양과 다른 수역에서 공기 중으로 증발하고 육지 식물과 동물에서 공기 중으로 증산합니다.
- 강수는 공기에서 응축되어 땅이나 바다로 떨어지는 수증기로부터 온다.
- 육지로부터의 유출은 보통 바다에 도달한다.
바다에서 주로 발견되는 대부분의 수증기는 바다로 흘러드는 유출과 같은 속도로 육지를 통해 수증기를 운반하며, 육지에서 발생하는 증발과 증산 또한 연간 72T를 기여한다.강수량은 육지에서 연간 119T의 비율로 몇 가지 형태를 취한다. 가장 일반적으로 비, 눈, 우박은 안개와 [66]이슬의 영향을 받는다.이슬은 높은 밀도의 수증기가 차가운 표면과 만나면 응축되는 작은 물방울이다.이슬은 보통 기온이 가장 낮은 아침, 일출 직전, 그리고 지구 표면의 온도가 [67]올라가기 시작할 때 형성된다.공기 중의 응축된 물은 또한 무지개를 만들기 위해 햇빛을 굴절시킬 수 있다.
유출수는 종종 강으로 흘러드는 유역 위로 모인다.하천 또는 하천 흐름을 시뮬레이션하고 수질 매개변수를 계산하는 데 사용되는 수학적 모델은 수문학적 운송 모델입니다.일부 물은 농사를 위해 관개용으로 쓰인다.강과 바다는 여행과 상업의 기회를 제공한다.침식을 통해, 유출은 인구 센터 설립을 위한 비옥한 토양과 평탄한 지반을 제공하는 강 계곡과 삼각주를 만드는 환경을 형성한다.홍수는 보통 저지대인 땅의 지역이 강물이 범람하거나 폭풍 해일이 일어날 때 발생한다.반면에, 가뭄은 한 지역이 물 공급의 부족을 발견했을 때 몇 달 또는 몇 년 동안 연장된 기간이다.이는 지형상 또는 위도에서의 위치 때문에 지역에 평균 이하의 비가 지속적으로 내릴 때 발생한다.
수자원
물은 "stock"과 "flow" 둘 다로 발생한다.물은 호수, 수증기, 지하수 또는 대수층, 그리고 얼음과 눈으로 저장될 수 있다.전 세계 담수의 총 부피 중 약 69%가 빙하와 영구 눈 덮개에 저장되고, 30%는 지하수에 저장되며, 나머지 1%는 호수, 강, 대기, 그리고 [68]생물군에 저장된다.물이 저장되는 시간은 매우 다양합니다. 일부 대수층은 수천 년 동안 저장된 물로 구성되지만 호수의 부피는 계절에 따라 변동할 수 있으며 건조한 시기에는 감소하고 습한 시기에는 증가할 수 있습니다.일부 지역의 수도 공급의 상당 부분은 비축된 물에서 추출된 물로 구성되며, 인출량이 충전을 초과하면 비축량이 감소한다.일부 추정에 따르면, 관개에 사용되는 전체 물의 30%가 지속 불가능한 지하수 유출로 인해 지하수 고갈을 [69]야기한다.
바닷물과 조류
바닷물에는 평균적으로 약 3.5퍼센트의 염화나트륨과 더 적은 양의 다른 물질이 포함되어 있습니다.바닷물의 물리적 특성은 몇 가지 중요한 측면에서 민물과 다르다.낮은 온도(약 -1.9°C(28.6°F))에서 동결되며, 동결점까지 온도가 내려가면 밀도가 증가합니다.주요 바다의 물의 염도는 발트해 0.7%에서 홍해 4.0%까지 다양하다(사해는 염도가 30~40%로 매우 높은 것으로 알려져 있다).
조수는 달과 태양이 바다에 작용하여 생기는 지역 해수면의 주기적인 상승과 하락이다.조수는 해양과 하구 수역의 깊이에 변화를 일으키고 조수 흐름으로 알려진 진동하는 해류를 생성한다.특정 위치에서 생성된 조수의 변화는 지구의 자전과 국지적 수심 측정의 효과와 함께 지구에 대한 달과 태양의 위치가 변화한 결과이다.썰물 때 물에 잠기고 썰물 때 드러나는 갯벌, 즉 조간대는 해조의 중요한 생태학적 산물이다.
생활에 미치는 영향
생물학적 관점에서 물은 생명체의 증식에 중요한 많은 뚜렷한 특성을 가지고 있다.유기화합물이 궁극적으로 복제를 허용하는 방식으로 반응하도록 함으로써 이러한 역할을 수행한다.알려진 모든 생명체들은 물에 의존한다.물은 신체의 많은 용질이 용해되는 용매로서 그리고 신체 내의 많은 대사 과정의 필수적인 부분으로서 필수적입니다.신진대사는 동화작용과 이화작용의 총합이다.동화 작용에서 물은 더 큰 분자(예: 전분자, 트리글리세리드, 연료와 정보의 저장을 위한 단백질)를 성장시키기 위해 분자로부터 제거된다.이화 작용에서 물은 더 작은 분자를 생성하기 위해 결합을 끊는 데 사용됩니다(예: 에너지 사용 또는 다른 목적을 위한 연료로 사용되는 포도당, 지방산 및 아미노산).물 없이는 이러한 특정한 대사 과정이 존재할 수 없었다.
물은 광합성과 호흡에 필수적이다.광합성 세포는 물의 수소를 [70]산소와 분리하기 위해 태양의 에너지를 사용합니다.수소는 CO와2 결합되어 포도당을 형성하고 [citation needed]산소를 방출합니다.모든 살아있는 세포는 이러한 연료를 사용하고 수소와 탄소를 산화시켜 태양의 에너지를 포착하고 그 과정에서 물과 이산화탄소를2 변화시킨다.
물은 또한 산염기 중성성과 효소 기능의 중심이다.산, 수소이온(H+, 즉 양성자) 공여체는 염기, 예를 들어 수산화이온(OH−)과 같은 양성자 수용체에 의해 중화되어 물을 형성할 수 있다.물은 pH(수소 이온 농도의 음수 로그)가 7인 중성인 것으로 간주된다.산은 pH 값이 7보다 작으며 염기는 7보다 크다.
수생생물
지표면의 물은 생명체로 가득 차 있다.최초의 생명체들은 물에서 나타났다; 거의 모든 물고기들은 물에서만 살고 돌고래와 고래와 같은 많은 종류의 해양 포유류들이 있다.양서류와 같은 몇몇 종류의 동물들은 그들의 삶의 일부를 물에서 보내고 일부는 육지에서 보낸다.다시마와 해조류와 같은 식물들은 물에서 자라며 일부 수중 생태계의 기초가 된다.플랑크톤은 일반적으로 해양 먹이사슬의 기초이다.
수생 척추동물은 생존하기 위해 산소를 공급받아야 하며, 다양한 방법으로 산소를 공급받는다.폐어 같은 물고기들은 둘 다 가지고 있지만, 물고기는 폐 대신 아가미를 가지고 있다.돌고래, 고래, 수달, 바다표범과 같은 해양 포유류는 공기를 마시기 위해 주기적으로 수면 위로 떠오를 필요가 있다.어떤 양서류는 피부를 통해 산소를 흡수할 수 있다.무척추동물은 호흡관(곤충과 연체동물 사이펀 참조)과 아가미(카르시누스)를 포함하여 산소가 부족한 물에서 생존하기 위해 광범위한 변화를 보인다.그러나 무척추동물이 수중 서식지에서 진화했기 때문에 대부분 물속에서의 호흡에 대한 전문성이 거의 없거나 전혀 없다.
인류 문명에 미치는 영향
이 섹션은 확인을 위해 추가 인용문이 필요합니다.2018년 5월 (이를 하는 방법과 에 대해 ) |
문명은 역사적으로 강과 주요 수로를 중심으로 번성했다; 문명의 요람이라 불리는 메소포타미아는 주요 강 티그리스와 유프라테스 사이에 위치해 있었다; 이집트 고대 사회는 나일강에 전적으로 의존했다.초기 인더스 계곡 문명은 인더스 강과 히말라야 산맥에서 흘러나온 지류를 따라 발달했다.로마는 또한 이탈리아 티베르 강둑에 세워졌다.로테르담, 런던, 몬트리올, 파리, 뉴욕, 부에노스 아이레스, 상하이, 도쿄, 시카고, 홍콩과 같은 대도시들은 부분적으로 그들의 성공을 물을 통한 쉬운 접근과 그로 인한 무역의 확장 덕분이다.싱가포르처럼 안전한 물 항구가 있는 섬들도 같은 이유로 번창했다.북아프리카와 중동과 같이 물이 부족한 지역에서는 깨끗한 식수에 대한 접근이 인간 발달의 주요 요인이었다.
건강과 오염

사람이 마시기에 적합한 물을 식수 또는 음용수라고 합니다.마실 수 없는 물은 여과 또는 증류 또는 다양한 다른 방법으로 마실 수 있다.6억 6천만 명 이상의 사람들이 안전한 [71][72]식수를 얻지 못하고 있다.
음용수에는 적합하지 않지만 수영이나 목욕에 사용했을 때 인체에 해롭지 않은 물은 음용수나 식수 이외의 다양한 이름으로 불리며, 안전한 물 또는 "목욕에 안전한 물"이라고 부르기도 합니다.염소는 피부와 점막을 자극하는 물질로 목욕이나 음용수를 안전하게 하기 위해 사용된다.이 용도는 매우 기술적이며, 일반적으로 정부 규정에 의해 모니터링됩니다(음용수의 경우 일반적으로 1ppm(ppm)이며, 목욕수의 경우 아직 불순물과 반응하지 않은 염소의 경우 1~2ppm).목욕용수는 염소 또는 오존과 같은 화학 소독제를 사용하거나 자외선을 사용하여 양호한 미생물학적 상태로 유지할 수 있다.
물 재활용은 폐수(일반적으로 도시 폐수라고도 함)를 다른 용도로 재사용할 수 있는 물로 바꾸는 과정입니다.
담수는 자연 수문 순환에 의해 재순환되는 재생 가능한 자원이지만, 접근에 대한 압력은 공간과 시간의 자연 고르지 못한 분포, 농업과 산업의 경제적 수요 증가, 인구 증가에서 비롯된다.현재 전 세계 약 10억 명의 사람들이 안전하고 저렴한 물을 얻지 못하고 있다.2000년 유엔은 안전한 물과 위생 시설을 이용하지 않는 전 세계 인구의 비율을 2015년까지 절반으로 줄이는 밀레니엄 개발 목표를 수립했다.이 목표를 향한 진전은 고르지 않았으며, 2015년 유엔은 2030년까지 안전하고 저렴한 물과 위생에 대한 보편적 접근을 달성한다는 지속 가능한 개발 목표에 전념했다.나쁜 수질과 나쁜 위생은 치명적이다; 매년 5백만 명의 사망자가 물과 관련된 질병으로 발생한다.세계보건기구는 안전한 물이 매년 [73]140만 명의 어린이가 설사로 사망하는 것을 예방할 수 있을 것으로 추산하고 있다.
개발도상국에서는 모든 도시 폐수의 90%가 여전히 처리되지 않은 채 지역 강이나 [74]하천으로 흘러들어갑니다.세계 인구의 약 3분의 1을 차지하는 약 50개국은 또한 중수 또는 고수 부족에 시달리고 있으며, 이 중 17개국은 매년 자연 [75]물 순환을 통해 재충전되는 물보다 더 많은 물을 추출한다.이 변종은 강이나 호수 같은 지표 민물에 영향을 미칠 뿐만 아니라 지하수 자원도 감소시킨다.
인간의 용도

농업
인간이 물을 가장 많이 사용하는 것은 농업으로, 관개 농업은 전체 물 [77]소비량의 8090%를 차지한다.미국에서는 사용을 위해 회수된 담수의 42%가 관개용이지만, 대부분의 물은 "소비되고 환경으로 환원되지 않음"으로 [78]농업에 사용되고 있다.
특히 물을 모으고, 정제하고, 전달하고, 폐수를 제거하기 위한 정교한 물 시스템을 구축하고 있는 선진국에서는 담수에 대한 접근이 종종 당연하게 여겨집니다.그러나 경제적, 인구학적, 기후적 압력의 증가로 인해 물 문제에 대한 우려가 높아지고 고정 수자원에 대한 경쟁이 치열해지면서 피크 [79]물의 개념이 생겨나고 있습니다.인구와 경제가 계속 증가하고, 물이 부족한 육류의 소비가 확대되고, 바이오 연료나 새로운 물 집약 산업에 대한 새로운 수요가 증가하면서, 새로운 물 문제가 발생할 가능성이 [80]높다.
농업의 물 관리에 대한 평가는 2007년 스리랑카 국제물관리연구소에 의해 세계가 증가하는 [81]인구를 위해 충분한 물을 공급할 수 있는지 알아보기 위해 실시되었다.농업용수의 현재 가용성을 전 세계적으로 평가하고 물 부족에 시달리는 지역을 파악했다.세계 인구의 5분의 1인 12억 명 이상이 물리적 물 부족 지역에 살고 있으며, 모든 수요를 충족시키기에는 물이 충분하지 않은 것으로 나타났다.추가로 16억 명의 사람들이 물 부족 현상을 겪고 있는 지역에 살고 있는데, 이 지역에서는 물 투자 부족이나 인적 능력 부족으로 인해 당국이 물 수요를 충족시킬 수 없다.보고서는 미래에 필요한 식량을 생산하는 것은 가능하겠지만, 오늘날의 식량 생산과 환경 추세가 지속되면 세계 많은 지역에서 위기가 발생할 것이라는 것을 발견했다.세계적인 물 위기를 피하기 위해, 농부들은 증가하는 식량 수요를 충족시키기 위해 생산성을 높이기 위해 노력해야 할 것이고, 산업과 도시는 물을 더 효율적으로 [82]사용하는 방법을 찾아야 할 것이다.
물 부족은 또한 물 집약적인 제품의 생산으로 인해 발생한다.예를 들어 면화: 청바지 한 벌에 해당하는 면화 1kg을 생산하려면 10.9입방미터(380cuft)의 물이 필요합니다.면화는 세계 물 사용량의 2.4%를 차지하지만, 물은 이미 물 부족의 위험이 있는 지역에서 소비되고 있다.예를 들어 옛 소련이 목화를 생산하기 위해 아무다리야 강이나 시르다리아 강에서 물을 빼돌린 것이 아랄해의 [83]실종에 큰 원인이었다.
밭작물의 관개
과학적 기준으로서
1795년 4월 7일, 그램은 프랑스에서 "녹는 [84]얼음의 온도에서 100분의 1미터의 세제곱과 같은 양의 순수한 물의 절대 무게"와 동일하다고 정의되었다.그러나 실제 목적을 위해서는 금속 기준 표준인 킬로그램이 1,000배 더 많이 요구되었습니다.따라서 1리터의 물의 질량을 정확하게 측정하기 위한 작업이 의뢰되었다.0°C(32°F)에서 규정된 물의 정의에도 불구하고, 과학자들은 표준을 재정의하고 당시 4°C(39°[85]F)로 측정되었던 최고 수밀도의 온도에서 측정을 수행하기로 결정했다.
SI 시스템의 켈빈 온도 척도는 정확히 273.16K(0.01°C; 32.02°F)로 정의된 물의 삼중점을 기반으로 했지만, 2019년 5월 현재 볼츠만 상수를 기반으로 한다.이 눈금은 섭씨 온도 눈금과 동일한 증분을 갖는 절대 온도 눈금으로, 원래 물의 비등점(100°C(212°F) 및 녹는점(0°C(32°F))에 따라 정의되었습니다.
천연수는 주로 수소-1과 산소-16의 동위원소로 구성되지만, 산소-18과 산소-17, 수소-2(중수소)의 무거운 동위원소도 소량 존재한다.더 무거운 동위원소의 비율은 매우 적지만, 여전히 물의 특성에 영향을 미친다.강과 호수의 물은 바닷물보다 무거운 동위원소를 덜 함유하는 경향이 있다.따라서 표준 물은 비엔나 표준 평균 해양수 규격에 정의되어 있다.
음료용


인체는 신체 [86]크기에 따라 55%에서 78%의 수분을 함유하고 있다.신체가 제대로 기능하려면 탈수를 방지하기 위해 하루에 1~7리터(0.22~1.54ppm, 0.26~1.85ppm)[citation needed]의 물이 필요합니다.정확한 양은 활동 수준, 온도, 습도 및 기타 요인에 따라 달라집니다.이 중 대부분은 직수 이외의 음식이나 음료를 통해 섭취된다.비록 영국 영양학 협회는 [87]음료에서 직접 얻는 1.8리터(6-7잔)를 포함하여 하루에 2.5리터의 총 수분 섭취가 적절한 수분을 유지하는데 최소한 필요하다고 조언하고 있지만, 건강한 사람들이 얼마나 많은 물을 섭취해야 하는지는 분명하지 않다.의학 문헌은 운동이나 따뜻한 [88]날씨로 인한 수분 손실로 인한 추가 요구 사항을 제외하고 일반적으로 평균 남성의 1리터 정도의 낮은 소비량을 선호한다.
건강한 신장은 시간당 0.8리터에서 1리터의 물을 배출할 수 있지만 운동과 같은 스트레스는 이 양을 줄일 수 있다.사람들은 운동하는 동안 필요 이상의 물을 마실 수 있고,[89][90] 치명적인 물 중독의 위험에 처하게 된다."한 사람이 하루에 8잔의 물을 마셔야 한다"는 속설은 [91]과학에 실질적인 근거가 없는 것처럼 보인다.연구에 따르면 식사 시간에 추가로 수분을 섭취하는 것, 특히 500밀리리터(18 imp floz; 17 us floz)가 체중 [92][93][94][95][96][97]감소와 관련이 있는 것으로 나타났다.적절한 수분 섭취는 [98]변비 예방에 도움이 된다.
1945년 미국 국립연구위원회 식품영양위원회가 권장한 물 섭취량은 다음과 같습니다.다양한 사람들의 일반적인 기준은 음식의 칼로리당 1밀리리터입니다.이 양은 대부분 조리된 [99]식품에 들어 있습니다.미국 국립연구위원회의 최신 식단 기준 섭취 보고서는 일반적으로 미국 조사 데이터(식량원 포함)의 총 수분 섭취 중위수에 기초하여 권장된다. 남성의 경우 3.7리터(0.81 imp gal; 0.98 美 gal), 여성의 경우 2.7리터(0.59 imp gal; 0.71 美 gal).총 [100]수분 섭취량의 약 19%를 조사했다.
특히, 임신과 모유 수유 여성은 수분을 유지하기 위해 추가 수액이 필요하다.미국 의학 연구소는 평균적으로 남성은 3리터(0.66리터, 미국 0.79리터), 여성은 2.2리터(0.48리터, 미국 0.58리터)를 섭취하고 임신부는 2.4리터(0.53리터, 미국 0.63리터)까지 모유 수유를 해야 한다고 권고했다.소변 [101]간호또한 일반적으로 수분 섭취의 약 20%는 음식에서 나오고 나머지는 식수와 음료(카페인 포함)에서 나온다.물은 소변과 대변을 통해, 땀을 흘리고, 호흡에서 수증기를 배출함으로써 다양한 형태로 몸에서 배출됩니다.신체적인 노력과 열 노출로 수분 손실이 증가하고 일일 수분 요구량도 증가할 수 있습니다.
인간은 불순물이 적은 물을 필요로 한다.일반적인 불순물에는 구리, 철, 칼슘 및 [102]납을 포함한 금속염 및 산화물 및/또는 Vibrio와 같은 유해 박테리아가 포함됩니다.일부 용질은 미각 증진과 필요한 전해질 [103]공급에 적합하고 심지어 바람직하다.
마시기에 적합한 단일 최대 담수 자원은 [104]시베리아의 바이칼 호수입니다.
세탁
세탁은 보통 물, 비누 또는 세제를 사용하여 청소하는 방법입니다.몸과 옷을 세탁하고 헹구는 것은 좋은 위생과 건강에 필수적인 부분입니다.[citation needed]
흔히 사람들은 비누와 세제를 사용하여 기름과 먼지 입자를 유화시켜 씻어낼 수 있도록 돕는다.비누는 직접 바르거나 수건으로 닦을 수 있습니다.
사람들은 종종 샤워나 욕조를 사용하여 몸을 씻거나 정기적으로 목욕을 한다.유아, 환자, 장애인은 간병인에 의해 목욕되지만, 씻을 수 있는 사람들은 종종 목욕한다.사람들은 대부분의 상황에서 벌거벗고 목욕하며 보통 집에서 혼자 목욕을 한다.목욕은 종교적 의식이나 치료[105] 목적 또는 레크리에이션 활동으로도 행해질 수 있다.
유럽에서는 화장실 사용 [106]후 화장지 대신 비데를 사용하여 외부 생식기와 항문 부위를 씻는다.비데는 물이 항문 [107]세척에 필수적이라고 여겨지는 가톨릭 국가들에서 흔하다.
손만 씻는 것이 더 잦다. 예를 들어 음식을 준비하고 먹은 후, 화장실을 사용한 후, 더러운 것을 만진 후 등.손 씻기는 [108][109][110]세균의 확산을 줄이는데 중요하다.아침에 일어나서 하는 세안이나 낮 동안 몸을 시원하게 하는 것도 흔한 일이다.양치질도 위생에 필수적이며 세탁의 일환이다.
'빨래'는 또한 의류나 침대 시트와 같은 다른 천 아이템을 손으로 또는 세탁기로 세탁하는 것을 의미할 수 있다.겉을 비누로 거품을 낸 뒤 호스로 헹구거나 조리기구를 씻는 등 세차도 할 수 있다.

교통.
해상 운송(또는 해양 운송) 및 유압식 배수 운송(또는 보다 일반적으로 수인 수송)은 수로를 통한 사람(여객) 또는 물품(화물)의 운송이다.해상 화물 운송은 기록된 역사를 통해 널리 사용되어 왔다.항공의 등장은 승객들에게 해상 여행의 중요성을 감소시켰지만, 그것은 여전히 단거리 여행과 유람선 여행으로 인기가 있다.환율 변동과 환율 조정 요인으로 알려진 운송 회사의 운임 외에 부과되는 수수료에도 불구하고, 수상 운송은 [113]항공 운송보다 저렴하다.2020년 UNCTAD에 따르면 해상 운송은 국제 무역의 약 80%를 차지한다.
해상 운송은 배, 배, 돛단배 또는 바지선, 바다와 호수, 운하를 통해 또는 강을 따라 어떤 거리에서도 실현될 수 있습니다.배송은 상업, 레크리에이션 또는 군사 목적으로 제공될 수 있습니다.광범위한 내륙 수송은 오늘날 그다지 중요하지 않지만, 많은 운하를 포함한 세계의 주요 수로는 여전히 매우 중요하며 세계 경제의 필수적인 부분입니다.특히, 어떤 재료도 물로 이동할 수 있지만, 다양한 유형의 부패하기 쉬운 생산물과 같이 재료의 배송이 시간적으로 중요할 경우, 물 수송은 실용적이지 않게 됩니다.그럼에도 불구하고 수상 운송은 소비자 제품의 해양 횡단 운송과 같은 정기적 화물, 특히 석탄, 코크스, 광석 또는 곡물과 같은 무거운 화물이나 벌크 화물에 매우 비용 효율적입니다.의심할 여지 없이, 산업 혁명은 운하를 통한 값싼 수상 운송, 항해 또는 자연 수로를 통한 모든 종류의 수상 선박이 비용 효율적인 대량 운송을 지원하는 곳에서 가장 잘 일어났다.
컨테이너화는 1970년대부터 해상 운송에 혁명을 일으켰다."일반 화물"은 상자, 상자, 팔레트, 통에 포장된 상품을 포함한다.화물이 둘 이상의 모드로 운송되는 경우, 그것은 인터모달 또는 공동모달입니다.화학적 용도
물은 화학 반응에 용매나 반응 물질로 널리 사용되며 용질이나 촉매로 많이 사용되지 않습니다.무기 반응에서 물은 많은 이온 화합물뿐만 아니라 암모니아와 물과 밀접한 관련이 있는 화합물과 같은 다른 극성 화합물들을 녹이는 일반적인 용매입니다.유기반응에서는 반응물을 잘 녹이지 않고 양성(산성 염기성)이며 친핵성이기 때문에 반응용매로는 일반적으로 사용되지 않는다.그럼에도 불구하고 이러한 특성은 때때로 바람직하다.또한 물에 의한 Diels-Alder 반응의 가속이 관찰되었다.초임계수는 최근 연구 주제가 되고 있다.산소포화 초임계수는 유기오염물질을 효율적으로 연소시킨다.수증기는 화학공업의 일부 공정에서 사용된다.예를 들어 아크로레인, 프로필렌 [114][115][116][117]및 프로판으로부터 아크릴산을 제조하는 것이 있습니다.이러한 반응에서 물의 가능한 영향에는 물과 촉매의 물리적, 화학적 상호작용 및 물과 반응 중간체의 화학적 반응이 포함된다.
열교환
물과 증기는 냉난방과 높은 열 용량으로 인해 열 교환에 사용되는 일반적인 유체입니다.차가운 물은 호수나 바다에서 자연적으로 구할 수도 있다.기화 및 물의 응축으로 열을 운반하는 것은 기화 잠열이 크기 때문에 특히 효과적입니다.단점은 철강이나 구리 같은 산업에서 흔히 볼 수 있는 금속이 처리되지 않은 물과 증기에 의해 더 빨리 산화된다는 것입니다.거의 모든 화력발전소에서 물은 작동 유체(보일러, 증기 터빈 및 콘덴서 사이의 폐쇄 루프에 사용됨)와 냉각수(냉각탑의 증발로 폐열을 수체로 교환하거나 운반하는 데 사용됨)로 사용됩니다.미국에서는 냉각 발전소가 [118]물을 가장 많이 사용한다.
원자력 산업에서는 물을 중성자 감속재로 사용할 수도 있다.대부분의 원자로에서 물은 냉각수이자 감속재이다.원자로에서 물을 제거하면 핵반응이 느려지기 때문에 이것은 일종의 소극적인 안전조치를 제공한다.그러나 반응을 멈추기 위해서는 다른 방법이 바람직하며 적절한 냉각을 보장하기 위해 핵심부를 물로 덮는 것이 바람직하다.
화재에 관한 고려 사항

물은 기화열이 높고 상대적으로 불활성이어서 소화액이 좋다.물의 증발은 불에서 열을 운반한다.많은 유기물질이 물에 떠다니고 물이 타는 액체를 퍼트리는 경향이 있기 때문에 기름과 유기용제가 포함된 화재에 물을 사용하는 것은 위험하다.
화재 진압에 물을 사용할 때는 좁은 공간에서 매우 뜨거운 불에 물을 사용할 때 발생할 수 있는 증기 폭발의 위험과 석탄, 목탄 또는 코크스 흑연과 같은 특정 금속이나 뜨거운 탄소와 반응하는 물질이 물을 분해하여 물을 발생시킬 때 발생할 수 있는 수소 폭발의 위험도 고려해야 한다.r 가스
이러한 폭발의 위력은 체르노빌 재난에서 확인되었지만, 이 사건에 관련된 물은 소방에서 나온 것이 아니라 원자로 자체의 수냉 시스템에서 나온 것이었다.노심의 극심한 과열로 물이 수증기로 폭발하면서 증기 폭발이 일어났다.수증기와 뜨거운 지르코늄 사이의 반응의 결과로 수소 폭발이 일어났을 수 있다.
일부 금속 산화물, 특히 알칼리 금속과 알칼리 토류 금속은 물과 반응할 때 너무 많은 열을 발생시켜 화재 위험이 발생할 수 있습니다.알칼리 토류 산화물 생석회는 종이 봉투에 넣어 운반하는 대량 생산 물질입니다.만약 그것들이 스며들면 내용물이 [119]물과 반응하면서 발화할 수 있다.
레크리에이션
인간은 운동과 스포츠뿐만 아니라 많은 레크리에이션 목적으로 물을 사용한다.그것들 중 일부는 수영, 수상스키, 보트타기, 서핑 그리고 다이빙을 포함한다.게다가, 아이스하키와 아이스스케이팅과 같은 몇몇 스포츠는 얼음 위에서 경기를 한다.호숫가, 해변, 워터파크는 사람들이 휴식을 취하고 휴식을 취하기 위해 가는 인기 있는 장소이다.많은 사람들은 흐르는 물의 소리와 외관이 차분하다고 생각하며, 분수나 다른 물의 특징들은 인기 있는 장식이다.어떤 사람들은 생선과 다른 동식물을 과시, 재미, 그리고 우정을 위해 수족관이나 연못 안에 기릅니다.인간은 또한 스키, 썰매, 스노우모빌, 스노보드와 같은 눈 스포츠를 위해 물을 사용하는데, 이는 물을 얼려야 한다.
물 산업
물 산업은 가정과 산업에 식수 및 폐수 서비스(하수 처리 포함)를 제공합니다.급수시설에는 우물, 빗물 수집용 저수조, 급수망, 정수시설, 물탱크, 급수탑, 낡은 수도관을 포함한 수도관 등이 있다.대기 물 생성기가 개발 중입니다.
식수는 종종 샘에서 수집되거나, 땅 속의 인공 보링에서 추출되거나, 호수나 강에서 펌프로 퍼진다.따라서 대수층이 적절한 흐름을 공급할 수 있다고 가정할 때 적절한 장소에 더 많은 유정을 건설하는 것이 더 많은 물을 생산할 수 있는 방법이다.다른 상수원에는 빗물 수집이 포함된다.물은 인간의 소비를 위해 정화가 필요할 수 있다.여기에는 용해되지 않은 물질, 용해된 물질 및 유해 미생물의 제거가 포함될 수 있습니다.유명한 방법은 분해되지 않은 물질만 제거하는 모래로 여과하는 반면 염소 처리와 끓는 것은 해로운 미생물을 죽이는 것이다.증류는 세 가지 기능을 모두 한다.역삼투와 같은 보다 고도의 기술이 존재한다.풍부한 바닷물을 담수화 하는 것은 해안 건조 기후에서 사용되는 더 비싼 해결책이다.
식수의 분배는 도시 수도 시스템, 유조선 배송 또는 생수로 이루어집니다.많은 나라의 정부들은 가난한 사람들에게 무료로 물을 나눠주는 프로그램을 가지고 있다.
식수(음용수)를 사람의 소비에만 사용하여 사용을 줄이는 것도 하나의 방법입니다.홍콩과 같은 일부 도시에서는 담수 자원을 보존하기 위해 도시 전역에 걸쳐 수세식 변기에 바닷물이 널리 사용되고 있다.
오염수는 물의 가장 큰 오남용일 수 있다. 오염물질이 물의 다른 사용을 제한한다면 오염자의 이익과 상관없이 자원의 낭비가 된다.다른 유형의 오염과 마찬가지로, 이것은 시장 원가의 표준 회계에 포함되지 않으며, 시장이 설명할 수 없는 외부 효과로 간주됩니다.따라서 다른 사람들은 수질오염의 대가를 치르고 민간기업들의 이윤은 이 오염의 피해자인 지역 주민들에게 재분배되지 않는다.인간이 소비하는 의약품은 생물이 축적되고 생분해되지 않을 경우 수로에 버려지고 수중 생물에 해로운 영향을 미칠 수 있다.
도시 및 산업용 폐수는 일반적으로 폐수 처리장에서 처리된다.오염된 지표면 유출의 완화는 다양한 예방 및 처리 기법을 통해 해결된다.(표면 유출 #감소 및 처리 참조).
산업용 응용 프로그램
많은 산업 공정은 물에 용해된 화학 물질을 사용한 반응, 물 슬러리에 고형물을 부유시키거나 물질을 용해 및 추출하기 위해 물을 사용한 반응 또는 제품 또는 공정 장비에 의존합니다.발전소의 광업, 화학 펄프, 펄프 표백, 제지, 섬유 생산, 염색, 인쇄, 냉각 등의 공정은 많은 양의 물을 사용하며 전용 수원을 필요로 하며 종종 심각한 수질 오염을 일으킨다.
물은 발전에 사용된다.수력전기는 수력발전에서 얻는 전기이다.수력발전은 발전기에 연결된 수력터빈을 구동하는 물로부터 나온다.수력전기는 저비용의 무공해 재생 에너지원입니다.그 에너지는 물의 움직임에 의해 공급된다.일반적으로 댐은 강 위에 건설되어 그 뒤에 인공 호수를 만든다.호수에서 흘러나오는 물은 발전기를 돌리는 터빈을 통해 강제된다.
가압수는 워터 블라스팅 및 워터 제트 커터에 사용됩니다.또한 정확한 절삭을 위해 고압 물총을 사용한다.그것은 매우 잘 작동하고, 비교적 안전하며, 환경에 해롭지 않습니다.또한 기계의 냉각에 사용되어 과열 방지 또는 톱날 과열을 방지합니다.
물은 화학 용매로 사용될 뿐만 아니라 증기 터빈과 열 교환기와 같은 많은 산업 공정과 기계에도 사용됩니다.산업용에서 처리되지 않은 물을 배출하는 것은 오염이다.오염에는 배출된 용질(화학 오염)과 배출된 냉각수(열 오염)가 포함됩니다.산업에서는 많은 용도로 순수한 물을 필요로 하며, 급수 및 배수 모두에서 다양한 정화 기술을 사용합니다.
식품 가공

끓이기, 찌기, 끓이기 등은 음식을 물에 담그거나 가스상태인 [120]증기를 필요로 하는 인기 있는 요리법이다.물은 설거지에도 사용된다.물은 또한 식품 과학 분야에서 많은 중요한 역할을 한다.
물에서 발견되는 소금과 설탕과 같은 용질은 물의 물리적 특성에 영향을 미친다.물의 끓는점과 어는점은 용질뿐만 아니라 기압에 의해 영향을 받는데, 기압은 차례로 고도에 의해 영향을 받습니다.물은 낮은 온도에서 높은 고도에서 발생하는 낮은 기압과 함께 끓는다.물 킬로그램당 수크로스(설탕) 1몰은 물의 끓는점을 0.51°C(0.918°F) 올리고, kg당 소금 1몰은 끓는점을 1.02°C(1.836°F) 올린다. 마찬가지로 용해된 입자의 수가 증가하면 물의 어는점이 [121]낮아진다.
물 속의 용질 또한 많은 화학 반응과 음식 [122]속의 미생물의 성장에 영향을 미치는 물의 활동에 영향을 미친다.물의 활동은 용액 중의 물의 증기압과 순수한 [121]물의 증기압의 비율로 설명할 수 있다.물 속의 용질은 물의 활동을 낮춘다. 대부분의 박테리아 성장은 낮은 수준의 물 [122]활동에서 멈추기 때문에 이 사실을 아는 것이 중요하다.미생물의 성장은 식품의 안전뿐만 아니라 식품의 보존과 유통기한에도 영향을 미칩니다.
물의 경도는 식품 가공에 있어서도 중요한 요소이며 화학 이온 교환 시스템을 사용하여 변경 또는 처리할 수 있다.제품의 품질에 큰 영향을 줄 뿐만 아니라 위생에도 큰 영향을 미칠 수 있습니다.물의 경도는 물의 탄산칼슘 농도에 따라 분류된다.물은 100mg/l(영국)[123] 미만이거나 60mg/l(미국)[124] 미만이면 연성으로 분류된다.
2010년 Water Footprint 기구가 발간한 보고서에 따르면 쇠고기 1kg에 1만5000L(3.3310^imp gal; 미국 4.0310^gal)의 물이 필요하지만, 저자들은 또한 이것이 쇠고기 [125]생산에 사용되는 물의 양을 결정하는 전 세계 평균과 상황적 요인임을 분명히 하고 있다.
의료용
주사를 위한 물은 세계보건기구의 필수 [126]의약품 목록에 있다.
자연에서의 분포
우주에서
우주의 물의 대부분은 별 형성의 부산물로 생산된다.별의 형성은 가스와 먼지의 강한 바깥바람을 동반한다.이 물질의 유출이 결국 주변 기체에 영향을 미칠 때, 생성된 충격파가 가스를 압축하고 가열합니다.관찰된 물은 이 따뜻하고 밀도가 높은 [128]기체로 빠르게 생성된다.
2011년 7월 22일, 보고서는 지구로부터 120억 광년 떨어진 퀘이사 주변에서 "지구 모든 해양을 합친 것보다 140조 배 많은" 물을 포함한 거대한 수증기 구름의 발견을 묘사했다.연구원들에 따르면, "이 발견은 물이 거의 모든 존재 동안 우주에 널리 퍼져 있었다는 것을 보여준다"[129][130]고 한다.
은하수 [131]내의 성간 구름에서 물이 검출되었다.물은 아마도 다른 은하에도 풍부하게 존재할 것이다. 왜냐하면 물의 성분인 수소와 산소는 우주에서 가장 풍부한 원소들 중 하나이기 때문이다.태양계와 다른 항성계의 형성 및 진화 모델에 따르면, 대부분의 다른 행성계는 비슷한 성분을 가지고 있을 가능성이 높다.
수증기
물은 다음 위치에서 증기로 존재합니다.
- 태양의 대기: 검출 가능한 미량[132]
- 수성 대기: 3.4%, 수성 외기권[133] 내 다량의 물
- 금성의 대기: 0.002%[134]
- 지구 대기: 전체 대기 중 0.40% 이하, 일반적으로 표면에서 1~4% 이하, 미량 달의[135] 대기 중
- 화성 대기: 0.03%[136]
- 케레스의 분위기[137]
- 목성의 대기: 0.0004 [138]% – 얼음으로만 표시; 그리고 목성의 위성[139] 유로파의 대기
- 토성의 대기 – 얼음만; 엔셀라두스: 91%[140] 및 디오네(외기)[citation needed]
- 천왕성의 대기 – 미량 50bar 미만
- 해왕성의 대기 – 깊은[141] 층에서 발견됨
- 외계 행성 대기: HD 189733[142] b와 HD 209458 [143]b, 타우 부티스 [144]b, HAT-P-11b,[145][146] XO-1b, WASP-12b, WASP-17b, WASP-19b [147]등.
- 별의 대기: 차가운 별에만 국한되지 않고 베텔게우스, 세페이 뮤, 안타레스, 아크투루스 [146][148]같은 거대한 뜨거운 별에서도 감지됩니다.
- 별 주위 원반: AA 황소자리[146] TW, 히드라자리 [149][150]TW, IRC +10216[151], APM 08279+5255,[129][130] 큰개자리 VY 및 페르세이와 [148]같은 T 황소자리 별들의 절반 이상이 포함되어 있습니다.
액체 물
액체 상태의 물은 지구 [3]표면의 71%를 덮고 있다.화성에 [152]액체 상태의 물이 가끔 존재한다.과학자들은 토성 위성인 엔셀라두스의 남극 [153][154]표면에서 약 30-40킬로미터 아래에 있는 10킬로미터 두께의 바다로서 액체 상태의 물이 존재하며,[155] 타이탄은 암모니아와 섞였을 가능성이 있는 지표면 아래 층으로서 존재한다고 믿고 있다.목성의 위성 유로파는 지표면 아래 액체 상태의 [156]물바다를 암시하는 표면 특성을 가지고 있다.액체 상태의 물은 목성의 달 가니메데에도 고압 얼음과 [157]바위 사이에 낀 층으로 존재할 수 있다.
물얼음
물은 얼음으로 표시됩니다.
- 화성: 레골리스 밑과 [158][159]극지방.
- 지구-달 시스템: 주로 지구와 달의 분화구 및 화산암에서[160] 얼음으로 나사는 2009년 [161]9월 인도우주연구기구의 찬드라얀 1호 우주선에 탑승한 나사의 달 광물학 매퍼에 의해 물 분자가 검출되었다고 보고했다.
- 케레스[162][163][164]
- 목성의 위성:유로파 표면과 가니메데와[165] 칼리스토[166][167] 표면
- 토성: 행성의 고리계[168], 타이탄과[170] 엔셀라두스의 표면과[169] 맨틀에 있다.
- 명왕성-카론계[168]
- 혜성[171][172] 및 기타 카이퍼 벨트와 오르트 구름 천체[173]
또한 다음 항목에도 존재할 수 있습니다.
이국적인 형태
물과 다른 휘발성들은 아마도 천왕성과 해왕성의 내부 구조의 대부분을 구성하며, 깊은 층에 있는 물은 분자들이 수소와 산소 이온의 수프로 분해되는 이온 물의 형태일 수 있고, 산소가 결정되는 초이온수로서 더 깊을 수 있지만, 수소 이온은 프리 주위를 떠다닌다.산소 [176]격자 안쪽에 있는 ely.
물과 행성의 거주 가능성
우리가 알고 있는 지구상의 생명체의 존재는 액체 상태의 물과 그 가스와 고체 형태의 어느 정도도 필수적이다.지구는 태양계의 거주 가능 지역에 위치해 있다; 만약 지구가 태양에 조금 더 가깝거나 더 멀리 있다면, 세 가지 형태가 동시에 존재할 수 있는 조건은 훨씬 [177][178]덜 존재할 것이다.
지구의 중력은 대기를 유지할 수 있게 해준다.대기 중의 수증기와 이산화탄소는 온도 완충제(온실 효과)를 제공하여 표면 온도를 비교적 일정하게 유지합니다.만약 지구가 더 작다면, 더 얇은 대기는 극지방의 만년설을 제외하고 물의 축적을 막을 수 있을 것이다.[citation needed]
지구 표면 온도는 들어오는 태양 복사(절연)의 다양한 수준에도 불구하고 지질학적 시간 동안 비교적 일정하게 유지되어 왔으며, 이는 동적 과정이 온실 가스와 표면 또는 대기 알베도의 조합을 통해 지구의 온도를 좌우한다는 것을 보여준다.이 제안은 가이아 [citation needed]가설로 알려져 있다.
행성의 물의 상태는 행성의 중력에 의해 결정되는 주변 압력에 의해 결정됩니다.만약 행성이 충분히 질량이 크다면, 글리제[179] 436 b와 GJ 1214 [180]b에서 관측된 것처럼 중력에 의한 높은 압력 때문에 높은 온도에서도 행성 위의 물은 고체일 수 있다.
법률, 정치, 위기
이 섹션은 업데이트해야 합니다.(2020년 6월) |

물 정치는 물과 수자원의 영향을 받는 정치이다.이런 이유로 세계에, 물은 전략적 자원과 많은 정치적 갈등에서 중요한 요소이다.건강 미치는 영향이나 생물 다양성에 손상을 유발한다.
지난 수십 년 동안 세계 거의 모든 지역에서 안전한 식수에 대한 접근이 개선되었지만, 약 10억 명의 사람들이 여전히 안전한 물에 대한 접근이 부족하고 25억 명 이상이 적절한 [181]위생 시설에 대한 접근이 부족하다.그러나 일부 관측통들은 2025년까지 세계 인구의 절반 이상이 수성에 기반한 [182]취약성에 직면할 것으로 추정했다.2009년 11월에 발표된 보고서에 따르면 2030년까지 세계의 일부 개발도상국에서는 물 수요가 [183]공급을 50% 초과할 것이라고 한다.
16억 명의 사람들이 1990년 [184]이후 안전한 수원에 접근했다.개도국에서는 안전한 물을 이용할 수 있는 비율이 1970년[185] 30%에서 1990년 71%, 2000년 79%,[181] 2004년 84%로 개선되고 있는 것으로 계산되고 있다.
2006년 유엔 보고서는 "모든 사람에게 충분한 물이 있다"고 밝혔지만, 잘못된 관리와 [186]부패로 인해 접근이 방해받고 있다.교육과 건강만큼 그들이 가진 게다가, 파리 선언 원조 총회에 같은 글로벌 이니셔티브를 지원 배달의 효율성 제고를 위해, 물 부문 원조자가 효과적으로, 잠재적으로 여러 기증자 중복 사업과 받는 사람 정부에 권력 부여하지 않고 행동하는 일하고 떠나고 시작되지 않았다.[187]
2007년 농업 물 관리의 포괄적 평가의 저자들은 물 부족의 한 가지 이유로 부실한 통치를 꼽았다.물 거버넌스는 물 관리와 관련된 의사결정이 이루어지는 공식 및 비공식 프로세스의 집합이다.좋은 물 관리는 주로 어떤 프로세스가 특정 물리적 및 사회 경제적 맥락에서 가장 잘 작동하는지를 아는 것입니다.선진국에서 작동하는 '청사진'을 개발 도상국의 위치와 상황에 적용하려다 실수를 하기도 한다.메콩강이 한 예다.국제물관리연구소가 메콩강에 물을 의존하고 있는 6개국의 정책을 검토한 결과, 철저하고 투명한 비용 편익 분석과 환경 영향 평가가 거의 이루어지지 않았다.그들은 또한 캄보디아의 물법 초안이 [188]필요 이상으로 복잡하다는 것을 발견했다.
세계 물 평가 프로그램의 UN 세계 물 개발 보고서(WWDR, 2003)는 향후 20년 이내에 모든 사람이 이용할 수 있는 물의 양이 30% 감소할 것으로 예측된다.현재 세계 인구의 40%가 최소한의 위생 상태를 유지하기에 충분한 담수를 보유하고 있지 않습니다.2000년에 220만 명 이상이 수인성 질병(오염수 소비와 관련된) 또는 가뭄으로 사망했다.2004년, 영국의 자선단체인 WaterAid는 쉽게 예방할 수 있는 물과 관련된 질병으로 인해 15초마다 한 명의 어린이가 사망한다고 보고했다; 이것은 종종 하수 [citation needed]처리의 부족을 의미한다.
물 보호에 관심이 있는 단체로는 국제수자원협회(IWA), 수자원협회(WaterAid), 수자원협회(Water First), 미국수자원협회(American Water Resources Association) 등이 있습니다.국제물관리연구소는 빈곤을 줄이기 위해 효과적인 물 관리를 목적으로 프로젝트를 수행하고 있다.물과 관련된 협약은 유엔사막화방지협약(UNCCD), 국제선박오염방지협약, 유엔해양법협약, 람사르협약이다.세계 물의 날은 3월 22일이고[189] 세계 해양의 날은 6월 [190]8일이다.
인컬쳐
종교
물은 대부분의 종교에서 정화제로 여겨진다.의식적인 씻기를 포함하는 믿음은 기독교,[191] 힌두교, 이슬람, 유대교, 라스타파리 운동, 신도, 도교, 위카 등을 포함한다.물에 사람을 담그는 것은 기독교의 중심 성찬식이다; 그것은 또한 이슬람, 유대교, 시크교를 포함한 다른 종교의 관습의 일부이다.게다가, 이슬람과 유대교를 포함한 많은 종교에서 죽은 사람들을 위해 순수한 물에서 의식적인 목욕이 행해진다.이슬람에서는 물을 사용할 수 없는 경우가 아니라면 대부분의 경우 깨끗한 물로 몸의 특정 부분을 씻은 후 매일 다섯 번의 기도를 할 수 있다.신도는 거의 모든 의식에서 사람이나 지역을 깨끗하게 하기 위해 물을 사용한다(예를 들어, 미기의 의식에서).
기독교에서 성수는 세례, 사람, 장소, 물건의 축복 또는 악을 물리치기 [192][193]위한 목적으로 성직자에 의해 신성화된 물이다.
조로아스터교에서는 물이 생명의 [194]근원으로 존중된다.
철학
고대 그리스 철학자 엠페도클레스는 물을 4대 고전적 요소 중 하나로 보고 물을 우주의 기본 물질, 즉 ylem으로 여겼다.아리스토텔레스가 천문학자이자 엔지니어로 묘사한 탈레스는 물보다 밀도가 높은 지구가 물 속에서 나타났다는 이론을 세웠다.모니스트인 탈레스는 모든 것이 물로 만들어진다고 더욱 믿었다.플라톤은 물의 모양이 입방체 모양의 지구에 [195]비해 쉽게 흐르는 20면체라고 믿었다.
사체유머의 이론은 물을 가래와 연관지어 차갑고 촉촉한 것으로 보았다.물의 고전적인 요소는 또한 중국 전통 철학의 다섯 가지 요소 중 하나였다.
일부 전통적이고 인기 있는 아시아 철학 체계들은 물을 역할 모델로 삼는다.제임스 레지가 1891년에 번역한 도 드 징은 "가장 뛰어난 것은 물과 같다.물의 우수성은 만물을 이롭게 하고, 모든 사람이 싫어하는 낮은 곳을 차지하는데서 나타난다.그래서 도에 가깝다" "세상에 물보다 부드럽고 약한 것은 없다" "그러나 강하고 강한 것을 공격하는 데는 이보다 우선할 수 있는 것이 없다" "왜냐하면 바꿀 [196]수 있는 것이 없기 때문이다""수이디"의 장에서 관자는 물의 상징성에 대해 더 자세히 설명하고 "사람은 물이다"라고 선언하며 중국 각 지역 사람들의 자연적 특성을 지역 [197]수자원의 특성으로 돌린다.
민속학
"살아 있는 물"은 게르만과 슬라브 민화에 죽은 사람들을 되살리는 수단으로 특징지어진다.그림 동화("생명의 물")와 살아있는과 죽은 물의두 가지로 되는 러시아의 이야기를 주목하십시오.젊음의 샘은 노화를 막는 마법의 물의 개념과 관련이 있다.
예술과 행동주의
화가이자 활동가인 프레데리카 포스터는 세인트루이스 대성당에서 물의 가치를 관장했다. 뉴욕시의 [198]요한 더 디바인(John the Divine)은 우리가 [199][200]물에 의존하는 것에 의존해 성당에 의해 1년 동안 계획을 정했습니다.대성당에서 [201]열린 가장 큰 전시회인 이 전시회에는 제니 홀저, 로버트 롱고, 마크 로스코, 윌리엄 켄트리지, 에이프릴 고닉, 키키 스미스, 팻 스타이어, 윌리엄 켄트리지, 앨리스 달튼 브라운, 테레시타 페르난데스,[202][203] 빌 비올라 등 40여 명의 예술가들이 참여했다.Foster는 물을 주제나 매개체로 사용하는 예술가들의 생태학적 집합체인 Think About Water를 만들었다.멤버는 Basia Irland, Aviva Rahmani, Betsy Damon, Diane Burko, Leila Daw, Stacy Levy, Charlotte Coté,[204] Meridel Rubenste, Stacy Levy, Anna Macleod, Aviva Rahmani입니다.
유엔에 의해 인간의 권리로 선언된 물과 위생에 대한 접근 10주년을 기념하기 위해, 자선단체인 WaterAid는 깨끗한 물이 사람들의 [205][206]삶에 미치는 영향을 보여주기 위해 10명의 시각 예술가들에게 의뢰했다.
일산화이수소 패러디
물은 기술적으로 정확하지만 거의 사용되지 않는 일산화수소라는 화학명이 과학 문맹을 조롱하는 일련의 장난과 장난에 사용되어 왔다.이것은 1983년 미시간 주 듀랜드에 있는 신문에 만우절 기사가 났을 때 시작되었다.그 거짓 이야기는 그 [207]물질에 대한 안전상의 우려로 구성되었다.
「 」를 참조해 주세요.
- 물의 개요 – 물의 개요 및 주제 안내
- 물(데이터 페이지)은 물의 화학적 및 물리적 특성을 모은 것입니다.
- 물 공포증 – 지속적이고 비정상적인 물 공포증(물 공포증)
- 물과 위생 시설이 인권 – 인권 유엔 총회의 2010년을 인정했었죠.
- 음펨바 효과 자연 현상이 뜨거운 물이 얼때 더 빨리 감기보다 –.
- 구강 수분 보충 요법 유체 교체하며 탈수 현상을 막는 데 사용되는 – 입력한다.
- 박쥐 – Craving에 알맞은 액 동물들에 의해 겪은.
- 물 압박 분석
레퍼런스
- ^ "Water Q&A: Why is water the "universal solvent"?". Water Science School. United States Geological Survey, U.S. Department of the Interior. 20 June 2019. Archived from the original on 6 February 2021. Retrieved 15 January 2021.
- ^ "10.2: Hybrid Orbitals in Water". Chemistry LibreTexts. 18 March 2020. Archived from the original on 30 July 2022. Retrieved 11 April 2021.
- ^ a b "How Much Water is There on Earth?". Water Science School. United States Geological Survey, U.S. Department of the Interior. 13 November 2019. Archived from the original on 9 June 2022. Retrieved 8 June 2022.
- ^ a b Gleick, P.H., ed. (1993). Water in Crisis: A Guide to the World's Freshwater Resources. Oxford University Press. p. 13, Table 2.1 "Water reserves on the earth". Archived from the original on 8 April 2013.
- ^ 기후 시스템의 수증기 2007년 3월 20일 Wayback Machine, Special Report, [AGU], 1995년 12월 (링크 4/2007)에 보관.2008년 2월 20일 Wayback Machine UNEP에서 Vital Water 아카이브 완료.
- ^ Baroni, L.; Cenci, L.; Tettamanti, M.; Berati, M. (2007). "Evaluating the environmental impact of various dietary patterns combined with different food production systems". European Journal of Clinical Nutrition. 61 (2): 279–286. doi:10.1038/sj.ejcn.1602522. PMID 17035955.
- ^ Troell, Max; Naylor, Rosamond L.; Metian, Marc; Beveridge, Malcolm; Tyedmers, Peter H.; Folke, Carl; Arrow, Kenneth J.; Barrett, Scott; Crépin, Anne-Sophie; Ehrlich, Paul R.; Gren, Åsa (16 September 2014). "Does aquaculture add resilience to the global food system?". Proceedings of the National Academy of Sciences. 111 (37): 13257–13263. Bibcode:2014PNAS..11113257T. doi:10.1073/pnas.1404067111. ISSN 0027-8424. PMC 4169979. PMID 25136111.
- ^ "Water (v.)". www.etymonline.com. Online Etymology Dictionary. Archived from the original on 2 August 2017. Retrieved 20 May 2017.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 620. ISBN 978-0-08-037941-8.
- ^ "Water, the Universal Solvent". USGS. Archived from the original on 9 July 2017. Retrieved 27 June 2017.
- ^ Reece, Jane B. (31 October 2013). Campbell Biology (10 ed.). Pearson. p. 48. ISBN 9780321775658.
- ^ Reece, Jane B. (31 October 2013). Campbell Biology (10 ed.). Pearson. p. 44. ISBN 9780321775658.
- ^ Leigh, G. J.; Favre, H. A; Metanomski, W. V. (1998). Principles of chemical nomenclature: a guide to IUPAC recommendations (PDF). Oxford: Blackwell Science. ISBN 978-0-86542-685-6. OCLC 37341352. Archived from the original (PDF) on 26 July 2011.
- ^ PubChem. "Water". National Center for Biotechnology Information. Archived from the original on 3 August 2018. Retrieved 25 March 2020.
- ^ a b Belnay, Louise. "The water cycle" (PDF). Critical thinking activities. Earth System Research Laboratory. Archived (PDF) from the original on 20 September 2020. Retrieved 25 March 2020.
- ^ a b Oliveira, Mário J. de (2017). Equilibrium Thermodynamics. Springer. pp. 120–124. ISBN 978-3-662-53207-2. Archived from the original on 8 March 2021. Retrieved 26 March 2020.
- ^ 이 성질을 가진 다른 물질로는 비스무트, 실리콘, 게르마늄 및 [16]갈륨이 있다.
- ^ a b Ball, Philip (2008). "Water: Water—an enduring mystery". Nature. 452 (7185): 291–2. Bibcode:2008Natur.452..291B. doi:10.1038/452291a. PMID 18354466. S2CID 4365814. Archived from the original on 17 November 2016. Retrieved 15 November 2016.
- ^ Kotz, J.C., Treichel, P., & Weaver, G.C. (2005). Chemistry & Chemical Reactivity. Thomson Brooks/Cole. ISBN 978-0-534-39597-1.
{{cite book}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Ben-Naim, Ariel; Ben-Naim, Roberta; et al. (2011). Alice's Adventures in Water-land. Singapore. doi:10.1142/8068. ISBN 978-981-4338-96-7.
- ^ Matsuoka, N.; Murton, J. (2008). "Frost weathering: recent advances and future directions". Permafrost Periglac. Process. 19 (2): 195–210. doi:10.1002/ppp.620. S2CID 131395533.
- ^ Wiltse, Brendan. "A Look Under The Ice: Winter Lake Ecology". Ausable River Association. Archived from the original on 19 June 2020. Retrieved 23 April 2020.
- ^ a b Chen, Zijun (21 April 2010). "Measurement of Diamagnetism in Water". Archived from the original on 8 January 2022. Retrieved 8 January 2022.
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ Wells, Sarah (21 January 2017). "The Beauty and Science of Snowflakes". Smithsonian Science Education Center. Archived from the original on 25 March 2020. Retrieved 25 March 2020.
- ^ Fellows, P. (Peter) (2017). "Freeze drying and freeze concentration". Food processing technology : principles and practice (4th ed.). Kent: Woodhead Publishing/Elsevier Science. pp. 929–940. ISBN 978-0081005231. OCLC 960758611.
- ^ Siegert, Martin J.; Ellis-Evans, J. Cynan; Tranter, Martyn; Mayer, Christoph; Petit, Jean-Robert; Salamatin, Andrey; Priscu, John C. (December 2001). "Physical, chemical and biological processes in Lake Vostok and other Antarctic subglacial lakes". Nature. 414 (6864): 603–609. Bibcode:2001Natur.414..603S. doi:10.1038/414603a. PMID 11740551. S2CID 4423510.
- ^ Davies, Bethan. "Antarctic subglacial lakes". AntarcticGlaciers. Archived from the original on 3 October 2020. Retrieved 25 March 2020.
- ^ Masterton, William L.; Hurley, Cecile N. (2008). Chemistry : principles and reactions (6th ed.). Cengage Learning. p. 230. ISBN 9780495126713. Archived from the original on 8 March 2021. Retrieved 3 April 2020.
- ^ Peaco, Jim. "Yellowstone Lesson Plan: How Yellowstone Geysers Erupt - Yellowstone National Park (U.S. National Park Service)". National Park Service. Archived from the original on 2 March 2020. Retrieved 5 April 2020.
- ^ Brahic, Catherine. "Found: The hottest water on Earth". New Scientist. Archived from the original on 9 May 2020. Retrieved 5 April 2020.
- ^ USDA Food Safety and Inspection Service. "High Altitude Cooking and Food Safety" (PDF). Archived from the original (PDF) on 20 January 2021. Retrieved 5 April 2020.
- ^ "Pressure Cooking - Food Science". Exploratorium. 26 September 2019. Archived from the original on 19 June 2020. Retrieved 21 April 2020.
- ^ Allain, Rhett (12 September 2018). "Yes, You Can Boil Water at Room Temperature. Here's How". Wired. Archived from the original on 28 September 2020. Retrieved 5 April 2020.
- ^ Murphy, D. M.; Koop, T. (1 April 2005). "Review of the vapour pressures of ice and supercooled water for atmospheric applications". Quarterly Journal of the Royal Meteorological Society. 131 (608): 1540. Bibcode:2005QJRMS.131.1539M. doi:10.1256/qj.04.94. S2CID 122365938. Archived from the original on 18 August 2020. Retrieved 31 August 2020.
- ^ International Bureau of Weights and Measures (2006), The International System of Units (SI) (PDF) (8th ed.), p. 114, ISBN 92-822-2213-6, archived (PDF) from the original on 14 August 2017
- ^ "9th edition of the SI Brochure". BIPM. 2019. Archived from the original on 19 April 2021. Retrieved 20 May 2019.
- ^ Wagner, W.; Pruß, A. (June 2002). "The IAPWS Formulation 1995 for the Thermodynamic Properties of Ordinary Water Substance for General and Scientific Use". Journal of Physical and Chemical Reference Data. 31 (2): 398. doi:10.1063/1.1461829.
- ^ Weingärtner, Hermann; Franck, Ernst Ulrich (29 April 2005). "Supercritical Water as a Solvent". Angewandte Chemie International Edition. 44 (18): 2672–2692. doi:10.1002/anie.200462468. PMID 15827975.
- ^ Adschiri, Tadafumi; Lee, Youn-Woo; Goto, Motonobu; Takami, Seiichi (2011). "Green materials synthesis with supercritical water". Green Chemistry. 13 (6): 1380. doi:10.1039/c1gc15158d.
- ^ Murray, Benjamin J.; Knopf, Daniel A.; Bertram, Allan K. (2005). "The formation of cubic ice under conditions relevant to Earth's atmosphere". Nature. 434 (7030): 202–205. Bibcode:2005Natur.434..202M. doi:10.1038/nature03403. PMID 15758996. S2CID 4427815.
- ^ Salzmann, Christoph G. (14 February 2019). "Advances in the experimental exploration of water's phase diagram". The Journal of Chemical Physics. 150 (6): 060901. arXiv:1812.04333. Bibcode:2019JChPh.150f0901S. doi:10.1063/1.5085163. PMID 30770019.
- ^ Sokol, Joshua (12 May 2019). "A Bizarre Form of Water May Exist All Over the Universe". Wired. Wired.com. Archived from the original on 12 May 2019. Retrieved 1 September 2021.
- ^ Millot, M.; Coppari, F.; Rygg, J.R.; Barrios, Antonio Correa; Hamel, Sebastien; Swift, Damian C.; Eggert, Jon H. (2019). "Nanosecond X-ray diffraction of shock-compressed superionic water ice". Nature. Springer. 569 (7755): 251–255. Bibcode:2019Natur.569..251M. doi:10.1038/s41586-019-1114-6. OSTI 1568026. PMID 31068720. S2CID 148571419.
- ^ Peplow, Mark (25 March 2015). "Graphene sandwich makes new form of ice". Nature. doi:10.1038/nature.2015.17175. S2CID 138877465.
- ^ Maestro, L.M.; Marqués, M.I.; Camarillo, E.; Jaque, D.; Solé, J. García; Gonzalo, J.A.; Jaque, F.; Valle, Juan C. Del; Mallamace, F. (1 January 2016). "On the existence of two states in liquid water: impact on biological and nanoscopic systems". International Journal of Nanotechnology. 13 (8–9): 667–677. Bibcode:2016IJNT...13..667M. doi:10.1504/IJNT.2016.079670. Archived from the original on 23 September 2017.
- ^ Mallamace, Francesco; Corsaro, Carmelo; Stanley, H. Eugene (18 December 2012). "A singular thermodynamically consistent temperature at the origin of the anomalous behavior of liquid water". Scientific Reports. 2 (1): 993. Bibcode:2012NatSR...2E.993M. doi:10.1038/srep00993. PMC 3524791. PMID 23251779.
- ^ Perakis, Fivos; Amann-Winkel, Katrin; Lehmkühler, Felix; Sprung, Michael; Mariedahl, Daniel; Sellberg, Jonas A.; Pathak, Harshad; Späh, Alexander; Cavalca, Filippo; Ricci, Alessandro; Jain, Avni; Massani, Bernhard; Aubree, Flora; Benmore, Chris J.; Loerting, Thomas; Grübel, Gerhard; Pettersson, Lars G.M.; Nilsson, Anders (26 June 2017). "Diffusive dynamics during the high-to-low density transition in amorphous ice". Proceedings of the National Academy of Sciences of the United States of America. 13 (8–9): 667–677. Bibcode:2017PNAS..114.8193P. doi:10.1073/pnas.1705303114. PMC 5547632. PMID 28652327.
- ^ Zocchi D, Wennemuth G, Oka Y (July 2017). "The cellular mechanism for water detection in the mammalian taste system". Nature Neuroscience. 20 (7): 927–933. doi:10.1038/nn.4575. PMID 28553944.
- ^ 에드먼드 T.롤스(2005), "감정 설명"옥스퍼드 대학 출판부, 의학부.ISBN 0198570031, 9780198570035.
- ^ R. Llinas, W. Precht (2012), "개구리 신경생물학: 핸드북"Springer Science & Business 미디어.ISBN 3642663168, 9783642663161
- ^ Candau, Joël (2004). "The Olfactory Experience: constants and cultural variables". Water Science and Technology. 49 (9): 11–17. doi:10.2166/wst.2004.0522. PMID 15237601. Archived from the original on 2 October 2016. Retrieved 28 September 2016.
- ^ Braun, Charles L.; Sergei N. Smirnov (1993). "Why is water blue?". J. Chem. Educ. 70 (8): 612. Bibcode:1993JChEd..70..612B. doi:10.1021/ed070p612. Archived from the original on 20 March 2012. Retrieved 21 April 2007.
- ^ Nakamoto, Kazuo (1997). Infrared and Raman Spectra of Inorganic and Coordination Compounds, Part A: Theory and Applications in Inorganic Chemistry (5th ed.). New York: Wiley. p. 170. ISBN 0-471-16394-5.
- ^ 볼 2001, 페이지 168
- ^ Franks 2007, 10페이지
- ^ "Physical Chemistry of Water". Michigan State University. Archived from the original on 20 October 2020. Retrieved 11 September 2020.
- ^ 볼 2001, 페이지 169
- ^ Isaacs, E.D; Shukla, A; Platzman, P.M; Hamann, D.R; Barbiellini, B; Tulk, C.A (1 March 2000). "Compton scattering evidence for covalency of the hydrogen bond in ice". Journal of Physics and Chemistry of Solids. 61 (3): 403–406. Bibcode:2000JPCS...61..403I. doi:10.1016/S0022-3697(99)00325-X.
- ^ Campbell, Neil A.; Brad Williamson; Robin J. Heyden (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. ISBN 978-0-13-250882-7. Archived from the original on 2 November 2014. Retrieved 11 November 2008.
- ^ 모세관 작용 – 액체, 물, 힘, 표면 – 2013년 5월 27일 웨이백 머신에 보관된 JRank 문서.Science.jrank.org 를 참조해 주세요.2015년 9월 28일 취득.
- ^ "Heat capacity water online". Desmos (in Russian). Archived from the original on 6 June 2022. Retrieved 3 June 2022.
- ^ Ball, Philip (14 September 2007). "Burning water and other myths". News@nature. doi:10.1038/news070910-13. S2CID 129704116. Archived from the original on 28 February 2009. Retrieved 14 September 2007.
- ^ Fine, R.A. & Millero, F.J. (1973). "Compressibility of water as a function of temperature and pressure". Journal of Chemical Physics. 59 (10): 5529. Bibcode:1973JChPh..59.5529F. doi:10.1063/1.1679903.
- ^ 영국 국립물리연구소, 해수 내 흡음 계산 2016년 10월 3일 웨이백 머신에 보관.온라인 사이트, 2016년 9월 28일 최종 접속.
- ^ Gleick, P.H., ed. (1993). Water in Crisis: A Guide to the World's Freshwater Resources. Oxford University Press. p. 15, Table 2.3. Archived from the original on 8 April 2013.
- ^ Ben-Naim, A. & Ben-Naim, R., P.H. (2011). Alice's Adventures in Water-land. World Scientific Publishing. p. 31. doi:10.1142/8068. ISBN 978-981-4338-96-7.
{{cite book}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Gleick, Peter H. (1993). Water in Crisis (1 ed.). New York: Oxford University Press. p. 13. ISBN 019507627-3.
- ^ Wada, Yoshihide; Van Beek, L.P.H.; Bierkens, Marc FP (2012). "Nonsustainable groundwater sustaining irrigation: A global assessment". Water Resources Research. 48 (6): W00L06. Bibcode:2012WRR....48.0L06W. doi:10.1029/2011WR010562.
- ^ "Catalyst helps split water : Plants". AskNature. Archived from the original on 28 October 2020. Retrieved 10 September 2020.
- ^ "On Water". European Investment Bank. Archived from the original on 14 October 2020. Retrieved 13 October 2020.
- ^ "2.4 billion Without Adequate Sanitation. 600 million Without Safe Water. Can We Fix it by 2030?". ieg.worldbankgroup.org. Archived from the original on 14 October 2020. Retrieved 13 October 2020.
- ^ "World Health Organization. Safe Water and Global Health". Who.int. 25 June 2008. Archived from the original on 24 December 2010. Retrieved 25 July 2010.
- ^ UNEP International Environment (2002). Environmentally Sound Technology for Wastewater and Stormwater Management: An International Source Book. IWA Publishing. ISBN 978-1-84339-008-4. OCLC 49204666.
- ^ Ravindranath, Nijavalli H.; Jayant A. Sathaye (2002). Climate Change and Developing Countries. Springer. ISBN 978-1-4020-0104-8. OCLC 231965991.
- ^ "Water withdrawals per capita". Our World in Data. Archived from the original on 12 March 2020. Retrieved 6 March 2020.
- ^ "WBCSD Water Facts & Trends". Archived from the original on 1 March 2012. Retrieved 25 July 2010.
- ^ Dieter, Cheryl A.; Maupin, Molly A.; Caldwell, Rodney R.; Harris, Melissa A.; Ivahnenko, Tamara I.; Lovelace, John K.; Barber, Nancy L.; Linsey, Kristin S. (2018). "Estimated use of water in the United States in 2015". Circular. U.S. Geological Survey. p. 76. doi:10.3133/cir1441. Archived from the original on 28 April 2019. Retrieved 21 May 2019.
- ^ Gleick, P.H.; Palaniappan, M. (2010). "Peak Water" (PDF). Proceedings of the National Academy of Sciences. 107 (125): 11155–11162. Bibcode:2010PNAS..10711155G. doi:10.1073/pnas.1004812107. PMC 2895062. PMID 20498082. Archived (PDF) from the original on 8 November 2011. Retrieved 11 October 2011.
- ^ 유엔 프레스 릴리즈 POP/952 (2007년 3월 13일).2050년까지 전 세계 인구가 25억 명 증가 2014년 7월 27일 Wayback Machine에서 보관
- ^ , Molden, D. (Ed.)식수, 생활수: 농업용수 관리의 종합적인 평가.Earthscan/IWMI, 2007.
- ^ 샤르트르, C. 및 바르마, S. (2010) 물 밖으로. 풍부함에서 희소성, 그리고 세계의 물 문제를 해결하는 방법.FT 프레스(US)
- ^ Chapagain, A.K.; Hoekstra, A.Y.; Savenije, H.H.G.; Guatam, R. (September 2005). "The Water Footprint of Cotton Consumption" (PDF). IHE Delft Institute for Water Education. Archived (PDF) from the original on 26 March 2019. Retrieved 24 October 2019.
- ^ Decret relativeif aux poids et aux mesure. 18 germinal an 3 (1795년 4월 7일) 2013년 2월 25일 웨이백 머신에 보관.도량형 및 치수에 관한 법령(프랑스어).quartier-rural.org
- ^ 2013년 7월 25일 웨이백 머신에 보관된 L'Histoire Du Métre, La Détermination De L'Unité de Poids.histoire.du.metre.free.fr
- ^ 질문: 인간의 신체 중 몇 퍼센트가 물로 구성되어 있나요?2007년 11월 25일 MadSci Network, M.D. Wayback Machine Jeffrey Utz에서 아카이브 완료
- ^ "Healthy Water Living". BBC. Archived from the original on 1 January 2007. Retrieved 1 February 2007.
- ^ Rhoades RA, Tanner GA (2003). Medical Physiology (2nd ed.). Baltimore: Lippincott Williams & Wilkins. ISBN 978-0-7817-1936-0. OCLC 50554808.
- ^ Noakes TD; Goodwin N; Rayner BL; et al. (1985). "Water intoxication: a possible complication during endurance exercise". Med Sci Sports Exerc. 17 (3): 370–375. doi:10.1249/00005768-198506000-00012. PMID 4021781.
- ^ Noakes TD, Goodwin N, Rayner BL, Branken T, Taylor RK (2005). "Water intoxication: a possible complication during endurance exercise, 1985". Wilderness Environ Med. 16 (4): 221–227. doi:10.1580/1080-6032(2005)16[221:WIAPCD]2.0.CO;2. PMID 16366205.
- ^ Valtin, Heinz (2002). ""Drink at least eight glasses of water a day." Really? Is there scientific evidence for "8 × 8"?" (PDF). American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 283 (5): R993–R1004. doi:10.1152/ajpregu.00365.2002. PMID 12376390. S2CID 2256436. Archived from the original (PDF) on 22 February 2019.
- ^ Stookey JD, Constant F, Popkin BM, Gardner CD (November 2008). "Drinking water is associated with weight loss in overweight dieting women independent of diet and activity". Obesity. 16 (11): 2481–2488. doi:10.1038/oby.2008.409. PMID 18787524. S2CID 24899383.
- ^ "Drink water to curb weight gain? Clinical trial confirms effectiveness of simple appetite control method". www.sciencedaily.com. 23 August 2010. Archived from the original on 7 July 2017. Retrieved 14 May 2017.
- ^ Dubnov-Raz G, Constantini NW, Yariv H, Nice S, Shapira N (October 2011). "Influence of water drinking on resting energy expenditure in overweight children". International Journal of Obesity. 35 (10): 1295–1300. doi:10.1038/ijo.2011.130. PMID 21750519.
- ^ Dennis EA; Dengo AL; Comber DL; et al. (February 2010). "Water consumption increases weight loss during a hypocaloric diet intervention in middle-aged and older adults". Obesity. 18 (2): 300–307. doi:10.1038/oby.2009.235. PMC 2859815. PMID 19661958.
- ^ Vij VA, Joshi AS (September 2013). "Effect of 'water induced thermogenesis' on body weight, body mass index and body composition of overweight subjects". Journal of Clinical and Diagnostic Research. 7 (9): 1894–1896. doi:10.7860/JCDR/2013/5862.3344. PMC 3809630. PMID 24179891.
- ^ Muckelbauer R, Sarganas G, Grüneis A, Müller-Nordhorn J (August 2013). "Association between water consumption and body weight outcomes: a systematic review". The American Journal of Clinical Nutrition. 98 (2): 282–299. doi:10.3945/ajcn.112.055061. PMID 23803882. S2CID 12265434.
- ^ 2015년 3월 4일 Wayback Machine에 보관된 물, 변비, 탈수 및 기타 액체.Sciencedaily.com 를 참조해 주세요.2015년 9월 28일 취득.
- ^ Food and Nutrition Board, National Academy of Sciences. Recommended Dietary Allowances. National Research Council, Reprint and Circular Series, No. 122. 1945. pp. 3–18.
- ^ Medicine, Institute of; Board, Food Nutrition; Intakes, Standing Committee on the Scientific Evaluation of Dietary Reference; Water, Panel on Dietary Reference Intakes for Electrolytes and (2005). 4 Water Dietary Reference Intakes for Water, Potassium, Sodium, Chloride, and Sulfate The National Academies Press. doi:10.17226/10925. ISBN 978-0-309-09169-5. Archived from the original on 13 January 2017. Retrieved 11 January 2017.
- ^ "Water: How much should you drink every day?". Mayoclinic.com. Archived from the original on 4 December 2010. Retrieved 25 July 2010.
- ^ 화학 정복 제4판2008년 발행
- ^ Maton, Anthea; Jean Hopkins; Charles William McLaughlin; Susan Johnson; Maryanna Quon Warner; David LaHart; Jill D. Wright (1993). Human Biology and Health. Englewood Cliffs, New Jersey: Prentice Hall. ISBN 978-0-13-981176-0. OCLC 32308337.
- ^ Unesco (2006). Water: a shared responsibility. Berghahn Books. p. 125. ISBN 978-1-84545-177-6.
- ^ Shove, Elizabeth (2004). Comfort, Cleanliness and Convenience The Social Organization of Normality (New Technologies/New Cultures). New York: Berg. ISBN 978-1-85973-630-2.
- ^ "Eco-Friendly Cleaning Cloth and Toilet Papers". SimplyNatural. 18 June 2020. Retrieved 1 July 2020.
- ^ E. Clark, Mary (2006). Contemporary Biology: Concepts and Implications. University of Michigan Press. p. 613. ISBN 9780721625973.
Douching is commonly practiced in Catholic countries. The bidet ... is still commonly found in France and other Catholic countries.
- ^ CDC: 손을 씻는 이유
- ^ 깨끗한 손, 토마스 오스본, M.D.
- ^ HealthReach CHC
- ^ 2012년 10월 6일, 당신은 아마도 머리를 너무 많이 감았을 것이다.
- ^ 산부인과 감염: 교재와 아틀라스는 2012년 10월 6일, 에이코 페테르센 - 6-13페이지
- ^ Stopford, Martin (1 January 1997). Maritime Economics. Psychology Press. p. 10. ISBN 9780415153102.
- ^ Naumann d'Alnoncourt, Raoul; Csepei, Lénárd-István; Hävecker, Michael; Girgsdies, Frank; Schuster, Manfred E; Schlögl, Robert; Trunschke, Annette (2014). "The reaction network in propane oxidation over phase-pure MoVTeNb M1 oxide catalysts" (PDF). Journal of Catalysis. 311: 369–385. doi:10.1016/j.jcat.2013.12.008. hdl:11858/00-001M-0000-0014-F434-5. Archived from the original (PDF) on 15 February 2016. Retrieved 14 January 2018.
- ^ Hävecker, Michael; Wrabetz, Sabine; Kröhnert, Jutta; Csepei, Lenard-Istvan; Naumann d'Alnoncourt, Raoul; Kolen'Ko, Yury V; Girgsdies, Frank; Schlögl, Robert; Trunschke, Annette (2012). "Surface chemistry of phase-pure M1 MoVTeNb oxide during operation in selective oxidation of propane to acrylic acid" (PDF). Journal of Catalysis. 285: 48–60. doi:10.1016/j.jcat.2011.09.012. hdl:11858/00-001M-0000-0012-1BEB-F. Archived from the original (PDF) on 30 October 2016. Retrieved 14 January 2018.
- ^ Kinetic studies of propane oxidation on Mo and V based mixed oxide catalysts (PDF). 2011. Archived (PDF) from the original on 20 December 2016. Retrieved 14 January 2018.
- ^ Amakawa, Kazuhiko; Kolen'Ko, Yury V; Villa, Alberto; Schuster, Manfred E/; Csepei, Lénárd-István; Weinberg, Gisela; Wrabetz, Sabine; Naumann d'Alnoncourt, Raoul; Girgsdies, Frank; Prati, Laura; Schlögl, Robert; Trunschke, Annette (2013). "Multifunctionality of Crystalline MoV(TeNb) M1 Oxide Catalysts in Selective Oxidation of Propane and Benzyl Alcohol". ACS Catalysis. 3 (6): 1103–1113. doi:10.1021/cs400010q. Archived from the original on 22 October 2018. Retrieved 14 January 2018.
- ^ 미국의 물 사용, National Atlas.gov 2009년 8월 14일 웨이백 머신에 보관
- ^ "Material Safety Data Sheet: Quicklime" (PDF). Lhoist North America. 6 August 2012. Archived (PDF) from the original on 5 July 2016. Retrieved 24 October 2019.
- ^ Duff, Sister Loretto Basil (1916). A Course in Household Arts: Part I. Whitcomb & Barrows. Archived from the original on 14 April 2021. Retrieved 3 December 2017.
- ^ a b Vaclavik, Vickie A. & Christian, Elizabeth W (2007). Essentials of Food Science. Springer. ISBN 978-0-387-69939-4. Archived from the original on 14 April 2021. Retrieved 31 August 2020.
- ^ a b DeMan, John M (1999). Principles of Food Chemistry. Springer. ISBN 978-0-8342-1234-3. Archived from the original on 14 April 2021. Retrieved 31 August 2020.
- ^ "Map showing the rate of hardness in mg/l as Calcium carbonate in England and Wales" (PDF). DEFRA/ Drinking Water Inspectorate. 2009. Archived (PDF) from the original on 29 May 2015. Retrieved 18 May 2015.
- ^ "Water hardness". US Geological Service. 8 April 2014. Archived from the original on 18 May 2015. Retrieved 18 May 2015.
- ^ M.M. Mekonnen; A.Y. Hoekstra (December 2010). "The green, blue and grey water footprint of farm animals and animal products, Value of Water Research Report Series No. 48 – Volume 1: Main report" (PDF). UNESCO – IHE Institute for Water Education. Archived (PDF) from the original on 27 May 2014. Retrieved 30 January 2014.
- ^ "WHO Model List of EssentialMedicines" (PDF). World Health Organization. October 2013. Archived (PDF) from the original on 23 April 2014. Retrieved 22 April 2014.
- ^ "ALMA Greatly Improves Capacity to Search for Water in Universe". Archived from the original on 23 July 2015. Retrieved 20 July 2015.
- ^ Melnick에 의해 게리, 하바드-스미스 소니언 천체 물리학 센터와 Neufeld, 데이빗, 존스 홉킨스 대학교"수증기 근처에 오리온 성운의 법칙을 발견 태양계(공격하다에서 가능성 기원 준비된 물의 있음을 암시하는)":에서 인용.하버드 대학 Gazette.231998년 4월.162000년 1월에 원래에서 Archived."공간 클라우드 지구의 넘쳐나는 백만 타임즈 채우기 충분한 물 보유합니다".헤드 라인 @홉킨스, JHU.4월 9일 1998년.911월 2007년에 원래에서 Archived.4월 21일 2007년 Retrieved."물, 물 일종:라디오 망원경 물 우주의 일반적인 것을 알게 되면".하버드 대학 Gazette.1999년 2월 25일.192011년 5월에 원래에서 Archived.192010년 9월.(아카이브 링크)Retrieved.
- ^ a b Clavin, Whitney; Buis, Alan (22 July 2011). "Astronomers Find Largest, Most Distant Reservoir of Water". NASA. Archived from the original on 24 July 2011. Retrieved 25 July 2011.
- ^ a b Staff (22 July 2011). "Astronomers Find Largest, Oldest Mass of Water in Universe". Space.com. Archived from the original on 29 October 2011. Retrieved 23 July 2011.
- ^ Bova, Ben (13 October 2009). Faint Echoes, Distant Stars: The Science and Politics of Finding Life Beyond Earth. Zondervan. ISBN 9780061854484. Archived from the original on 14 April 2021. Retrieved 31 August 2020.
- ^ Solanki, S.K.; Livingston, W.; Ayres, T. (1994). "New Light on the Heart of Darkness of the Solar Chromosphere" (PDF). Science. 263 (5143): 64–66. Bibcode:1994Sci...263...64S. doi:10.1126/science.263.5143.64. PMID 17748350. S2CID 27696504. Archived from the original (PDF) on 7 March 2019.
- ^ "MESSENGER Scientists 'Astonished' to Find Water in Mercury's Thin Atmosphere". Planetary Society. 3 July 2008. Archived from the original on 6 April 2010. Retrieved 5 July 2008.
- ^ Bertaux, Jean-Loup; Vandaele, Ann-Carine; Korablev, Oleg; Villard, E.; Fedorova, A.; Fussen, D.; Quémerais, E.; Belyaev, D.; et al. (2007). "A warm layer in Venus' cryosphere and high-altitude measurements of HF, HCl, H2O and HDO". Nature. 450 (7170): 646–649. Bibcode:2007Natur.450..646B. doi:10.1038/nature05974. PMID 18046397. S2CID 4421875.
- ^ Sridharan, R.; Ahmed, S.M.; Dasa, Tirtha Pratim; Sreelathaa, P.; Pradeepkumara, P.; Naika, Neha; Supriya, Gogulapati (2010). "'Direct' evidence for water (H2O) in the sunlit lunar ambience from CHACE on MIP of Chandrayaan I". Planetary and Space Science. 58 (6): 947. Bibcode:2010P&SS...58..947S. doi:10.1016/j.pss.2010.02.013.
- ^ Rapp, Donald (28 November 2012). Use of Extraterrestrial Resources for Human Space Missions to Moon or Mars. Springer. p. 78. ISBN 978-3-642-32762-9. Archived from the original on 15 July 2016. Retrieved 9 February 2016.
- ^ Küppers, M.; O'Rourke, L.; Bockelée-Morvan, D.; Zakharov, V.; Lee, S.; Von Allmen, P.; Carry, B.; Teyssier, D.; Marston, A.; Müller, T.; Crovisier, J.; Barucci, M.A.; Moreno, R. (23 January 2014). "Localized sources of water vapour on the dwarf planet (1) Ceres". Nature. 505 (7484): 525–527. Bibcode:2014Natur.505..525K. doi:10.1038/nature12918. PMID 24451541. S2CID 4448395.
- ^ Atreya, Sushil K.; Wong, Ah-San (2005). "Coupled Clouds and Chemistry of the Giant Planets — A Case for Multiprobes" (PDF). Space Science Reviews. 116 (1–2): 121–136. Bibcode:2005SSRv..116..121A. doi:10.1007/s11214-005-1951-5. hdl:2027.42/43766. S2CID 31037195. Archived (PDF) from the original on 22 July 2011. Retrieved 1 April 2014.
- ^ Cook, Jia-Rui C.; Gutro, Rob; Brown, Dwayne; Harrington, J.D.; Fohn, Joe (12 December 2013). "Hubble Sees Evidence of Water Vapor at Jupiter Moon". NASA. Archived from the original on 15 December 2013. Retrieved 12 December 2013.
- ^ Hansen; C.J.; et al. (2006). "Enceladus' Water Vapor Plume" (PDF). Science. 311 (5766): 1422–1425. Bibcode:2006Sci...311.1422H. doi:10.1126/science.1121254. PMID 16527971. S2CID 2954801. Archived from the original (PDF) on 18 February 2020.
- ^ Hubbard, W.B. (1997). "Neptune's Deep Chemistry". Science. 275 (5304): 1279–1280. doi:10.1126/science.275.5304.1279. PMID 9064785. S2CID 36248590.
- ^ 먼 행성에서 발견된 물은 2007년 7월 16일 웨이백 머신에서 2007년 7월 12일 로라 블루에 의해 보관되었습니다.
- ^ 2010년 12월 30일 웨이백 머신에 보관된 외계 행성 대기 중 발견된 물– Space.com
- ^ Lockwood, Alexandra C; Johnson, John A; Bender, Chad F; Carr, John S; Barman, Travis; Richert, Alexander J.W.; Blake, Geoffrey A (2014). "Near-IR Direct Detection of Water Vapor in Tau Boo B". The Astrophysical Journal. 783 (2): L29. arXiv:1402.0846. Bibcode:2014ApJ...783L..29L. doi:10.1088/2041-8205/783/2/L29. S2CID 8463125.
- ^ Clavin, Whitney; Chou, Felicia; Weaver, Donna; Villard; Johnson, Michele (24 September 2014). "NASA Telescopes Find Clear Skies and Water Vapor on Exoplanet". NASA. Archived from the original on 14 January 2017. Retrieved 24 September 2014.
- ^ a b c Arnold Hanslmeier (29 September 2010). Water in the Universe. Springer Science & Business Media. pp. 159–. ISBN 978-90-481-9984-6. Archived from the original on 15 July 2016. Retrieved 9 February 2016.
- ^ "Hubble Traces Subtle Signals of Water on Hazy Worlds". NASA. 3 December 2013. Archived from the original on 6 December 2013. Retrieved 4 December 2013.
- ^ a b Andersson, Jonas(2012년 6월).항성 대기의 물 "붉은 거성의 물의 대기 거동을 설명하기 위해 새로운 사진이 필요할까?"2015년 2월 13일 스웨덴 룬드 대학교 Wayback Machine Lund 천문대에서 보관
- ^ 2015년 2월 19일 웨이백 머신에 보관된 근처 별의 원반에서 물의 바다를 발견한 허셜.Nasa.gov (2011년 10월 20일)2015년 9월 28일 취득.
- ^ "JPL". NASA Jet Propulsion Laboratory (JPL). Archived from the original on 4 June 2012.
- ^ 로이드, 로빈"수증기, 가능한 혜성, 궤도를 도는 별 발견", 2001년 7월 11일, Space.com.2006년 12월 15일 취득.2009년 5월 23일 Wayback Machine에서 아카이브 완료
- ^ "NASA Confirms Evidence That Liquid Water Flows on Today's Mars". NASA. 28 September 2015. Archived from the original on 28 September 2015. Retrieved 22 June 2020.
- ^ Platt, Jane; Bell, Brian (3 April 2014). "NASA Space Assets Detect Ocean inside Saturn Moon". NASA. Archived from the original on 3 April 2014. Retrieved 3 April 2014.
- ^ Iess, L.; Stevenson, D. J.; Parisi, M.; Hemingway, D.; Jacobson, R.A.; Lunine, Jonathan I.; Nimmo, F.; Armstrong, J. W.; Asmar, S. W.; Ducci, M.; Tortora, P. (4 April 2014). "The Gravity Field and Interior Structure of Enceladus" (PDF). Science. 344 (6179): 78–80. Bibcode:2014Sci...344...78I. doi:10.1126/science.1250551. PMID 24700854. S2CID 28990283. Archived (PDF) from the original on 2 December 2017. Retrieved 14 July 2019.
- ^ Dunaeva, A.N.; Kronrod, V.A.; Kuskov, O.L. (2013). "Numerical Models of Titan's Interior with Subsurface Ocean" (PDF). 44th Lunar and Planetary Science Conference (2013) (1719): 2454. Bibcode:2013LPI....44.2454D. Archived (PDF) from the original on 23 March 2014. Retrieved 23 March 2014.
- ^ Tritt, Charles S. (2002). "Possibility of Life on Europa". Milwaukee School of Engineering. Archived from the original on 9 June 2007. Retrieved 10 August 2007.
- ^ Will. (2014년 5월 3일) 목성의 달 가니메데는 웨이백 머신에 2014년 5월 3일 보관된 로이터의 '클럽 샌드위치' 층을 가지고 있을 수 있습니다.In.reuters.com 를 참조해 주세요.2015년 9월 28일 취득.
- ^ Carr, M.H. (1996). Water on Mars. New York: Oxford University Press. p. 197.
- ^ Bibring, J.-P.; Langevin, Yves; Poulet, François; Gendrin, Aline; Gondet, Brigitte; Berthé, Michel; Soufflot, Alain; Drossart, Pierre; Combes, Michel; Bellucci, Giancarlo; Moroz, Vassili; Mangold, Nicolas; Schmitt, Bernard; Omega Team, the; Erard, S.; Forni, O.; Manaud, N.; Poulleau, G.; Encrenaz, T.; Fouchet, T.; Melchiorri, R.; Altieri, F.; Formisano, V.; Bonello, G.; Fonti, S.; Capaccioni, F.; Cerroni, P.; Coradini, A.; Kottsov, V.; et al. (2004). "Perennial Water Ice Identified in the South Polar Cap of Mars". Nature. 428 (6983): 627–630. Bibcode:2004Natur.428..627B. doi:10.1038/nature02461. PMID 15024393. S2CID 4373206.
- ^ 글라스페렌의 Versteckt: Auf dem Mond Gibtes Wasser – Wissenschaft – 2008년 7월 10일 Wayback Machine Der Spiegel – Nachrichten에서 아카이브 완료
- ^ 2009년 9월 27일 NASA 웨이백 머신에 보관된 달에서 발견된 물 분자
- ^ McCord, T.B.; Sotin, C. (21 May 2005). "Ceres: Evolution and current state". Journal of Geophysical Research: Planets. 110 (E5): E05009. Bibcode:2005JGRE..110.5009M. doi:10.1029/2004JE002244.
- ^ Thomas, P.C.; Parker, J.Wm.; McFadden, L.A.; et al. (2005). "Differentiation of the asteroid Ceres as revealed by its shape". Nature. 437 (7056): 224–226. Bibcode:2005Natur.437..224T. doi:10.1038/nature03938. PMID 16148926. S2CID 17758979.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Carey, Bjorn (7 September 2005). "Largest Asteroid Might Contain More Fresh Water than Earth". SPACE.com. Archived from the original on 18 December 2010. Retrieved 16 August 2006.
- ^ Chang, Kenneth (12 March 2015). "Suddenly, It Seems, Water Is Everywhere in Solar System". New York Times. Archived from the original on 12 August 2018. Retrieved 12 March 2015.
- ^ Kuskov, O.L.; Kronrod, V.A. (2005). "Internal structure of Europa and Callisto". Icarus. 177 (2): 550–369. Bibcode:2005Icar..177..550K. doi:10.1016/j.icarus.2005.04.014.
- ^ Showman, A. P.; Malhotra, R. (1 October 1999). "The Galilean Satellites" (PDF). Science. 286 (5437): 77–84. doi:10.1126/science.286.5437.77. PMID 10506564. S2CID 9492520. Archived from the original (PDF) on 12 April 2020.
- ^ a b Sparrow, Giles (2006). The Solar System. Thunder Bay Press. ISBN 978-1-59223-579-7.
- ^ Tobie, G.; Grasset, Olivier; Lunine, Jonathan I.; Mocquet, Antoine; Sotin, Christophe (2005). "Titan's internal structure inferred from a coupled thermal-orbital model". Icarus. 175 (2): 496–502. Bibcode:2005Icar..175..496T. doi:10.1016/j.icarus.2004.12.007.
- ^ Verbiscer, A.; French, R.; Showalter, M.; Helfenstein, P. (9 February 2007). "Enceladus: Cosmic Graffiti Artist Caught in the Act". Science. 315 (5813): 815. Bibcode:2007Sci...315..815V. doi:10.1126/science.1134681. PMID 17289992. S2CID 21932253. (지원 온라인 자료, 표 S1)
- ^ Greenberg, J. Mayo (1998). "Making a comet nucleus". Astronomy and Astrophysics. 330: 375. Bibcode:1998A&A...330..375G.
- ^ "Dirty Snowballs in Space". Starryskies. Archived from the original on 29 January 2013. Retrieved 15 August 2013.
- ^ E.L. Gibb; M.J. Mumma; N. Dello Russo; M.A. DiSanti & K. Magee-Sauer (2003). "Methane in Oort Cloud comets". Icarus. 165 (2): 391–406. Bibcode:2003Icar..165..391G. doi:10.1016/S0019-1035(03)00201-X.
- ^ NASA, "MESSENGER가 수성의 극지방에서 물의 얼음에 대한 새로운 증거를 발견했다" 2012년 11월 30일 웨이백 머신에 보관됨, NASA, 2012년 11월 29일.
- ^ Thomas, P.C.; Burns, J.A.; Helfenstein, P.; Squyres, S.; Veverka, J.; Porco, C.; Turtle, E.P.; McEwen, A.; Denk, T.; Giesef, B.; Roatschf, T.; Johnsong, T.V.; Jacobsong, R.A. (October 2007). "Shapes of the saturnian icy satellites and their significance" (PDF). Icarus. 190 (2): 573–584. Bibcode:2007Icar..190..573T. doi:10.1016/j.icarus.2007.03.012. Archived (PDF) from the original on 27 September 2011. Retrieved 15 December 2011.
- ^ 거대 행성 안에 숨어 있는 이상한 물 2015년 4월 15일 New Scientist Wayback Machine, 2010년 9월 1일자 매거진 2776호에 보관.
- ^ Ehlers, E.; Krafft, T, eds. (2001). "J.C.I. Dooge. "Integrated Management of Water Resources"". Understanding the Earth System: compartments, processes, and interactions. Springer. p. 116.
- ^ "Habitable Zone". The Encyclopedia of Astrobiology, Astronomy and Spaceflight. Archived from the original on 23 May 2007. Retrieved 26 April 2007.
- ^ Shiga, David (6 May 2007). "Strange alien world made of "hot ice"". New Scientist. Archived from the original on 6 July 2008. Retrieved 28 March 2010.
- ^ Aguilar, David A. (16 December 2009). "Astronomers Find Super-Earth Using Amateur, Off-the-Shelf Technology". Harvard-Smithsonian Center for Astrophysics. Archived from the original on 7 April 2012. Retrieved 28 March 2010.
- ^ a b "MDG Report 2008" (PDF). Archived (PDF) from the original on 27 August 2010. Retrieved 25 July 2010.
- ^ Kulshreshtha, S.N (1998). "A Global Outlook for Water Resources to the Year 2025". Water Resources Management. 12 (3): 167–184. doi:10.1023/A:1007957229865. S2CID 152322295.
- ^ "Charting Our Water Future: Economic frameworks to inform decision-making" (PDF). Archived from the original (PDF) on 5 July 2010. Retrieved 25 July 2010.
- ^ Millennium Development Goals Report 2010년 8월 27일 Wayback Machine, UN, 2008년
- ^ Lomborg, Björn (2001). The Skeptical Environmentalist (PDF). Cambridge University Press. p. 22. ISBN 978-0-521-01068-9. Archived from the original (PDF) on 25 July 2013.
- ^ 유네스코, (2006), 물, 공동 책임. 유엔 세계 물 개발 보고서 2 2009년 1월 6일 웨이백 머신에 보관
- ^ 웰레, 카타리나; 에반스, 바바라;Tucker, Josephine, and Nicol, Alan (2008) 물이 원조 효과에서 뒤처져 있는가?2011년 7월 27일 Wayback Machine에서 아카이브 완료
- ^ "Search Results". International Water Management Institute (IWMI). Archived from the original on 5 June 2013. Retrieved 3 March 2016.
- ^ Nations, United. "World Water Day". United Nations. Archived from the original on 9 September 2020. Retrieved 10 September 2020.
- ^ "About World Oceans Day Online Portal". www.unworldoceansday.org. Archived from the original on 20 September 2020. Retrieved 10 September 2020.
- ^ Z. Wahrman, Miryam (2016). The Hand Book: Surviving in a Germ-Filled World. University Press of New England. p. 46-48. ISBN 9781611689556.
Water plays a role in other Christian rituals as well. ... In the early days of Christianity, two to three centuries after Christ, the lavabo (Latin for “I wash myself”), a ritual handwashing vessel and bowl, was introduced as part of Church service.
- ^ 챔버스 백과사전, 리핀콧 & 컴퍼니 (1870). 페이지 394.
- ^ Altman, Nathaniel (2002) 성수: 생명의 영적인 원천. 페이지 130–133.ISBN 1-58768-013-0.
- ^ "ĀB i. The concept of water in ancient Iran – Encyclopaedia Iranica". www.iranicaonline.org. Encyclopedia Iranica. Archived from the original on 16 May 2018. Retrieved 19 September 2018.
- ^ 린드버그, D. (2008)서양 과학의 시작: 철학적, 종교적, 제도적 맥락에서의 유럽의 과학적 전통은 서기 1450년까지의 선사시대(2기)입니다.시카고:시카고 대학 출판부
- ^ "Internet Sacred Text Archive Home". Sacred-texts.com. Archived from the original on 12 July 2010. Retrieved 25 July 2010.
- ^ Guanzi : Sui Di – 중국어 텍스트 프로젝트 2014년 11월 6일 아카이브.오늘.Ctext.org 를 참조해 주세요.2015년 9월 28일 취득.
- ^ Vartanian, Hrag (3 October 2011). "Manhattan Cathedral Explores Water in Art". Hyperallergic. Archived from the original on 3 February 2021. Retrieved 14 December 2020.
- ^ Rev. Dr. A. Kowalski, James (6 October 2011). "The Cathedral of St. John the Divine and The Value of Water". huffingtonpost.com. Huffington Post. Archived from the original on 6 August 2015. Retrieved 14 December 2020.
- ^ Foster, Fredericka. "The Value of Water at St John the Divine". vimeo.com. Sara Karl. Archived from the original on 1 March 2021. Retrieved 14 December 2020.
- ^ Miller, Reverend Canon, Tom. "The Value of Water Exhibition". UCLA Art Science Center. Archived from the original on 3 February 2021. Retrieved 14 December 2020.
- ^ Madel, Robin (6 December 2017). "Through Art, the Value of Water Expressed". Huffington Post. Archived from the original on 1 December 2020. Retrieved 16 December 2020.
- ^ Cotter, Mary (4 October 2011). "Manhattan Cathedral Examines "The Value of Water" in a New Star-Studded Art Exhibition". inhabitat.com. inhabitat. Archived from the original on 8 July 2019. Retrieved 14 December 2020.
- ^ "Influential Figures Dr. Charlotte Cote". tseshaht.com. Tseshaht First Nation [c̓išaaʔatḥ]. Archived from the original on 19 August 2021. Retrieved 19 August 2021.
- ^ "10 years of the human rights to water and sanitation". United Nations. Un - Water Family News. 27 February 2020. Archived from the original on 19 August 2021. Retrieved 19 August 2021.
- ^ "Water is sacred': 10 visual artists reflect on the human right to water". The Guardian. 4 August 2020. Archived from the original on 19 August 2021. Retrieved 19 August 2021.
- ^ "dihydrogen monoxide". Archived from the original on 2 May 2018. Retrieved 2 May 2018.
추가 정보
- Ball, Philip (2001). Life's matrix : a biography of water (1st ed.). Farrar, Straus, and Giroux. ISBN 9780520230088.
- 데베네티, 페이지 및 HE스탠리, "과냉각 및 유리수", 물리 투데이 56(6), 페이지 40-46(2003)다운로드 가능한 PDF(1.9MB) 2018년 11월 1일 Wayback Machine에 보관
- Franks, Felix (2007). Water : a matrix of life (2nd ed.). Royal Society of Chemistry. ISBN 9781847552341.
- Gleick, Ph., (편집자), The World's Water: 담수자원에 관한 격년 보고서.워싱턴 D.C. 아일랜드 프레스(1998년부터 2년마다 발행)The Water, Island Press 2009년 2월 26일 웨이백 머신에 보관
- Jones, Oliver A.; Lester, John N.; Voulvoulis, Nick (2005). "Pharmaceuticals: a threat to drinking water?". Trends in Biotechnology. 23 (4): 163–167. doi:10.1016/j.tibtech.2005.02.001. PMID 15780706.
- Wayback Machine에 2016년 3월 3일 보관된 현대 물 연구 및 교육 저널
- 포스텔, S., 마지막 오아시스: 물 부족에 직면하고 있습니다.W.W. Norton and Company(뉴욕) 1992년
- 레이스너, M., 캐딜락 사막: 미국 서부와 그 사라져가는 물펭귄 북스, 뉴욕, 1986년
- UN World Water Development Report 2009년 2월 22일 웨이백 머신에 보관.3년마다 생산됩니다.
- 성 플뢰르, 니콜라스2017년 1월 15일 Wayback Machine에 보관된 유리의 물은 태양보다 오래되었을 수 있습니다."당신이 마시는 물은 지금 서 있는 행성보다 오래되었습니다."뉴욕타임스 (2016년 4월 15일)
외부 링크
- OECD 물 통계
- 세계의 물 데이터 페이지
- FAO 종합수 데이터베이스, AQUASTAT
- 물의 충돌 연표: Water Conflict Database 2013년 1월 16일 웨이백 머신에 보관
- 수상과학학교(USGS)
- 수자원에 관한 세계은행의 전략, 작업 및 관련 출판물 포털
- 미국 수자원협회, 2018년 3월 24일 웨이백 머신에 보관
- 웹상의 물
- Wayback Machine에 2014년 12월 28일 물 구조와 과학 아카이브
- 왜 물은 우주에서 가장 이상한 것들 중 하나인가 BBC 아이디어, 비디오, 3:16분, 2019년
- 물의 화학성분(NSF 특보)
- 국제 수증기 특성 협회
- H2O: 우리를 만든 분자, 2020년 PBS 다큐멘터리






 액상과 고상의
액상과 고상의  용해 시 몰
용해 시 몰