G단백질결합수용체
G protein-coupled receptor| GPCR | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| 식별자 | |||||||||
| 기호. | 7tm_1 | ||||||||
| 팜 | PF00001 | ||||||||
| 인터프로 | IPR000276 | ||||||||
| 프로 사이트 | PDOC00210 | ||||||||
| TCDB | 9. A.14 | ||||||||
| OPM 슈퍼 패밀리 | 6 | ||||||||
| OPM단백질 | 1gzm | ||||||||
| CDD | cd6464 | ||||||||
| |||||||||
G단백질결합수용체(GPCRs)는 7-(패스)-막 통과 도메인 수용체, 7TM 수용체, 7TM 수용체, 헵타헬릭 수용체, 서펜틴 수용체 및 G단백질 연결 수용체(GPLR)로 알려져 있으며 세포 밖에서 분자를 검출하고 세포를 활성화하는 세포 표면 수용체이다.es. G단백질과 결합하는 그것들은 세포막을 7번 [2]통과하기 때문에 7개의 막 통과 수용체라고 불린다.리간드는 세포 외 N 말단 및 루프(예: 글루탐산 수용체) 또는 막 통과 나선(Rodopsin-like family) 내의 결합 부위에 결합할 수 있다.이들은 모두 작용제에 의해 활성화되지만 빈 수용체의 자발적 자동 활성화도 [2]관찰될 수 있다.
G단백질 결합 수용체는 효모, choanoflagellate [3]및 동물을 포함한 진핵생물에서만 발견된다.이러한 수용체를 결합하고 활성화하는 리간드는 빛에 민감한 화합물, 냄새, 페로몬, 호르몬, 신경전달물질 등을 포함하며 작은 분자, 펩타이드, 큰 단백질에 이르기까지 크기가 다양하다.G단백질결합수용체는 많은 질병과 관련되어 있다.
G 단백질 결합 수용체와 관련된 두 가지 주요 신호 전달 경로가 있다.
배위자가 GPCR에 결합하면 GPCR의 배위변화를 일으켜 구아닌 뉴클레오티드 교환인자(GEF)로 작용할 수 있다.GPCR은 G단백질에 결합된 GDP를 GTP와 교환함으로써 관련 G단백질을 활성화시킬 수 있다.결합된 GTP와 함께 G 단백질의 α 서브유닛은 β 서브유닛 및 β 서브유닛에서 분리되어 세포 내 시그널링 단백질 또는 α 서브유닛(Gαs, Gαi/o, Gαq/11α12/13)[5]: 1160 에 따라 직접적으로 기능성 단백질을 대상으로 할 수 있다.
GPCR은 중요한 약물 대상이며, FDA(Food and Drug Administration)가 승인한 약물의 약 34%[6]가 이 제품군의 108개 구성원을 대상으로 한다.이들 약품의 전 세계 매출액은 [6]2018년 기준으로[update] 1800억 달러(약 1조8000억 원)로 추산된다.GPCR은 주로 정신, 대사, 바이러스 감염을 포함한 면역학, 심혈관, 염증, 감각 장애 및 암과 같은 많은 질병과 관련된 신호 경로에 관여하기 때문에 현재 시판 중인 약의 약 50%가 대상인 것으로 추정된다.GPCRs와 많은 내인성 및 외인성 물질 간의 연관성이 오래 전에 발견되어 진통증을 일으키는 것은 제약 [2]연구의 또 다른 역동적으로 발전하는 분야이다.
역사와 의의
2011년 G-단백질 결합 수용체(GPCR)와 G-단백질 삼량체(Gαβδ) 사이의 복합체의 첫 번째 구조가 결정됨에 따라 두 개 이상의 단백질이 조사되는 글로벌 스위치의 구조 조사를 위한 GPCR 연구의 새로운 장이 열렸다.이전의 비약적 발전은 2000년 첫 번째 GPCR인 로돕신의 결정구조와 2007년 확산성 배위자2(βAR)를 가진 첫 번째 GPCR의 결정구조를 결정하는 것이었다.2차원 결정의 저온전자현미경 연구에서 개구리 로돕신의 저해상도 모델을 바탕으로 GPCR의 7개의 막 통과 나선형을 다발로 배열하는 방법을 의심했다.3년 후 나타난 로돕신의 결정 구조는 추가적인 세포질 나선 H8과 망막 결합 부위를 덮는 루프의 정확한 위치를 제외하고는 놀라운 것이 아니었다.그러나, 그것은 다른 GPCR을 위한 호몰로지 모델링과 약물 설계를 위한 보편적인 템플릿이 되기를 바라는 발판을 제공했는데, 이는 너무 낙관적인 개념으로 판명되었다.
7년 후, 확산성 리간드에 의한 β-아드레날린2 수용체(βAR2)의 결정화는 로돕신과는 상당히 다른 수용체 세포외측의 형태를 드러냈기 때문에 놀라운 결과를 가져왔다.이 영역은 리간드 결합에 책임이 있고 많은 약물의 표적이 되기 때문에 중요하다.또한, 리간드 결합 부위는 로돕신 구조보다 훨씬 더 넓고 외부에 개방되어 있었다.직후 결정화된 다른 수용체에서는 결합면이 배위자에 더욱 쉽게 접근할 수 있었다.생화학적 조사를 보완한 새로운 구조는 작용제의 활성화 상태 또는 역작용제의 [2]완전 또는 부분 불활성 상태로 이어지는 수용체 구조를 변조하는 분자 스위치의 작용 메커니즘을 밝혀냈다.
2012년 노벨 화학상은 "G단백질 결합 수용체가 어떻게 [7]기능하는지 이해하는 데 중요한" 그들의 업적으로 브라이언 코빌카와 로버트 레프코위츠에게 수여되었다.G단백질 매개 시그널링의 일부 측면에 대해 적어도 7개의 노벨상이 수여되었습니다.2012년 기준, 전 세계 베스트셀링 의약품 상위 10개 중 2개(Advair Discus 및 Abilify)는 G 단백질 결합 [8]수용체를 대상으로 작용한다.
분류

GPCR 슈퍼패밀리의 정확한 크기는 알려지지 않았지만, 적어도 831개의 다른 인간 유전자(또는 전체 단백질 코드 게놈의 약 4%)가 게놈 배열 [9][10]분석을 통해 그것들을 코드화할 것으로 예측되었다.수많은 분류 방식이 제안되었지만, 슈퍼 패밀리는 클래스 간에 검출 가능한 공유 시퀀스 호몰로지가 없는 세 가지 주요 클래스(A, B, C)로 고전적으로 구분되었다.
지금까지 가장 큰 등급은 GPCR 유전자의 거의 85%를 차지하는 A 등급이다.클래스 A GPCR 중 절반 이상이 후각 수용체를 코드하는 것으로 예측되며, 나머지 수용체는 알려진 내인성 화합물에 의해 결합되거나 고아 수용체로 분류된다.클래스 간 시퀀스 호몰로지가 없음에도 불구하고 모든 GPCR은 신호 전달의 공통 구조와 메커니즘을 가지고 있습니다.매우 큰 로돕신 A 그룹은 19개의 서브그룹(A1-A19)[11]으로 더욱 세분화되었다.
기존의 A-F 시스템에 따르면, GPCR은 시퀀스 호몰로지 및 기능 [12][13][14][15]유사성에 따라 6개의 클래스로 분류할 수 있다.
- 클래스 A(또는 1) (로돕신 유사)
- 클래스 B(또는 2) (세크레틴 수용체 패밀리)
- 클래스 C(또는 3) (메타보트로픽 글루탐산/페로몬)
- 클래스 D(또는 4) (번지 짝짓기 페로몬 수용체)
- 클래스 E(또는 5)(사이클릭 AMP 수용체)
- 클래스 F(또는 6)(프리즈/스무딩)
최근 척추동물 GPCR에 [9]대한 GRAFS(Glutamate, Rodopsin, 접착, Frizled/Taste2, Secretin)라는 대체 분류 시스템이 제안되었다.이들은 클래식 클래스 C, A, B2, F 및 [16]B에 대응합니다.
이용 가능한 DNA 염기서열에 기초한 초기 연구는 인간 게놈이 약 750G의 단백질 결합 [17]수용체를 암호화하고, 그 중 약 350개가 호르몬, 성장인자, 그리고 다른 내인성 배위자를 검출한다고 제안했다.인간 게놈에서 발견된 약 150개의 GPCR은 알려지지 않은 기능을 가지고 있다.
일부 웹서버[18] 및 생물정보학 예측방법은[19][20] 유사 아미노산 조성접근법에 의해 아미노산 배열에 따른 GPCR의 분류를 예측하기 위해 사용되어 왔다.
생리학적 역할
GPCR은 다양한 생리적 과정에 관여한다.생리학적 역할의 예는 다음과 같습니다.
- 시각적 감각:옵신은 광이성화 반응을 이용하여 전자파 복사를 세포 신호로 변환한다.예를 들어 Rhodopsin은 이 목적을 위해 11-cis-retinal에서 all-trans-retinal로의 변환을 사용합니다.
- 미각(미각) : 미각세포의 GPCR은 쓴맛, 감미맛, 단맛의 물질에 반응하여 구스두신의 방출을 중개한다.
- 후각 : 후각 상피 수용체는 냄새제(후각 수용체)와 페로몬(보메로나살 수용체)을 결합한다.
- 행동 및 기분 조절:포유류의 뇌에 있는 수용체는 세로토닌, 도파민, 히스타민, GABA, 글루탐산염을 포함한 여러 다른 신경전달물질과 결합한다.
- 면역 시스템 활동 및 염증의 조절: 케모카인 수용체는 면역 시스템의 세포들 사이의 세포 간 통신을 매개하는 리간드를 결합합니다; 히스타민 수용체와 같은 수용체는 염증 매개체와 결합하고 염증 반응에 표적 세포 유형을 결합합니다.또한 GPCR은 면역 조절, 예를 들어 인터류킨 유도[21] 조절 또는 T세포의 [22]TLR 유도 면역 반응 억제에도 관여한다.
- 자율신경계 전달:교감신경계와 부교감신경계는 혈압, 심박수, 소화과정과 같은 신체의 많은 자동기능을 제어하는 GPCR 경로에 의해 조절된다.
- 셀 밀도 감지:세포 밀도 감지를 조절하는 새로운 GPCR 역할.
- 항상성 변조(예: 수분 [23]밸런스)
- 종양의 [24]성장과 전이에 관여한다.
- 표적 세포의 세포막에서 GCPR에 결합하는 펩타이드 및 아미노산 유도체 호르몬에 내분비계에서 사용된다.이는 cAMP를 활성화하고, 이는 여러 키나제를 활성화하여 전사 등의 세포 반응을 가능하게 합니다.
수용체 구조
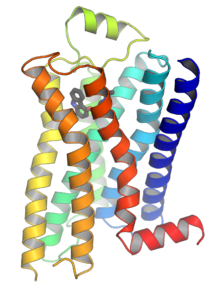
GPCR은 7개의 막-스판 도메인 또는 막-스판 나선형(transmembrane helic)[25][26]을 가진 일체형 막 단백질이다.수용체의 세포외 부분은 글리코실화 될 수 있다.이러한 세포외 루프는 또한 수용체 구조를 안정시키기 위해 디술피드 결합을 형성하는 두 개의 고도로 보존된 시스테인 잔기를 포함합니다.GPCR과 유사한 일부 7개의 막 통과 나선 단백질(channelrodopsin)은 단백질 내에 이온 채널을 포함할 수 있다.
2000년에는 포유동물 GPCR의 첫 결정구조인 소 로돕신(1F88)이 [27]해결됐다.2007년 인간 GPCR의 첫 번째 구조가 해결되었다. 이 인간 β-아드레날린2 수용체 GPCR 구조는 소 로돕신과 매우 유사한 것으로 입증되었다.활성 또는 작용제 결합 GPCR의 구조도 결정되었다.[30][31][32][33]이러한 구조는 수용체의 세포외측에서 리간드 결합이 수용체의 세포질측에서 어떻게 구조변화를 초래하는지를 나타낸다.가장 큰 변화는 5, 6번째 막간나선(TM5, TM6)의 세포질 부분이 바깥쪽으로 이동하는 것이다.G와s 복합체 내 활성화된 베타-2 아드레날린 수용체의 구조는 Gα가 이러한 움직임에 [34]의해 만들어진 공동에 결합한다는 것을 확인했다.
GPCR은 미생물 로돕신 및 아디포넥틴 수용체 1 및 2(ADIPOR1 및 ADIPOR2)와 같은 7개의 막 통과 도메인을 가진 다른 단백질과 유사한 구조를 보인다.그러나 이러한 7TMH 수용체와 채널은 G 단백질과 관련이 없다.또한 ADIPOR1 및 ADIPOR2는 막내 GPCR과 반대방향으로 배치된다(즉, GPCR은 보통 세포외 N-말단, 세포질 C-말단을 가지지만 ADIPORs는 [35]반전된다).
구조-기능 관계
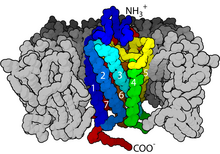
구조면에서 GPCR은 세포외 N말단에 의해 특징지어지며, 이어서 세포내 3개(IL-1~IL-3) 및 세포외 3개(EL-1~EL-3)로 연결된 7개의 막간(7-TM)α-헬리체(TM-1~TM-7)와 최종적으로 세포내 C말단에 의해 결합된다.GPCR은 종종 EL-2에 의해 덮이는 리간드 결합 도메인에 서비스를 제공하는 플라즈마 막 내에 공동을 형성하는 7개의 막 통과 나선과 함께 배럴과 유사한 3차 구조로 배치됩니다.그러나 리간드는 더 부피가 큰 리간드(예: 단백질 또는 큰 펩타이드)의 경우와 같이 다른 곳에 결합할 수 있으며, 대신 세포외 루프 또는 클래스 C 메타이트로픽 글루탐산 수용체(mGluRs)에 의해 설명되었듯이 N-말단 꼬리와 상호작용할 수 있다.클래스 C GPCR은 리간드 결합 도메인을 포함하는 큰 N 말단 꼬리로 구분됩니다.글루탐산염이 mGluR에 결합하면, N 말단 꼬리는 세포 외 루프 및 TM 도메인의 잔류물과의 상호작용으로 이어지는 구조 변화를 겪는다.세 가지 유형의 작용제 유도 활성화의 궁극적인 효과는 TM 헬리스의 상대적인 방향의 변화(뒤틀림 운동으로 인해)로 인해 세포 내 표면이 넓어지고 신호 전달 기능(즉, G-단백질 결합)에 중요한 세포 내 헬리스와 TM 도메인의 잔류물이 "발견"된다.역작용제와 길항제 또한 여러 다른 부위에 결합할 수 있지만, 최종적인 효과는 이러한 TM나선 방향 [2]변경의 예방이 되어야 한다.
GPCR의 N 말단 및 C 말단 꼬리의 구조는 리간드 결합을 넘어 중요한 기능을 할 수도 있다.예를 들어 M 무스카린 수용체의3 C-말단은 충분하며, [36]G단백질과의q 사전조립에는 C-말단의 6-아미노산 폴리염기(KKRRK) 도메인이 필요하다.특히 C 말단은 종종 세린(Ser) 또는 트레오닌(Thr) 잔기를 포함하고 있으며, 이는 인산화되었을 때 β-아레스틴(β-arr)[37]이라 불리는 비계 단백질의 결합에 대한 세포 내 표면의 친화력을 증가시킨다.일단 결합되면, β-아레스틴은 G-단백질 결합을 입체적으로 방지하고 다른 단백질을 모집할 수 있으며, 세포외 신호 조절 키나아제(ERK) 경로 활성화 또는 수용체 엔도사이토시스(내화)와 관련된 신호 복합체를 생성하게 된다.이들 Ser 및 Thr 잔기의 인산화효과는 GPCR 활성화의 결과로 발생하는 경우가 많기 때문에 GPCR의 β-ar-mediated G-단백질-탈결합 및 내부화는 [38]탈감작의 중요한 메커니즘이다.또한 단일 GPCR, β-arr(꼬리배위)[39][40] 및 헤테로트리머 G단백질로 이루어진 내부화된 '메가복합체'가 존재하며,[41][42] 엔도솜으로부터의 단백질 시그널링을 설명할 수 있다.
GPCR의 최종 공통 구조 테마는 C 말단 꼬리 또는 세포 내 루프의 하나 이상의 부위의 팔미토일화이다.팔미토일화는 소수성 아실기 추가를 통한 시스테인(Cys) 잔기의 공유 변성 작용으로, 지질 뗏목이라고 불리는 혈장 막의 콜레스테롤 및 스핑고리피드가 풍부한 마이크로도메인을 대상으로 하는 효과가 있다.GPCR의 하류 변환기 및 이펙터 분자(음성 피드백 경로에 관여하는 분자 포함)의 상당수도 지질 뗏목을 대상으로 하기 때문에 이는 신속한 수용체 시그널링을 촉진하는 효과가 있다.
GPCR은 단백질에서 생물아민, 양성자에 이르는 다양한 작용제에 의해 매개되는 세포외 신호에 반응하지만, 모두 G단백질 결합의 메커니즘을 통해 이 신호를 전달한다.이는 주로 IL-2와 IL-3의 조합에 의해 형성된 구아닌-뉴클레오티드 교환인자(GEF) 도메인과 관련 TM 헬리크의 인접 잔류물에 의해 가능하다.
메커니즘
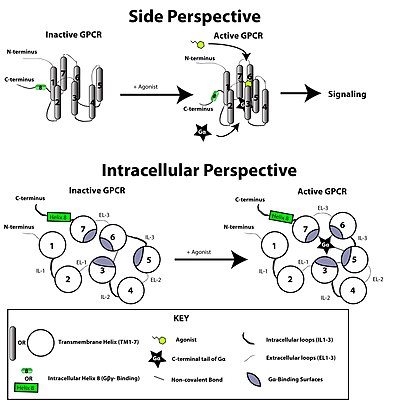
G단백질결합수용체는 배위자 또는 기타 신호매개체의 형태로 외부신호에 의해 활성화된다.이것은 수용체에 구조 변화를 일으켜 G단백질의 활성화를 일으킨다.추가적인 효과는 G단백질의 종류에 따라 달라집니다.G단백질은 이후 RGS단백질로 알려진 GTPase 활성화 단백질에 의해 불활성화된다.
배위자 결합
GPCR은 다음 리간드에 대한 하나 이상의 수용체를 포함한다. 감각 신호 매개체(예를 들어 빛 및 후각 자극 분자), 아데노신, 봄베신, 브래디키닌, 엔도셀린, γ-아미노부틸산(GABA), 간세포 성장인자(HGF), 멜라노코르틴, 신경펩티드, 오피디아이드활성 장내 펩타이드 패밀리 및 바소프레신, 바이오제닉 아민(예: 도파민, 에피네프린, 노르에피네프린, 히스타민, 세로토닌, 멜라토닌), 글루탐산(자극성 효과), 글루카곤, 아세틸콜린(무스카린 효과), 케모킨, 염증의 지질 매개제(예: 프로스타노이드)nes), 펩타이드 호르몬(예: 칼시토닌, C5a 아나필라톡신, 모낭자극호르몬(FSH), 고나도트로핀 방출호르몬(GnRH), 신경키닌, 티로트로핀 방출호르몬(TRH), 옥시토신) 및 엔도칸나비노이드.
아직 확인되지 않은 자극에 대한 수용체로 작용하는 GPCR은 고아 수용체로 알려져 있다.
그러나 리간드가 막에 외부적으로 결합하는 연구된 다른 유형의 수용체에서는 GPCR의 리간드가 일반적으로 막 통과 도메인 내에서 결합한다.단, 단백질분해효소 활성화 수용체는 세포외 도메인의 [44]일부를 분할함으로써 활성화된다.
구성 변경
리셉터에 의한 멤브레인을 통한 신호 전달은 완전히 이해되지 않습니다.불활성 상태에서 GPCR은 헤테로 이성질체 G단백질 복합체에 결합하는 것으로 알려져 있다.작용제가 GPCR에 결합하면 수용체의 배좌 변화가 일어나 단백질 도메인 역학을 통해 헤테로 이성질 G 단백질의 결합α G 서브유닛으로 전달된다.활성화된α G 서브유닛은 GDP 대신 GTP를 교환하고, G 서브유닛은 G 이합체βγ 및 수용체로부터 G 서브유닛의 해리를α 유발한다.해리된α G와βγ G 서브유닛은 다른 세포 내 단백질과 상호작용하여 신호 전달을 계속하는 반면, 해방된 GPCR은 또 다른 이종 이성질 G 단백질에 재결합하여 신호 [45]전달을 시작할 준비가 된 새로운 복합체를 형성할 수 있다.
수용체 분자는 활성 생물물리학 상태와 비활성 생물물리학 [46]상태 사이의 입체구조 평형 상태에 존재하는 것으로 여겨진다.수용체에 대한 리간드의 결합은 활성 수용체 상태를 향해 평형을 이동할 수 있다.리간드에는 다음 3가지 유형이 있습니다.작용제는 활성 상태로 평형을 전환하는 리간드이고, 역작용제는 비활성 상태로 평형을 전환하는 리간드이며, 중성 길항제들은 평형에 영향을 미치지 않는 리간드이다.액티브 상태와 비액티브 상태가 서로 어떻게 다른지는 아직 알려지지 않았습니다.
G단백질활성화/비활성화 사이클
수용체가 비활성일 때, GEF 도메인은 헤테로트리머 G-단백질의 비활성 α-서브유닛에도 결합할 수 있다.이러한 "G-단백질"은 α, β 및 γ 소단위(각각 Gα, Gβ 및 G,로 알려져 있음)의 삼량체이며, 구아노신 이인산(GDP)에 가역적으로 결합할 때는 비활성(또는 구아닌 뉴클레오티드가 없음)이 되지만, 구아노신 삼인산(GTP)에 결합할 때는 활성이다.수용체가 활성화되면 GEF 도메인은 G단백질의 α-서브유닛에서 GTP에 대한 GDP 분자의 교환을 촉진함으로써 G단백질을 알로스테릭하게 활성화한다.세포는 세포질 GTP의 10:1 비율을 유지합니다.그래서 GTP와의 교환이 보장된다.이 시점에서 G단백질의 서브유닛은 수용체뿐만 아니라 서로 분리되어 Gα-GTP 모노머와 긴밀하게 상호작용하는 Gβγ 이합체를 생성하며, 이들은 이제 다른 세포 내 단백질의 활성을 조절하는 데 자유롭다.그러나 Gα의 팔미토일화와 Gγ의 C 말단에 공유적으로 첨가된 이소프레노이드 부분의 존재로 인해 확산될 수 있는 범위가 제한된다.
또한 Gα는 느린 GTP→GDP 가수분해 능력을 가지고 있기 때문에 α-서브유닛(Gα-GDP)의 비활성 형태는 결국 재생되며, 따라서 Gβγ이합체와의 재결합을 통해 G-단백질을 형성할 수 있으며, GPCR에 다시 결합하여 활성화를 기다릴 수 있다.GTP 가수분해 속도는 GTPase-Activating Protein, 즉 GAP의 일종인 RGS 단백질이라고 불리는 알로스테릭 변조 단백질의 다른 계열의 작용으로 인해 종종 가속화된다.실제로 Gα-GTP와의 상호작용에 따라 활성화/비활성화되는 많은 1차 이펙터 단백질(예: 아데닐산 사이클라아제)도 GAP 활성을 가진다.따라서 프로세스의 이 초기 단계에서도 GPCR에 의해 개시되는 시그널링은 자기 종단 처리 능력을 가지고 있습니다.
크로스 토크

다운스트림 GPCR 신호는 FAK [47]등의 인테그린 신호와 상호작용할 가능성이 있는 것으로 나타났습니다.인테그린 시그널링은 FAK를 인산화하여 GPCRαs G 활성을 감소시킬 수 있다.
시그널링
활성상태의 수용체가 G단백질을 만나면 활성화 시킬 수 있다.몇몇 증거들은 수용체와 G단백질이 실제로 사전에 [36]결합되어 있다는 것을 암시한다.예를 들어, G 단백질의 수용체 결합은 리간드에 대한 수용체의 친화력에 영향을 미친다.활성화된 G단백질은 GTP에 결합되어 있다.
추가적인 신호 전달은 G 단백질의 유형에 따라 달라집니다.아데닐산 시클라아제 효소는 G단백질(이 경우 G단백질s)에 의해 조절될 수 있는 세포단백질의 한 예이다.아데닐산 시클라아제 활성은 활성화된 G단백질의 서브유닛에 결합할 때 활성화된다.아데닐산환원효소의 활성화는 G단백질이 GDP 결합 상태로 돌아오면 종료된다.
아데닐산 사이클라아제(인간에서 9개의 막 결합 형태와 1개의 세포 결합 형태가 알려져 있음)는 또한 G 단백질과 함께 이러한 효소의 활성을 첨가 또는 상승적인 방식으로 수정할 수 있는 다른 방법(예: Ca2+/Calmodulin 결합)으로 활성화되거나 억제될 수 있다.
GPCR을 통해 활성화된 신호 경로는 GPCR 자체의 1차 배열 및 3차 구조에 의해 제한되지만, 궁극적으로 특정 배위자에 의해 안정화된 특정 배위 및 변환기 분자의 가용성에 의해 결정된다.현재 GPCR은 G-단백질과 β-아레스틴이라는 두 가지 주요 유형의 변환기를 이용하는 것으로 간주된다.β-arr은 대부분의 GPCR의 인산화 형태에만 높은 친화력을 가지므로(위 또는 아래 참조), 신호 전달의 대부분은 궁극적으로 G-단백질 활성화에 의존한다.단, 상호작용 가능성은 G단백질 비의존적 시그널링을 가능하게 합니다.
G단백질 의존성 시그널링
염기서열 호몰로지(Gαsαi/o, Gαq/11, G, Gα12/13)에 의해 서로 구별되는 4개의 G단백질 서브클래스에 의해 매개되는 3개의 주요 G단백질 매개 신호 경로가 있다.G-단백질의 각 하위 등급은 여러 개의 단백질로 구성되며, 각 단백질은 신호 특성과 관련하여 미묘한 것부터 구별되는 것까지 다양한 차이를 그들에게 주입할 수 있는 여러 유전자 또는 스플라이스 변이의 산물로 구성되지만, 일반적으로 그들은 4개의 등급으로 합리적으로 그룹화된 것으로 보인다.다양한 가능한 βγ 조합의 신호 전달 특성이 서로 근본적으로 다른 것으로 보이지 않기 때문에 이러한 등급은 α-서브유닛의 [5]: 1163 등유형에 따라 정의된다.
대부분의 GPCR은 하나 이상의 Gα-subtype을 활성화할 수 있지만, 또한 다른 서브타입보다 한 서브타입에 대한 선호도를 보인다.활성화된 아형이 GPCR에 결합되어 있는 배위자에 의존할 때, 이를 기능 선택성(작용제 유도 트래픽 또는 배위 특이적 작용이라고도 함)이라고 한다.단, 단일 특정 작용제의 결합은 GPCR의 GEF 도메인의 둘 이상의 배열을 단일 상호작용의 과정에서도 안정화시킬 수 있기 때문에 복수의 다른 G단백질의 활성화를 개시할 수도 있다.또한 바람직하게는 Gα의 한 아이소폼을 활성화하는 배치는 선호도가 낮은 경우 다른 아이소폼을 활성화시킬 수 있다.또한 피드백 경로는 G단백질 선호도를 변화시키는 수용체 수정(예를 들어, 인산화)을 초래할 수 있다.이러한 다양한 뉘앙스에 관계없이, GPCR의 바람직한 결합 파트너는 보통 대부분의 생리학적 또는 실험 조건에서 내인성 배위자에 의해 가장 분명하게 활성화된 G-단백질에 따라 정의된다.
Gα 시그널링
- Gαs 경로와αi/o G 경로의 이펙터는 모두 고리형 아데닐산염(cAMP) 생성 효소인 아데닐산환원 아데닐산 시클라아제(cAMP)포유류에는 각각 조직 분포나 기능에 미묘한 차이가 있는 10가지 AC 유전자 산물이 있지만 모두 세포질 아데노신 삼인산(ATP)의 cAMP로의 전환을 촉매하고 모두 G급αs G단백질에 의해 직접 자극된다.그러나 반대로 G타입의αi/o Gα 서브유닛과의 상호작용은 AC가 cAMP를 발생시키는 것을 억제한다.따라서 G에 결합된αs GPCR은 G에 결합된αi/o GPCR의 작용에 대항하며, 그 반대도 마찬가지입니다.세포질 cAMP의 수준은 다양한 이온 채널뿐만 아니라 ser/thr 특이적 단백질 키나제 A(PKA) 계열의 구성원들의 활성을 결정할 수 있다.따라서 cAMP는 두 번째 전달자로 간주되고 PKA는 두 번째 이펙터로 간주됩니다.
- Gαq/11 경로의 이펙터는 포스포리파아제 C-β(PLCβ)로, 막결합 포스파티딜이노시톨 4,5-비스인산(PIP2)을 두 번째 메신저 이노시톨(1,4,5) 트리시톨(IP3)과 디아실글리세롤(DAG)로 분해하는 것을 촉매한다.IP3는 소포체(ER)의 막에서 발견되는 IP3 수용체에 작용하여 ER로부터 Ca 방출을 유도하는2+ 반면, DAG는 혈장막을 따라 확산되어 단백질 키나제 C(PKC)라고 불리는 두 번째 ser/thr 키나제의 막 국소화된 형태를 활성화시킬 수 있다.PKC의 많은 동소체들도 세포2+ 내 Ca의 증가에 의해 활성화되기 때문에, 이러한 두 경로는 또한 동일한 2차 이펙터를 통해 신호를 보내기 위해 서로 수렴할 수 있다.세포2+ 내 Ca의 증가는 또한 카르모듈린이라고 불리는 단백질을 결합하고 알로스테릭하게 활성화시키며, 이는 다시 토솔릭의 작은 GTPase인 Rho입니다.일단 GTP에 결합되면, Rho는 Rho-kinase (ROCK)와 같은 세포골격 조절을 담당하는 다양한 단백질을 활성화 시킬 수 있다.G에α12/13 결합하는 대부분의 GPCR은 다른 하위 클래스(종종αq/11 G)에도 결합한다.
Gβγ 시그널링
위의 설명은 특히 활성화된 G-결합αi/o GPCR의 경우에도 중요할 수 있는 Gβ-신호의 영향을 무시한다.Gβγ의 1차 이펙터는 G-단백질 조절 내향 정류+ K채널(GIRKs), P/Q- 및 N형 전압2+ 게이트 Ca 채널, AC 및 PLC의 일부 등 다양한 이온 채널과 일부 포스포이노시드-3-키나아제(PI3k) ISO 형태이다.
G단백질비의존신호
GPCR은 고전적으로만 함께 작동하는 것으로 생각되지만, GPCR은 G-단백질 비의존적 메커니즘을 통해 신호를 보낼 수 있으며, 헤테로리머 G-단백질은 GPCR과 무관하게 기능적 역할을 할 수 있다. GPCR은 β-단백질 의존적 신호 전달, SRsk와 같은 G-단백질 의존적 신호 전달에서 이미 언급된 많은 단백질을 통해 독립적으로 신호를 보낼 수 있다.s. 그러한 시그널링은 생리적으로 관련이 있는 것으로 나타났으며, 예를 들어 활성화된 T세포의 [48]완전한 유효 화학축성을 위해 케모카인 수용체 CXCR3에 의해 매개되는 β-아레스틴 시그널링이 필요했다.또한 GPCR의 세포내 국재화에 관여하는 발판단백질(예를 들어 PDZ 도메인을 포함한 단백질)도 신호전달기로서 기능할 수 있다.대부분의 경우 이펙터는 MAPK 제품군의 구성원입니다.
예
1990년대 후반, 일부 GPCR이 G단백질 없이도 신호를 보낼 수 있다는 증거가 축적되기 시작했다.많은 경로에서 수용체 활성화의 핵심 신호 전달 매개체인 ERK2 마이트겐 활성화 단백질 키나제는 연관된 G 단백질 α- 및 β-서브유닛이 [49]없음에도 불구하고 슬라임 곰팡이 D. 디스코이디움에서 cAMP 매개 수용체 활성화에 반응하여 활성화되는 것으로 나타났다.
포유동물 세포에서 많이 연구된 β-아드레노수용체는2 G-단백질 매개 시그널링의 아레스틴 매개 분리 후 ERK2 경로를 활성화하는 것으로 입증되었다.따라서, 이전에 순전히 수용체 탈감작과 관련이 있다고 믿었던 일부 메커니즘은 단순히 꺼지는 것이 아니라 수용체가 신호 경로를 전환하는 실제 사례일 수 있다.
신장 세포에서 브라디키닌 수용체 B2는 단백질 티로신 포스파타아제와 직접 상호작용하는 것으로 나타났다.B2 수용체에 티로신-인산화 ITIM(면역수용체 티로신 기반 억제 모티브) 배열이 존재하는 것은 이러한 상호작용과 이후 브라디키닌의 [50]항증식 효과를 매개하기 위해 필요하다.
헤테로트리머 G단백질에 의한 GPCR 비의존적 시그널링
이것은 비교적 미숙한 연구 영역이지만, 헤테로트리머 G단백질도 비GPCR 시그널링에 관여하는 것으로 보인다.인테그린, 수용체 티로신 키나아제(RTKs), 사이토카인 수용체(JAK/STATs) 및 GEF, 구아닌-뉴클레오티드 해리 억제제(GDIS) 및 포스파타아제 등 다양한 "보조" 단백질의 변조를 포함한 거의 모든 수용체 매개 신호 전달체로서의 역할에 대한 증거가 있다.G-단백질 시그널링(AGS)의 활성제라고 불리는 GPCR 독립 경로의 일부로서 일차 기능이 있는 이러한 등급의 특정 단백질이 있을 수 있다.이러한 상호작용의 편재성과 이러한 과정에 대한 Gα 대 Gβγ 서브유닛의 중요성은 여전히 불분명하다.
cAMP 및 PIP2 경로 상세
G 단백질 연결 수용체와 관련된 두 가지 주요 신호 전달 경로가 있는데, cAMP 신호 경로와 포스파티딜리노시톨 신호 [4]경로이다.
cAMP 신호 경로
cAMP 신호전달은 자극호르몬 수용체(Rs) 또는 억제호르몬 수용체(Ri), 자극조절 G단백질(Gs) 또는 억제조절 G단백질(Gi), 아데닐시클라아제, 단백질인산화효소A(PKA) 및 CAMPodiesterase의 5가지 주요 특성을 포함한다.
자극호르몬수용체(Rs)는 자극신호분자와 결합할 수 있는 수용체이며, 억제호르몬수용체(Ri)는 억제신호분자와 결합할 수 있는 수용체이다.
자극조절 G단백질은 자극호르몬수용체(Rs)와 연결된 G단백질이며, 활성화 시 그 α 서브유닛은 효소 또는 기타 세포내 대사의 활성을 자극할 수 있다.반대로 억제조절 G-단백질은 억제호르몬 수용체에 연결되어 활성화 시 그 α 서브유닛은 효소 또는 기타 세포내 대사를 저해할 수 있다.
아데닐환원효소는 보조인자2+ Mg 또는2+ Mn의 도움으로 ATP의 cAMP로의 전환을 촉매하는 12-막 통과 당단백질이다.생성된 cAMP는 세포 대사의 두 번째 전달자이며 단백질 키나제 A의 알로스테릭 활성제이다.
단백질 키나제 A는 대사 경로에서 특정 공여 효소를 인산화함으로써 세포 대사를 조절하는 능력 때문에 세포 대사의 중요한 효소이다.그것은 또한 특정 유전자 발현, 세포 분비, 막 투과성을 조절할 수 있다.단백질 효소는 두 개의 촉매 서브유닛과 두 개의 조절 서브유닛을 포함합니다.cAMP가 없는 경우 복합체는 비활성화됩니다.cAMP가 조절 서브유닛에 결합하면, 그 배치가 변화하여 조절 서브유닛의 해리를 유발하고, 이는 단백질 키나제 A를 활성화하고 추가적인 생물학적 효과를 가능하게 한다.
이러한 신호는 cAMP를 5'-AMP로 분해하고 단백질 키나제 A를 비활성화시키는 효소인 cAMP 포스포디에스테라아제에 의해 종료될 수 있다.
포스파티딜이노시톨 신호 경로
포스파티딜이노시톨 신호경로는 세포표면상의 G단백질 수용체(Gq)와 결합해 혈장막상에 위치한 포스폴리파아제 C를 활성화한다.리파아제는 포스파티딜이노시톨 4,5-이인산염(PIP2)을 가수분해하여 이노시톨 1,4,5-트리인산염(IP3)과 디아실글리세롤(DAG) 두 개의 두 번째 전달자로 만듭니다.IP3는 매끄러운 소포체와 미토콘드리아의 막에서 IP3 수용체와 결합하여2+ Ca 채널을 연다.DAG는 단백질 키나제 C(PKC)를 활성화시키는데 도움을 주며, 단백질 키나제는 많은 다른 단백질을 인산화하여 촉매 작용을 변화시키고, 세포 반응을 유도합니다.
소금의 효과 또한:DAG과 야전 하역 장비 활성화에서 calcium-modulated 단백질 칼모듈린(CaM)소금을 하나로 묶는 것은 CaM인산화 효소 경로, 활성화 시킬 수 있습니다, 모양에 변화를 겪는다, 그리고 CaM인산화 효소 II, 특별한 능력 CaM에 자기 인산화에 의해 그것의 바인딩 친화를 늘였다를 활성화시키고, Ca를 만들고 적극 협력해 주목할 만 하다Mun다른 효소의 활성화에 사용할 수 있습니다.키나제는 표적 효소를 인산화하여 그들의 활동을 조절한다.두 신호 경로는 Ca-CaM에2+ 의해 함께 연결되며, Ca-CaM은 cAMP 신호 경로에서 아데닐환원효소 및 포스포디에스테라아제의 조절 서브 유닛이기도 하다.
수용체 조절
GPCR은 그들의 배위자에 장기간 노출되면 둔감해진다.탈감작에는 1)활성화된 GPCR이 하향 조절되는 상동 탈감작과 2)활성화된 GPCR이 다른 GPCR의 하향 조절을 일으키는 상동 탈감작의 두 가지 형태가 있다.이 하향 조절의 핵심 반응은 단백질 키나제에 의한 세포 내(또는 세포질) 수용체 도메인의 인산화이다.
cAMP의존성 단백질인산화효소
고리형 AMP의존성 단백질인산화효소(단백질인산화효소 A)는 아데닐산 시클라아제 및 고리형 AMP(cAMP)를 통해 G단백질(수용체에 의해 활성화됨)에서 오는 신호사슬에 의해 활성화된다.피드백 메커니즘에서 이들 활성화된 키나아제들은 수용체를 인산화한다.수용체가 오랫동안 활성 상태를 유지할수록 더 많은 키나아제들이 활성화되고 더 많은 수용체가 인산화된다.β-아드레노2 수용체에서 이러한 인산화 작용은 결합을 G-단백질 Gs 클래스에서 G [51]클래스로i 전환시킨다. cAMP 의존성 PKA 매개 인산화 작용은 활성화된 [52]수용체 이외의 수용체에서 이종 탈감작증을 일으킬 수 있다.
GRK에 의한 인산화
G단백질결합수용체키나아제(GRKs)는 활성 GPCR만을 인산화시키는 단백질키나아제이며, G단백질결합수용체키나아제(GRKs)는 G단백질결합수용체(GPCR)[53] 시그널링의 주요 조절제이다.그들은 작용제 결합 수용체를 인산화시키는 7개의 포유동물 세린-트레오닌 단백질 키나아제 패밀리를 구성한다.GRKs 매개 수용체 인산화 작용은 수용체 시그널링 및 탈감작의 심각한 장애를 빠르게 일으킨다.GRKs 및 세포내 표적화 활동은 수용체 도메인, G단백질 서브유닛, 지질, 정착단백질 및 칼슘 감수성 [54]단백질과의 상호작용에 의해 엄격하게 조절된다.
수용체의 인산화에는 두 가지 결과가 있을 수 있다.
- 이행 장소:수용체는 그것이 박혀 있는 막의 일부와 함께 세포 내부로 가져와 산성 소포 환경[55] 내에서 탈인산화되었다가 다시 가져온다.이 메커니즘은 예를 들어 호르몬에 대한 장기 노출을 조절하기 위해 사용되며, 리센시제이션이 탈감작에 이어 이루어지도록 허용한다.또는 수용체는 용융체 분해를 겪거나 내부화된 채로 있을 수 있으며, 내부화된 소포의 세포하 [52]국소에 따라 달라지는 신호 전달 이벤트의 개시에 관여하는 것으로 생각된다.
- Arestin 링크:인산화 수용체는 G 단백질의 결합(및 활성화)을 방지하는 아레스틴 분자와 연결될 수 있으며, 사실상 단기간 동안 이를 끌 수 있습니다.예를 들어, 이 메커니즘은 밝은 빛에 노출되는 것을 보상하기 위해 망막 세포에 있는 로돕신과 함께 사용됩니다.많은 경우에, 수용체에 대한 아레스틴 결합은 전위 필요조건이다.예를 들어 β-아레스틴은2 클래트린 및 AP2(클라트린 어댑터 분자)의 베타 서브유닛과의 결합을 위한 어댑터로서 작용하며, 따라서 아레스틴은 β-아드레놀2 [56][57]수용체의 클래트린 매개 엔도사이토시스(endocytosis)에 필요한 성분을 조립하는 발판으로서 작용한다.
GPCR 신호 종료 메커니즘
앞에서 설명한 바와 같이 G-단백질은 고유의 GTP→GDP 가수분해 능력으로 인해 자체 활성화를 종료할 수 있다.단, 이 반응은 느린 속도(초당 0.02배)로 진행되기 때문에 다른 요인이 작용하지 않으면 단일 G단백질이 비활성화되기까지 약 50초가 소요됩니다.실제로 GAP 도메인을 통해 Gα에 결합되었을 때 가수분해 속도가 초당 30배 이상으로 빨라지는 약 30개의 RGS 단백질이 있다.이 1500배 속도의 증가는 생성 가능한 세컨드 메신저의 양이 제한되고 G단백질이 0.03초 만에 확산할 수 있는 거리가 제한되어 있기 때문에 셀이 외부 신호에 고속으로 응답할 수 있을 뿐만 아니라 공간 분해능을 가능하게 한다.대부분의 경우, RGS 단백질은 G-단백질을 활성화하는 능력에 있어 문란하지만, 어떤 RGS가 주어진 시그널링 경로에 관여하는지는 다른 어떤 조직과 GPCR에 의해 더 결정되는 것으로 보인다.또한 RGS 단백질은 GPCR에서의 GTP-GDP 교환 속도를 증가시키는 부가적인 기능을 가지고 있으며(즉, 일종의 co-GEF로서) GPCR 시그널링의 시간 분해능에 더욱 기여한다.
또한 GPCR은 그 자체로 감도가 저하될 수 있다.이 문제는 다음과 같이 발생합니다.
- 배위자 점유의 직접적인 결과로서, 배위 변화에 따라 IL-3 및 C 말단 꼬리의 다양한 세린/트레오닌 잔기를 인산화시키는 GPCR-Regulating Kinase(GRK)의 모집이 가능해진다.GRK 인산화 시, β-아레스틴(대부분의 조직에서는 β-아레스틴-1/2)에 대한 GPCR의 친화력이 증가하며, 이때 β-아레스틴은 G-단백질 결합을 입체적으로 저해하고 클라트린 매개 엔도사이토시스(Clathrin-mediated endocytosisisisisis)를 통한 수용체 내화 과정을 시작할 수 있다.결합 수용체만이 이 메커니즘에 의해 감작 해제되기 때문에, 상동성 감작이라고 불린다.
- β-아레스틴에 대한 친화력은 PKC 및 PKA에 의한 서로 다른 ser/thr 부위(IL-3 및 C 말단 꼬리)의 인산화를 통해 리간드 직업 및 GRK 비의존적 방식으로 증가할 수 있다.이러한 인산화들은 종종 G-단백질 결합 자체를 손상시키기에 충분하다.[58]
- 대신 PKC/PKA는 GRK를 인산화시킬 수 있으며, 이는 또한 직업의존적인 방식으로 GPCR 인산화 및 β-아레스틴 결합을 초래할 수 있다.이러한 후자의 두 가지 메커니즘은 다른 사람들의 활동으로 인해 하나의 GPCR의 감작성 또는 이종감작성을 허용한다.GRK는 또한 GAP 도메인을 가질 수 있으며, 따라서 비키나아제 메커니즘을 통해 불활성화에 기여할 수도 있다.이러한 메커니즘의 조합도 발생할 수 있습니다.
일단 β-아레스틴이 GPCR에 결합되면, 그것은 AP-2라고 불리는 어댑터 복합체의 발판 단백질로 기능할 수 있는 구조 변화를 겪으며, 이는 다시 클라트린이라고 불리는 또 다른 단백질을 모집한다.국소적으로 충분한 수용체가 이러한 방식으로 클라트린을 모집하면, 옵소닌화라고 불리는 과정에서 클라트린 분자 간의 상호작용의 결과로 막이 내향적으로 형성된다.일단 암피피신과 다이나민이라고 불리는 두 개의 다른 단백질의 작용으로 인해 혈장막에서 피트(pit)가 분리되면, 그것은 이제 세포내 소포이다.이 시점에서 어댑터 분자와 클래트린은 분리되며, 수용체는 플라즈마 막에 다시 전달되거나 분해하기 위해 리소좀을 목표로 한다.
β-아레스틴은 또한 예를 들어 작은 GTPase, RASK, RASK의 인산화를 통해 ERK1/2 또는 다른 마이트젠 활성화 단백질 키나제(MAPK) 시그널링을 활성화시킬 수 있는 비수용체 티로신 키나제(nRTK), c-SRC와 같은 다른 단백질을 모집할 수 있다.EK, ERK-1/2)는 서로 근접하기 때문에 시그널링이 개시됩니다.c-SRC의 또 다른 표적은 엔도사이토시스(endocytosis)에 관여하는 다이너민 분자이다.유입되는 소포의 목 주위에 다이나믹스가 중합되고 c-SRC에 의한 인산화 작용은 구조 변화에 필요한 에너지를 제공하여 막에서 최종적인 "고정"을 가능하게 합니다.
GPCR세포조절
수용체 탈감작성은 위와 같이 조합인산화, β-arr 결합 및 세포내구증(Endocytosis)을 통해 매개된다.다운 레귤레이터는 엔도솜에 세포내 수용체가 내장되어 리소좀이라고 불리는 세포소기관과의 결합을 위해 운반될 때 발생한다.리소좀막은 양성자 펌프가 풍부하기 때문에 내부는 낮은 pH(pH77.2 세포질 대비 pH74.8)를 가지며, 이는 GPCR을 변성시키는 역할을 한다.또한 리소좀은 낮은 pH에서만 기능할 수 있는 단백질 분해효소를 포함한 많은 분해효소를 포함하므로 GPCR의 잔류물을 함께 결합하는 펩타이드 결합을 분해할 수 있다.주어진 수용체가 리소좀에 전달될지, 엔도솜에 저장될지, 또는 혈장막으로 다시 전달될지는 수용체 유형과 신호의 크기를 포함한 다양한 요인에 의해 결정됩니다.GPCR 조절은 유전자 전사 인자에 의해 추가로 매개된다.이러한 인자는 유전자 전사를 증가시키거나 감소시킬 수 있으며, 따라서 세포막으로 이동하는 새로운 수용체(업 또는 다운 조절)의 생성을 증가시키거나 감소시킬 수 있다.
수용체 올리고머화
G-단백질 결합 수용체 올리고머화는 광범위한 현상이다.가장 잘 연구된 예 중 하나는 메타로피성B GABA 수용체이다.이른바 구성B 수용체는 GABAR1B 및 GABAR2 서브유닛의 헤테로다이머화에 의해 형성된다.이종계에서의 GABAR2가B 없는B GABAR1의 발현에 의해 서브유닛이 소포체 내에 유지된다.한편 GABAR2B 서브유닛의 발현만으로도 서브유닛의 표면발현으로 이어진다(즉 수용체는 작용제와 결합하지 않으며 작용제에 대한 노출 후 반응을 개시할 수 없다).두 서브유닛의 발현은 기능성 수용체의 혈장막 발현으로 이어진다.GAB는, GAB는,GABAR1에B 대한 AR2 결합은B 기능성 [60]수용체의 유지[59] 신호를 마스킹한다.
슈퍼패밀리의 기원과 다양화
GPCR의 슈퍼패밀리에 의해 매개되는 신호 전달은 다세포성의 기원으로 거슬러 올라간다.포유류와 유사한 GPCR은 균류에서 발견되며, GPCR [16]지문에 기초한 GRAFS 분류 체계에 따라 분류되었다.진핵생물 영역에 걸친 슈퍼패밀리의 식별과 패밀리 고유의 모티브의 비교는 GPCR의 슈퍼패밀리가 공통의 [61]기원을 가지고 있음을 보여주었다.특징적인 모티브는 5개의 GRAFS 패밀리 중 Rodopsin, 접착, Frizled 등 3개가 Opisthokonts가 분할되기 전에 Dictyostelium discoideum cAMP 수용체에서 진화했음을 나타낸다.이후 시크리틴 계열은 선충이 [16]분열되기 전에 접착성 GPCR 수용체 계열에서 진화했다.곤충 GPCRs는 그들 자신의 그룹에 속하는 것으로 보이며, Taste2는 [61]Rodopsin에서 내려오는 것으로 식별된다.시크릿인/접착 분할은 시그니처가 아닌 추정된 기능에 근거하고 있습니다.이는 연구에서 양쪽을 식별하기 위해 Class B(7tm_2, Pfam PF00002)가 사용되기 때문입니다.
「 」를 참조해 주세요.
- G단백질결합수용체 데이터베이스
- MeSH 코드 목록 (D12.776)
- 메타트로픽수용체
- 고아수용체
- GPCR을 대상으로 하는 약물 후보군인 펩두신류
- 합성 GPCR을 통한 세포 시그널링 제어 기술인 합성 리간드에 의해서만 활성화되는 수용체
- TOG 슈퍼 패밀리
레퍼런스
- ^ a b Cherezov V, Rosenbaum DM, Hanson MA, Rasmussen SG, Thian FS, Kobilka TS, et al. (November 2007). "High-resolution crystal structure of an engineered human beta2-adrenergic G protein-coupled receptor". Science. 318 (5854): 1258–65. Bibcode:2007Sci...318.1258C. doi:10.1126/science.1150577. PMC 2583103. PMID 17962520.
- ^ a b c d e Trzaskowski B, Latek D, 얀 S, Ghoshdastider U, Debinski A, Filipek S(2012년)."분자 스위치의 GPCRs에 액션과 실험 이론적 연구".현재 약용 화학 19일(8):1090–109. doi:10.2174/092986712799320556.PMC3343417.PMID 22300046.텍스트는 저작자 표시 2.5제네릭(CC2.5. 왜냐하면)2월 22일 2011년 승객을 기계 면허증에 Archived에서 이용할 수 있다 이 원본에서 복사되었다.
- ^ King N, Hittinger CT, Carroll SB (July 2003). "Evolution of key cell signaling and adhesion protein families predates animal origins". Science. 301 (5631): 361–3. Bibcode:2003Sci...301..361K. doi:10.1126/science.1083853. PMID 12869759. S2CID 9708224.
- ^ a b Gilman AG (1987). "G proteins: transducers of receptor-generated signals". Annual Review of Biochemistry. 56 (1): 615–49. doi:10.1146/annurev.bi.56.070187.003151. PMID 3113327.
- ^ a b Wettschureck N, Offermanns S (October 2005). "Mammalian G proteins and their cell type specific functions". Physiological Reviews. 85 (4): 1159–204. doi:10.1152/physrev.00003.2005. PMID 16183910.
- ^ a b Hauser AS, Chavali S, Masuho I, Jahn LJ, Martemyanov KA, Gloriam DE, Babu MM (January 2018). "Pharmacogenomics of GPCR Drug Targets". Cell. 172 (1–2): 41–54.e19. doi:10.1016/j.cell.2017.11.033. PMC 5766829. PMID 29249361.
- ^ Royal Swedish Academy of Sciences (10 October 2012). "The Nobel Prize in Chemistry 2012 Robert J. Lefkowitz, Brian K. Kobilka". Retrieved 10 October 2012.
- ^ Lindsley CW (June 2013). "The top prescription drugs of 2012 globally: biologics dominate, but small molecule CNS drugs hold on to top spots". ACS Chemical Neuroscience. 4 (6): 905–7. doi:10.1021/cn400107y. PMC 3689196. PMID 24024784.
- ^ a b c Bjarnadóttir TK, Gloriam DE, Hellstrand SH, Kristiansson H, Fredriksson R, Schiöth HB (September 2006). "Comprehensive repertoire and phylogenetic analysis of the G protein-coupled receptors in human and mouse". Genomics. 88 (3): 263–73. doi:10.1016/j.ygeno.2006.04.001. PMID 16753280.
- ^ "keyword:"G-protein coupled receptor [KW-0297]" AND organism:"Homo sapiens (Human) [9606]" in UniProtKB". www.uniprot.org. Archived from the original on 15 September 2020. Retrieved 24 June 2019.
- ^ Joost P, Methner A (October 2002). "Phylogenetic analysis of 277 human G-protein-coupled receptors as a tool for the prediction of orphan receptor ligands". Genome Biology. 3 (11): RESEARCH0063. doi:10.1186/gb-2002-3-11-research0063. PMC 133447. PMID 12429062.
- ^ Attwood TK, Findlay JB (February 1994). "Fingerprinting G-protein-coupled receptors". Protein Engineering. 7 (2): 195–203. doi:10.1093/protein/7.2.195. PMID 8170923.
- ^ Kolakowski LF (1994). "GCRDb: a G-protein-coupled receptor database". Receptors & Channels. 2 (1): 1–7. PMID 8081729.
- ^ Foord SM, Bonner TI, Neubig RR, Rosser EM, Pin JP, Davenport AP, et al. (June 2005). "International Union of Pharmacology. XLVI. G protein-coupled receptor list". Pharmacological Reviews. 57 (2): 279–88. doi:10.1124/pr.57.2.5. PMID 15914470. S2CID 34541683.
- ^ "InterPro". Archived from the original on 21 February 2008. Retrieved 10 December 2007.
- ^ a b c Krishnan A, Almén MS, Fredriksson R, Schiöth HB (2012). Xue C (ed.). "The origin of GPCRs: identification of mammalian like Rhodopsin, Adhesion, Glutamate and Frizzled GPCRs in fungi". PLOS ONE. 7 (1): e29817. Bibcode:2012PLoSO...729817K. doi:10.1371/journal.pone.0029817. PMC 3251606. PMID 22238661.
- ^ Vassilatis DK, Hohmann JG, Zeng H, Li F, Ranchalis JE, Mortrud MT, et al. (April 2003). "The G protein-coupled receptor repertoires of human and mouse". Proceedings of the National Academy of Sciences of the United States of America. 100 (8): 4903–8. Bibcode:2003PNAS..100.4903V. doi:10.1073/pnas.0230374100. PMC 153653. PMID 12679517.
- ^ Xiao X, Wang P, Chou KC (July 2009). "GPCR-CA: A cellular automaton image approach for predicting G-protein-coupled receptor functional classes". Journal of Computational Chemistry. 30 (9): 1414–23. doi:10.1002/jcc.21163. PMID 19037861. S2CID 813484. Archived from the original on 9 April 2017.
- ^ Qiu JD, Huang JH, Liang RP, Lu XQ (July 2009). "Prediction of G-protein-coupled receptor classes based on the concept of Chou's pseudo amino acid composition: an approach from discrete wavelet transform". Analytical Biochemistry. 390 (1): 68–73. doi:10.1016/j.ab.2009.04.009. PMID 19364489.
- ^ Gu Q, Ding YS, Zhang TL (May 2010). "Prediction of G-protein-coupled receptor classes in low homology using Chou's pseudo amino acid composition with approximate entropy and hydrophobicity patterns". Protein and Peptide Letters. 17 (5): 559–67. doi:10.2174/092986610791112693. PMID 19594431.
- ^ Saroz Y, Kho DT, Glass M, Graham ES, Grimsey NL (December 2019). "Cannabinoid Receptor 2 (CB2) Signals via G-alpha-s and Induces IL-6 and IL-10 Cytokine Secretion in Human Primary Leukocytes". ACS Pharmacology & Translational Science. 2 (6): 414–428. doi:10.1021/acsptsci.9b00049. PMC 7088898. PMID 32259074.
- ^ Sharma N, Akhade AS, Qadri A (April 2013). "Sphingosine-1-phosphate suppresses TLR-induced CXCL8 secretion from human T cells". Journal of Leukocyte Biology. 93 (4): 521–8. doi:10.1189/jlb.0712328. PMID 23345392. S2CID 21897008.
- ^ Hazell GG, Hindmarch CC, Pope GR, Roper JA, Lightman SL, Murphy D, et al. (January 2012). "G protein-coupled receptors in the hypothalamic paraventricular and supraoptic nuclei--serpentine gateways to neuroendocrine homeostasis". Frontiers in Neuroendocrinology. 33 (1): 45–66. doi:10.1016/j.yfrne.2011.07.002. PMC 3336209. PMID 21802439.
- ^ Dorsam RT, Gutkind JS (February 2007). "G-protein-coupled receptors and cancer". Nature Reviews. Cancer. 7 (2): 79–94. doi:10.1038/nrc2069. PMID 17251915. S2CID 10996598.
- ^ Venkatakrishnan AJ, Deupi X, Lebon G, Tate CG, Schertler GF, Babu MM (February 2013). "Molecular signatures of G-protein-coupled receptors". Nature. 494 (7436): 185–94. Bibcode:2013Natur.494..185V. doi:10.1038/nature11896. PMID 23407534. S2CID 4423750.
- ^ Hollenstein K, de Graaf C, Bortolato A, Wang MW, Marshall FH, Stevens RC (January 2014). "Insights into the structure of class B GPCRs". Trends in Pharmacological Sciences. 35 (1): 12–22. doi:10.1016/j.tips.2013.11.001. PMC 3931419. PMID 24359917.
- ^ Palczewski K, Kumasaka T, Hori T, Behnke CA, Motoshima H, Fox BA, et al. (August 2000). "Crystal structure of rhodopsin: A G protein-coupled receptor". Science. 289 (5480): 739–45. Bibcode:2000Sci...289..739P. CiteSeerX 10.1.1.1012.2275. doi:10.1126/science.289.5480.739. PMID 10926528.
- ^ Rasmussen SG, Choi HJ, Rosenbaum DM, Kobilka TS, Thian FS, Edwards PC, et al. (November 2007). "Crystal structure of the human beta2 adrenergic G-protein-coupled receptor". Nature. 450 (7168): 383–7. Bibcode:2007Natur.450..383R. doi:10.1038/nature06325. PMID 17952055. S2CID 4407117.
- ^ Rosenbaum DM, Cherezov V, Hanson MA, Rasmussen SG, Thian FS, Kobilka TS, et al. (November 2007). "GPCR engineering yields high-resolution structural insights into beta2-adrenergic receptor function". Science. 318 (5854): 1266–73. Bibcode:2007Sci...318.1266R. doi:10.1126/science.1150609. PMID 17962519. S2CID 1559802.
- ^ Rasmussen SG, Choi HJ, Fung JJ, Pardon E, Casarosa P, Chae PS, et al. (January 2011). "Structure of a nanobody-stabilized active state of the β(2) adrenoceptor". Nature. 469 (7329): 175–80. Bibcode:2011Natur.469..175R. doi:10.1038/nature09648. PMC 3058308. PMID 21228869.
- ^ Rosenbaum DM, Zhang C, Lyons JA, Holl R, Aragao D, Arlow DH, et al. (January 2011). "Structure and function of an irreversible agonist-β(2) adrenoceptor complex". Nature. 469 (7329): 236–40. Bibcode:2011Natur.469..236R. doi:10.1038/nature09665. PMC 3074335. PMID 21228876.
- ^ Warne T, Moukhametzianov R, Baker JG, Nehmé R, Edwards PC, Leslie AG, et al. (January 2011). "The structural basis for agonist and partial agonist action on a β(1)-adrenergic receptor". Nature. 469 (7329): 241–4. Bibcode:2011Natur.469..241W. doi:10.1038/nature09746. PMC 3023143. PMID 21228877.
- ^ Xu F, Wu H, Katritch V, Han GW, Jacobson KA, Gao ZG, et al. (April 2011). "Structure of an agonist-bound human A2A adenosine receptor". Science. 332 (6027): 322–7. Bibcode:2011Sci...332..322X. doi:10.1126/science.1202793. PMC 3086811. PMID 21393508.
- ^ Rasmussen SG, DeVree BT, Zou Y, Kruse AC, Chung KY, Kobilka TS, et al. (July 2011). "Crystal structure of the β2 adrenergic receptor-Gs protein complex". Nature. 477 (7366): 549–55. Bibcode:2011Natur.477..549R. doi:10.1038/nature10361. PMC 3184188. PMID 21772288.
- ^ Yamauchi T, Kamon J, Ito Y, Tsuchida A, Yokomizo T, Kita S, et al. (June 2003). "Cloning of adiponectin receptors that mediate antidiabetic metabolic effects". Nature. 423 (6941): 762–9. Bibcode:2003Natur.423..762Y. doi:10.1038/nature01705. PMID 12802337. S2CID 52860797.
- ^ a b Qin K, Dong C, Wu G, Lambert NA (August 2011). "Inactive-state preassembly of G(q)-coupled receptors and G(q) heterotrimers". Nature Chemical Biology. 7 (10): 740–7. doi:10.1038/nchembio.642. PMC 3177959. PMID 21873996.
- ^ Lohse MJ, Benovic JL, Codina J, Caron MG, Lefkowitz RJ (June 1990). "beta-Arrestin: a protein that regulates beta-adrenergic receptor function". Science. 248 (4962): 1547–50. Bibcode:1990Sci...248.1547L. doi:10.1126/science.2163110. PMID 2163110.
- ^ Luttrell LM, Lefkowitz RJ (February 2002). "The role of beta-arrestins in the termination and transduction of G-protein-coupled receptor signals". Journal of Cell Science. 115 (Pt 3): 455–65. doi:10.1242/jcs.115.3.455. hdl:10161/7805. PMID 11861753.
- ^ Cahill TJ, Thomsen AR, Tarrasch JT, Plouffe B, Nguyen AH, Yang F, et al. (March 2017). "Distinct conformations of GPCR-β-arrestin complexes mediate desensitization, signaling, and endocytosis". Proceedings of the National Academy of Sciences of the United States of America. 114 (10): 2562–2567. doi:10.1073/pnas.1701529114. PMC 5347553. PMID 28223524.
- ^ Kumari P, Srivastava A, Banerjee R, Ghosh E, Gupta P, Ranjan R, et al. (November 2016). "Functional competence of a partially engaged GPCR-β-arrestin complex". Nature Communications. 7: 13416. Bibcode:2016NatCo...713416K. doi:10.1038/ncomms13416. PMC 5105198. PMID 27827372.
- ^ Thomsen AR, Plouffe B, Cahill TJ, Shukla AK, Tarrasch JT, Dosey AM, et al. (August 2016). "GPCR-G Protein-β-Arrestin Super-Complex Mediates Sustained G Protein Signaling". Cell. 166 (4): 907–919. doi:10.1016/j.cell.2016.07.004. PMC 5418658. PMID 27499021.
- ^ Nguyen AH, Thomsen AR, Cahill TJ, Huang R, Huang LY, Marcink T, et al. (December 2019). "Structure of an endosomal signaling GPCR-G protein-β-arrestin megacomplex". Nature Structural & Molecular Biology. 26 (12): 1123–1131. doi:10.1038/s41594-019-0330-y. PMC 7108872. PMID 31740855.
- ^ Millar RP, Newton CL (January 2010). "The year in G protein-coupled receptor research". Molecular Endocrinology. 24 (1): 261–74. doi:10.1210/me.2009-0473. PMC 5428143. PMID 20019124.
- ^ Brass LF (September 2003). "Thrombin and platelet activation". Chest. 124 (3 Suppl): 18S–25S. doi:10.1378/chest.124.3_suppl.18S. PMID 12970120. S2CID 22279536.
- ^ Digby GJ, Lober RM, Sethi PR, Lambert NA (November 2006). "Some G protein heterotrimers physically dissociate in living cells". Proceedings of the National Academy of Sciences of the United States of America. 103 (47): 17789–94. Bibcode:2006PNAS..10317789D. doi:10.1073/pnas.0607116103. PMC 1693825. PMID 17095603.
- ^ Rubenstein LA, Lanzara RG (1998). "Activation of G protein-coupled receptors entails cysteine modulation of agonist binding". Journal of Molecular Structure: Theochem. 430: 57–71. doi:10.1016/S0166-1280(98)90217-2. Archived from the original on 16 May 2011. Retrieved 14 January 2006.
- ^ Teoh CM, Tam JK, Tran T (2012). "Integrin and GPCR Crosstalk in the Regulation of ASM Contraction Signaling in Asthma". Journal of Allergy. 2012: 341282. doi:10.1155/2012/341282. PMC 3465959. PMID 23056062.
- ^ Smith JS, Nicholson LT, Suwanpradid J, Glenn RA, Knape NM, Alagesan P, et al. (November 2018). "Biased agonists of the chemokine receptor CXCR3 differentially control chemotaxis and inflammation". Science Signaling. 11 (555): eaaq1075. doi:10.1126/scisignal.aaq1075. PMC 6329291. PMID 30401786.
- ^ Kim JY, Haastert PV, Devreotes PN (April 1996). "Social senses: G-protein-coupled receptor signaling pathways in Dictyostelium discoideum". Chemistry & Biology. 3 (4): 239–43. doi:10.1016/S1074-5521(96)90103-9. PMID 8807851.
- ^ Duchene J, Schanstra JP, Pecher C, Pizard A, Susini C, Esteve JP, et al. (October 2002). "A novel protein-protein interaction between a G protein-coupled receptor and the phosphatase SHP-2 is involved in bradykinin-induced inhibition of cell proliferation". The Journal of Biological Chemistry. 277 (43): 40375–83. doi:10.1074/jbc.M202744200. PMID 12177051.
- ^ Chen-Izu Y, Xiao RP, Izu LT, Cheng H, Kuschel M, Spurgeon H, Lakatta EG (November 2000). "G(i)-dependent localization of beta(2)-adrenergic receptor signaling to L-type Ca(2+) channels". Biophysical Journal. 79 (5): 2547–56. doi:10.1016/S0006-3495(00)76495-2. PMC 1301137. PMID 11053129.
- ^ a b Tan CM, Brady AE, Nickols HH, Wang Q, Limbird LE (2004). "Membrane trafficking of G protein-coupled receptors". Annual Review of Pharmacology and Toxicology. 44 (1): 559–609. doi:10.1146/annurev.pharmtox.44.101802.121558. PMID 14744258.
- ^ Santulli G, Trimarco B, Iaccarino G (March 2013). "G-protein-coupled receptor kinase 2 and hypertension: molecular insights and pathophysiological mechanisms". High Blood Pressure & Cardiovascular Prevention. 20 (1): 5–12. doi:10.1007/s40292-013-0001-8. PMID 23532739. S2CID 45674941.
- ^ Penela P, Ribas C, Mayor F (November 2003). "Mechanisms of regulation of the expression and function of G protein-coupled receptor kinases". Cellular Signalling. 15 (11): 973–81. doi:10.1016/S0898-6568(03)00099-8. PMID 14499340.
- ^ Krueger KM, Daaka Y, Pitcher JA, Lefkowitz RJ (January 1997). "The role of sequestration in G protein-coupled receptor resensitization. Regulation of beta2-adrenergic receptor dephosphorylation by vesicular acidification". The Journal of Biological Chemistry. 272 (1): 5–8. doi:10.1074/jbc.272.1.5. PMID 8995214.
- ^ Laporte SA, Oakley RH, Holt JA, Barak LS, Caron MG (July 2000). "The interaction of beta-arrestin with the AP-2 adaptor is required for the clustering of beta 2-adrenergic receptor into clathrin-coated pits". The Journal of Biological Chemistry. 275 (30): 23120–6. doi:10.1074/jbc.M002581200. PMID 10770944.
- ^ Laporte SA, Oakley RH, Zhang J, Holt JA, Ferguson SS, Caron MG, Barak LS (March 1999). "The beta2-adrenergic receptor/betaarrestin complex recruits the clathrin adaptor AP-2 during endocytosis". Proceedings of the National Academy of Sciences of the United States of America. 96 (7): 3712–7. Bibcode:1999PNAS...96.3712L. doi:10.1073/pnas.96.7.3712. PMC 22359. PMID 10097102.
- ^ Tobin AB (March 2008). "G-protein-coupled receptor phosphorylation: where, when and by whom". British Journal of Pharmacology. 153 Suppl 1: S167–76. doi:10.1038/sj.bjp.0707662. PMC 2268057. PMID 18193069.
- ^ Margeta-Mitrovic M, Jan YN, Jan LY (July 2000). "A trafficking checkpoint controls GABA(B) receptor heterodimerization". Neuron. 27 (1): 97–106. doi:10.1016/S0896-6273(00)00012-X. PMID 10939334. S2CID 15430860.
- ^ White JH, Wise A, Main MJ, Green A, Fraser NJ, Disney GH, et al. (December 1998). "Heterodimerization is required for the formation of a functional GABA(B) receptor". Nature. 396 (6712): 679–82. Bibcode:1998Natur.396..679W. doi:10.1038/25354. PMID 9872316. S2CID 4406311.
- ^ a b Nordström KJ, Sällman Almén M, Edstam MM, Fredriksson R, Schiöth HB (September 2011). "Independent HHsearch, Needleman--Wunsch-based, and motif analyses reveal the overall hierarchy for most of the G protein-coupled receptor families". Molecular Biology and Evolution. 28 (9): 2471–80. doi:10.1093/molbev/msr061. PMID 21402729.
추가 정보
- Vassilatis DK, Hohmann JG, Zeng H, Li F, Ranchalis JE, Mortrud MT, et al. (April 2003). "The G protein-coupled receptor repertoires of human and mouse". Proceedings of the National Academy of Sciences of the United States of America. 100 (8): 4903–8. Bibcode:2003PNAS..100.4903V. doi:10.1073/pnas.0230374100. PMC 153653. PMID 12679517.
- "GPCR Reference Library". Retrieved 11 August 2008.
Reference for molecular and mathematical models for the initial receptor response
- "The Nobel Prize in Chemistry 2012" (PDF). Retrieved 10 October 2012.
외부 링크
- 미국 국립 의학 도서관(MeSH)의 G-단백질 결합+수용체
- 2015년 4월 3일 Wayback Machine에 GPCR Cell Line 아카이브 완료
- "IUPHAR/BPS Guide to PHARMACOLOGY Database (GPCRs)". IUPHAR Database. University of Edinburgh / International Union of Basic and Clinical Pharmacology. Retrieved 6 February 2019.
- "GPCRdb".
Data, diagrams and web tools for G protein-coupled receptors (GPCRs).
; Munk C, Isberg V, Mordalski S, Harpsøe K, Rataj K, Hauser AS, et al. (July 2016). "GPCRdb: the G protein-coupled receptor database - an introduction". British Journal of Pharmacology. 173 (14): 2195–207. doi:10.1111/bph.13509. PMC 4919580. PMID 27155948. - "G Protein-Coupled Receptors on the NET". Retrieved 10 November 2010.
a classification of GPCRs
- "PSI GPCR Network Center". Archived from the original on 25 July 2013. Retrieved 11 July 2013.
a Protein Structure Initiative:Biology Network Center aimed at determining the 3D structures of representative GPCR family proteins
- GPCR-HGmod Archived 2월 1일 2016년은 승객을 기계 인간의 모든과 짝을 수용체의 3D구조 모델에 GPCR-I-TASSER 파이프 라인 장 J-YangJ장 씨 R, 장 Y(8월 2015년)으로 짐작되는 데이터베이스에."GPCR-I-TASSER:GProtein-Coupled 수용체 구조 모델링에 대한 하이브리드 접근과 인간 게놈에 적용".구조체입니다. 23(8):1538–1549. doi:10.1016/j.str.2015.06.007.PMC 4526412.PMID 26190572.