사이토솔
Cytosol
| 세포생물학 | |
|---|---|
| 동물세포도 | |
 |
세포질 매트릭스 또는 지반플라즘으로도 알려져 있는 시토솔은 세포 안에서 발견되는 액체 중 하나이다([2]세포내액(ICF)).[3]그것은 막으로 칸막이로 나뉜다.예를 들어, 미토콘드리아 매트릭스는 미토콘드리온을 많은 구획으로 분리한다.
진핵세포에서 세포핵은 세포막으로 둘러싸여 있고 세포질의 일부로서 미토콘드리아, 플라스티드, 기타 오르간세포(내부 유체와 구조물은 제외)로 구성된다. 세포핵은 분리되어 있다.따라서 시토솔은 오르가넬 주위에 있는 액체 기질이다.원핵생물에서는 신진대사의 화학반응의 대부분이 세포솔에서 일어나는 반면, 몇몇은 세포막이나 근막 공간에서 일어난다.진핵생물에서, 많은 신진대사 경로가 여전히 사이토솔에서 발생하는 반면, 다른 것들은 오르가넬 안에서 일어난다.
시토솔은 물에 용해된 물질들의 복잡한 혼합물이다.비록 물이 세포질의 대부분을 형성하지만, 세포 내의 그것의 구조와 성질은 잘 이해되지 않는다.시토솔의 나트륨과 칼륨과 같은 이온의 농도는 세포외 액체와 다르다; 이러한 이온 수준의 차이는 내분비, 신경, 근육 세포와 같은 흥분성 세포의 작용 전위 생성과 같은 과정에서 중요하다.시토솔은 또한 분자의 행동을 변화시킬 수 있는 고분자를 다량으로 함유하고 있는데, 이는 고분자 혼잡을 통해 분자의 행동을 변화시킬 수 있다.
한때는 단순한 분자의 해결책이라고 생각되었지만, 시토솔은 여러 단계의 조직을 가지고 있다.칼슘과 같은 작은 분자의 농도 구배, 함께 작용하고 대사 경로에 참여하는 효소의 큰 복합체, 세포솔의 일부를 감싸고 분리하는 프로테아솜, 카르복시솜 등의 단백질 복합체 등이 그것이다.
정의
시토솔이라는 용어는 1965년 H. A. 라디가 처음 도입했으며, 처음에는 세포가 분열되고 초밀접리화 작용에 의해 불용성 성분이 모두 투과되어 생성되는 액체를 가리켰다.[4][5]그러한 수용성 세포 추출물은 세포 세포질의 수용성 부분과 동일하지 않으며 보통 세포질 분율이라고 불린다.[6]
시토솔이라는 용어는 이제 온전한 세포에서 세포질의 액체 단계를 가리키는 말로 쓰인다.[6]이것은 오르가넬 내에 포함된 세포질의 어떤 부분을 제외한다.[7]세포의 추출물과 온전한 세포에서 세포질의 수용성 부분을 모두 지칭하는 '사이토솔'이라는 단어의 사용 간 혼동 가능성 때문에 살아있는 세포의 세포질의 액체 성분을 설명하는 데 '수성 세포질'이라는 문구가 사용되어 왔다.[5]
이에 앞서 효소체를 포함한 다른 용어는 [8]세포액의 성질이 그다지 명확하지 않았기 때문에 항상 동의어는 아니지만 세포액에 사용되었다(원형체 참조).[6]
속성 및 구성
세포 부피 중 세포 부피의 비율은 다양하다. 예를 들어 이 구획이 박테리아에서 세포 구조의 대부분을 형성하는 반면,[9] 식물 세포에서 주요 구획은 큰 중앙 빈쿠올이다.[10]시토솔은 대부분 물, 용해 이온, 작은 분자, 그리고 큰 수용성 분자(단백질 등)로 이루어져 있다.이들 비단백질 분자의 대다수는 분자량이 300Da 미만이다.[11]신진대사(대사물)에 관여하는 분자의 다양성이 어마어마하기 때문에 이 작은 분자의 혼합은 매우 복잡하다.예를 들어, 비록 이 모든 것이 같은 종이나 단일 세포에 존재하지는 않겠지만, 최대 20만 개의 서로 다른 작은 분자들이 식물에서 만들어질 수 있다.[12]대장균, 제빵 효모 등 단일 세포 내 대사물 수를 추정하면 1000명 미만이 만들어질 것으로 예측한다.[13][14]
물
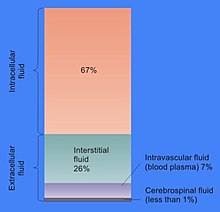
시토솔의 대부분은 물인데, 이것은 전형적인 세포의 총 부피의 약 70%를 차지한다.[15]세포내 액체의 pH는 [16]7.4인 반면 인간의 세포질 pH는 7.0~7.4이며, 일반적으로 세포가 성장 중인 경우 더 높다.[17]시토플라즘의 점도는 이 액체를 통한 작은 분자의 확산이 순수한 물에서보다 약 4배 느리지만 대부분 시토솔의 많은 고분자와의 충돌로 인해 순수한 물과 거의 같다.[18]브라인새우 연구는 물이 세포 기능에 어떻게 영향을 미치는지 연구했다; 이것들은 세포 내 물의 양이 20% 감소하면 신진대사가 억제되고, 세포가 마르면 신진대사가 점진적으로 감소하며, 수심이 정상보다 70%에 도달하면 모든 대사 활동이 중단된다는 것을 보았다.[5]
물은 생명에 필수적이지만, 핵자기공명분광법 같은 방법은 물의 평균 구조에 대한 정보만을 제공하고, 미세한 규모로 국소적 변동을 측정할 수 없기 때문에, 시토솔에 있는 이 물의 구조는 잘 이해되지 않는다.물이 수소 결합을 통해 물 군집 같은 구조를 형성할 수 있는 능력 때문에 순수한 물의 구조조차 제대로 파악되지 못하고 있다.[19]
세포에서 물의 고전적인 견해는 이 물의 약 5%가 용해수로서 용해수나 고분자에 의해 강하게 결합되어 있는 반면, 대다수는 순수한 물과 동일한 구조를 가지고 있다는 것이다.[5]이 용해수는 삼투에 활성이 없고 용해 성질이 다를 수 있으므로 용해된 분자는 배제되고 다른 분자는 농축된다.[20][21]그러나 다른 이들은 세포의 고농도 고분자의 영향이 세포질 전체로 확장되며 세포의 물은 희석액에서 물과 매우 다르게 작용한다고 주장한다.[22]이러한 아이디어는 세포가 세포의 다른 부분의 구조와 기능에 광범위한 영향을 미칠 수 있는 저밀도 및 고밀도 물의 구역을 포함한다는 제안을 포함한다.[19][23]그러나, 살아있는 세포에서 물의 이동성을 직접 측정하기 위한 첨단 핵자기공명법을 사용하는 것은, 세포수의 85%가 그 순수한 물처럼 작용하는 반면, 나머지는 이동성이 떨어지고 아마도 고분자에 묶여 있다는 것을 암시하기 때문에, 이러한 생각과는 모순된다.[24]
이온스
시토솔의 다른 이온의 농도는 세포외액과 상당히 다르며, 시토솔 역시 세포구조의 외부보다 단백질과 핵산 등 전하 고분자를 훨씬 많이 함유하고 있다.
| 이온 | 농도(밀리몰라) | |
|---|---|---|
| 사이토솔로 | 인플라즈마 | |
| 칼륨 | 139–150[25][26] | 4 |
| 나트륨 | 12 | 145 |
| 염화물 | 4 | 116 |
| 중탄산염 | 12 | 29 |
| 단백질 내 아미노산 | 138 | 9 |
| 마그네슘 | 0.8 | 1.5 |
| 칼슘 | <0.0002 | 1.8 |
세포외액과 대조적으로 시토솔은 칼륨 이온의 농도가 높고 나트륨 이온의 농도가 낮다.[27]이온 농도의 차이는 삼모세포에 매우 중요하다. 이온 농도가 세포 내부에서 외부와 같다면 세포 내부의 고분자 수준이 외부 수준보다 높기 때문에 삼모세포에 의해 물이 끊임없이 유입되기 때문이다.대신 나트륨 이온은 배출되고 칼륨 이온인 Na⁺/K⁺-ATPase, 칼륨 이온이 차지하는 칼륨 이온은 칼륨 선택 이온 채널을 통해 농도 구배를 따라 흘러 내려가는데, 이러한 양의 전하의 손실은 음극 전위를 생성한다.이 전위차이의 균형을 맞추기 위해 음의 염화 이온도 선택적 염화 채널을 통해 세포 밖으로 나간다.나트륨과 염화 이온의 상실은 세포 내 유기 분자의 고농도의 삼투학적 효과를 보상한다.[27]
세포는 체토솔에 베타인이나 트레할로스와 같은 삼투방지제를 축적함으로써 훨씬 더 큰 삼투성 변화를 다룰 수 있다.[27]이러한 분자 중 일부는 세포가 완전히 말라죽는 상태로 살아남게 할 수 있고, 유기체가 암호생물증이라고 불리는 가사상태로 들어가도록 할 수 있다.[28]이 상태에서 시토솔과 오스모피보호제는 탈염의 해로운 영향으로부터 단백질과 세포막을 안정시키는 데 도움을 주는 유리 같은 고체가 된다.[29]
시토솔의 칼슘 농도가 낮으면 칼슘 이온이 칼슘 신호의 제2의 전달자 역할을 할 수 있다.여기서 호르몬이나 작용전위와 같은 신호는 칼슘 통로를 열어 칼슘이 사이토솔로 흘러들어가도록 한다.[30]세포질 칼슘의 급격한 증가는 칼모듈린과 단백질 키나아제 C와 같은 다른 신호 분자를 활성화시킨다.[31]염화나 칼륨과 같은 다른 이온도 세포솔에 신호 기능을 가지고 있을 수 있지만, 이것들은 잘 이해되지 않는다.[32]
고분자
세포막이나 세포골격과 결합하지 않는 단백질 분자는 세포골격에 용해된다.세포 내 단백질의 양은 극히 많으며, 사이토솔 부피의 약 20~30%를 점유하면서 200mg/ml에 접근한다.[1]그러나 어떤 단백질은 세포 전체의 세포막이나 오르간ell과 약하게 연관되어 있고 세포 투석 시 용액으로 방출되기 때문에, 온전한 세포의 세포에서 얼마나 많은 단백질이 용해되는지를 정확하게 측정하는 것은 어렵다.[5]실제로 세포의 혈장막을 사포닌을 이용해 조심스럽게 교란시킨 실험에서는 다른 세포막을 손상시키지 않고 세포단백질의 약 4분의 1만 방출되었다.이 세포들은 또한 ATP와 아미노산이 주어지면 단백질을 합성할 수 있었는데, 이는 시토솔의 많은 효소들이 시토스켈레톤에 결합되어 있음을 암시한다.[33]그러나 세포 내 단백질의 대다수가 마이크로 트라베큘러 격자라 불리는 네트워크에 단단히 묶여 있다는 생각은 이제 가능성이 없는 것으로 보인다.[34]
원핵생물에서 사이토솔은 핵으로 알려진 구조 내에 세포의 게놈을 포함한다.[35]이것은 박테리아 염색체와 플라스미드의 전사 및 복제를 제어하는 DNA와 관련 단백질의 불규칙한 질량이다.eukaryotes에서 게놈은 세포핵 내에서 잡히고, 세포핵은 직경 약 10나노미터 이상의 분자의 자유로운 확산을 차단하는 핵 모공에 의해 세포핵으로부터 분리된다.[36]
이처럼 시토솔에 고농축된 고분자는 이동량이 적기 때문에 다른 고분자의 유효농도가 증가하면 고분자 혼잡이라는 효과를 일으킨다.이 혼잡 효과는 세포솔 내 반응의 화학적 평형률과 위치 모두에 큰 변화를 일으킬 수 있다.[1]특히 다수의 단백질이 모여 단백질 복합체를 형성할 때, 또는 DNA 결합 단백질이 게놈에서 그들의 표적과 결합할 때 등 고분자의 연계를 선호하여 분화 상수를 바꾸는 능력에 있어서 중요하다.[37]
조직
비록 세포막에 의해 세포의 구성 요소들이 지역으로 분리되지는 않지만, 이러한 구성 요소들이 항상 무작위로 혼합되는 것은 아니며, 여러 단계의 조직이 특정 분자들을 세포 내에 정의된 부위로 국부화할 수 있다.[38]
농도 구배
비록 작은 분자가 사이토솔에서 빠르게 확산되지만, 집중력 구배는 여전히 이 구획 내에서 생성될 수 있다.잘 연구된 예로는 개방된 칼슘 채널을 중심으로 지역에서 단기간 생산되는 "칼슘 스파크"가 있다.[39]이것들은 직경 약 2마이크로미터로, 비록 몇 개의 불꽃이 합쳐져서 "칼슘 파동"[40]이라고 불리는 더 큰 구배를 형성할 수 있지만, 단 몇 밀리초 동안만 지속된다.산소와 아데노신 3인산염과 같은 다른 작은 분자의 농도 구배는 미토콘드리아 군집 주위의 세포에서 생성될 수 있지만, 이것들은 잘 이해되지는 않는다.[41][42]
단백질 복합체
단백질은 단백질 복합체를 형성하기 위해 연관될 수 있는데, 이것들은 종종 같은 신진대사 경로에서 여러 단계를 수행하는 효소와 같이 유사한 기능을 가진 단백질 세트를 포함한다.[43]이 조직은 기질 채널링을 허용할 수 있는데, 이것은 한 효소의 생산물이 용액으로 방출되지 않고 경로로 바로 다음 효소로 전달되는 것이다.[44]채널링은 효소가 시토솔에 무작위로 분포했을 때보다 더 빠르고 효율적인 경로를 만들 수 있으며, 불안정한 반응 매개체의 방출을 막을 수도 있다.[45]비록 매우 다양한 신진대사 경로가 서로 단단히 묶여 있는 효소를 포함하지만, 다른 것들은 세포 밖에서 연구하기 매우 어려운 더 느슨하게 연관된 복합체를 포함할 수도 있다.[46][47]따라서, 일반적으로 신진대사에 대한 이러한 복합체의 중요성은 여전히 불명확하다.
단백질 컴파트먼트
일부 단백질 복합체에는 큰 중심강이가 들어 있어 시토솔의 나머지 부분으로부터 격리된다.그러한 밀폐된 구획의 한 예는 프로테아솜이다.[48]여기서, 한 세트의 서브유닛은 세포질 단백질을 저하시키는 프로테아제를 함유한 속이 빈 통을 형성한다.이것들은 시토솔의 나머지 부분과 자유롭게 섞이면 손상되기 때문에, 통은 단백질을 분해하도록 지시하는 신호(유비쿼시틴 태그)로 인식하여 단백질을 단백질 용해성 공동에 공급하는 일련의 규제 단백질에 의해 덮인다.[49]
단백질 구획의 또 다른 큰 종류는 세균성 마이크로 컴포넌트인데, 이것은 다양한 효소를 캡슐화하는 단백질 껍질로 만들어진다.[50]이 구획들은 일반적으로 지름이 100~200나노미터 정도 되며 서로 연결된 단백질로 만들어진다.[51]잘 이해된 예가 카복시솜인데, 이 카복시솜에는 루비스 등 탄소 고정과 관련된 효소가 들어 있다.CO.[52]
생체 분자 응축물
비메브레인 결합 유기체는 세포질이나 핵의 콜로이드 위상 분리를 촉진하기 위해 고분자의 군집화, 과점화 또는 중합화에 의해 발생하는 생체 분자 응축물로 형성될 수 있다.
시토스켈레톤 체이빙
비록 사이토스켈레톤은 사이토솔의 일부가 아니지만, 이 필라멘트 네트워크의 존재는 세포 내 큰 입자의 확산을 제한한다.예를 들어, 여러 연구에서 약 25나노미터(리보솜 크기 약)[53]보다 큰 추적기 입자는 세포 가장자리와 핵 옆에 있는 사이토솔의 일부에서 제외되었다.[54][55]이러한 "구획 제외"는 액틴 섬유로 구성된 훨씬 밀도가 높은 메쉬 구조를 시토솔의 나머지 부분보다 더 높을 수 있다.이러한 마이크로도메인은 리보솜이나 오르가넬과 같은 큰 구조물의 분포에 영향을 줄 수 있는데, 이를 일부 영역에서 배제하고 다른 영역에 집중시킴으로써 시토솔 내에서의 분포를 좌우할 수 있다.[56]
함수
시토솔은 단일 기능이 없으며 대신 복수의 세포 과정이 존재하는 곳이다.이러한 과정의 예로는 세포막에서 세포핵과 같은 세포 내의 부위로의 신호 전도가 포함된다.[57][58]이 구획은 또한 체세포 분열에서 핵막이 파괴된 후 사이토키네시스(cytokinesis)의 많은 과정들의 현장이기도 하다.[59]시토솔의 또 다른 주요 기능은 대사물들을 생산지에서 그들이 사용되는 곳으로 운반하는 것이다.이는 세포솔을 통해 빠르게 확산될 수 있는 아미노산 등 수용성 분자의 경우 비교적 간단하다.[18]그러나 지방산이나 스테롤과 같은 소수성 분자는 세포막 사이에서 이러한 분자들을 순환시키는 특정한 결합 단백질에 의해 세포질을 통해 운반될 수 있다.[60][61]세포 내분자에 의해 세포로 흡수되거나 분비되는 길에 있는 분자들은 또한 베시클 내부의 세포솔을 통해 운반될 수 있는데,[62] 이 세포들은 운동 단백질에 의해 세포골격을 따라 이동되는 지질들의 작은 구이다.[63]
시토솔은 원핵생물에서 가장 많은 신진대사를 하는 곳이며,[9] 진핵생물의 대사량이 많은 지역이다.예를 들어 포유류에서는 세포 내 단백질의 약 절반이 세포질에 국부화되어 있다.[64]가장 완전한 데이터는 효모에서 이용할 수 있는데, 여기서 대사 재구성은 대사 과정과 대사물의 대부분이 사이토솔에서 발생한다는 것을 나타낸다.[65]동물의 사이토솔에서 발생하는 주요 대사경로는 단백질 생합성, 펜토오스 인산염 경로, 글리콜리시스, 글루코네제네시스 등이 있다.[66]경로의 국소화는 다른 유기체에서 다를 수 있다. 예를 들어 지방산 합성은 식물의[67][68] 엽록체와 아피콤플렉스의 아피코플라스에서 발생한다.[69]
참조
- ^ a b c Ellis RJ (October 2001). "Macromolecular crowding: obvious but underappreciated". Trends Biochem. Sci. 26 (10): 597–604. doi:10.1016/S0968-0004(01)01938-7. PMID 11590012.
- ^ Cammack, Richard CammackRichard; Atwood, Teresa AtwoodTeresa; Campbell, Peter CampbellPeter; Parish, Howard ParishHoward; Smith, Anthony SmithAnthony; Vella, Frank VellaFrank; Stirling, John StirlingJohn (2006). Cammack, Richard; Atwood, Teresa; Campbell, Peter; Parish, Howard; Smith, Anthony; Vella, Frank; Stirling, John (eds.). "Cytoplasmic matrix". Oxford Dictionary of Biochemistry and Molecular Biology. Oxford University Press. doi:10.1093/acref/9780198529170.001.0001. ISBN 9780198529170.
- ^ Liachovitzky, Carlos (2015). "Human Anatomy and Physiology Preparatory Course" (pdf). CUNY Bronx Community College. CUNY Academic Works. p. 69. Archived from the original on 2017-08-23. Retrieved 2021-06-22.
- ^ 1965년 H. A. Lardy.글루코네제네시스 및 지질제네시스에서의 피리딘 뉴클레오티드 산화환원 반응 방향.In: B가 편집한 에너지 대사 제어.찬스, R. 설정루크, J. R. 윌리엄슨.뉴욕: 학술, 1965년, 페이지 245, [1].
- ^ a b c d e Clegg James S. (1984). "Properties and metabolism of the aqueous cytoplasm and its boundaries". Am. J. Physiol. 246 (2 Pt 2): R133–51. doi:10.1152/ajpregu.1984.246.2.R133. PMID 6364846.
- ^ a b c Cammack, Richard; Teresa Atwood; Attwood, Teresa K.; Campbell, Peter Scott; Parish, Howard I.; Smith, Tony; Vella, Frank; Stirling, John (2006). Oxford dictionary of biochemistry and molecular biology. Oxford [Oxfordshire]: Oxford University Press. ISBN 0-19-852917-1. OCLC 225587597.
- ^ a b Lodish, Harvey F. (1999). Molecular cell biology. New York: Scientific American Books. ISBN 0-7167-3136-3. OCLC 174431482.
- ^ J. 한슈타인(1880).다스 프로토플라즈마.하이델베르크. 페이지 24.
- ^ a b Hoppert M, Mayer F (1999). "Principles of macromolecular organization and cell function in bacteria and archaea". Cell Biochem. Biophys. 31 (3): 247–84. doi:10.1007/BF02738242. PMID 10736750. S2CID 21004307.
- ^ Bowsher CG, Tobin AK (April 2001). "Compartmentation of metabolism within mitochondria and plastids". J. Exp. Bot. 52 (356): 513–27. doi:10.1093/jexbot/52.356.513. PMID 11373301.
- ^ Goodacre R, Vaidyanathan S, Dunn WB, Harrigan GG, Kell DB (May 2004). "Metabolomics by numbers: acquiring and understanding global metabolite data" (PDF). Trends Biotechnol. 22 (5): 245–52. doi:10.1016/j.tibtech.2004.03.007. PMID 15109811. Archived from the original (PDF) on 2008-12-17.
- ^ Weckwerth W (2003). "Metabolomics in systems biology". Annu Rev Plant Biol. 54: 669–89. doi:10.1146/annurev.arplant.54.031902.135014. PMID 14503007. S2CID 1197884.
- ^ Reed JL, Vo TD, Schilling CH, Palsson BO (2003). "An expanded genome-scale model of Escherichia coli K-12 (iJR904 GSM/GPR)". Genome Biol. 4 (9): R54. doi:10.1186/gb-2003-4-9-r54. PMC 193654. PMID 12952533.
- ^ Förster J, Famili I, Fu P, Palsson BØ, Nielsen J (February 2003). "Genome-Scale Reconstruction of the Saccharomyces cerevisiae Metabolic Network". Genome Res. 13 (2): 244–53. doi:10.1101/gr.234503. PMC 420374. PMID 12566402.
- ^ Luby-Phelps K (2000). "Cytoarchitecture and physical properties of cytoplasm: volume, viscosity, diffusion, intracellular surface area" (PDF). Int. Rev. Cytol. International Review of Cytology. 192: 189–221. doi:10.1016/S0074-7696(08)60527-6. ISBN 978-0-12-364596-8. PMID 10553280. Archived from the original (PDF) on 2011-07-19.
- ^ Roos A, Boron WF (April 1981). "Intracellular pH". Physiol. Rev. 61 (2): 296–434. doi:10.1152/physrev.1981.61.2.296. PMID 7012859.
- ^ Bright, G R; Fisher, GW; Rogowska, J; Taylor, DL (1987). "Fluorescence ratio imaging microscopy: temporal and spatial measurements of cytoplasmic pH". The Journal of Cell Biology. 104 (4): 1019–1033. doi:10.1083/jcb.104.4.1019. PMC 2114443. PMID 3558476.
- ^ a b Verkman AS (January 2002). "Solute and macromolecule diffusion in cellular aqueous compartments". Trends Biochem. Sci. 27 (1): 27–33. doi:10.1016/S0968-0004(01)02003-5. PMID 11796221.
- ^ a b Wiggins PM (1 December 1990). "Role of water in some biological processes". Microbiol. Rev. 54 (4): 432–49. doi:10.1128/MMBR.54.4.432-449.1990. PMC 372788. PMID 2087221.
- ^ Fulton AB (September 1982). "How crowded is the cytoplasm?". Cell. 30 (2): 345–7. doi:10.1016/0092-8674(82)90231-8. PMID 6754085. S2CID 6370250.
- ^ Garlid KD (2000). "The state of water in biological systems". Int. Rev. Cytol. International Review of Cytology. 192: 281–302. doi:10.1016/S0074-7696(08)60530-6. ISBN 978-0-12-364596-8. PMID 10553283.
- ^ Chaplin M (November 2006). "Do we underestimate the importance of water in cell biology?". Nat. Rev. Mol. Cell Biol. 7 (11): 861–6. doi:10.1038/nrm2021. PMID 16955076. S2CID 42919563.
- ^ Wiggins PM (June 1996). "High and low density water and resting, active and transformed cells". Cell Biol. Int. 20 (6): 429–35. doi:10.1006/cbir.1996.0054. PMID 8963257. S2CID 42866068.
- ^ Persson E, Halle B (April 2008). "Cell water dynamics on multiple time scales". Proc. Natl. Acad. Sci. U.S.A. 105 (17): 6266–71. Bibcode:2008PNAS..105.6266P. doi:10.1073/pnas.0709585105. PMC 2359779. PMID 18436650.
- ^ Thier, S. O. (April 25, 1986). "Potassium physiology". The American Journal of Medicine. 80 (4A): 3–7. doi:10.1016/0002-9343(86)90334-7. PMID 3706350.
- ^ Lote, Christopher J. (2012). Principles of Renal Physiology, 5th edition. Springer. p. 12.
- ^ a b c Lang F (October 2007). "Mechanisms and significance of cell volume regulation". J Am Coll Nutr. 26 (5 Suppl): 613S–623S. doi:10.1080/07315724.2007.10719667. PMID 17921474. S2CID 1798009.
- ^ Sussich F, Skopec C, Brady J, Cesàro A (August 2001). "Reversible dehydration of trehalose and anhydrobiosis: from solution state to an exotic crystal?". Carbohydr. Res. 334 (3): 165–76. doi:10.1016/S0008-6215(01)00189-6. PMID 11513823.
- ^ Crowe JH, Carpenter JF, Crowe LM (1998). "The role of vitrification in anhydrobiosis". Annu. Rev. Physiol. 60: 73–103. doi:10.1146/annurev.physiol.60.1.73. PMID 9558455.
- ^ Berridge MJ (1 March 1997). "Elementary and global aspects of calcium signalling". J. Physiol. 499 (Pt 2): 291–306. doi:10.1113/jphysiol.1997.sp021927. PMC 1159305. PMID 9080360.
- ^ Kikkawa U, Kishimoto A, Nishizuka Y (1989). "The protein kinase C family: heterogeneity and its implications". Annu. Rev. Biochem. 58: 31–44. doi:10.1146/annurev.bi.58.070189.000335. PMID 2549852.
- ^ Orlov SN, Hamet P (April 2006). "Intracellular monovalent ions as second messengers". J. Membr. Biol. 210 (3): 161–72. doi:10.1007/s00232-006-0857-9. PMID 16909338. S2CID 26068558.
- ^ Hudder A, Nathanson L, Deutscher MP (December 2003). "Organization of Mammalian Cytoplasm". Mol. Cell. Biol. 23 (24): 9318–26. doi:10.1128/MCB.23.24.9318-9326.2003. PMC 309675. PMID 14645541.
- ^ Heuser J (2002). "Whatever happened to the 'microtrabecular concept'?". Biol Cell. 94 (9): 561–96. doi:10.1016/S0248-4900(02)00013-8. PMID 12732437. S2CID 45792524.
- ^ Thanbichler M, Wang S, Shapiro L (2005). "The bacterial nucleoid: a highly organized and dynamic structure". J Cell Biochem. 96 (3): 506–21. doi:10.1002/jcb.20519. PMID 15988757. S2CID 25355087.
- ^ Peters R (2006). Introduction to nucleocytoplasmic transport: molecules and mechanisms. Methods in Molecular Biology. Vol. 322. pp. 235–58. doi:10.1007/978-1-59745-000-3_17. ISBN 978-1-58829-362-6. PMID 16739728.
- ^ Zhou HX, Rivas G, Minton AP (2008). "Macromolecular crowding and confinement: biochemical, biophysical, and potential physiological consequences". Annu Rev Biophys. 37: 375–97. doi:10.1146/annurev.biophys.37.032807.125817. PMC 2826134. PMID 18573087.
- ^ Norris V, den Blaauwen T, Cabin-Flaman A (March 2007). "Functional Taxonomy of Bacterial Hyperstructures". Microbiol. Mol. Biol. Rev. 71 (1): 230–53. doi:10.1128/MMBR.00035-06. PMC 1847379. PMID 17347523.
- ^ Wang SQ, Wei C, Zhao G (April 2004). "Imaging microdomain Ca2+ in muscle cells". Circ. Res. 94 (8): 1011–22. doi:10.1161/01.RES.0000125883.68447.A1. PMID 15117829.
- ^ Jaffe LF (November 1993). "Classes and mechanisms of calcium waves". Cell Calcium. 14 (10): 736–45. doi:10.1016/0143-4160(93)90099-R. PMID 8131190.
- ^ Aw, T.Y. (2000). "Intracellular compartmentation of organelles and gradients of low molecular weight species". Int Rev Cytol. International Review of Cytology. 192: 223–53. doi:10.1016/S0074-7696(08)60528-8. ISBN 978-0-12-364596-8. PMID 10553281.
- ^ Weiss JN, Korge P (20 July 2001). "The cytoplasm: no longer a well-mixed bag". Circ. Res. 89 (2): 108–10. doi:10.1161/res.89.2.108. PMID 11463714.
- ^ Srere PA (1987). "Complexes of sequential metabolic enzymes". Annu. Rev. Biochem. 56: 89–124. doi:10.1146/annurev.bi.56.070187.000513. PMID 2441660.
- ^ Perham RN (2000). "Swinging arms and swinging domains in multifunctional enzymes: catalytic machines for multistep reactions". Annu. Rev. Biochem. 69: 961–1004. doi:10.1146/annurev.biochem.69.1.961. PMID 10966480.
- ^ Huang X, Holden HM, Raushel FM (2001). "Channeling of substrates and intermediates in enzyme-catalyzed reactions". Annu. Rev. Biochem. 70: 149–80. doi:10.1146/annurev.biochem.70.1.149. PMID 11395405. S2CID 16722363.
- ^ Mowbray J, Moses V (June 1976). "The tentative identification in Escherichia coli of a multienzyme complex with glycolytic activity". Eur. J. Biochem. 66 (1): 25–36. doi:10.1111/j.1432-1033.1976.tb10421.x. PMID 133800.
- ^ Srivastava DK, Bernhard SA (November 1986). "Metabolite transfer via enzyme-enzyme complexes". Science. 234 (4780): 1081–6. Bibcode:1986Sci...234.1081S. doi:10.1126/science.3775377. PMID 3775377.
- ^ Groll M, Clausen T (December 2003). "Molecular shredders: how proteasomes fulfill their role". Curr. Opin. Struct. Biol. 13 (6): 665–73. doi:10.1016/j.sbi.2003.10.005. PMID 14675543.
- ^ Nandi D, Tahiliani P, Kumar A, Chandu D (March 2006). "The ubiquitin-proteasome system" (PDF). J. Biosci. 31 (1): 137–55. doi:10.1007/BF02705243. PMID 16595883. S2CID 21603835.
- ^ Bobik, T. A. (2007). "Bacterial Microcompartments" (PDF). Microbe. Am Soc Microbiol. 2: 25–31. Archived from the original (PDF) on 2008-08-02.
- ^ Yeates TO, Kerfeld CA, Heinhorst S, Cannon GC, Shively JM (August 2008). "Protein-based organelles in bacteria: carboxysomes and related microcompartments". Nat. Rev. Microbiol. 6 (9): 681–691. doi:10.1038/nrmicro1913. PMID 18679172. S2CID 22666203.
- ^ Badger MR, Price GD (February 2003). "CO2 concentrating mechanisms in cyanobacteria: molecular components, their diversity and evolution". J. Exp. Bot. 54 (383): 609–22. doi:10.1093/jxb/erg076. PMID 12554704.
- ^ Cate JH (November 2001). "Construction of low-resolution x-ray crystallographic electron density maps of the ribosome". Methods. 25 (3): 303–8. doi:10.1006/meth.2001.1242. PMID 11860284.
- ^ Provance DW, McDowall A, Marko M, Luby-Phelps K (1 October 1993). "Cytoarchitecture of size-excluding compartments in living cells". J. Cell Sci. 106 (2): 565–77. doi:10.1242/jcs.106.2.565. PMID 7980739.
- ^ Luby-Phelps K, Castle PE, Taylor DL, Lanni F (July 1987). "Hindered diffusion of inert tracer particles in the cytoplasm of mouse 3T3 cells". Proc. Natl. Acad. Sci. U.S.A. 84 (14): 4910–3. Bibcode:1987PNAS...84.4910L. doi:10.1073/pnas.84.14.4910. PMC 305216. PMID 3474634.
- ^ Luby-Phelps K (June 1993). "Effect of cytoarchitecture on the transport and localization of protein synthetic machinery". J. Cell. Biochem. 52 (2): 140–7. doi:10.1002/jcb.240520205. PMID 8366131. S2CID 12063324.
- ^ Kholodenko BN (June 2003). "Four-dimensional organization of protein kinase signaling cascades: the roles of diffusion, endocytosis and molecular motors". J. Exp. Biol. 206 (Pt 12): 2073–82. doi:10.1242/jeb.00298. PMID 12756289.
- ^ Pesaresi P, Schneider A, Kleine T, Leister D (December 2007). "Interorganellar communication". Curr. Opin. Plant Biol. 10 (6): 600–6. doi:10.1016/j.pbi.2007.07.007. PMID 17719262.
- ^ Winey M, Mamay CL, O'Toole ET (June 1995). "Three-dimensional ultrastructural analysis of the Saccharomyces cerevisiae mitotic spindle". J. Cell Biol. 129 (6): 1601–15. doi:10.1083/jcb.129.6.1601. PMC 2291174. PMID 7790357.
- ^ Weisiger RA (October 2002). "Cytosolic fatty acid binding proteins catalyze two distinct steps in intracellular transport of their ligands". Mol. Cell. Biochem. 239 (1–2): 35–43. doi:10.1023/A:1020550405578. PMID 12479566. S2CID 9608133.
- ^ Maxfield FR, Mondal M (June 2006). "Sterol and lipid trafficking in mammalian cells". Biochem. Soc. Trans. 34 (Pt 3): 335–9. doi:10.1042/BST0340335. PMID 16709155.
- ^ Pelham HR (August 1999). "The Croonian Lecture 1999. Intracellular membrane traffic: getting proteins sorted". Philos. Trans. R. Soc. Lond. B Biol. Sci. 354 (1388): 1471–8. doi:10.1098/rstb.1999.0491. PMC 1692657. PMID 10515003.
- ^ Kamal A, Goldstein LS (February 2002). "Principles of cargo attachment to cytoplasmic motor proteins". Curr. Opin. Cell Biol. 14 (1): 63–8. doi:10.1016/S0955-0674(01)00295-2. PMID 11792546.
- ^ Foster LJ, de Hoog CL, Zhang Y (April 2006). "A mammalian organelle map by protein correlation profiling". Cell. 125 (1): 187–99. doi:10.1016/j.cell.2006.03.022. PMID 16615899. S2CID 32197.
- ^ Herrgård, MJ; Swainston, N; Dobson, P; Dunn, WB; Arga, KY; Arvas, M; Blüthgen, N; Borger, S; Costenoble, R; et al. (October 2008). "A consensus yeast metabolic network reconstruction obtained from a community approach to systems biology". Nature Biotechnology. 26 (10): 1155–60. doi:10.1038/nbt1492. PMC 4018421. PMID 18846089.
- ^ Stryer, Lubert; Berg, Jeremy Mark; Tymoczko, John L. (2002). Biochemistry. San Francisco: W.H. Freeman. ISBN 0-7167-4684-0. OCLC 179705944.
- ^ Ohlrogge J, Pollard M, Bao X (December 2000). "Fatty acid synthesis: from CO2 to functional genomics". Biochem. Soc. Trans. 28 (6): 567–73. doi:10.1042/BST0280567. PMID 11171129.
- ^ Ohlrogge JB, Kuhn DN, Stumpf PK (March 1979). "Subcellular localization of acyl carrier protein in leaf protoplasts of Spinacia oleracea". Proc. Natl. Acad. Sci. U.S.A. 76 (3): 1194–8. Bibcode:1979PNAS...76.1194O. doi:10.1073/pnas.76.3.1194. PMC 383216. PMID 286305.
- ^ Goodman CD, McFadden GI (January 2007). "Fatty acid biosynthesis as a drug target in apicomplexan parasites". Curr Drug Targets. 8 (1): 15–30. doi:10.2174/138945007779315579. PMID 17266528. S2CID 2565225.
추가 읽기
- Wheatley, Denys N.; Pollack, Gerald H.; Cameron, Ivan L. (2006). Water and the Cell. Berlin: Springer. ISBN 1-4020-4926-9. OCLC 71298997.