베타락탐
Beta-lactam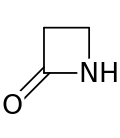
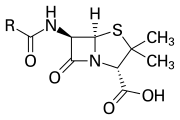
베타락탐(β-락탐) 링은 4흡입 젖탐이다.[1] 락탐은 순환아미드(cyclic amide)이며, 베타락탐은 질소 원자가 카보닐에 상대적인 β-탄소 원자에 붙어 있기 때문에 그렇게 명명된다. 가능한 가장 간단한 β-락탐은 2-아제티디논이다. β-락탐은 많은 β-락탐 항생제에서[2] 발현된 의약품의 중요한 구조적 단위다 1970년까지 대부분의 β-락탐 연구는 페니실린과 세팔로스포린 그룹에 관련되어 있었지만, 그 이후로 다양한 구조가 설명되어 왔다.[3][4]
임상적 유의성
β-락탐 링은 여러 항생제 계열의 핵심 구조의 일부로서, 주된 것은 페니실린, 세팔로스포린, 카바베넴, 모노박탐으로, 따라서 β-락탐 항생제라고도 불린다. 거의 모든 항생제는 박테리아 세포벽 생합성을 억제함으로써 효과가 있다. 이는 박테리아에 치명적인 영향을 미치지만, 주어진 박테리아 집단은 일반적으로 β-락탐 항생제에 내성이 있는 부분군을 포함할 것이다. 박테리아 저항성은 β-락탐 링을 여는 효소의 일종인 β-락타마아제 생산을 위한 많은 유전자 중 하나의 발현으로 인해 발생한다. 1,800개 이상의 서로 다른 β-락타마아제 효소가 다양한 종류의 박테리아에서 문서화되었다.[5] 이 효소들은 화학 구조와 촉매 효율성에 있어 매우 다양하다.[6] 박테리아 집단에 이러한 저항성 부분군이 있는 경우, β-락탐을 이용한 치료는 저항성 변종이 더 널리 퍼져 더욱 치명적일 수 있다. β-lactam 유도 항생제는 가장 중요한 항생제 종류 중 하나로 간주될 수 있지만 임상적으로 내성이 생기기 쉽다. β-락탐은 박테리아 세포벽의 펩티도글리칸 부분을 교차 연결하는 기능을 가진 페니실린 결합 단백질(PBP)[7]으로 알려진 효소 그룹에 대해 자연적으로 발생하는 d-Ala-d-Ala 기질을 모방하여 항생제 특성을 나타낸다.
합성
최초의 합성 β-락탐은 [2+2] 사이클로어데이션(Ph는 페닐 기능군을 나타냄)에서 아닐린과 디페닐케틴을[8][9] 함유한 벤즈알데히드의 쉬프 베이스의 반응으로 1907년 헤르만 스토딩거에 의해 준비되었다.
β-락탐 합성을 위한 많은 방법이 개발되었다.[10][11][12]
Breckpot β-락탐 합성은[13] 그리그나드 시약을 사용해 베타 아미노산 에스테르를 사이클화함으로써 대체된 β-락탐을 생산한다.[14] 무카이야마의 시약은 변형된 브렉팟 합성에도 사용된다.[13]
반응
링 스트레인 때문에 β-락탐은 선형 아미드나 큰 젖가슴보다 더 쉽게 가수 분해된다. 대부분의 β-락탐 항생제에서 볼 수 있듯이 이 변종은 두 번째 링에 융접함으로써 더욱 증가한다. 이러한 경향은 β-락탐의 아미드 특성이 시스템의 명성에 의해 감소되기 때문이다. 이상적인 아미드의 질소 원자는 공명으로 인해 sp-하이브리드화되며2, sp-하이브리드2 원자는 삼각 평면 결합 기하학을 가진다. 피라미드 결합 기하학이 고리 변형률에 의해 질소 원자에 강요되면서 아미드 결합의 공명이 감소하고 카보닐은 더욱 케톤처럼 된다. 노벨상 수상자인 로버트 번스 우드워드는 매개변수 h를 질소(정점으로서)에 의해 정의되는 삼각 피라미드와 그 인접한 세 원자의 높이에 대한 척도로 묘사했다. h는 더 낮은 숫자(더 많은 평면, 더 이상적인 아미드)가 더 강하고 덜 반응하는 β-lact람 결합의 강도에 해당한다.[15] 모노박텀은 h 값이 0.05와 0.10 앵그스트롬( () 사이에 있다. 세뇌는 0.20–0.25 å의 h 값을 가지고 있다. 페남의 값은 0.40–0.50 range의 범위인 반면, 카바페넴과 쇄골은 0.50–0.60 å의 값을 가지고 있어 가수분해에 대한 β-락탐의 가장 반응성이 높은 값이다.[16]
참고 항목
참조
- ^ Gilchrist T (1987). Heterocyclic Chemistry. Harlow: Longman Scientific. ISBN 978-0-582-01421-3.
- ^ Fisher, J. F.; Meroueh, S. O.; Mobashery, S. (2005). "Bacterial resistance to β-lactam antibiotics: compelling opportunism, compelling opportunity". Chemical Reviews. 105 (2): 395–424. doi:10.1021/cr030102i. PMID 15700950.
- ^ Flynn EH (1972). Cephalosporins and Penicillins : Chemistry and Biology. New York and London: Academic Press.
- ^ Hosseyni S, Jarrahpour A (October 2018). "Recent advances in β-lactam synthesis". Organic & Biomolecular Chemistry. 16 (38): 6840–6852. doi:10.1039/c8ob01833b. PMID 30209477.
- ^ Brandt C, Braun SD, Stein C, Slickers P, Ehricht R, Pletz MW, Makarewicz O (February 2017). "In silico serine β-lactamases analysis reveals a huge potential resistome in environmental and pathogenic species". Scientific Reports. 7: 43232. Bibcode:2017NatSR...743232B. doi:10.1038/srep43232. PMC 5324141. PMID 28233789.
- ^ Ehmann DE, Jahić H, Ross PL, Gu RF, Hu J, Kern G, Walkup GK, Fisher SL (July 2012). "Avibactam is a covalent, reversible, non-β-lactam β-lactamase inhibitor". Proceedings of the National Academy of Sciences of the United States of America. 109 (29): 11663–8. Bibcode:2012PNAS..10911663E. doi:10.1073/pnas.1205073109. PMC 3406822. PMID 22753474.
- ^ Tipper DJ, Strominger JL (October 1965). "Mechanism of action of penicillins: a proposal based on their structural similarity to acyl-D-alanyl-D-alanine". Proceedings of the National Academy of Sciences of the United States of America. 54 (4): 1133–41. Bibcode:1965PNAS...54.1133T. doi:10.1073/pnas.54.4.1133. PMC 219812. PMID 5219821.
- ^ Tidwell TT (2008). "Hugo (Ugo) Schiff, Schiff bases, and a century of beta-lactam synthesis". Angewandte Chemie. 47 (6): 1016–20. doi:10.1002/anie.200702965. PMID 18022986.
- ^ Staudinger H (1907). "Zur Kenntniss der Ketene. Diphenylketen". Justus Liebigs Ann. Chem. 356 (1–2): 51–123. doi:10.1002/jlac.19073560106.
- ^ Alcaide, Benito; Almendros, Pedro; Aragoncillo, Cristina (2007). "Β-Lactams: Versatile Building Blocks for the Stereoselective Synthesis of Non-β-Lactam Products". Chemical Reviews. 107 (11): 4437–4492. doi:10.1021/cr0307300. PMID 17649981.
- ^ Hosseyni, Seyedmorteza; Jarrahpour, Aliasghar (2018). "Recent advances in β-lactam synthesis". Organic & Biomolecular Chemistry. 16 (38): 6840–6852. doi:10.1039/C8OB01833B. ISSN 1477-0520. PMID 30209477.
- ^ Pitts, Cody Ross; Lectka, Thomas (2014-08-27). "Chemical Synthesis of β-Lactams: Asymmetric Catalysis and Other Recent Advances". Chemical Reviews. 114 (16): 7930–7953. doi:10.1021/cr4005549. ISSN 0009-2665. PMID 24555548.
- ^ a b "Breckpot β-Lactam Synthesis", Comprehensive Organic Name Reactions and Reagents, Hoboken, NJ, USA: John Wiley & Sons, Inc., pp. conrr115, 2010-09-15, doi:10.1002/9780470638859.conrr115, ISBN 978-0-470-63885-9, retrieved 2021-02-04
- ^ Bogdanov B, Zdravkovski Z, Hristovski K. "Breckpot Synthesis". Institute of Chemistry Skopje.
- ^ Woodward RB (May 1980). "Penems and related substances". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 289 (1036): 239–50. Bibcode:1980RSPTB.289..239W. doi:10.1098/rstb.1980.0042. PMID 6109320.
- ^ Nangia A, Biradha K, Desiraju GR (1996). "Correlation of biological activity in β-lactam antibiotics with Woodward and Cohen structural parameters: A Cambridge database study". J. Chem. Soc. Perkin Trans. 2 (5): 943–53. doi:10.1039/p29960000943.