NMDA수용체
NMDA receptorN-메틸-D-아스파르트산 수용체(NMDA 수용체 또는 NMDAR로도 알려져 있음)는 뉴런에서 발견되는 글루탐산 수용체 및 이온 채널이다.NMDA 수용체는 세 가지 유형의 이오노트로픽 글루탐산 수용체 중 하나이며, 나머지 두 가지는 AMPA 수용체와 카이네이트 수용체이다.서브유닛 조성에 따라 리간드는 글루탐산염과 글리신(또는 D-세린)이다.그러나 리간드의 결합은 뉴런이 충분히 탈분극되었을 때만 제거되는 Mg 이온에 의해2+ 차단될 수 있기 때문에 일반적으로 채널을 열기에 충분하지 않다.따라서 채널은 "공동 검출기"로 작동하며, 이 두 조건이 모두 충족되어야만 채널이 열리고 양으로 대전된 이온( 양이온)이 [3]세포막을 통해 흐를 수 있습니다.NMDA 수용체는 시냅스 가소성을 제어하고 학습 및 기억 [4]기능을 매개하는 데 매우 중요한 것으로 생각됩니다.
NMDA 수용체는 이온 방향성이며, 이는 세포막을 [5]통해 이온이 통과할 수 있는 단백질임을 의미합니다.NMDA 수용체는 작용제 분자 N-메틸-D-아스파르트산(NMDA)이 다른 글루탐산 수용체가 아닌 선택적으로 결합하기 때문에 이름이 붙여졌다.NMDA 수용체가 활성화되면 양이온에 대해 선택적이지 않은 이온 채널이 열리며, 결합 반전 전위는 0mV에 가깝다.이온 채널의 개폐는 주로 리간드 결합에 의해 게이트되지만 이온 채널을 통과하는 전류는 전압에 의존합니다.세포외 마그네슘(Mg2+) 및 아연(Zn2+) 이온은 수용체 상의 특정 부위에 결합하여 개방 이온 채널을 통한 다른 양이온의 통과를 차단할 수 있습니다.세포의 탈분극에 의해 Mg 및 Zn2+ 이온이2+ 모공에서 이탈 및 반발함으로써 나트륨(Na+) 및 칼슘(Ca2+) 이온의 전압의존성 흐름이 세포 내로, 칼륨(K+)이 [6][7][8][9]세포 밖으로 흐를 수 있다.특히2+ NMDA 수용체를 통한 Ca 플럭스는 Ca 이온에 결합하고 활성화되는2+ 단백질로 인해 학습과 기억을 위한 세포 메커니즘인 시냅스 가소성에서 중요한 것으로 생각됩니다.
NMDA 수용체의 활성은 펜시클리딘(PCP), 알코올(에탄올), 덱스트로메토르판(DXM)과 같은 많은 정신 반응 약물에 의해 영향을 받습니다.약물 케타민과 아산화질소의 마취 및 진통 효과는 부분적으로 NMDA 수용체 활성에 대한 영향 때문이다.그러나 NMDAR의 과활성화는 CB1 [10]수용체 활성화를 통해 NMDAR 매개 NO 생산 및 아연 방출의 독성 효과를 상쇄하기 위해 HINT1 단백질이 필요하므로 신경사멸에 유의하게 기여하는 칼슘 및 아연의 세포질 농도를 증가시킨다.산화질소합성효소(nNOS) 발현 억제를 통한 필로폰 유도 신경독성 예방과 더불어 성세포 활성화는 각각 CB1 의존성 및 독립성 메커니즘을 통해 필로폰 유도 뇌손상을 감소시키는 것으로 보여지며 필로폰 유도 아스트로글라이오시스 억제는 다음을 통해 발생할 가능성이 높다.THC를 [11]위한 CB2 수용체 의존 메커니즘.1989년 이후 메만틴은 NMDA 수용체의 비경쟁적 길항제로서 활성화 된 후 수용체의 채널에 들어가 [12][13][14]이온의 흐름을 차단하는 것으로 인식되어 왔다.
Ca의2+ 과도한 유입을 야기하는 수용체의 과활성화는 일부 신경변성 장애에 관여하는 것으로 암시되는 흥분독성을 초래할 수 있다.따라서 NMDA 수용체의 차단은 이론적으로 그러한 [14][15][16][17]질병을 치료하는데 유용할 수 있다.그러나 NMDA 수용체의 기능 저하(글루타티온 결핍 또는 기타 원인으로 인한)는 시냅스 가소성[18] 장애와 관련될 수 있으며 다른 부정적인 영향을 미칠 수 있다.신경 보호를 위한 NMDA 수용체 길항제 활용의 주요 문제는 NMDA 수용체의 생리 작용이 정상적인 신경 기능에 필수적이라는 것이다.임상적으로 유용한 NMDA 길항제들은 정상적인 기능을 방해하지 않고 과도한 활성화를 차단해야 합니다.메만틴은 이 [19]성질을 가지고 있어요
역사
NMDA 수용체의 발견은 1960년대에 제프 왓킨스와 동료들에 의해 N-메틸-D-아스파르트산(NMDA)의 합성과 연구가 뒤따랐다.1980년대 초, NMDA 수용체는 여러 중앙 시냅스 [20][21]경로에 관여하는 것으로 나타났다.수용체 서브유닛 선택성은 1990년대 초에 발견되었고, 이는 NR2B 서브유닛을 선택적으로 억제하는 새로운 종류의 화합물을 인식하게 되었다.이러한 연구 결과는 제약업계에서 [9]활발한 캠페인으로 이어졌다.이를 통해 NMDA 수용체는 간질, 파킨슨병, 알츠하이머병, 헌팅턴병 및 기타 CNS [6]질환과 같은 다양한 신경학적 질환과 관련이 있는 것으로 간주되었다. 뇌전증
2002년, Hilmar Bading과 동료들은 NMDA 수용체 자극의 세포 결과가 신경 세포 표면에서 [22][23]수용체의 위치에 따라 달라진다는 것을 발견했다.시냅스 NMDA 수용체는 유전자 발현, 가소성 관련 사건 및 후천성 신경 보호를 촉진합니다.시냅스 외 NMDA 수용체는 전사 차단, 미토콘드리아 기능 장애, 구조적 [22][23]붕괴를 일으킨다.이러한 비시냅스 외 NMDA 수용체 시그널링의 병리학적 삼합은 여러 급성 및 만성 신경변성 조건의 [24]병인학에서 공통 전환점을 나타낸다.독성 비시냅스 외 NMDA 수용체 시그널링의 분자 기반은 [25]Hilmar Bading과 동료들에 의해 2020년에 밝혀졌다.NMDAR/TRPM4 상호작용 계면 억제제(인터페이스 억제제라고도 함)는 NMDAR/TRPM4 복합체를 교란시키고 비교섭성 NMDA [25]수용체를 해독한다.
1968년 한 여성이 독감 약으로 아만타딘을 복용하고 파킨슨병의 증상이 현저하게 완화되는 것을 경험한 우연한 발견이 이루어졌다.Scawab 등이 보고한 이 발견은 CNS에 [26]영향을 미치는 질병의 맥락에서 아다만탄 유도체의 약화학이 시작된 것이다.이 발견이 있기 전에 또 다른 아다만탄 유도체인 메만틴은 1963년 엘리 릴리와 컴퍼니에 의해 합성되었다.저혈당 약을 개발하는 것이 목적이었지만, 그러한 효과는 나타나지 않았다.1972년이 되어서야 신경변성 장애를 치료하기 위한 메만틴의 가능한 치료적 중요성이 발견되었다.1989년부터 메만틴은 NMDA [13]수용체의 비경쟁적 길항제로서 인식되었다.
구조.
기능성 NMDA 수용체는 2개의 GluN1과 일반적으로 2개의 GluN2 서브유닛으로 [27]구성된 헤테로테트라머이다.유전자를 코드하는 1개의 GluN1, 4개의 GluN2, 2개의 GluN3 서브유닛이 있으며 각 유전자는 2개 이상의 스플라이스 변이를 생성할 수 있다.
- GluN1 – Green1
- GluN2
- GluN3
게이트
NMDA 수용체는 글리신과 글루타메이트가 [3]결합할 때 활성화되는 글루타메이트 및 이온 채널 단백질 수용체이다.수용체는 GluN1, GluN2, GluN3의 세 개의 서로 다른 서브유닛에 의해 여러 세포 내 단백질과 상호작용하는 헤테로머 복합체이다. GluN1은 유전자 GRIN1의 대체 스플라이싱으로 인해 8개의 서로 다른 아이소폼을 가진다. 4개의 서로 다른 GluN2 서브유닛(A-D 서브유닛)과 2개의 서로 다른 서브유닛이 있다.6별도의 유전자 GluN2과 GluN3.[28][29]에 암호화하다 모든 서브 유닛은 대형 세포외 즉, 세포막을 지역 3막관통 부분, 오목하게 들어간 구멍 루프, 투과 성막 세그먼트 사이의 구조적으로 잘 알려 진 사람들이 아닙니다. 세포 밖의 루프, 그리고 intra으로 구성된에 의해 지배되는 흔한 막위상을 공유한다.봉소서브유닛에 따라 크기가 다르며 많은 세포내 [28][30]단백질과 상호작용하는 여러 부위를 제공하는 R C 말단.그림 1은 메만틴, Mg2+ 및 케타민의 결합 부위를 형성하는 GluN1/GluN2 서브유닛의 기본 구조를 나타낸다.
Mg는2+ 전압 의존적인 방식으로 NMDA 수용체 채널을 차단합니다.채널은 Ca에 대한2+ 투과성도 높다.수용기의 컨트롤러 시냅스 후 세포막의 Mg2+로 전압 종속 채널 블록을 덜어준다 그것의GluN1-linked 결합 부위와 AMPA receptor-mediated 편광의 소멸에 글루탐산 바인딩, D-serine 또는 글리신 바인딩에 달려 있다.활성화 및 이 수용체 채널을 개설하는 따라서 K+, Na+과 소금 이온의 흐름, 그리고 그 i. 수 있nflux of2+ Ca는 세포 내 신호 경로를 [12][31]트리거합니다.아연, 단백질 및 폴리아민 스펠미딘 및 스펠민에 대한 알로스테릭 수용체 결합 부위도 NMDA 수용체 채널의 [32]조절제이다.
GluN2B 서브유닛은 학습, 기억, 처리 및 섭식 행동과 같은 활동 조절과 인간 착란 횟수에 관여하고 있습니다.NMDA 수용체와 관련된 기본 구조와 기능은 GluN2B 서브유닛에 기인할 수 있다.예를 들어 글루탐산염 결합부위 및 Mg블록2+ 제어는 GluN2B 서브유닛에 의해 형성된다.글리신 길항제 고친화성 부위도 GluN1/GluN2B [29]수용체에 의해 단독으로 표시된다.
GluN1/GluN2B 막간 세그먼트는 비경쟁적 NMDA 수용체 길항제 결합 포켓을 형성하는 수용체의 일부로 간주되지만, 막간 세그먼트 구조는 위와 같이 완전히 알려져 있지 않다.그림 [30]2와 같이 메만틴 및 관련 화합물의 결합에는 수용체 내 3개의 결합 부위, 즉 GluNB 서브유닛의 A644와 GluN1 서브유닛의 A645와 N616이 중요하다고 주장되고 있다.
NMDA 수용체는 2개의 GluN1 서브유닛과 2개의 GluN2 서브유닛(이전의 서브유닛은 GluN1 서브유닛과 GluN2 서브유닛으로 표시됨), 2개의 필수 GluN1 서브유닛과 2개의 국소적인 GluN2 서브유닛 사이에서 헤테로테트라메타미어를 형성한다.GluN3 A 및 B 서브유닛의 관련 유전자 패밀리는 수용체 활성에 억제 효과가 있다.뚜렷한 뇌 분포와 기능적 특성을 가진 다중 수용체 아이소폼은 GluN1 전사체의 선택적 스플라이싱과 GluN2 서브유닛의 차등 발현에 의해 발생한다.
각 수용체 서브유닛은 모듈식 설계를 가지며 각 구조 모듈은 기능 단위를 나타냅니다.
- 세포외 도메인은 조절 도메인과 리간드 결합 도메인이라는 두 가지 구상 구조를 포함한다.GluN1 서브유닛은 공동고니스트 글리신을 결합하고, GluN2 서브유닛은 신경전달물질 글루타메이트를 [1][2]결합한다.
- 작용제 결합 모듈은 3개의 막 통과 세그먼트와 칼륨 채널의 선택성 필터를 연상시키는 재진입 루프로 구성된 막 도메인에 연결됩니다.
- 막 도메인은 채널 모공에 잔류물을 기여하며 수용체의 고단위 전도율, 고칼슘 투과성 및 전압 의존성 마그네슘 블록을 담당합니다.
- 각 서브유닛은 일련의 단백질 키나아제 및 단백질 포스파타아제에 의해 직접 수정될 수 있는 잔류물과 다수의 구조, 어댑터 및 발판 단백질과 상호작용하는 잔류물을 포함하는 광범위한 세포질 도메인을 가지고 있다.
GluN1 및 GluN3 서브유닛의 글리신 결합모듈과 GluN2A 서브유닛의 글루탐산 결합모듈은 수용성 단백질로 발현되며, 이들의 3차원 구조는 X선 결정학으로 원자 분해능으로 해결되었다.이는 아미노산 결합 세균 단백질과 AMPA 수용체 및 카이네이트 수용체의 글루탐산 결합 모듈과의 공통 접힘을 드러냈다.
작용 메커니즘
NMDA 수용체는 중추신경계 발달의 중요한 부분이다.학습, 기억, 신경 가소성의 과정은 NMDA 수용체의 메커니즘에 의존합니다.NMDA 수용체는 칼슘 투과성의 증가를 허용하는 글루탐산염 게이트 양이온 채널이다.NMDA 수용체의 채널 활성화는 글리신과 글루탐산염이라는 두 가지 공동 작용제의 결합의 결과이다.
NMDA 수용체의 과활성화는 Ca의 과도한2+ 유입을 유발하며 흥분독성을 초래할 수 있다.흥분독성은 알츠하이머병, 파킨슨병,[14][15][16][17] 헌팅턴병과 같은 신경변성 질환에 관여하는 것으로 암시된다.따라서 NMDA 수용체의 차단은 이론적으로 그러한 [14][15][16]질병을 치료하는데 유용할 수 있다.그러나 생리학적 NMDA 수용체의 과도한 흥분독성 활성을 차단하면서 NMDA 수용체 활성을 보존하는 것이 중요하다.이것은 과도하게 [16]개방되었을 때 수용체 이온 채널을 차단하는 비경쟁적 길항제들에 의해 달성될 수 있다.
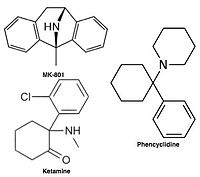
비경쟁성 NMDA 수용체 길항제 또는 채널 차단제는 활성화 후 NMDA 수용체의 채널에 [12][14]들어가 이온의 흐름을 차단합니다.MK-801, 케타민, 아만타딘 및 메만틴이 그러한 [12]길항제이다(그림 1 참조).수용체 채널의 길항제 오프 레이트는 중요한 요인이다. 왜냐하면 너무 느린 오프 레이트는 수용체의 정상적인 기능을 방해할 수 있고 너무 빠른 오프 레이트는 과도하게 열린 [16]수용체를 효과적으로 차단할 수 없기 때문이다.
메만틴은 상대적으로 빠른 오프환율과 낮은 친화력을 가진 NMDA 수용체의 비경쟁적 채널 차단제의 한 예이다.생리학적 pH에서 아민기는 양전하를 띠며 수용체 길항작용은 전압 [16]의존적이다.이것에 의해 채널 [13]블로커로서의 Mg의 생리2+ 기능을 모방한다.Memantine은 흥분독성 조건에서 마그네슘을 결합 부위에서 대체함으로써 NMDA 수용체 관련 채널을 장기간 활성화하는 동안만 차단합니다.정상적인 수용체 활동 동안 채널은 몇 밀리초 동안만 열려 있으며 이러한 상황에서는 memantine이 채널 내에서 결합할 수 없으므로 정상적인 시냅스 [19]활동을 방해하지 않습니다.
변종
GluN1
GRIN1의 [33]대체 스플라이싱에 의해 생성되는 GluN1 서브유닛에는 8가지 종류가 있습니다.
- GluN1-1a, GluN1-1b; GluN1-1a는 가장 풍부하게 발현되는 형태이다.
- GluN1-2a, GluN1-2b;
- GluN1-3a, GluN1-3b;
- GluN1-4a, GluN1-4b;
GluN2
GluN2 서브유닛은 무척추동물에서 발견되지만, GluN2 서브유닛의 4가지 동질체는 척추동물에서 발현되며 GluN2A~GluN2D(GRIN2A, GRIN2B, GRIN2C, GRIN2D에 의해 인코딩됨)로 참조된다.강력한 증거는 척추동물의 GluN2 서브유닛을 코드하는 유전자가 적어도 두 번의 유전자 [34]복제를 거쳤다는 것을 보여준다.글루탐산염의 결합 부위를 포함한다.더욱 중요한 것은, 각 GluN2 서브유닛은 서로 다른 일련의 신호 전달 [35]분자와 상호작용할 수 있는 서로 다른 세포 내 C-말단 도메인을 가지고 있다는 것이다.GluN1 서브유닛과는 달리, GluN2 서브유닛은 다양한 세포 유형 및 발달 시점에 걸쳐 다르게 발현되며 NMDA 수용체의 전기생리학적 특성을 제어한다.고전회로에서 GluN2B는 주로 미성숙한 뉴런 및 성장추체 [36]등의 비시냅스 외 위치에 존재하며 선택적 억제제 ifenprodil의 [37]결합 부위를 포함한다.그러나 새롭게 진화한 영장류 배측 전전두피질의 피라미드 세포 시냅스에서는 GluN2B가 시냅스 후 밀도 내에 배타적으로 존재하며 [38]작업기억 등의 고도의 인지조작을 매개한다.이것은 원숭이와 인간의 피질 계층 전반과 영장류 피질 [41]진화 전반에서 GluN2B 작용과 발현의 확장과 일치합니다.
GluN2B에서 GluN2A로의 스위치

GluN2B가 초기 산후 뇌에서 우세하지만, GluN2A 서브유닛의 수는 초기 발달 중에 증가하며, 결국 GluN2A 서브유닛은 GluN2B보다 더 많아진다.이것은 GluN2B-GluN2A 개발 스위치라고 불리며, 각 GluN2 서브유닛이 [43]수용체 기능에 기여하는 동태가 다르기 때문에 주목할 만하다.예를 들어, GluN2B 서브유닛의 비율이 높을수록 GluN2A가 [44]더 많은 NMDA 수용체에 비해 개방된 상태가 더 오래 유지된다.이것은 부분적으로 말년에 비해 산후 즉시 기억력이 더 뛰어나다는 것을 설명할 수 있는데, 이것은 유전자 조작 '두기 쥐'의 원리이다.인간 소뇌에서 이 스위치의 상세한 시간 경로는 발현 마이크로어레이와 RNA seq를 사용하여 추정되었으며 오른쪽 그림에 나와 있습니다.
이 스위치 메커니즘을 설명하는 가상 모델은 다음 3가지입니다.
- GluN2B의 감소와 함께 시냅스 GluN2A의 증가
- GluN2 증가에 따른 시냅스로부터의 GluN2B의 시냅스 외 변위a
- GluN2A의 증가(GluN2B의 감소 없이 희석)
또한 GluN2B 및 GluN2A 서브유닛은 흥분성 신경의 [45]죽음을 매개하는 데 다른 역할을 한다.서브유닛 구성의 발달 전환은 NMDA 신경독성의 [46]발달 변화를 설명하는 것으로 생각된다.생쥐에서 GluN2B에 대한 유전자의 호모 접합 파괴는 산기 주변 치사율을 야기하는 반면, GluN2A 유전자의 파괴는 해마 가소성이 [47]손상되었지만 생존 가능한 생쥐를 생산한다.한 연구에 따르면 Reelin은 GluN2B 서브유닛 [48]이동성을 증가시킴으로써 NMDA 수용체 성숙에 역할을 할 수 있다.
GluN2B에서 GluN2C로의 스위치
소뇌의 과립세포 전구체(GCPs)는 외부과립세포층(EGL)에서 대칭세포분열을[49] 거친 후 내부과립세포층(IGL)으로 이동하여 GluN2B를 다운 조절하고 negulin 및 neugulin β Er2B 시그널링에 의존하지 않는 프로세스인 GluN2C를 활성화한다.
흥분독성에서의 역할
NMDA 수용체는 흥분독성과 강하게 [51][52][53]관련된 많은 연구에 의해 관련되었다.NMDA 수용체가 뉴런의 건강과 기능에 중요한 역할을 하기 때문에, 이러한 수용체가 세포의 생존과 [54]세포사망 모두에 어떻게 영향을 미칠 수 있는지에 대한 많은 논의가 있었다.최근의 증거는 시냅스 외 NMDA 수용체의 과도한 자극이 시냅스 외 [51][22]NMDA 수용체의 자극보다 흥분독성과 더 관련이 있다는 가설을 뒷받침한다.또한 시냅스 외 NMDA 수용체의 자극이 세포사멸에 기여하는 것으로 보이지만 시냅스 외 NMDA 수용체의 자극이 세포의 건강과 수명에 기여함을 시사하는 증거가 있다.위치에 기초한 NMDA 수용체의 이중성을 뒷받침하는 충분한 증거가 있으며, 두 가지 다른 메커니즘을 설명하는 가설을 "국재화 가설"[51][54]이라고 한다.
다른 캐스케이드 경로
국소화 가설을 뒷받침하기 위해서는 세포막 [51]내에서의 위치에 기초하여 NMDA 수용체에 의해 서로 다른 세포 신호 경로가 활성화됨을 보여줄 필요가 있다.실험은 시냅스 또는 비시냅스 NMDA 수용체를 독점적으로 자극하도록 설계되었다.이러한 유형의 실험을 통해 [55]신호 발생 위치에 따라 다른 경로가 활성화되거나 조정되는 것으로 나타났습니다.이러한 경로의 대부분은 동일한 단백질 신호를 사용하지만 위치에 따라 NMDAR에 의해 반대로 조절됩니다.예를 들어 시냅스 NMDA 들뜸은 p38 마이트겐 활성화 단백질 키나제(p38MAPK)의 세포 내 농도 감소를 유발했다.시냅스 외 자극 NMDARs 조절 p38MAPK는 반대로 세포 [56][57]내 농도의 증가를 일으킨다.이러한 유형의 실험은 이러한 차이가 세포 생존 및 흥분 [51]독성과 관련된 많은 경로로 확장된다는 것을 보여주는 결과와 함께 반복되었다.
두 개의 특정 단백질은 이러한 다른 세포 반응 ERK1/2와 [51]제이콥을 담당하는 주요 경로로 확인되었다.ERK1/2는 시냅스 NMDAR에 의해 흥분될 때 제이콥의 인산화 작용을 담당한다.그런 다음 이 정보는 핵으로 전송됩니다.제이콥의 인산화 작용은 비시냅스 외 NMDA 자극에서는 일어나지 않는다.이것은 핵의 전사 인자가 [58]제이콥의 인산화 상태에 따라 다르게 반응하도록 한다.
신경가소성
NMDA 수용체(NMDARs)는 시냅스 가소성 유도에 결정적으로 영향을 미친다.NMDAR는 고속 시냅스 [59]전송을 통해 장기강화(LTP)와 장기강하(LTD)를 모두 트리거합니다.실험 데이터에 따르면 비시냅스 외 NMDA 수용체는 [60]LTD를 생성하는 동안 LTP를 억제한다.NMDA [51]길항제 도입으로 LTP 억제를 방지할 수 있다.일반적으로 시냅스 외 NMDAR에 선택적으로 적용하면 시냅스 외 NMDAR에 의해 LTP를 유도하는 세타 버스트 자극은 [61]LTD를 생성한다.또한 실험에 따르면 LTP 형성에 비시냅스 외 활동이 필요하지 않습니다.또한 시냅스 활성과 시냅스 외 활성 모두 완전한 [62]LTD 발현에 관여한다.
서로 다른 서브유닛의 역할
NMDAR 유도 독성에 영향을 미치는 것으로 보이는 또 다른 인자는 서브유닛 구성의 관측된 변화이다.NMDA 수용체는 2개의 GluN1 서브유닛과 2개의 가변 서브유닛을 [51][63]가진 헤테로트램이다.이러한 가변 서브유닛 중 두 개인 GluN2A와 GluN2B는 각각 우선적으로 세포 생존과 세포 사멸의 계단식으로 이어지는 것으로 나타났다.시냅스 외 및 시냅스 외 NMDARs에서 두 서브유닛이 발견되기는 하지만 GluN2B 서브유닛이 시냅스 외 수용체에서 더 자주 발생함을 시사하는 몇 가지 증거가 있다.이러한 관찰은 NMDA 수용체가 흥분독성에서 [64][65]하는 이원론적 역할을 설명하는 데 도움이 될 수 있다.
설득력 있는 증거와 이 두 이론의 상대적 단순성에도 불구하고, 이러한 주장의 중요성에 대해서는 여전히 의견이 분분하다.이러한 이론을 입증하는 데 있어 몇 가지 문제는 특정 NMDAR의 [51][66]하위 유형을 결정하기 위해 약리학적 수단을 사용하는 것의 어려움에서 발생한다.또한, 서브유닛 변동 이론은 이 효과가 어떻게 우세할 수 있는지를 설명하지 않는다. 왜냐하면 가장 일반적인 사량체는 2개의 GluN1 서브유닛과 각 서브유닛 GluN2A 및 GluN2B [51]중 하나로 이루어지며, NMDARs의 높은 비율을 차지한다고 널리 알려져 있기 때문이다.
임상 환경에서 흥분독성
흥분독성은 1950년대 [67]후반부터 신경변성 조건의 퇴행성 특성에 영향을 미치는 것으로 여겨져 왔다.NMDA 수용체는 뇌에 영향을 미치는 많은 퇴행성 질환에 중요한 역할을 하는 것으로 보인다.가장 주목할 만한 것은 NMDA 수용체와 관련된 흥분독성 사건은 뇌졸중과 [51][68]뇌전증과 같은 다른 의학적 조건뿐만 아니라 알츠하이머병과 헌팅턴병과 관련이 있다는 것이다.그러나 이러한 상태를 알려진 NMDA 수용체 길항제 중 하나로 치료하면 다양한 원치 않는 부작용이 발생하며, 그 중 일부는 심각할 수 있다.이러한 부작용은 부분적으로 NMDA 수용체가 세포 사멸을 알리는 신호일 뿐만 아니라 세포 [54]사멸의 생명력에도 중요한 역할을 하기 때문에 관찰된다.이러한 [51][23]조건에 대한 치료는 시냅스에서 발견되지 않는 NMDA 수용체를 차단하는 것에서 찾을 수 있다.질환의 흥분독성의 한 클래스는 폴리마이크로지리아와 [69]같은 피질 기형과 관련된 GRIN2B 및 GRIN1의 기능상 돌연변이를 포함한다.
리간드
어거니스트


NMDA 수용체를 활성화하려면 글루탐산염 또는 아스파르트산염의 결합이 필요하다(아스파르트산은 수용체를 강하게 [70]자극하지 않는다).또한 NMDARs는 이 수용체의 일부인 이온 채널의 효율적인 개방을 위해 공동고니스트 글리신의 결합을 필요로 한다.
D-세린은 또한 글리신보다 [71]훨씬 더 큰 효력으로 NMDA 수용체를 공동 활성화시키는 것으로 밝혀졌다.세린 라세마아제에 의해 생성되며, NMDA 수용체와 동일한 영역에서 농축됩니다.D-세린의 제거는 많은 영역에서 NMDA 매개 흥분성 신경 전달을 차단할 수 있다.최근에는 NMDA 수용체를 조절하기 위해 신경세포와 성상세포에 의해 D-세린이 방출될 수 있는 것으로 나타났다.
NMDA 수용체(NMDAR) 매개 전류는 막 탈분극과 직접 관련이 있다.따라서 NMDA 작용제는 빠른2+ Mg 비결합 동력을 나타내며 탈분극과 함께 채널 개방 확률을 증가시킨다.이러한 특성은 기억과 학습에서 NMDA 수용체의 역할에 기초적이며, 이 채널은 막 탈분극과 시냅스 전달을 위한 일치 검출기 역할을 할 수 있는 헵비어 학습의 생화학 기질이라고 제안되었다.
예
알려진 NMDA 수용체 작용제에는 다음이 포함됩니다.
- 아미노산 및 아미노산 유도체
- 양극 알로스테릭 변조기
- Cerebrosterol – 내인성 약한 양성 알로스테릭 변조기
- 콜레스테롤 – 내인성 약한 양성 알로스테릭 변조기
- 디하이드로에피안드로스테론(DHEA) – 내인성 약한 양성 알로스테릭 변조제
- 디히드로에피안드로스테론황산염(DHEA-S) - 내인성 약양성 알로스테릭 변조제
- 네보스티넬(네보글아민)– 글리신 부위의 합성 양성 알로스테릭 조절제
- 프레그네놀론 황산염 – 내인성 약한 양성 알로스테릭 변조기
- 폴리아민
네라멕산
메만틴 유도체의 예로는 NMDA 수용체 길항제로서 메만틴을 템플릿으로 하는 아미노알킬 시클로헥산 수를 연구하여 발견된 네라멕산이 있다.Neramexane은 NMDA 수용체 관련 채널 내에서 memantine과 동일한 부위에 결합하고 그에 상응하는 친화력을 가지고 있다.또한 메만틴과 매우 유사한 생체 가용성과 생체 내 역학을 차단한다.Neramexane은 알츠하이머병을 포함한 [26]네 가지 징후를 위해 임상 실험을 했다.
부분작용제

NMDA 수용체의 이름을 딴 N-메틸-D-아스파르트산(NMDA)은 활성 또는 글루탐산 인식 부위의 부분 작용제이다.
3,5-Dibromo-L-phenylalanine, L-phenylalanine의 자연적으로 발생하는 할로겐인 파생물은 약한 부분 NMDA수용체 모두의 효능 제이다는 글리신 사이트에 작용하다.[72]3,5-Dibromo-L-phenylalanine schizophrenia,[73]과 신경학 상의 질환 같은 신경 장애와 질병이 치료를 위한 소설 치료 학적 약물 후보 제안되고 있다.허혈성 뇌졸중이나 간질 [74]발작 같은 거요
Rapastinel(GLYX-13) 및 Apimostinel(NRX-1074)과 같은 새로운 부위에 작용하는 NMDA 수용체의 다른 부분작용제는 이제 뚜렷한 정신 자극 [75]활동 없이 항우울제 및 진통 효과가 있는 신약 개발에 대해 검토되고 있다.
예
- 아미노시클로프로판카르본산(ACC) - 합성글리신 부위 부분작용제
- 사이클로세린(D-시클로세린)– 스트렙토미세스 난초에서 발견되는 자연발생 글리신 부위 부분작용제
- HA-966 - 합성 글리신 부위 약부분작용제
- 호모키놀린산 – 합성글루탐산부위부분작용제
- N-메틸-D-아스파르트산(NMDA) - 합성글루탐산부위부분작용제
포지티브 알로스테릭 변조기에는 다음과 같은 것이 있습니다.
- 젤키스티넬(AGN-241751) - 합성 신규 부위 부분작용제
- 아피모스티넬(NRX-1074)– 합성 신규 부위 부분작용제
- Rapastinel (GLYX-13) – 합성 신규 부위 부분작용제[76]
대항마

NMDA 수용체의 길항제들은 동물과 때로는 사람의 마취제로 사용되며, 해리 등 높은 용량에서의 독특한 효과 외에도 환각 유발 특성 때문에 종종 레크리에이션 약물로 사용된다.특정 NMDA 수용체 길항제들이 설치류에게 대량으로 투여될 때, 그들은 올니 병변이라고 불리는 뇌 손상을 일으킬 수 있다.올니의 병변을 유도하는 것으로 나타난 NMDA 수용체 길항제에는 케타민, 펜시클리딘 및 덱스트로판(덱스트로메토르판의 대사물)과 연구 환경에서만 사용되는 일부 NMDA 수용체 길항제 등이 있다.지금까지, 올니의 병변에 대한 발표된 연구는 NMDA 수용체 [77]길항제들의 존재 증가와 관련하여 인간이나 원숭이 뇌조직에서 발생한다는 점에서 결론을 내리지 못했다.
대부분의 NMDAR 길항제들은 채널 모공의 비경쟁적 또는 비경쟁적 차단제이거나 활성/글루탐산 부위의 길항제라기보다는 글리신 공동 조절 부위의 길항제이다.
예
NMDA 수용체 길항작용이 주요 또는 주요 작용 메커니즘인 일반 약제:
- 4-클로로키뉴레닌(AV-101) – 글리신 사이트 길항제, 7-클로로키뉴레인의[78][79] 프로드러그
- 7-클로로키누렌산– 글리신 사이트 길항제
- 아그마틴 – 내인성 폴리아민 사이트 길항제[80][81]
- Argiotoxin-636 – Argiope 독에서 발견되는 자연발생 디조실핀 또는 관련 부위
- AP5 – 글루탐산염 사이트 길항제
- AP7 – 글루탐산염 사이트 길항제
- CGP-37849 – 글루탐산염 사이트 길항제
- 딜루체민(NPS-1506) – 디조실핀 또는 관련 부위 길항제. 아르지오톡신-636에서[82][83] 유래함
- 덱스트로메토르판(DXM) – 디조실핀 부위 길항제; 덱스트로르판의 프로드러그
- 덱스트로판(DXO) – 디조실핀 사이트 길항제
- 덱사나비놀 – 디조실핀 관련 부위 길항제[84][85][86]
- 디에틸에테르 - 미지의 부위 길항제
- 디페니딘 – 디조실핀 부위 길항제
- 디조실핀(MK-801) – 디조실핀 부위 길항제
- 엘리프로딜 – ifenprodil 부위 길항제
- 에스케타민 – 디조실핀 부위 길항제
- Hodgkinsine – 정의되지 않은 부위 길항제
- Ifenprodil – Ifenprodil 부위 길항제[87]
- 카이토세팔린 – 유피니실륨시아리에서 발견되는 자연발생 글루탐산염 사이트 길항제
- 케타민 – 디조실핀 사이트 길항제
- 키누렌산 – 내인성 글리신 사이트 길항제
- 라니세민 – 저트래핑 디조실핀 사이트 길항제
- LY-235959 – 글루탐산염 사이트 길항제
- 메만틴 – 저트래핑 디조실핀 사이트 길항제
- 메톡세타민 – 디조실핀 부위 길항제
- Midafotel – 글루탐산염 사이트 길항제
- 아산화질소(NO2) – 정의되지 않은 부위 길항제
- PEAQX – 글루탐산염 사이트 길항제
- Perzinfotel – 글루탐산염 사이트 길항제
- 펜시크리딘(PCP)– 디조실핀 부위 길항제
- 페닐알라닌 - 자연적으로 발생하는 아미노산, 글리신 사이트 길항제[88][89]
- Psychotridine – 정의되지 않은 부위 길항제
- 셀프오텔 – 글루탐산염 사이트 길항제
- 타일타민 – 디조실핀 사이트 길항제
- Tracosoprodil – ifenprodil 부위 길항제
- 제논 – 알 수 없는 부위 길항제
약한 NMDA 수용체 길항작용이 2차 작용 또는 추가 작용인 일반적인 약물은 다음과 같습니다.
- 아만타딘 – 항바이러스 및 항파킨슨제, 저트랩 디조실핀 사이트 길항제[90]
- 아토목세틴 – 치료에 사용되는 노르에피네프린 재흡수 억제제
- 덱스트로프로옥시펜– 오피오이드 진통제
- 에탄올(알코올) – 레크리에이션에 사용되는 행복제, 진정제, 항불안제, 알려지지 않은 부위 길항제
- 과이페네신 – 기대제
- Huperzine A – 자연적으로 발생하는 아세틸콜린에스테라아제 억제제 및 잠재적 항치매제
- 이보가인 – 자연적으로 발생하는 환각제 및 항중독제
- 케토베미돈 – 오피오이드 진통제
- 메타돈 – 오피오이드 진통제
- 미노사이클린 – 항생제[92]
- Tramadol – 비정형 오피오이드 진통제 및 세로토닌 방출제
니트로메만틴
NMDA 수용체는 니트로실화를 통해 조절되며 아미노아다만탄은 NMDA 수용체 내에서 질소산화물(NO)을 가까이 가져가 이온 채널 전도성을 [26]조절하는 표적 방향 셔틀로 사용될 수 있습니다.NMDA 수용체 활성을 감소시키기 위해 사용될 수 있는 NO 공여체는 질산 알킬 니트로글리세린이다.다른 많은 NO 공여자들과 달리, 알킬 질산염은 잠재적인 NO 관련 신경 독성 효과를 가지고 있지 않다.질산알킬은 신경독성을 회피하는 안전한 공여체인 그림 7, -NO-와2 같이 니트로기 형태로 NO를 공여한다.니트로 그룹은 NMDA 수용체를 대상으로 해야 하며, 그렇지 않으면 혈관의 확장 및 그에 따른 저혈압과 같은 NO의 다른 영향이 [93]발생할 수 있습니다.니트로메만틴은 메만틴의 2세대 유도체로, 안전을 희생하지 않고 NMDA 수용체를 차단함으로써 글루탐산계의 과활성화에 의해 매개되는 흥분독성을 감소시킨다.동물 모델에 대한 잠정 연구는 니트로메만틴이 체외와 체내 모두에서 신경 보호제로서 메만틴보다 더 효과적이라는 것을 보여준다.메만틴과 새로운 유도체는 신경 손상과의 [16]싸움에서 매우 중요한 무기가 될 수 있다.
- 25-히드록시콜레스테롤– 내인성 약한 음성 알로스테릭 조절제
- 코난토킨 – 코너스 지오그래피우스에서[94] 발견되는 폴리아민 부위의 자연발생 음성 알로스테릭 변조제
변조기
예
NMDA 수용체는 다수의 내인성 [95]및 외인성 화합물에 의해 조절됩니다.
- 아미노글리코시드는 폴리아민과 유사한 효과가 있는 것으로 나타났으며, 이것은 그들의 신경 독성 효과를 설명할 수 있다.
- CDK5는 시냅스막의 NR2B 함유 NMDA 수용체의 양을 조절하여 시냅스 [96][97]가소성에 영향을 미친다.
- 폴리아민은 NMDA 수용체를 직접 활성화하지 않고 글루타메이트 매개 반응을 증강하거나 억제하는 역할을 한다.
- Reelin은 Src 패밀리 키나아제 및 DAB1을 [98]통해 NMDA 기능을 조절하여 해마의 LTP를 크게 향상시킵니다.
- Src 키나제는 NMDA 수용체 [99]전류를 증가시킨다.
- Na+, K+, Ca는2+ NMDA 수용체 채널을 통과할 뿐만 아니라 NMDA [100]수용체의 활성을 조절한다.
- Zn2+ 및2+ Cu는 일반적으로 비경쟁적이고 전압에 의존하지 않는 방식으로 NMDA 전류 활동을 차단합니다.그러나 아연은 신경 [101]활동에 따라 전류를 강화하거나 억제할 수 있습니다.
- Pb는2+[102] 강력한 NMDAR 길항제이다.시냅스 형성 중 Pb 노출로 인한2+ 시냅스 전 결손은 NMDAR 의존성 BDNF 시그널링의 파괴에 의해 매개된다.
- 주요 조직적합성 복합체 클래스 I의 단백질은 성인 해마에서 NMDAR 매개 전류의 내인성 음성 조절제이며, AMPAR 밀매 및 NMDAR 의존 시냅스 [103]가소성 및 학습 및 기억의 [104][105]적절한 NMDAR 유도 변화에 필요하다.
- NMDA 수용체의 활성은 또한 pH의 변화에 현저하게 민감하며, 생리학적 [106]조건 하에서 H의+ 주변 농도에 의해 부분적으로 억제된다.양전하를 띤 삽입물 Exon 5를 포함하는 NR1a 아형을 포함하는 수용체에서 H에 의한+ 억제 수준은 크게 감소한다.이 삽입물의 효과는 양전하를 띤 폴리아민 및 아미노글리코시드에 의해 모방될 수 있으며, 이러한 작용 방식을 설명할 수 있습니다.
- NMDA 수용체 기능도 이른바 "레독스 조절 부위"[107]를 통해 화학적 감소와 산화에 의해 강하게 조절된다.이 사이트를 통해 환원제는 NMDA 채널 활성을 극적으로 증가시키는 반면 산화제는 환원제의 효과를 역전시키거나 자연 반응을 억제한다.일반적으로 NMDA 수용체는 글루타티온, 리포산 및 필수 영양소인 필롤로퀴놀린 퀴논과 같은 내인성 산화환원제에 의해 조절된다고 여겨진다.
NMDA 수용체 길항제 개발
신경 보호를 위한 NMDA 길항제 개발의 주요 문제는 생리적인 NMDA 수용체 활동이 정상적인 신경 기능에 필수적이라는 것이다.모든 NMDA 수용체 활동을 완전히 차단하면 환각, 교란 및 마취와 같은 부작용이 발생합니다.임상적으로 관련성이 있으려면 NMDA 수용체 길항제 작용이 [19]수용체의 정상적인 기능을 제한하지 않고 과도한 활성화 차단으로 제한되어야 한다.
경쟁 NMDA 수용체 길항제
먼저 개발된 경쟁력 있는 NMDA 수용체 길항제들은 작용제인 글루탐산염과 경쟁하고 수용체 상의 동일한 부위(NR2 서브유닛)와 결합하기 때문에 정상적인 기능도 [19][108]차단하기 때문에 좋은 옵션이 아니다.건강한 부위에는 병리학적 부위보다 더 낮은 수준의 작용제가 포함되어 있기 때문에 그들은 병리학적 부위에 영향을 미치기 전에 뇌의 건강한 부위를 차단할 것이다.이러한 길항제들은 흥분독성 [14]상황에서 존재할 수 있는 고농도의 글루탐산염에 의해 수용체로부터 치환될 수 있다.
비경쟁적 NMDA 수용체 길항제
비경쟁성 NMDA 수용체 길항제들은 Mg 부위2+(포어 영역)에서 이온 채널 내를 차단하여 Ca의 과도한2+ 유입을 방지한다.비경쟁적 길항작용은 글루탐산염 농도의 증가를 극복할 수 없는 블록의 일종으로 작용제에 의한 수용체의 사전 활성화에 의존하며, 즉 작용제에 의해 [19][109]개방될 때만 채널에 진입한다.
이러한 고친화성 차단제의 부작용으로 인해 신경변성 질환에 대한 임상적으로 성공한 NMDA 수용체 길항제 연구는 계속되었고 저친화성 차단제 개발에 초점을 맞췄다.그러나 친화력은 너무 낮으면 안 되며 막 탈분극이 블록을 완화시키는 (Mg에서2+ 볼 수 있는) 너무 짧으면 안 된다.따라서 채널 내 체류시간은 Mg보다2+ 길지만 MK-801보다는 짧은 비경쟁적 길항제 개발이 이루어졌다.그렇게 하면 이 약물이 NMDA 수용체와 관련된 채널을 과도하게 열었을 [19][109]뿐 정상적인 신경 전달은 차단하지 못할 것이다.메만틴이 그 약이에요그것은 처음에는 항인플루엔자제였으나 나중에 우연히 파킨슨병에 효과가 있다는 것을 발견한 아만타딘의 유도체이다.메만틴과 아만타딘의 화학적 구조는 그림 5에서 확인할 수 있다.이 화합물은 처음에는 도파민 작동성 또는 항콜린 작동성으로 생각되었으나 나중에 NMDA 수용체 [13][19]길항제인 것으로 밝혀졌다.
메만틴은 예를 들어 항콜린제로는 별로 효과가 없는 중증 알츠하이머병 치료에 승인된 [109]첫 번째 약이다.그것은 시냅스 기능의 회복에 도움을 주며, 그렇게 함으로써 손상된 기억력과 [17]학습을 개선합니다.2015년 메만틴은 또한 추가적인 신경 [93]질환의 치료적 중요성에 대한 시험도 진행 중이다.
많은 2세대 메만틴 유도체들은 훨씬 더 나은 신경 보호 효과를 보일 수 있는 개발 중에 있으며, 주요 생각은 관련된 이온 [93]채널 외에 NMDA 수용체에 다른 안전하지만 효과적인 조절 부위를 사용하는 것이다.
구조 활동 관계(SAR)
메만틴(1-아미노-3,5-디메틸라다만탄)은 아미노알킬시클로헥산 유도체 및 비평면 3차원 삼환 구조를 가진 비정형 약물 화합물이다.그림 8은 아미노알킬 시클로헥산 유도체의 SAR을 나타낸다.Memantine은 그 효과성을 위해 구조에 몇 가지 중요한 특징을 가지고 있습니다.
- 교두 아민이 있는 3륜 구조, -NH2
- -NH2 그룹은 양전하를 띠기 위해 신체의 생리학적 pH 하에서 양성자화된다. -NH3+
- 아만타딘(1-아다만타나민)[16][109]과 비교하여 체류 시간을 연장하고 안정성을 증가시키며 NMDA 수용체 채널에 대한 친화력을 증가시키는 역할을 하는 두 개의 메틸(CH3) 사이드 그룹.
두 개의 아다만탄 유도체인 memantine과 amantadine 사이의 구조적 차이가 작음에도 불구하고, NR1/NR2B 서브유닛의 결합 부위에 대한 친화력은 memantine에 대해 훨씬 더 크다.패치 클램프 측정에서 memantine의 IC는50 (2.3+0.3)μM이고 amantadine의 IC는50 (71.0+11.1)μM입니다.[26]친화력이 가장 높은 결합 부위를 지배적인 결합 부위라고 합니다.이는 메만틴의 아민기와 NR1/NR2B 서브유닛의 NR1-N161 결합 포켓 사이의 연결을 포함한다.메틸 사이드 그룹은 개방된 NMDA 수용체 채널에 대한 친화력을 높이고 아만타딘보다 훨씬 더 좋은 신경 보호 약물로 만드는 데 중요한 역할을 한다.메틸 그룹의 결합 포켓은 NR1/NR2B의 [30]NR1-A645 및 NR2B-A644에 있는 것으로 간주됩니다.결속 포켓은 그림 2에 나와 있습니다.메만틴은 NMDA 수용체 관련 채널 내의 Mg 부위2+ 또는 그 근처에 결합한다.체내 생리학적 pH 하에서2 양성자화된 메만틴의 -NH 그룹은 Mg [16]부위2+ 또는 그 부근에서 결합하는 영역을 나타낸다.메만틴 구조상의 -N에 두 개의 메틸기를 추가하면 친화력이 감소하여 (28.4+1.4) [26]μM의50 IC 값을 얻을 수 있다.
메만틴 2세대 유도체(니트로메만틴)
메만틴의 2세대 유도체인 니트로메만틴의 여러 유도체가 이들 신규 약물의 상세한 구조활성관계(SAR)를 수행하기 위해 합성되었다.교두 아민(NH)과2 반대편에 있는 니트로(NO2)기를 포함하는 한 클래스는 유망한 결과를 보였다.니트로메만틴은 NMDA 수용체 상의 메만틴 결합 부위를 이용하여 메만틴 결합 부위 외부의 S- 니트로실화/헥사스 부위와의 상호작용을 위해 NO(X=1 또는 2) 그룹을x 표적화한다.메만틴의 곁사슬을 길게 하는 것은2 –ONO[110] 그룹의 추가와 관련된 채널의 더 나쁜 약물 친화력을 보상한다.
치료용 응용 프로그램
흥분독성은 알츠하이머병, 파킨슨병, 헌팅턴병, 근위축성 측삭경화증과 [14][15][16][17]같은 신경변성 질환에 관여하는 것으로 암시된다.따라서 NMDA 수용체의 차단은 이론적으로 그러한 [14][15][16]질병을 치료하는데 유용할 수 있다.그러나 생리학적 NMDA 수용체의 과도한 흥분독성 활성을 차단하면서 NMDA 수용체 활성을 보존하는 것이 중요하다.이것은 경쟁적이지 않은 길항제들에 의해 달성될 수 있으며, 과도하게 개방되었을 때 수용체 이온 채널을 차단한다.
메만틴은 신경변성 질환 알츠하이머에 대한 적응증을 승인한 비경쟁적 NMDA 수용체 길항제이다.2015년에도 메만틴은 여전히 추가적인 신경 [30][93]질환에 대한 임상시험을 진행 중이다.
수용체 변조
NMDA 수용체는 Ca와 Na를+ 세포로, K를+ 세포2+ 밖으로 통과시킬 수 있는 비특이적인 양이온 채널이다.NMDA 수용체의 활성화에 의해 생성된 흥분성 시냅스 후 전위(EPSP)는 세포 내 Ca 농도를2+ 증가시킨다.Ca는 다양한2+ 시그널링 경로에서 두 번째 메신저로 기능할 수 있습니다.그러나 NMDA 수용체 양이온 채널은 휴지막 전위에서 [111]Mg에 의해2+ 차단된다.마그네슘 차단 해제는 순간적이지 않습니다. 사용 가능한 모든 채널을 차단 해제하려면 시냅스 후 세포를 충분히 오랜 시간(밀리초 [112]단위) 동안 탈분극해야 합니다.
따라서 NMDA 수용체는 "분자 일치 검출기"로 기능한다.글루탐산염은 수용체에 결합하고 시냅스 후 세포는 탈분극(채널을 차단하는 Mg를2+ 제거함)되는 두 조건이 충족될 때만 이온 채널이 열립니다.NMDA 수용체의 이러한 특성은 장기 증강(LTP) 및 시냅스 가소성의 [113]많은 측면을 설명합니다.
휴지막 전위에서는 NMDA 수용체 기공이 개방되어 외부 마그네슘 이온이 결합하여 유입되어 더 이상의 이온 [114]투과를 방지할 수 있다.외부 마그네슘 이온은 밀리몰 범위에 있고 세포 내 마그네슘 이온은 마이크로몰 범위에 있어 음의 막 전위를 일으킨다.NMDA 수용체는 다수의 내인성 및 외인성 화합물에 의해 조절되며 광범위한 생리학적 과정(예: 기억) 및 병리학적 과정(예: 흥분독성)에서 중요한 역할을 한다.마그네슘은 NMDA 채널을 차단하면서 양의 막 전위에서 NMDA 유도 반응을 증강시키는 역할을 합니다.칼슘, 칼륨 및 나트륨의 사용은 NMDA 막을 통과하는 NMDAR의 활성을 조절하는 데 사용됩니다.H+ 농도의 변화는 다양한 생리 조건에서 NMDA 수용체의 활성을 부분적으로 억제할 수 있다.
임상적 의의
전신마취제로는 케타민, 에스케타민, 타일타민, 펜시클리딘, 아산화질소, 제논 등의 NMDAR 길항제들이 사용된다.덱스트로메토르판, 메톡세타민과 같은 이러한 유사한 약물들은 또한 해리성, 환각성, 그리고 행복감을 유발하는 효과를 만들어 내고 레크리에이션 약물로 사용된다.
케타민, esketamine(JNJ-54135419),rapastinel(GLYX-13),apimostinel(NRX-1074),zelquistinel(AGN-241751),4-chlorokynurenine(AV-101), 그리고 rislenemdaz(CERC-301, MK-0657)등 NMDAR-targeted 화합물, 개발 중에 기분 장애의 치료를 받기 위해 주요 우울 장애와 항료성 우울증 등이 포함된다.[78][79][115]게다가, 케타민은 이미 일부 [116][117]클리닉에서 오프 라벨 치료법으로 사용되고 있다.
연구에 따르면 티안펩틴은 글루탐산염 수용체 활성의 간접적인 변화 및 억제를 통해 항우울제 효과를 발생시키고 신경 [118][119][120][121][122]가소성에 영향을 미칩니다.티안펩틴은 또한 NMDA와 AMPA [118][122]수용체에도 작용한다.동물 모델에서 티안펩틴은 편도체와 해마에서 글루탐산성 신경전달의 병리학적 스트레스에 의한 변화를 억제한다.
저선량 NMDAR 길항제인 메만틴은 미국과 유럽에서 중증에서 중증 알츠하이머병의 [123]치료를 위해 승인되었으며, 현재 영국 국립 건강 관리 연구소로부터 다른 치료 [124]방법들에 실패한 환자들에 대한 제한적인 권고를 받았다.
달팽이관 NMDARs는 이명을 치료하기 위한 약리학적 해결책을 찾기 위한 집중적인 연구의 대상이다.NMDARs는 희귀 자가면역질환인 항NMDA 수용체 뇌염(NMDAR[125] 뇌염이라고도 함)과 관련되는데, 이는 기형종에서 발견되는 것과 같은 이소성 뇌조직에 대한 면역체계에 의해 생성된 항체의 교차 반응으로 인해 주로 발생한다.이것들은 항글루탐산 수용체 항체로 알려져 있다.
필로폰과 같은 도파민성 자극제와 비교하여 NMDAR 길항제 펜시클리딘은 건강한 지원자들에게 정신분열증과 유사한 광범위한 증상을 일으킬 수 있으며, 이는 정신분열증의 [126]글루탐산 가설을 이끌었다.설치류가 NMDA 수용체 길항제 치료를 받는 실험은 새로운 정신분열증 치료법의 테스트나 정신분열증 치료에 이미 승인된 약물의 정확한 메커니즘을 탐구할 때 오늘날 가장 일반적인 모델이다.
예를 들어 엘리프로딜, 가베스티넬, 리코스티넬 및 셀프텔과 같은 NMDAR 길항제들은 허혈성 뇌졸중 및 외상성 뇌손상과 같은 상황에서 흥분독성 매개 신경독성 치료를 위해 광범위하게 연구되어 왔지만 진정제를 피하기 위해 소량으로 사용된 임상시험에서는 성공하지 못했지만 NMDAR 길항제들은 S를 차단할 수 있다.동물과 뇌손상 [127]환자에게서 탈분극이 유행하고 있다.이 용도는 임상시험에서 아직 시험되지 않았다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b Laube B, Hirai H, Sturgess M, Betz H, Kuhse J (March 1997). "Molecular determinants of agonist discrimination by NMDA receptor subunits: analysis of the glutamate binding site on the NR2B subunit". Neuron. 18 (3): 493–503. doi:10.1016/S0896-6273(00)81249-0. PMID 9115742.
Since two molecules of glutamate and glycine each are thought to be required for channel activation (3, 6), this implies that the NMDA receptor should be composed of at least four subunits.
- ^ a b Anson LC, Chen PE, Wyllie DJ, Colquhoun D, Schoepfer R (January 1998). "Identification of amino acid residues of the NR2A subunit that control glutamate potency in recombinant NR1/NR2A NMDA receptors". The Journal of Neuroscience. 18 (2): 581–589. doi:10.1523/JNEUROSCI.18-02-00581.1998. PMC 6792534. PMID 9425000.
- ^ a b Furukawa H, Singh SK, Mancusso R, Gouaux E (November 2005). "Subunit arrangement and function in NMDA receptors". Nature. 438 (7065): 185–192. Bibcode:2005Natur.438..185F. doi:10.1038/nature04089. PMID 16281028. S2CID 4400777.
- ^ Li F, Tsien JZ (July 2009). "Memory and the NMDA receptors". The New England Journal of Medicine. 361 (3): 302–303. doi:10.1056/NEJMcibr0902052. PMC 3703758. PMID 19605837.
- ^ Moriyoshi K, Masu M, Ishii T, Shigemoto R, Mizuno N, Nakanishi S (November 1991). "Molecular cloning and characterization of the rat NMDA receptor". Nature. 354 (6348): 31–37. Bibcode:1991Natur.354...31M. doi:10.1038/354031a0. PMID 1834949. S2CID 4368947.
- ^ a b Dingledine R, Borges K, Bowie D, Traynelis SF (March 1999). "The glutamate receptor ion channels". Pharmacological Reviews. 51 (1): 7–61. PMID 10049997.
- ^ Liu Y, Zhang J (October 2000). "Recent development in NMDA receptors". Chinese Medical Journal. 113 (10): 948–956. PMID 11775847.
- ^ Cull-Candy S, Brickley S, Farrant M (June 2001). "NMDA receptor subunits: diversity, development and disease". Current Opinion in Neurobiology. 11 (3): 327–335. doi:10.1016/S0959-4388(00)00215-4. PMID 11399431. S2CID 11929361.
- ^ a b Paoletti P, Neyton J (February 2007). "NMDA receptor subunits: function and pharmacology". Current Opinion in Pharmacology. 7 (1): 39–47. doi:10.1016/j.coph.2006.08.011. PMID 17088105.
- ^ Sánchez-Blázquez P, Rodríguez-Muñoz M, Vicente-Sánchez A, Garzón J (November 2013). "Cannabinoid receptors couple to NMDA receptors to reduce the production of NO and the mobilization of zinc induced by glutamate". Antioxidants & Redox Signaling. 19 (15): 1766–1782. doi:10.1089/ars.2012.5100. PMC 3837442. PMID 23600761.
- ^ Castelli MP, Madeddu C, Casti A, Casu A, Casti P, Scherma M, et al. (2014-05-20). "Δ9-tetrahydrocannabinol prevents methamphetamine-induced neurotoxicity". PLOS ONE. 9 (5): e98079. Bibcode:2014PLoSO...998079C. doi:10.1371/journal.pone.0098079. PMC 4028295. PMID 24844285.
- ^ a b c d Johnson JW, Kotermanski SE (February 2006). "Mechanism of action of memantine". Current Opinion in Pharmacology. 6 (1): 61–67. doi:10.1016/j.coph.2005.09.007. PMID 16368266.
- ^ a b c d Dominguez E, Chin TY, Chen CP, Wu TY (December 2011). "Management of moderate to severe Alzheimer's disease: focus on memantine". Taiwanese Journal of Obstetrics & Gynecology. 50 (4): 415–423. doi:10.1016/j.tjog.2011.10.004. PMID 22212311.
- ^ a b c d e f g h Chen HS, Lipton SA (June 2006). "The chemical biology of clinically tolerated NMDA receptor antagonists". Journal of Neurochemistry. 97 (6): 1611–1626. doi:10.1111/j.1471-4159.2006.03991.x. PMID 16805772. S2CID 18376541.
- ^ a b c d e Kemp JA, McKernan RM (November 2002). "NMDA receptor pathways as drug targets". Nature Neuroscience. 5 (11): 1039–1042. doi:10.1038/nn936. PMID 12403981. S2CID 41383776.
- ^ a b c d e f g h i j k l Lipton SA (February 2006). "Paradigm shift in neuroprotection by NMDA receptor blockade: memantine and beyond". Nature Reviews. Drug Discovery. 5 (2): 160–170. doi:10.1038/nrd1958. PMID 16424917. S2CID 21379258.
- ^ a b c d Koch HJ, Szecsey A, Haen E (1 January 2004). "NMDA-antagonism (memantine): an alternative pharmacological therapeutic principle in Alzheimer's and vascular dementia". Current Pharmaceutical Design. 10 (3): 253–259. doi:10.2174/1381612043386392. PMID 14754385.
- ^ Steullet P, Neijt HC, Cuénod M, Do KQ (February 2006). "Synaptic plasticity impairment and hypofunction of NMDA receptors induced by glutathione deficit: relevance to schizophrenia". Neuroscience. 137 (3): 807–819. doi:10.1016/j.neuroscience.2005.10.014. PMID 16330153. S2CID 1417873.
- ^ a b c d e f g Lipton SA (January 2004). "Failures and successes of NMDA receptor antagonists: molecular basis for the use of open-channel blockers like memantine in the treatment of acute and chronic neurologic insults". NeuroRx. 1 (1): 101–110. doi:10.1602/neurorx.1.1.101. PMC 534915. PMID 15717010.
- ^ Yamakura T, Shimoji K (October 1999). "Subunit- and site-specific pharmacology of the NMDA receptor channel". Progress in Neurobiology. 59 (3): 279–298. doi:10.1016/S0301-0082(99)00007-6. PMID 10465381. S2CID 24726102.
- ^ Watkins JC, Jane DE (January 2006). "The glutamate story". British Journal of Pharmacology. 147 (S1): S100–S108. doi:10.1038/sj.bjp.0706444. PMC 1760733. PMID 16402093.
- ^ a b c Hardingham GE, Fukunaga Y, Bading H (May 2002). "Extrasynaptic NMDARs oppose synaptic NMDARs by triggering CREB shut-off and cell death pathways". Nature Neuroscience. 5 (5): 405–414. doi:10.1038/nn835. PMID 11953750. S2CID 659716.
- ^ a b c Hardingham GE, Bading H (October 2010). "Synaptic versus extrasynaptic NMDA receptor signalling: implications for neurodegenerative disorders". Nature Reviews. Neuroscience. 11 (10): 682–696. doi:10.1038/nrn2911. PMC 2948541. PMID 20842175.
- ^ Bading H (March 2017). "Therapeutic targeting of the pathological triad of extrasynaptic NMDA receptor signaling in neurodegenerations". The Journal of Experimental Medicine. 214 (3): 569–578. doi:10.1084/jem.20161673. PMC 5339681. PMID 28209726.
- ^ a b Yan J, Bengtson CP, Buchthal B, Hagenston AM, Bading H (October 2020). "Coupling of NMDA receptors and TRPM4 guides discovery of unconventional neuroprotectants". Science. 370 (6513): eaay3302. doi:10.1126/science.aay3302. PMID 33033186. S2CID 222210921.
- ^ a b c d e Wanka L, Iqbal K, Schreiner PR (May 2013). "The lipophilic bullet hits the targets: medicinal chemistry of adamantane derivatives". Chemical Reviews. 113 (5): 3516–3604. doi:10.1021/cr100264t. PMC 3650105. PMID 23432396.
- ^ Salussolia CL, Prodromou ML, Borker P, Wollmuth LP (August 2011). "Arrangement of subunits in functional NMDA receptors". The Journal of Neuroscience. 31 (31): 11295–11304. doi:10.1523/JNEUROSCI.5612-10.2011. PMC 3207322. PMID 21813689.
- ^ a b Loftis JM, Janowsky A (January 2003). "The N-methyl-D-aspartate receptor subunit NR2B: localization, functional properties, regulation, and clinical implications". Pharmacology & Therapeutics. 97 (1): 55–85. doi:10.1016/s0163-7258(02)00302-9. PMID 12493535.
- ^ a b Kristiansen LV, Huerta I, Beneyto M, Meador-Woodruff JH (February 2007). "NMDA receptors and schizophrenia". Current Opinion in Pharmacology. 7 (1): 48–55. doi:10.1016/j.coph.2006.08.013. PMID 17097347.
- ^ a b c d Limapichat W, Yu WY, Branigan E, Lester HA, Dougherty DA (February 2013). "Key binding interactions for memantine in the NMDA receptor". ACS Chemical Neuroscience. 4 (2): 255–260. doi:10.1021/cn300180a. PMC 3751542. PMID 23421676.
- ^ Maher, T.J. (2013년)마취제:전신 마취와 국소 마취.수신자: T.L. Lemke & D.A.윌리엄스(편집자).포이의 약화학 원리(16장)필라델피아: 리핀콧 윌리엄스 & 윌킨스
- ^ Danysz W, Parsons CG (September 2003). "The NMDA receptor antagonist memantine as a symptomatological and neuroprotective treatment for Alzheimer's disease: preclinical evidence". International Journal of Geriatric Psychiatry. 18 (Suppl 1): S23–S32. doi:10.1002/gps.938. PMID 12973747. S2CID 14852616.
- ^ Stephenson FA (November 2006). "Structure and trafficking of NMDA and GABAA receptors". Biochemical Society Transactions. 34 (Pt 5): 877–881. doi:10.1042/BST0340877. PMID 17052219. S2CID 24875113.
- ^ Teng H, Cai W, Zhou L, Zhang J, Liu Q, Wang Y, et al. (October 2010). "Evolutionary mode and functional divergence of vertebrate NMDA receptor subunit 2 genes". PLOS ONE. 5 (10): e13342. Bibcode:2010PLoSO...513342T. doi:10.1371/journal.pone.0013342. PMC 2954789. PMID 20976280.
- ^ Ryan TJ, Grant SG (October 2009). "The origin and evolution of synapses". Nature Reviews. Neuroscience. 10 (10): 701–712. doi:10.1038/nrn2717. PMID 19738623. S2CID 5164419.
- ^ Georgiev D, Taniura H, Kambe Y, Takarada T, Yoneda Y (August 2008). "A critical importance of polyamine site in NMDA receptors for neurite outgrowth and fasciculation at early stages of P19 neuronal differentiation". Experimental Cell Research. 314 (14): 2603–2617. doi:10.1016/j.yexcr.2008.06.009. PMID 18586028.
- ^ Bunk EC, König HG, Prehn JH, Kirby BP (June 2014). "Effect of the N-methyl-D-aspartate NR2B subunit antagonist ifenprodil on precursor cell proliferation in the hippocampus". Journal of Neuroscience Research. 92 (6): 679–691. doi:10.1002/jnr.23347. PMID 24464409. S2CID 18582691.
- ^ Wang M, Yang Y, Wang CJ, Gamo NJ, Jin LE, Mazer JA, et al. (February 2013). "NMDA receptors subserve persistent neuronal firing during working memory in dorsolateral prefrontal cortex". Neuron. 77 (4): 736–749. doi:10.1016/j.neuron.2012.12.032. PMC 3584418. PMID 23439125.
- ^ Yang ST, Wang M, Paspalas CD, Crimins JL, Altman MT, Mazer JA, Arnsten AF (April 2018). "Core Differences in Synaptic Signaling Between Primary Visual and Dorsolateral Prefrontal Cortex". Cerebral Cortex. 28 (4): 1458–1471. doi:10.1093/cercor/bhx357. PMC 6041807. PMID 29351585.
- ^ Burt JB, Demirtaş M, Eckner WJ, Navejar NM, Ji JL, Martin WJ, et al. (September 2018). "Hierarchy of transcriptomic specialization across human cortex captured by structural neuroimaging topography". Nature Neuroscience. 21 (9): 1251–1259. doi:10.1038/s41593-018-0195-0. PMC 6119093. PMID 30082915.
- ^ Muntané G, Horvath JE, Hof PR, Ely JJ, Hopkins WD, Raghanti MA, et al. (June 2015). "Analysis of synaptic gene expression in the neocortex of primates reveals evolutionary changes in glutamatergic neurotransmission". Cerebral Cortex. 25 (6): 1596–1607. doi:10.1093/cercor/bht354. PMC 4428301. PMID 24408959.
- ^ Bar-Shira O, Maor R, Chechik G (December 2015). "Gene Expression Switching of Receptor Subunits in Human Brain Development". PLOS Computational Biology. 11 (12): e1004559. Bibcode:2015PLSCB..11E4559B. doi:10.1371/journal.pcbi.1004559. PMC 4670163. PMID 26636753.
- ^ Liu XB, Murray KD, Jones EG (October 2004). "Switching of NMDA receptor 2A and 2B subunits at thalamic and cortical synapses during early postnatal development". The Journal of Neuroscience. 24 (40): 8885–8895. doi:10.1523/JNEUROSCI.2476-04.2004. PMC 6729956. PMID 15470155.
- ^ Tsien JZ (April 2000). "Building a brainier mouse". Scientific American. 282 (4): 62–68. Bibcode:2000SciAm.282d..62T. doi:10.1038/scientificamerican0400-62. PMID 10789248.
- ^ Liu Y, Wong TP, Aarts M, Rooyakkers A, Liu L, Lai TW, et al. (March 2007). "NMDA receptor subunits have differential roles in mediating excitotoxic neuronal death both in vitro and in vivo". The Journal of Neuroscience. 27 (11): 2846–2857. doi:10.1523/JNEUROSCI.0116-07.2007. PMC 6672582. PMID 17360906.
- ^ Zhou M, Baudry M (March 2006). "Developmental changes in NMDA neurotoxicity reflect developmental changes in subunit composition of NMDA receptors". The Journal of Neuroscience. 26 (11): 2956–2963. doi:10.1523/JNEUROSCI.4299-05.2006. PMC 6673978. PMID 16540573.
- ^ Sprengel R, Suchanek B, Amico C, Brusa R, Burnashev N, Rozov A, et al. (January 1998). "Importance of the intracellular domain of NR2 subunits for NMDA receptor function in vivo". Cell. 92 (2): 279–289. doi:10.1016/S0092-8674(00)80921-6. PMID 9458051. S2CID 9791935.
- ^ Groc L, Choquet D, Stephenson FA, Verrier D, Manzoni OJ, Chavis P (September 2007). "NMDA receptor surface trafficking and synaptic subunit composition are developmentally regulated by the extracellular matrix protein Reelin". The Journal of Neuroscience. 27 (38): 10165–10175. doi:10.1523/JNEUROSCI.1772-07.2007. PMC 6672660. PMID 17881522.
- ^ Espinosa JS, Luo L (March 2008). "Timing neurogenesis and differentiation: insights from quantitative clonal analyses of cerebellar granule cells". The Journal of Neuroscience. 28 (10): 2301–2312. doi:10.1523/JNEUROSCI.5157-07.2008. PMC 2586640. PMID 18322077.
- ^ Gajendran N, Kapfhammer JP, Lain E, Canepari M, Vogt K, Wisden W, Brenner HR (February 2009). "Neuregulin signaling is dispensable for NMDA- and GABA(A)-receptor expression in the cerebellum in vivo". The Journal of Neuroscience. 29 (8): 2404–2413. doi:10.1523/JNEUROSCI.4303-08.2009. PMC 6666233. PMID 19244516.
- ^ a b c d e f g h i j k l Parsons MP, Raymond LA (April 2014). "Extrasynaptic NMDA receptor involvement in central nervous system disorders". Neuron. 82 (2): 279–293. doi:10.1016/j.neuron.2014.03.030. PMID 24742457.
- ^ Choi DW, Koh JY, Peters S (January 1988). "Pharmacology of glutamate neurotoxicity in cortical cell culture: attenuation by NMDA antagonists". The Journal of Neuroscience. 8 (1): 185–196. doi:10.1523/JNEUROSCI.08-01-00185.1988. PMC 6569373. PMID 2892896.
- ^ Henchcliffe C (2007). Handbook of Clinical Neurology. New York, NY, USA: Weill Medical College of Cornell University, Department of Neurology and Neuroscience. pp. 553–569.
- ^ a b c Hardingham GE, Bading H (February 2003). "The Yin and Yang of NMDA receptor signalling". Trends in Neurosciences. 26 (2): 81–89. doi:10.1016/s0166-2236(02)00040-1. PMID 12536131. S2CID 26207057.
- ^ Xia P, Chen HS, Zhang D, Lipton SA (August 2010). "Memantine preferentially blocks extrasynaptic over synaptic NMDA receptor currents in hippocampal autapses". The Journal of Neuroscience. 30 (33): 11246–11250. doi:10.1523/JNEUROSCI.2488-10.2010. PMC 2932667. PMID 20720132.
- ^ Wang Y, Briz V, Chishti A, Bi X, Baudry M (November 2013). "Distinct roles for μ-calpain and m-calpain in synaptic NMDAR-mediated neuroprotection and extrasynaptic NMDAR-mediated neurodegeneration". The Journal of Neuroscience. 33 (48): 18880–18892. doi:10.1523/JNEUROSCI.3293-13.2013. PMC 3841454. PMID 24285894.
- ^ Xu J, Kurup P, Zhang Y, Goebel-Goody SM, Wu PH, Hawasli AH, et al. (July 2009). "Extrasynaptic NMDA receptors couple preferentially to excitotoxicity via calpain-mediated cleavage of STEP". The Journal of Neuroscience. 29 (29): 9330–9343. doi:10.1523/JNEUROSCI.2212-09.2009. PMC 2737362. PMID 19625523.
- ^ Karpova A, Mikhaylova M, Bera S, Bär J, Reddy PP, Behnisch T, et al. (February 2013). "Encoding and transducing the synaptic or extrasynaptic origin of NMDA receptor signals to the nucleus". Cell. 152 (5): 1119–1133. doi:10.1016/j.cell.2013.02.002. PMID 23452857.
- ^ Hunt DL, Castillo PE (June 2012). "Synaptic plasticity of NMDA receptors: mechanisms and functional implications". Current Opinion in Neurobiology. 22 (3): 496–508. doi:10.1016/j.conb.2012.01.007. PMC 3482462. PMID 22325859.
- ^ Li S, Jin M, Koeglsperger T, Shepardson NE, Shankar GM, Selkoe DJ (May 2011). "Soluble Aβ oligomers inhibit long-term potentiation through a mechanism involving excessive activation of extrasynaptic NR2B-containing NMDA receptors". The Journal of Neuroscience. 31 (18): 6627–6638. doi:10.1523/JNEUROSCI.0203-11.2011. PMC 3100898. PMID 21543591.
- ^ Liu DD, Yang Q, Li ST (April 2013). "Activation of extrasynaptic NMDA receptors induces LTD in rat hippocampal CA1 neurons". Brain Research Bulletin. 93: 10–16. doi:10.1016/j.brainresbull.2012.12.003. PMID 23270879. S2CID 7836184.
- ^ Papouin T, Ladépêche L, Ruel J, Sacchi S, Labasque M, Hanini M, et al. (August 2012). "Synaptic and extrasynaptic NMDA receptors are gated by different endogenous coagonists". Cell. 150 (3): 633–646. doi:10.1016/j.cell.2012.06.029. PMID 22863013.
- ^ Sanz-Clemente A, Nicoll RA, Roche KW (February 2013). "Diversity in NMDA receptor composition: many regulators, many consequences". The Neuroscientist. 19 (1): 62–75. doi:10.1177/1073858411435129. PMC 3567917. PMID 22343826.
- ^ Petralia RS, Wang YX, Hua F, Yi Z, Zhou A, Ge L, et al. (April 2010). "Organization of NMDA receptors at extrasynaptic locations". Neuroscience. 167 (1): 68–87. doi:10.1016/j.neuroscience.2010.01.022. PMC 2840201. PMID 20096331.
- ^ Lai TW, Shyu WC, Wang YT (May 2011). "Stroke intervention pathways: NMDA receptors and beyond". Trends in Molecular Medicine. 17 (5): 266–275. doi:10.1016/j.molmed.2010.12.008. PMID 21310659.
- ^ Fourie C, Li D, Montgomery JM (February 2014). "The anchoring protein SAP97 influences the trafficking and localisation of multiple membrane channels". Biochimica et Biophysica Acta (BBA) - Biomembranes. 1838 (2): 589–594. doi:10.1016/j.bbamem.2013.03.015. PMID 23535319.
- ^ Lucas DR, Newhouse JP (August 1957). "The toxic effect of sodium L-glutamate on the inner layers of the retina". A.M.A. Archives of Ophthalmology. 58 (2): 193–201. doi:10.1001/archopht.1957.00940010205006. PMID 13443577.
- ^ Milnerwood AJ, Gladding CM, Pouladi MA, Kaufman AM, Hines RM, Boyd JD, et al. (January 2010). "Early increase in extrasynaptic NMDA receptor signaling and expression contributes to phenotype onset in Huntington's disease mice". Neuron. 65 (2): 178–190. doi:10.1016/j.neuron.2010.01.008. PMID 20152125. S2CID 12987037.
- ^ Smith RS, Walsh CA (February 2020). "Ion Channel Functions in Early Brain Development". Trends in Neurosciences. 43 (2): 103–114. doi:10.1016/j.tins.2019.12.004. PMC 7092371. PMID 31959360.
- ^ Chen PE, Geballe MT, Stansfeld PJ, Johnston AR, Yuan H, Jacob AL, et al. (May 2005). "Structural features of the glutamate binding site in recombinant NR1/NR2A N-methyl-D-aspartate receptors determined by site-directed mutagenesis and molecular modeling". Molecular Pharmacology. 67 (5): 1470–1484. doi:10.1124/mol.104.008185. PMID 15703381. S2CID 13505187.
- ^ Wolosker H (October 2006). "D-serine regulation of NMDA receptor activity". Science's STKE. 2006 (356): pe41. doi:10.1126/stke.3562006pe41. PMID 17033043. S2CID 39125762.
- ^ Yarotskyy V, Glushakov AV, Sumners C, Gravenstein N, Dennis DM, Seubert CN, Martynyuk AE (May 2005). "Differential modulation of glutamatergic transmission by 3,5-dibromo-L-phenylalanine". Molecular Pharmacology. 67 (5): 1648–1654. doi:10.1124/mol.104.005983. PMID 15687225. S2CID 11672391.
- ^ Martynyuk AE, Seubert CN, Yarotskyy V, Glushakov AV, Gravenstein N, Sumners C, Dennis DM (November 2006). "Halogenated derivatives of aromatic amino acids exhibit balanced antiglutamatergic actions: potential applications for the treatment of neurological and neuropsychiatric disorders". Recent Patents on CNS Drug Discovery. 1 (3): 261–270. doi:10.2174/157488906778773706. PMID 18221208.
- ^ Cao W, Shah HP, Glushakov AV, Mecca AP, Shi P, Sumners C, et al. (December 2009). "Efficacy of 3,5-dibromo-L-phenylalanine in rat models of stroke, seizures and sensorimotor gating deficit". British Journal of Pharmacology. 158 (8): 2005–2013. doi:10.1111/j.1476-5381.2009.00498.x. PMC 2807662. PMID 20050189.
- ^ J. 모스칼, D.리앤더, R. 버치(2010).NMDA 수용체의 치료 잠재력 잠금 해제.약물 검출 및 개발 뉴스.2013년 12월 19일 취득.
- ^ Donello, John E.; Banerjee, Pradeep; Li, Yong-Xin; Guo, Yuan-Xing; Yoshitake, Takashi; Zhang, Xiao-Lei; Miry, Omid; Kehr, Jan; Stanton, Patric K.; Gross, Amanda L.; Burgdorf, Jeffery S. (2019-03-01). "Positive N-Methyl-D-Aspartate Receptor Modulation by Rapastinel Promotes Rapid and Sustained Antidepressant-Like Effects". The International Journal of Neuropsychopharmacology. 22 (3): 247–259. doi:10.1093/ijnp/pyy101. ISSN 1469-5111. PMC 6403082. PMID 30544218.
- ^ Anderson C (2003-06-01). "The Bad News Isn't In: A Look at Dissociative-Induced Brain Damage and Cognitive Impairment". Erowid DXM Vaults : Health. Retrieved 2008-12-17.
- ^ a b Flight MH (December 2013). "Trial watch: phase II boost for glutamate-targeted antidepressants". Nature Reviews. Drug Discovery. 12 (12): 897. doi:10.1038/nrd4178. PMID 24287771. S2CID 33113283.
- ^ a b Vécsei L, Szalárdy L, Fülöp F, Toldi J (January 2013). "Kynurenines in the CNS: recent advances and new questions". Nature Reviews. Drug Discovery. 12 (1): 64–82. doi:10.1038/nrd3793. PMID 23237916. S2CID 31914015.
- ^ Reis DJ, Regunathan S (May 2000). "Is agmatine a novel neurotransmitter in brain?". Trends in Pharmacological Sciences. 21 (5): 187–193. doi:10.1016/s0165-6147(00)01460-7. PMID 10785653.
- ^ Gibson DA, Harris BR, Rogers DT, Littleton JM (October 2002). "Radioligand binding studies reveal agmatine is a more selective antagonist for a polyamine-site on the NMDA receptor than arcaine or ifenprodil". Brain Research. 952 (1): 71–77. doi:10.1016/s0006-8993(02)03198-0. PMID 12363406. S2CID 38065910.
- ^ Mueller AL, Artman LD, Balandrin MF, Brady E, Chien Y, DelMar EG, et al. (2000). "NPS 1506, a moderate affinity uncompetitive NMDA receptor antagonist: preclinical summary and clinical experience". Amino Acids. 19 (1): 177–179. doi:10.1007/s007260070047. PMID 11026487. S2CID 2899648.
- ^ Monge-Fuentes V, Gomes FM, Campos GA, Silva J, Biolchi AM, Dos Anjos LC, et al. (2015). "Neuroactive compounds obtained from arthropod venoms as new therapeutic platforms for the treatment of neurological disorders". The Journal of Venomous Animals and Toxins Including Tropical Diseases. 21: 31. doi:10.1186/s40409-015-0031-x. PMC 4529710. PMID 26257776.
- ^ Pop E (September 2000). "Nonpsychotropic synthetic cannabinoids". Current Pharmaceutical Design. 6 (13): 1347–1360. doi:10.2174/1381612003399446. PMID 10903397.
- ^ Feigenbaum JJ, Bergmann F, Richmond SA, Mechoulam R, Nadler V, Kloog Y, Sokolovsky M (December 1989). "Nonpsychotropic cannabinoid acts as a functional N-methyl-D-aspartate receptor blocker". Proceedings of the National Academy of Sciences of the United States of America. 86 (23): 9584–9587. Bibcode:1989PNAS...86.9584F. doi:10.1073/pnas.86.23.9584. PMC 298542. PMID 2556719.
- ^ Nadler V, Mechoulam R, Sokolovsky M (September 1993). "Blockade of 45Ca2+ influx through the N-methyl-D-aspartate receptor ion channel by the non-psychoactive cannabinoid HU-211". Brain Research. 622 (1–2): 79–85. doi:10.1016/0006-8993(93)90804-v. PMID 8242387. S2CID 36689761.
- ^ Karakas E, Simorowski N, Furukawa H (June 2011). "Subunit arrangement and phenylethanolamine binding in GluN1/GluN2B NMDA receptors". Nature. 475 (7355): 249–253. doi:10.1038/nature10180. PMC 3171209. PMID 21677647.
- ^ Glushakov AV, Dennis DM, Morey TE, Sumners C, Cucchiara RF, Seubert CN, Martynyuk AE (2002). "Specific inhibition of N-methyl-D-aspartate receptor function in rat hippocampal neurons by L-phenylalanine at concentrations observed during phenylketonuria". Molecular Psychiatry. 7 (4): 359–367. doi:10.1038/sj.mp.4000976. PMID 11986979.
- ^ Glushakov AV, Glushakova O, Varshney M, Bajpai LK, Sumners C, Laipis PJ, et al. (February 2005). "Long-term changes in glutamatergic synaptic transmission in phenylketonuria". Brain. 128 (Pt 2): 300–307. doi:10.1093/brain/awh354. PMID 15634735.
- ^ 임상시험번호 NCT00188383 - "N-Methyl-D-Aspartate (NMDA)-수용체 길항작용이 과알제증, 오피오이드 사용 및 래디칼 전립선 절제술 후 통증에 미치는 영향" (ClinicalTrials.gov )
- ^ Ludolph AG, Udvardi PT, Schaz U, Henes C, Adolph O, Weigt HU, et al. (May 2010). "Atomoxetine acts as an NMDA receptor blocker in clinically relevant concentrations". British Journal of Pharmacology. 160 (2): 283–291. doi:10.1111/j.1476-5381.2010.00707.x. PMC 2874851. PMID 20423340.
- ^ Shultz RB, Zhong Y (May 2017). "Minocycline targets multiple secondary injury mechanisms in traumatic spinal cord injury". Neural Regeneration Research. 12 (5): 702–713. doi:10.4103/1673-5374.206633. PMC 5461601. PMID 28616020.
- ^ a b c d Lipton SA (October 2007). "Pathologically activated therapeutics for neuroprotection". Nature Reviews. Neuroscience. 8 (10): 803–808. doi:10.1038/nrn2229. PMID 17882256. S2CID 34931289.
- ^ Skolnick P, Boje K, Miller R, Pennington M, Maccecchini ML (October 1992). "Noncompetitive inhibition of N-methyl-D-aspartate by conantokin-G: evidence for an allosteric interaction at polyamine sites". Journal of Neurochemistry. 59 (4): 1516–1521. doi:10.1111/j.1471-4159.1992.tb08468.x. PMID 1328523. S2CID 25871948.
- ^ Huggins DJ, Grant GH (January 2005). "The function of the amino terminal domain in NMDA receptor modulation". Journal of Molecular Graphics & Modelling. 23 (4): 381–388. doi:10.1016/j.jmgm.2004.11.006. PMID 15670959.
- ^ Hawasli AH, Benavides DR, Nguyen C, Kansy JW, Hayashi K, Chambon P, et al. (July 2007). "Cyclin-dependent kinase 5 governs learning and synaptic plasticity via control of NMDAR degradation". Nature Neuroscience. 10 (7): 880–886. doi:10.1038/nn1914. PMC 3910113. PMID 17529984.
- ^ Zhang S, Edelmann L, Liu J, Crandall JE, Morabito MA (January 2008). "Cdk5 regulates the phosphorylation of tyrosine 1472 NR2B and the surface expression of NMDA receptors". The Journal of Neuroscience. 28 (2): 415–424. doi:10.1523/JNEUROSCI.1900-07.2008. PMC 6670547. PMID 18184784.
- ^ Chen Y, Beffert U, Ertunc M, Tang TS, Kavalali ET, Bezprozvanny I, Herz J (September 2005). "Reelin modulates NMDA receptor activity in cortical neurons". The Journal of Neuroscience. 25 (36): 8209–8216. doi:10.1523/JNEUROSCI.1951-05.2005. PMC 6725528. PMID 16148228.
- ^ Yu XM, Askalan R, Keil GJ, Salter MW (January 1997). "NMDA channel regulation by channel-associated protein tyrosine kinase Src". Science. 275 (5300): 674–678. doi:10.1126/science.275.5300.674. PMID 9005855. S2CID 39275755.
- ^ Petrozziello T, Boscia F, Tedeschi V, Pannaccione A, de Rosa V, Corvino A, et al. (January 2022). "Na+/Ca2+ exchanger isoform 1 takes part to the Ca2+-related prosurvival pathway of SOD1 in primary motor neurons exposed to beta-methylamino-L-alanine". Cell Communication and Signaling. 20 (1): 8. doi:10.1186/s12964-021-00813-z. PMC 8756626. PMID 35022040.
- ^ Horning MS, Trombley PQ (October 2001). "Zinc and copper influence excitability of rat olfactory bulb neurons by multiple mechanisms". Journal of Neurophysiology. 86 (4): 1652–1660. doi:10.1152/jn.2001.86.4.1652. PMID 11600628. S2CID 6141092.
- ^ Neal AP, Stansfield KH, Worley PF, Thompson RE, Guilarte TR (July 2010). "Lead exposure during synaptogenesis alters vesicular proteins and impairs vesicular release: potential role of NMDA receptor-dependent BDNF signaling". Toxicological Sciences. 116 (1): 249–263. doi:10.1093/toxsci/kfq111. PMC 2886862. PMID 20375082.
- ^ a b Fourgeaud L, Davenport CM, Tyler CM, Cheng TT, Spencer MB, Boulanger LM (December 2010). "MHC class I modulates NMDA receptor function and AMPA receptor trafficking". Proceedings of the National Academy of Sciences of the United States of America. 107 (51): 22278–22283. Bibcode:2010PNAS..10722278F. doi:10.1073/pnas.0914064107. PMC 3009822. PMID 21135233.
- ^ Huh GS, Boulanger LM, Du H, Riquelme PA, Brotz TM, Shatz CJ (December 2000). "Functional requirement for class I MHC in CNS development and plasticity". Science. 290 (5499): 2155–2159. Bibcode:2000Sci...290.2155H. doi:10.1126/science.290.5499.2155. PMC 2175035. PMID 11118151.
- ^ Nelson PA, Sage JR, Wood SC, Davenport CM, Anagnostaras SG, Boulanger LM (September 2013). "MHC class I immune proteins are critical for hippocampus-dependent memory and gate NMDAR-dependent hippocampal long-term depression". Learning & Memory. 20 (9): 505–517. doi:10.1101/lm.031351.113. PMC 3744042. PMID 23959708.
- ^ Traynelis SF, Cull-Candy SG (May 1990). "Proton inhibition of N-methyl-D-aspartate receptors in cerebellar neurons". Nature. 345 (6273): 347–350. Bibcode:1990Natur.345..347T. doi:10.1038/345347a0. PMID 1692970. S2CID 4351139.
- ^ Aizenman E, Lipton SA, Loring RH (March 1989). "Selective modulation of NMDA responses by reduction and oxidation". Neuron. 2 (3): 1257–1263. doi:10.1016/0896-6273(89)90310-3. PMID 2696504. S2CID 10324716.
- ^ Monaghan DT, Jane DE (2009). "Pharmacology of NMDA Receptors". In Van Dongen AM (ed.). Biology of the NMDA Receptor. Boca Raton, Florida: CRC Press. ISBN 978-1-4200-4414-0. PMID 21204415.
- ^ a b c d Sonkusare SK, Kaul CL, Ramarao P (January 2005). "Dementia of Alzheimer's disease and other neurodegenerative disorders--memantine, a new hope". Pharmacological Research. 51 (1): 1–17. doi:10.1016/j.phrs.2004.05.005. PMID 15519530.
- ^ Takahashi H, Xia P, Cui J, Talantova M, Bodhinathan K, Li W, et al. (October 2015). "Pharmacologically targeted NMDA receptor antagonism by NitroMemantine for cerebrovascular disease". Scientific Reports. 5: 14781. Bibcode:2015NatSR...514781T. doi:10.1038/srep14781. PMC 4609936. PMID 26477507.
- ^ Purves D, Augustine GJ, Fitzpatrick D, Hall WC, LaMantia AS, McNamara JD, White LE (2008). Neuroscience (4th ed.). Sinauer Associates. pp. 129–131. ISBN 978-0-87893-697-7. Archived from the original on 2011-09-27.
- ^ Vargas-Caballero M, Robinson HP (July 2004). "Fast and slow voltage-dependent dynamics of magnesium block in the NMDA receptor: the asymmetric trapping block model". The Journal of Neuroscience. 24 (27): 6171–6180. doi:10.1523/jneurosci.1380-04.2004. PMC 6729657. PMID 15240809.
- ^ Purves D, Augustine GJ, Fitzpatrick D, Hall WC, LaMantia AS, McNamara JD, White LE (2008). Neuroscience (4th ed.). Sinauer Associates. pp. 191–195. ISBN 978-0-87893-697-7. Archived from the original on 2011-09-27.
- ^ Nowak L, Bregestovski P, Ascher P, Herbet A, Prochiantz A (February 1984). "Magnesium gates glutamate-activated channels in mouse central neurones". Nature. 307 (5950): 462–465. doi:10.1038/307462a0. PMID 6320006. S2CID 4344173.
- ^ Wijesinghe R (2014). "Emerging Therapies for Treatment Resistant Depression". Ment Health Clin. 4 (5): 56. doi:10.9740/mhc.n207179. ISSN 2168-9709.
- ^ Poon L (2014). "Growing Evidence That A Party Drug Can Help Severe Depression". NPR.
- ^ Stix G (2014). "From Club to Clinic: Physicians Push Off-Label Ketamine as Rapid Depression Treatment". Scientific American.
- ^ a b McEwen BS, Chattarji S, Diamond DM, Jay TM, Reagan LP, Svenningsson P, Fuchs E (March 2010). "The neurobiological properties of tianeptine (Stablon): from monoamine hypothesis to glutamatergic modulation". Molecular Psychiatry. 15 (3): 237–249. doi:10.1038/mp.2009.80. PMC 2902200. PMID 19704408.
- ^ McEwen BS, Chattarji S (December 2004). "Molecular mechanisms of neuroplasticity and pharmacological implications: the example of tianeptine". European Neuropsychopharmacology. 14 (Suppl 5): S497–S502. doi:10.1016/j.euroneuro.2004.09.008. PMID 15550348. S2CID 21953270.
- ^ McEwen BS, Olié JP (June 2005). "Neurobiology of mood, anxiety, and emotions as revealed by studies of a unique antidepressant: tianeptine". Molecular Psychiatry. 10 (6): 525–537. doi:10.1038/sj.mp.4001648. PMID 15753957.
- ^ Brink CB, Harvey BH, Brand L (January 2006). "Tianeptine: a novel atypical antidepressant that may provide new insights into the biomolecular basis of depression". Recent Patents on CNS Drug Discovery. 1 (1): 29–41. doi:10.2174/157488906775245327. PMID 18221189. Archived from the original on 2013-04-14. Retrieved 2020-04-12.
- ^ a b Kasper S, McEwen BS (2008). "Neurobiological and clinical effects of the antidepressant tianeptine". CNS Drugs. 22 (1): 15–26. doi:10.2165/00023210-200822010-00002. PMID 18072812. S2CID 30330824.
- ^ Mount C, Downton C (July 2006). "Alzheimer disease: progress or profit?". Nature Medicine. 12 (7): 780–784. doi:10.1038/nm0706-780. PMID 16829947.
- ^ NICE 기술평가 2011년 1월 18일 아즈하이머병 - 도네페질, 갈란타민, 리바스티그민, 메만틴 (검토) : 최종평가 결정
- ^ Todd A Hardy, Reddel, Barnett, Palace, Lucchinetti, Weinshenker, CNS의 비정형 염증 탈수 증후군, The lancet neurology, Volume 15, Issue 9, 2016년 8월호, Pags 967-981, doi: [1]에서 구할 수 있다.
- ^ Lisman JE, Coyle JT, Green RW, Javitt DC, Benes FM, Heckers S, Grace AA (May 2008). "Circuit-based framework for understanding neurotransmitter and risk gene interactions in schizophrenia". Trends in Neurosciences. 31 (5): 234–242. doi:10.1016/j.tins.2008.02.005. PMC 2680493. PMID 18395805.
- ^ Santos E, Olivares-Rivera A, Major S, Sánchez-Porras R, Uhlmann L, Kunzmann K, et al. (December 2019). "Lasting s-ketamine block of spreading depolarizations in subarachnoid hemorrhage: a retrospective cohort study". Critical Care. 23 (1): 427. doi:10.1186/s13054-019-2711-3. PMC 6937792. PMID 31888772.