생장콘
Growth cone성장 원뿔은 시냅스 목표를 추구하는 개발 또는 재생 뉴라이트의 큰 액틴 지원 확장이다. 그들의 존재는 원래 스페인 역사학자 산티아고 라몬 이 카잘이 현미경으로 관찰한 고정된 이미지를 바탕으로 제안하였다. 그는 먼저 고정된 세포에 기반한 성장 원뿔을 "아메보이드 운동이 부여된 원뿔 형태의 원형질 농도"(Cajal, 1890)[1]라고 설명했다. 성장 원뿔은 신경 세포의 덴드라이트나 액손과 같은 뉴런의 끝에 위치한다. 성장 축과 덴드라이트의 감각, 운동, 통합 및 적응 기능은 모두 이 특수 구조 안에 포함되어 있다.
구조
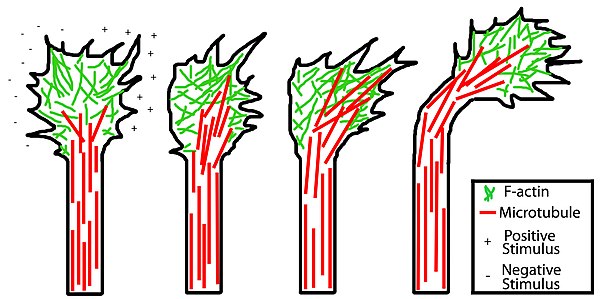
성장 원뿔의 형태학은 손을 비유로 사용함으로써 쉽게 설명할 수 있다. 성장 원뿔의 미세한 확장은 미세반점이라고 알려진 뾰족한 필로포디아다.[2] 필로포디아(filopodia)는 성장 원뿔의 "손가락"과 같다; 그것들은 그들에게 모양과 지지를 주는 액틴 필라멘트(F-actin) 뭉치를 포함하고 있다. 필로포디아(filopodia)는 성장 원뿔의 지배적인 구조로, 성장 원뿔의 가장자리를 넘어 여러 마이크로미터를 확장할 수 있는 좁은 원통형 확장으로 나타난다. 필로포디아(filopodia)는 수용체를 포함하는 막과 액손의 성장과 지도에 중요한 세포 접착 분자에 의해 결합된다.
손의 띠와 같은 필로포디아 사이에 "라멜리포디아"가 있다. 이것들은 필로포디아에서처럼 F-actin이 번들거리지 않고 밀집된 액틴 망사의 평평한 지역이다. 성장 원뿔의 앞쪽 가장자리에 인접해 나타나는 경우가 많고 두 개의 필로포디아 사이에 위치하여 '야생성' 같은 모습을 보인다. 성장 원추에서, 새로운 필로포디아는 보통 이러한 열간 베일로부터 나온다.
성장 원뿔은 주변(P) 영역, 과도(T) 영역, 중앙(C) 영역의 세 가지 영역으로 구분하여 설명한다. 주변 영역은 성장 원뿔의 바깥쪽 가장자리를 둘러싼 얇은 영역이다. 주로 액틴 기반의 시토스켈레톤으로 구성되어 있으며, 역동성이 강한 라멜리포디아와 필로포디아 등이 함유되어 있다. 그러나 미세관(microtubulle)은 동적 불안정이라고 불리는 과정을 통해 일시적으로 주변부로 들어가는 것으로 알려져 있다. 중심 영역은 축에 가장 가까운 성장 원뿔의 중앙에 위치한다. 이 지역은 주로 미세관 기반의 시토스켈레톤으로 이루어져 있으며, 일반적으로 두께가 두껍고, 다양한 크기의 오르가넬과 베시클이 많이 함유되어 있다. 과도 도메인은 중앙 영역과 주변 영역 사이의 얇은 대역에 위치한 영역이다.
성장 원뿔은 분자적으로 전문화되어 있으며, 부모 세포의 그것과 구별되는 대본과 프로테오메트를 가지고 있다.[3] 세포골격계 관련 단백질이 많으며, 성장 원뿔 내에서 서로에 대한 앵커링 액틴과 미세관, 막, 그리고 다른 세포골격계 구성 요소에 대한 다양한 역할을 수행한다. 이러한 구성 요소들 중 일부는 성장 원뿔 내에서 힘을 발생시키는 분자 모터와 미세 관을 통해 성장 원뿔을 안팎으로 운반하는 막 결합형 복실체를 포함한다. 세포골격계 관련 단백질의 예로는 파신·필라비타민(액틴 번들링), 탈린(액틴 앵커링), 미오신(혈관 운반), mDia(마이크로튜브-액틴 연결) 등이 있다.
액손 분기 및 성장
성장 원뿔의 고도로 역동적인 성질은 다양한 자극에 반응하여 방향을 빠르게 바꾸고 가지를 치면서 주변 환경에 대응할 수 있게 한다. 액손의 외성장은 돌출, 발진, 통폐합이라는 세 단계가 있다. 돌출 중에는 성장 원뿔의 앞 가장자리를 따라 필로포디아와 성층 확장이 빠르게 진행된다. 화농은 필로포디아가 성장콘의 측면 가장자리로 이동하면 뒤따르며, 미세관(microtubule)이 성장콘 안으로 더 깊숙이 침입하여 미토콘드리아, 내포체성 망막과 같은 음낭과 오르가넬을 가져온다. 마지막으로, 성장 원뿔의 목에 있는 F-actin이 고갈되고 필로포디아(filopodia)가 수축할 때 통합이 일어난다. 그리고 나서 막은 축소되어 마이크로 관 뭉치 주위에 원통형 액손 샤프트를 형성한다. 한 형태의 액손 분기 역시 같은 과정을 통해 발생하는데, 성장 원뿔이 발기부전 단계에서 "분열"되는 것을 제외한다. 이것은 주 액손의 분리를 초래한다. 액손 분기기의 추가적인 형태는 담보(또는 중간) 분기라고 불린다.[4][5] 부수적인 분기점은 액손 분기와는 달리 기성 액손 샤프트에서 새로운 분기를 형성하는 것을 포함하며, 성장 중인 액손 끝의 성장 원뿔과는 독립적이다. 이 메커니즘에서, 액손은 처음에 필로포듐 또는 라멜리포듐을 생성하는데, 액손 마이크로튜브에 의한 침입 이후 액손 샤프트에서 수직으로 확장되는 분기로 더 발전할 수 있다. 메인 액손과 같이 확립된 보조지점은 성장 원뿔을 보이며 메인 액손 팁과 독립적으로 발전한다.
전체적으로 액손 연장은 팁 성장이라고 알려진 공정의 산물이다. 이 과정에서 신소재가 성장 원뿔에 추가되는 한편, 차축 사이토스켈레톤 나머지 부분은 정지 상태를 유지한다. 이것은 두 가지 과정 즉, 세포골격계 기반 역학과 기계적 장력을 통해 발생한다. 세포골격 역학으로 미세관들이 성장콘으로 중합되어 중요한 요소들을 전달한다. 기계적 장력은 성장 원뿔의 분자 모터에 의한 힘 생성과 액손의 기질에 대한 강한 접착으로 인해 막이 늘어나면서 발생한다. 일반적으로 급성장하는 성장 원뿔은 작고 스트레칭 정도가 큰 반면, 느리게 움직이거나 정지된 성장 원뿔은 매우 크고 스트레칭 정도가 낮다.
액틴 마이크로필라멘트의 시공과 베시클 융합을 통한 플라즈마 막의 확장을 통해 성장 원뿔이 지속적으로 쌓이고 있다. 액틴 필라멘트는 액틴 필라멘트를 중합하여 다시 부착할 수 있는 액틴 필라멘트의 앞쪽 가장자리(디스트 엔드)로 자유 모노머가 이동할 수 있도록 근위부 끝단에서 분해 및 분해한다. 액틴 필라멘트 또한 역행 F 액틴 흐름으로 알려진 미오신 모터 구동 공정에 의해 가장자리로부터 지속적으로 운반되고 있다. 액틴 필라멘트는 주변 지역에서 중합된 다음 필라멘트가 고농축되는 과도 영역으로 역방향으로 운반되어 모노머가 순환을 반복할 수 있게 한다. 이것은 단백질 전체가 움직이기 때문에 액틴 트레드밀링과는 다르다. 만약 단백질이 단순히 러닝머신이라면, 단백질 자체는 움직이지 않는 동안 단층동물들은 한쪽 끝에서 고갈되어 다른 쪽 끝으로 중합될 것이다.
액손의 성장 용량은 액틴 필라멘트 바로 너머에 위치한 마이크로 튜브에 있다. 마이크로튜브는 빠르게 중합되어 성장콘의 액틴이 풍부한 주변부위로 "프로브"할 수 있다. 이렇게 되면 마이크로튜브의 중합 끝단이 F-액틴 접착 부위에 닿게 되는데, 미세튜브 팁 관련 단백질이 '리간스' 역할을 한다. 기저막의 라미네인은 성장 원뿔의 통합체와 상호작용하여 성장 원뿔의 전진 운동을 촉진한다. 또한 액손의 외생성은 액손의 구조적 지원을 제공하는 마이크로튜브의 근위부 끝단 안정화에 의해서도 지지된다.
액손 유도
차축의 움직임은 칼슘과 주기적 뉴클레오티드와 같은 두 번째 메신저를 통해 확립된 감각 기능과 운동 기능의 통합에 의해 제어된다(위에서 설명함). 액손의 감각 기능은 매력적이거나 혐오스러울 수 있는 세포외 기질로부터의 단서에 의존하므로 액손들을 특정 경로로부터 멀리 인도하여 적절한 목적지로 유인하는 데 도움이 된다. 매력적인 단서는 액틴 필라멘트의 역행 흐름을 억제하고 조립을 촉진하는 반면 혐오 단서는 정반대의 효과를 가진다. 액틴 안정화 단백질도 관여하며 매력적인 단서가 있는 곳에서 필로포디아와 라멜리포디아의 지속적인 돌출에 필수적이며 액틴 불안화 단백질은 반발 큐의 존재에 관여한다.
이와 유사한 과정이 미세관들과 관련되어 있다. 성장 원뿔의 한쪽 면에 매력적인 큐가 있는 상황에서 특정 미세 관이 미세 관을 대상으로 단백질을 안정시켜 성장 원뿔이 양성 자극 방향으로 회전하게 된다. 반발하는 단서들과 함께, 반대되는 것은 사실이다: 성장 원뿔의 반대편에서 성장 원뿔이 반발하는 것을 유발하는 부정적인 자극으로 인해 성장 원뿔의 안정화가 선호된다. 이 프로세스는 행위 관련 프로세스와 결합되어 액손의 전반적인 지시 성장을 초래한다.
성장 콘 수용체는 네트린, 슬릿, 에프린, 세마포린과 같은 액손 유도 분자의 존재를 감지한다. Wnt나 Shi와 같은 세포 운명 결정 요인도 지침 단서 역할을 할 수 있다는 것이 더 최근에 밝혀졌다. 동일한 안내 큐가 맥락에 따라 유인물 또는 기피제 역할을 할 수 있다. 대표적인 예가 DCC 수용체를 통해 끌어당김을, Unc-5 수용기를 통해 반발 신호를 보내는 넷린-1이다. 게다가, 이와 같은 분자들이 혈관 성장을 이끄는 데 관여한다는 것이 밝혀졌다. 액손 지침은 신경계의 초기 배선을 지시하며, 부상 후 축 재생에도 중요하다.[6]
참조
- ^ Ramon, Cajal S (1890). "A quelle epoque apparaissent les expansions des cellule nerveuses de la moelle epinere du poulet". Anat. Anzeiger. 5: 609–613.
- ^ Gilbert, Scott (2006). Developmental biology (8th ed.). Sunderland, Mass.: Sinauer Associates, Inc. Publishers. p. 395. ISBN 9780878932504.
- ^ Poulopoulos, Alexandros; Murphy, Alexander J.; Ozkan, Abdulkadir; Davis, Patrick; Hatch, John; Kirchner, Rory; Macklis, Jeffrey D. (2019). "Subcellular transcriptomes and proteomes of developing axon projections in the cerebral cortex". Nature. 565 (7739): 356–360. Bibcode:2019Natur.565..356P. doi:10.1038/s41586-018-0847-y. ISSN 0028-0836. PMC 6484835. PMID 30626971.
- ^ Gallo G (2011). "The cytoskeletal and signaling mechanisms of axon collateral branching". Dev Neurobiol. 71 (3): 201–20. doi:10.1002/dneu.20852. PMID 21308993. S2CID 205758311.
- ^ Kalil K, Dent EW (2014). "Branch management: mechanisms of axon branching in the developing vertebrate CNS". Nat. Rev. Neurosci. 15 (1): 7–18. doi:10.1038/nrn3650. PMC 4063290. PMID 24356070.
- ^ Yoo S, van Niekerk EA, Merianda TT, Twiss JL (2010). "Dynamics of axonal mRNA transport and implications for peripheral nerve regeneration". Experimental Neurology. 1. 223 (1): 19–27. doi:10.1016/j.expneurol.2009.08.011. PMC 2849851. PMID 19699200.