사이클록시겐화효소 2 억제제 발견 및 개발
Discovery and development of cyclooxygenase 2 inhibitors사이클록시유전체는 다불포화 지방산이 프로스타글란딘과 트롬박산(s)으로 변환되는 복합 생합성 캐스케이드에 참여하는 효소다.[1]그들의 주된 역할은 다양하고 강력한 생물학적 작용을 가진 다양한 프로스타노이드의 전구체인 중간 프로스타글란딘 H2로의 아라키돈산의 변형을 촉진하는 것이다.[2]사이클록시유전체는 COX-1과 COX-2(COX-3뿐만 아니라)라고 불리는 두 가지 주요 이소성형을 가지고 있다.COX-1은 위장관과 혈소판을 포함한 여러 종류의 세포에서 프로스타글란딘과 트롬복산의 합성을 담당한다.COX-2는 염증성 세포와 중추신경계의 프로스타글란딘 생합성에 큰 역할을 한다.이들 부위의 프로스타글란딘 합성은 염증과 고농도 발병의 핵심 요인이다.[3]COX-2 억제제는 아라키돈산이 프로스타글란딘 H2로 변형되는 것을 선택적으로 차단하여 진통성 및 항염증 활성을 가진다.[4]
선택적 COX-2 억제제 개발을 위한 상승
 |
| DuP-697 |
선택적 COX-2 억제제의 개발 동기는 NSAIDs의 위장 부작용이었다. NSAIDs의 작용 메커니즘이 발견된 직후, COX의 대체 형태에 대한 강한 징후가 나타났으나, 근거가 거의 발견되지 않았다.COX 효소는 정화가 어렵다는 것이 증명되어 1988년까지 서열화되지 않았다.[5]1991년 브리검영대학교의 댄 시몬스 박사에 의해 COX-2 효소의 존재가 확인되었다.COX-2 존재 확인 이전에 듀퐁사는 많은 항염증 측정에서 강력한 성분인 DuP-697을 개발했지만 NSAID의 궤양 유발 효과가 없었다. 일단 COX-2 효소가 확인되자 Dup-697은 COX-2 억제제 합성을 위한 빌딩 블록이 되었다.시장에 진출한 최초의 COX-2 억제제인 셀레콕시브와 로페콕시브는 DuP-697을 기반으로 했다.[5][6]1998년 12월 셀렉스(셀렉시브)가, 1999년 5월 비옥스(로페콕시브)가 출시되는 등 최초의 COX-2 억제제를 개발·시판하는 데 8년이 채 걸리지 않았다.[7][8]셀레콕시브와 다른 COX-2 선택억제제인 발데콕시브, 파레콕시브, 마바콕시브 등이 존 탈리가 이끄는 몬산토의 서얼 부문 팀에 의해 발견되었다.[9][10]
COX-2 억제제 개발
초기 연구들은 염증이 유발될 때, 영향을 받은 장기가 예기치 않게 프로스타글랜딘을 발생시킬 수 있는 엄청난 능력을 발달시킨다는 것을 보여주었다.그 증가는 신선한 효소의 디노보합성에 기인한다는 것이 증명되었다.1991년 루스 육종 바이러스로 변형된 섬유질에서 초기반응 유전자의 발현에 대한 조사 과정에서 정합성 COX 효소와 유사하지만 동일하지는 않은 새로운 mRNA 대본이 확인되었다.COX의 Isoenzyme이 발견되었다고 제안되었다.또 다른 그룹은 스위스 3T3 세포에서 포볼-에스테르 유도 유전자를 연구하던 중 COX-1과 유사한 구조의 단백질을 인코딩하는 새로운 cDNA 종을 발견했다.같은 실험실은 이 유전자가 진실로 새로운 COX 효소를 표현했다는 것을 보여주었다.두 효소는 원래의 효소와 COX-2를 참조하여 COX-1로 개칭되었다.[5]이러한 결과를 바탕으로 과학자들은 선택적 COX-2 억제제에 초점을 맞추기 시작했다.1960년대와 1980년대 사이에 NSAIDs 개발에 엄청난 노력을 기울였기 때문에 COX-2가 발견되었을 때 시험해야 할 수많은 약리학자들이 있었다.초기 노력은 DuP-697과 NS-398이라는 두 개의 납 화합물에 대한 수정에 초점을 맞췄다.이 화합물은 아릴알코닉산 아날로그인 NSAID와는 크게 다르다.선택적 억제제를 사용한 "개념 시험" 실험에 고무되어, 몇 개의 견고한 리드(lead)와 결합 부지의 성질에 대한 명확한 아이디어로 무장한 이 분야의 발전이 빨랐다.[3]시험관내 재조합 효소 측정은 COX 선택성과 효력 평가를 위한 강력한 수단을 제공하였고, 최초로 합리적으로 설계된 COX-2 선택억제제인 셀렉시브의 발견과 임상 개발을 이끌었다.알킬카르복실산 사이드체인을 연장해 엔사이드(NSAID)를 인데메타신 등 선택적 COX-2 억제제로 전환하려는 노력이 있었지만, 아직 시장에 나온 것은 없다.[1]
구조물 활동 관계(SAR)
DuP-697은 COX-2 억제제 합성을 위한 빌딩 블록이었으며, 현재 시중에 유통되고 있는 유일한 선택적 COX-2 억제제인 콕시브의 기본 화학적 모델 역할을 했다.DuP-697은 CIS-stilbene moiety를 가진 일기의 이성애자다.일지 헤테로사이클릭 화합물에 대한 구조 활성 관계(SAR) 연구는 시스틸 유익성 및 아릴 링 중 하나의 파라 위치의 변화가 COX-2 선택성에 중요한 역할을 한다는 것을 보여주었다.[1][11]셀레콕시브와 파레콕시브는 아릴 링 중 하나에 있는 파라 위치에 설폰아미드 대체물(SONH22)이 있고, 에트로리콕시브와 로페콕시브는 메틸설폰(SOCH23)이 있다.[12]황의 산화 상태는 선택성을 위해 중요하다. COX-2는 황소와 설포나미드가 선택적이지만 황산화물과 황화물은 선택적이지 않다.이 스틸베인 시스템에 융합된 링 시스템은 다양한 링 크기의 모든 상상할 수 있는 이성애 및 카보시크릭 골격을 포함하도록 광범위하게 조작되었다.발데콕시브의 원약인 파레콕시브에 함유된 SONHCOCH23 moiety는 단순한 아미드보다 효소 세린 수산화효소의 반응성 아세틸화제가 105~10배6 더 많은 것으로 알려져 있다.[11]다양한 운동 메커니즘이 COX-1 대 COX-2의 효력에 영향을 미치기 때문에 인간 전혈에서 효력과 선택성에 의존하는 것은 많은 그룹에 의해 사용되며 COX-2 효력과 선택성의 표준 평가로 받아들여지고 있다.
COX-2 효소의 아미노산 프로파일과 억제 메커니즘의 관계
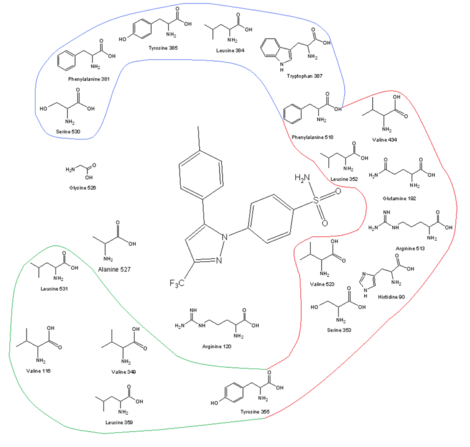 |
| COX-2 수용체 부위와 결합 부위의 아미노산 프로필 및 셀레콕시브 |
COX-2 선택적 약물을 개발하기 위한 핵심 중 하나는 COX-2의 더 큰 활성 부위가 있는데, 이는 분자를 너무 크게 만들어 COX-1 활성 부지에 맞지만 여전히 COX-2를 맞출 수 있게 하는 것이다.The larger active site of COX-2 is partly due to a polar hydrophilic side-pocket that forms because of substitution of Ile523, His513, and Ile434 in COX-1 by Val523, Arg513, and Val434 in COX-2. Val523 is less bulky than Ile523, which increases the volume of the active site.일레434를 발434로 대체하면 페518의 사이드체인이 뒤로 이동하여 여분의 공간을 만들 수 있다.이 측면 포켓은 COX-1의 His513을 대체하는 Arg513과 상호작용을 허용한다. Arg513은 콕시브와 같은 일지 헤테로사이클 억제제의 핵심 잔류물로 여겨진다.수용체 채널 상단에 있는 Leu384의 사이드 체인은 COX-1의 활성 부지를 지향하지만, COX-2에서는 활성 부지를 벗어나 방향을 잡고 결합 부지의 정점에 더 많은 공간을 만든다.[13][14]셀레콕시브, 로페콕시브 등 COX-2 억제제의 부피가 큰 설포나미드 그룹은 분자가 COX-1 채널로 들어가는 것을 막는다.콕시브의 최적 활동과 선택성을 위해 4-메틸설폰펜틸이 필요하며, 불포화(일반적으로) 5-엠베 링에 부착되며, 바이실리 지방질 그룹이 있다(로페콕시브).SOCH는23 SONH로22 대체될 수 있으며, 이 경우 선택적으로 대체된 페닐 링 또는 부피가 큰 알코시 대체물(셀렉시브)이 지방질 주머니를 점유한다.COX-2의 친수성 측면포켓 내에서, 설폰아미드(또는 설폰) 그룹의 산소는 히스90, 아르그513, 글렌192와 상호작용하여 수소 결합을 형성한다.채널 상단의 대체 페닐 그룹은 소수성 및 정전 상호작용을 통해 아미노산 잔류물의 측면 체인과 상호작용한다.Tyr385는 이 쪽의 결합 부위의 일부 흉상 제약을 만들어 페닐 그룹의 작은 대체물이 더 나은 결합을 만든다.자유도는 구속력을 갖기 위해서도 중요하다.콕시브의 중심 고리는 방향족의 방향을 결정하므로, 아미노산 잔류물과 정전기적 상호작용이 없는 경우가 많음에도 불구하고 COX 효소에 대한 결합을 결정한다.활성 부위의 높은 지방질성은 콕시브의 중앙 비계의 낮은 극성을 필요로 한다.[14][15]
바인딩 메커니즘
선택적 COX-2 억제제의 결합 메커니즘에 관한 연구에서는 COX-1과 COX-2 모두로 가역적 단계를 두 개 가지고 있지만, COX-2에 대한 선택성은 COX-1이 아닌 COX-2의 억제에서만 보이는 느리고 돌이킬 수 없는 또 다른 단계 때문이다.돌이킬 수 없는 단계는 COX-2의 옆포켓에 맞는 설포나미드(또는 설폰)가 존재했기 때문으로 풀이됐다.이는 SC-58125(셀레콕시브의 아날로그)와 돌연변이 COX-2를 사용하여 연구되었으며, 여기서 발라인 523 잔여물은 이솔레우신 523으로 대체되었다.되돌릴 수 없는 억제는 일어나지 않았지만, 되돌릴 수 있는 억제가 눈에 띄었다.선택적 COX-2 억제제의 억제 효과 이면에 있는 이 3단계 메커니즘을 설명하는 모델이 만들어졌다.첫 번째 단계는 소수성 채널(로비 지역이라고 함)의 게이트와 억제제의 접촉을 설명한다.두 번째 단계는 억제제가 로비 지역에서 COX 효소의 활성 부지로 이동하는 것을 설명할 수 있다.마지막 단계는 아마도 활성 부위에서 억제제의 위치를 재조정하는 것으로, 억제제의 페닐설폰아미드 또는 페닐설폰 그룹과 측면 포켓의 아미노산의 강한 상호작용으로 이어진다.[16]그것은 포스트aglanding을 직접적으로 억제한다.
콕시브의 약동학
콕시브는 몸 전체에 널리 분포되어 있다.모든 콕시브는 중앙 진통 효과를 갖기에 충분한 뇌 농도를 달성하고, 모두 염증이 생긴 관절에서 프로스타글란딘 형성을 감소시킨다.모든 것이 잘 흡수되지만, 콕시브마다 최고 농도가 다를 수 있다.콕시브는 단백질 결합도가 높고, 반감기 추정치는 콕시브 사이에서 가변적이다.[17]
셀레콕시브
셀레콕시브는 류머티즘과 골관절염 환자들을 치료하기 위해 승인된 COX-2의 첫 번째 특정 억제제였다.경구 투여 시 흡수율이 보통 수준이며 약 2~4시간 후에 최고 혈장 농도가 발생한다는 연구결과가 나왔다.그러나 흡수의 정도는 잘 알려져 있지 않다.셀레콕시브는 혈장 단백질, 특히 혈장 알부민에 광범위하게 결합하는 친화력을 가지고 있다.인체에서 455 +/- 166 L의 겉보기 분포량(VD)을 가지며, 혈장 농도-시간 곡선(AUC) 아래의 면적은 경구 용량 증가에 비례하여 100 ~ 800 mg 사이에서 증가한다.셀레콕시브는 카복실산에 주로 CYP2C9 이소엔자임과 글루쿠로니드 대사물에 대한 비CYP 의존적 글루쿠로니드화에 의해 대사된다.대사물은 소변과 대변에 배설되며 소변에는 변화하지 않는 약제(2%)가 소량 있다.그것의 제거 반감기는 건강한 개인에서 약 11시간(6~12시간)이지만, 약물 처분의 인종적 차이와 노인들의 약동학적 변화가 보고되었다.만성 신장질환자는 건강한 개인에 비해 혈장 농도가 43% 낮은 것으로 나타나 겉보기 간격이 47% 증가했으며, 경증~중증 간질환자는 정상상태 AUC가 증가한 것으로 예상할 수 있다.[18]
| 셀레콕시브 | ||
|---|---|---|
| 피크 [약물] | 2~4시간 |  |
| 단백질 결합 | 97% | |
| 대사물 | 카르복시산 및 글루쿠로니드 접합체 | |
| 반감기[t1/2] | 6-12시간 | |
파레콕시브와 발데콕시브
파레콕시브 나트륨은 발데콕시브의 수용성 비활성 에스테르 아미드 약물로, 새로운 2세대 COX-2 특이 억제제로서 주입 가능한 사용을 위해 개발된 최초의 그러한 제제다.간 효소 가수분해에 의해 발데콕시브 활성형태로 빠르게 전환된다.그런 다음 화합물은 시토크롬 P450 매개 경로(CYP2C9, CYP3A4)와 비 시토크롬 P450 매개 경로 모두를 히드록시화 대사물 및 글루쿠로니드 대사물로 변환한다.COX-2 특유의 억제 특성이 약한 히드록실화 대사물은 비사이토크롬 P450 경로로 글루쿠로니드 대사물에 추가 대사된다.이 대사물들은 소변으로 배설된다.[17]파레콕시브 나트륨 혈장 농도의 근육내 투여 후 15분 이내에 최대 혈장 농도에 도달한다.혈장 농도는 투여 후 15~52분 정도인 다소 짧은 혈청 반감기로 인해 급격히 감소한다.이는 발데콕시브의 빠른 형성으로 설명할 수 있다.파레콕시브의 빠른 간극과 대조적으로 발데콕시브의 혈장 농도는 반감기가 길어지면서 서서히 감소한다.[19]반면 발데콕시브를 구강으로 복용하면 빠르게 흡수(1~2시간)되지만 음식물의 존재는 최고 혈청 농도를 지연시킬 수 있다.그런 다음 위에서 설명한 것과 동일한 신진대사를 거친다.광범위한 단백질 결합(98%)이며 혈장 반감기는 약 7~8시간이다.노약자나 간손상 환자에서 반감기가 현저하게 길어질 수 있으며, 약물 축적을 초래할 수 있다는 점에 유의한다.[17]히드록실 대사물은 투여 후 3~4시간 이내에 최고 평균 혈장 농도에 도달하지만 발데콕시브 또는 발데콕시브 혈장 농도의 약 1/10에 비해 상당히 낮다.[19]
| 파레콕시브 | ||
|---|---|---|
| 피크 [약물] | 15분 이내 |  |
| 단백질 결합 | 해당 없음 | |
| 대사물 | 발데콕시브, 간 효소 가수분해 후 | |
| 반감기[t1/2] | 15~52분 | |
| 발데콕시브 | ||
|---|---|---|
| 피크 [약물] | 식량으로 인해 지연된 2~4시간 |  |
| 단백질 결합 | 98% | |
| 대사물 | 히드록실 유도체 및 글루쿠로니드 대사물 | |
| 반감기[t1/2] | 7~8시간 | |
에트로리옥시브
만성 절지통증과 근골격계통, 치아통증 환자에게 쓰이는 에트로릭시브는 구강으로 주면 적당히 흡수된다.약동학에 관한 연구에서는 약 1시간 후에 에토릭시브의 혈장 피크 농도가 발생하는 것으로 나타났다.플라즈마 알부민(약 90%)에 광범위하게 결합되어 있는 것으로 나타났으며, 인체에서 겉보기 분포량(VD)은 120 L이다.혈장 농도-시간 곡선(AUC) 아래의 면적은 용량 증가(5–120 mg)에 비례하여 증가한다.제거 반감기는 건강한 개인에게 약 20시간이며, 그렇게 긴 반감기는 하루 한 번 복용량을 선택할 수 있게 해준다.에토릭시브는 다른 콕시브들과 마찬가지로 소변과 대변에 배설되고 또한 마찬가지로 대사된다.CYP3A4는 대부분 카르복실산 대사물에 대한 에토릭시브의 생물역조화를 담당하지만, 글루쿠로니드 대사물에 대한 비 CYP450 대사 경로도 가까이에 있다.소변에서 아주 적은 양의 에트로리옥시브(<1%)가 변하지 않고 제거된다.만성 신장질환 환자는 건강한 개인에 비해 혈장농도 곡선(AUC)이 다른 것으로 나타나지 않는다.그러나 중간 정도의 간 손상 환자는 혈장 농도 곡선(AUC)을 약 40% 증가시킨 것으로 보고되었다.다른 임상 옵션과 비교했을 때 에토릭시브의 임상적 유익성 및 위해성 측면에서 약동학적 특성의 관련성을 정밀하게 기술하기 위해 추가 연구가 필요하다고 명시되어 있다.[20][21]
| 에트로리옥시브 | ||
|---|---|---|
| 피크 [약물] | 1시간 | 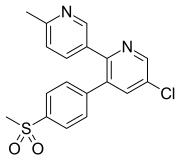 |
| 단백질 결합 | 90% | |
| 대사물 | 카르복실산 대사물 및 글루쿠로니드 대사물 | |
| 반감기[t1/2] | 20시간 | |
루미라콕시브
루미라콕시브는 약한 산이라는 점에서 콕시브들 사이에서 독특하다.골관절염, 류마티스관절염, 급성통증의 치료를 위해 개발되었다.루미라콕시브의 산성 성질은 염증 부위에 잘 침투할 수 있게 한다.약 1~3시간 만에 최고 혈장 농도가 발생하는 등 빠르고 잘 흡수되는 것으로 나타났다.[17]피험자에게 400mg을 투여했을 때 투여 후 2.5시간 후 혈장 내 불변 약물의 양이 적은 첫 번째 통과 효과를 시사한다는 연구 결과가 나왔다.혈장 내 단자 반감기는 5.4 - 8.6 시간(평균 = 6.5 시간)이었다.시노빌 액의 반감기는 플라즈마보다 상당히 길며, 투여 후 24시간 후 시노빌 액의 농도는 상당한 COX-2 억제를 초래할 것으로 예상된다.이러한 사실은 일부 사용자들이 짧은 혈장 반감기에도 불구하고 하루 1회 복용량으로 충분할 수 있는 이유를 설명할 수 있다.주요 플라즈마 대사물은 5-카르복시, 4'-하이드록시, 4'-하이드록시-5-카르복시 유도체들이다.루미라콕시브는 배설되기 전에 광범위하게 대사되며, 배설 경로는 소변이나 대변에 있다.피크 플라즈마 농도는 COX-2를 최대 억제하는 데 필요한 농도를 초과하며 이는 더 긴 약리학적 반감기와 일치한다.시험관내 루미라콕시브는 다른 어떤 콕시브보다 더 큰 COX-2 선택성을 보였다.[22]
| 루미라콕시브 | ||
|---|---|---|
| 피크 [약물] | 1~3시간 |  |
| 단백질 결합 | 90% | |
| 대사물 | 5-제복시, 4-제복시 및 4-제복시-5-제복시 파생 모델 | |
| 반감기[t1/2] | 6,5시간 | |
로페콕시브
로페콕시브는 시판된 두 번째 선택적 COX-2 억제제였으며, 시판된 첫 번째 억제제였다.[8]건강한 인간 과목에서 약동학을 연구했을 때, 약 17시간의 효과적인 반감기로 9시간 만에 최고 집중을 달성했다.2차 피크가 관찰되었는데, 이는 로페콕시브의 흡수가 장운동성에 따라 달라지기 때문에 피크 농도가 충족될 때까지 시간의 변동성이 크다는 것을 암시할 수 있다.복용량의 71.5%는 소변(미흡수율 1% 미만), 14.2%는 대변(담즙 약 1.8%)에서 회복됐다.Among the metabolites were rofecoxib-3’,4’-dihydrodiol, 4’-hydroxyrofecoxib-O-β-D-glucuronide, 5-hydroxyrofecoxib-O-β-D-glucuronide, 5-hydroxyrofecoxib, rofecoxib-erythro-3,4-dihydrohydroxy acid, rofecoxib-threo-3,4-dihydrohydroxy acid, cis-3,4-dihydrorofecoxib and trans-3,4-dihydrorofecoxib.[23]
| 로페콕시브 | ||
|---|---|---|
| 피크 [약물] | 9시간 | 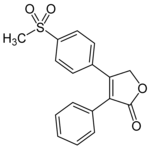 |
| 단백질 결합 | 해당 없음 | |
| 대사물 | 주요: 로페콕시브-트레오-3,4-디하이드로하이드록시산 및 로페콕시브-에르스로-3,4-디하이드록시산 | |
| 반감기[t1/2] | 17시간 | |
선택적 COX-2 억제제와 관련된 심혈관계 사건
최초의 선택적 COX-2 억제제가 시판되기 전부터 전문가들은 이 종류의 의약품과 관련된 심혈관계 위험이 있을 수 있다고 의심하기 시작했다.VIGH 연구(Vioxx 위장 결과 연구)에서 로페콕시브(Vioxx)를 나프록센과 비교했다.잠시 후 로페콕시브 그룹에서 심근경색 위험이 나프록센을 받은 그룹에 비해 5배 높다는 사실이 명백해졌다.저자들은 그 차이가 나프록센의 심장 보호 효과 때문이라고 제안했다.[24]PROPERVe(Vioxx에 대한 ADenomatous Poly Prevention) 연구는 대장 아데노마(Colorectal Adenomas)가 있는 개인의 신소성 용종 재발에 대한 로페콕시브(rofecoxib)를 사용한 3년 치료의 효과를 평가하기 위한 다중 무작위, 무작위, 위약 제어의 이중 블라인드 시험이었다.[25][26]2000년과 2001년에는 대장 아데노마 병력이 있는 2587명의 환자를 모집해 그 뒤를 따랐다.심혈관 독성에 대한 우려 때문에 데이터 안전 및 모니터링 위원회의 권고에 따라 재판이 조기에 중단되었다([25]예상 완료 2개월 전).연구 결과를 보면 18개월 치료 후 시작된 위약에[25][26] 비해 로페콕시브를 복용할 때 심혈관 위험이 통계적으로 유의미하게 증가하는 것으로 나타났다.[25][26][27]그 후 9월 30일 Merck는 Vioxx의 자발적인 전세계적 철수를 알리는 뉴스 발표를 했다.[27]다른 콕시브에 대한 일부 연구에서는 심혈관 질환의 위험이 증가하는 반면 다른 연구에서는 그렇지 않은 것으로 나타났다.예를 들어 셀렉시브 연구(APC)를 이용한 아데노마 예방법에서는 셀렉시브를 복용할 때 위약에 비해 심혈관 사망, 심근경색, 뇌졸중 또는 심부전 위험이 증가하였고, 연속 셀렉시브 효능 및 안전 연구 I(SUPUT-I)에서는 10회 복용 시 심근경색 위험이 증가하였다.셀레콕시브는 디클로페낙과 나프록센에 비해 하루에 두 번 0mg씩 복용했지만 하루에 200mg을 복용하면 디클로페낙과 나프록센에 비해 심근경색 발병률이 낮았다.누스메이어 외(2005) 관상동맥우회 수술 후 파레콕시브와 발데콕시브(paldecoxib)를 복용할 때 심혈관 질환 발생률 증가가 연구에서 나타났다.[26]
가능한 메커니즘
COX-2 선택성이 혈관 내 프로스타글란딘 불균형을 유발할 수 있다는 제안이 나왔다.이것이 심혈관 위험 증가의 설명이었다면 저선량 아스피린은 이 효과를 무효화해야 하는데,[26][28] 이는 FARINVe 시험에서는 그렇지 않았다.[28]또한 선택적이지 않은 COX 억제제는 심혈관 질환에서도 증가하였다.[29]또 다른 가능한 설명은 Li H. 외 연구진에 의해 연구되었다.(2008).그들은 비선택적 NSAIDs와 coxibs(SHR)자발적으로 고혈압 쥐에 산화 스트레스, 혈장에서 NADPH산화 효소의 diclofenac과naproxen의 사용과, 약한 정도로, rof과 눈에 뜨이향상된 표현, 협조 강화된 혈관 superoxide(O2−)콘텐츠와 높은 과산화 수소에 의해 표시를 생산해 보여 주었다.e콕시브와 셀렉시브혈장 내 질산염도 감소하여 혈관성 질소산화물(NO)의 합성이 감소하였다.이러한 NO 합성의 감소는 eNOS mRNA의 발현이 감소되지 않았고, 심지어 일부 제품에 대해 상향 조정되었기 때문에 eNOS(eNothelial antitric 산화물 synthase)의 발현이 감소했기 때문에 발생하지 않았다.NO 합성의 감소는 오히려 eNOS 기능의 상실로 설명될 수 있다.[29]eNOS가 정상적으로 기능하려면 조광기를 형성하고 자연발생 저감제 중 가장 강력한 것으로 꼽히는 공동인자 BH를4 갖춰야 한다.BH는4 NO가 O와2− 반응할 때 생성되는 과록시니트라이트(ONOO−)에 의한 산화에 민감하므로, BH의4 고갈이 과도한 산화 응력으로 발생할 수 있다는 가설(NSAID에 의해 발생할 수 있음)이 eNOS 기능장애의 원인이 될 수 있다는 가설이 제기되어 왔다.eNOS 언커플링이라고 하는 이 기능장애는 eNOS에 의한 O의2− 생성을 유발하여 eNOS에 의한 산화스트레스가 더 많이 발생하게 된다.[30]연구에서 선택적 COX-2 억제제와 비선택적 NSAID는 모두 산화응력을 발생시켰으며, 비선택적 NSAID 사용에서 더 큰 효과를 보였다.이것은 프로스타시클린/트롬박산 불균형에 관한 가설과 들어맞을 수 있다.즉, 비선택적 NCAID는 더 많은 산화 스트레스를 발생시키지만 혈소판 집적을 방지하는 반면, COX-2 억제제는 프로스타시클린 생산을 감소시키고, 따라서 비선택적 NSAID의 심혈관계 위험은 콕시브보다 높지 않다.[29]다른 가설로는 혈압 상승, 에피-리산신(항염증 효과가 있는) 생산 감소, 선택적 COX-2 억제제 사용 시 혈관 리모델링 억제 등이 있다.[26]
참고 항목
참조
- ^ a b c Marnett, L. J.; Kalgutkar, A. S. (1999). "Cyclooxygenase 2 inhibitors: Discovery, selectivity and the future". Trends in Pharmacological Sciences. 20 (11): 465–9. doi:10.1016/s0165-6147(99)01385-1. PMID 10542447.
- ^ Mardini, I. A.; Fitzgerald, G. A. (2001). "Selective inhibitors of cyclooxygenase-2: A growing class of anti-inflammatory drugs". Molecular Interventions. 1 (1): 30–8. PMID 14993336.
- ^ a b Marnett, L. J.; Kalgutkar, A. S. (1998). "Design of selective inhibitors of cyclooxygenase-2 as nonulcerogenic anti-inflammatory agents". Current Opinion in Chemical Biology. 2 (4): 482–90. doi:10.1016/s1367-5931(98)80124-5. PMID 9736921.
- ^ 킹, 에프디, 에드(2002)약용 화학 원리와 실천.케임브리지, 왕립 화학 협회
- ^ a b c Flower, R. J. (2003). "The development of COX2 inhibitors". Nature Reviews Drug Discovery. 2 (3): 179–91. doi:10.1038/nrd1034. PMID 12612644.
- ^ Dannhardt, G; Kiefer, W (2001). "Cyclooxygenase inhibitors--current status and future prospects". European Journal of Medicinal Chemistry. 36 (2): 109–26. doi:10.1016/s0223-5234(01)01197-7. PMID 11311743.
- ^ FDA, 의약품 평가 및 연구 센터(2008)"FDA 승인 의약품 – Cellebrex."[1]에서 2008년 18.10, 검색됨
- ^ a b FDA, 의약품 평가 및 연구 센터(2008)"FDA 승인 의약품 – Vioxx."[2]에서 2008년 18.10, 검색됨
- ^ Langreth, Robert (23 June 2003). "The Chemical Cobbler". Forbes.
- ^ "Dr. John Talley: 2001 St. Louis Awardee" (PDF). Chemical Bond. St. Louis Section, American Chemical Society. 52 (5): 2. May 2001. Archived from the original (PDF) on 15 April 2018.
- ^ a b Zarghi, A; Rao, P. N.; Knaus, E. E. (2007). "Design and synthesis of new rofecoxib analogs as selective cyclooxygenase-2 (COX-2) inhibitors: Replacement of the methanesulfonyl pharmacophore by a N-acetylsulfonamido bioisostere". Journal of Pharmacy & Pharmaceutical Sciences. 10 (2): 159–67. PMID 17706175.
- ^ Mattia, C; Coluzzi, F (2005). "COX-2 inhibitors: Pharmacological data and adverse effects". Minerva Anestesiologica. 71 (7–8): 461–70. PMID 16012420.
- ^ Llorens, O; Perez, J. J.; Palomer, A; Mauleon, D (1999). "Structural basis of the dynamic mechanism of ligand binding to cyclooxygenase". Bioorganic & Medicinal Chemistry Letters. 9 (19): 2779–84. doi:10.1016/s0960-894x(99)00481-3. PMID 10522690.
- ^ a b Michaux, C; Charlier, C (2004). "Structural approach for COX-2 inhibition". Mini Reviews in Medicinal Chemistry. 4 (6): 603–15. doi:10.2174/1389557043403756. PMID 15279594.
- ^ Ermondi, G; Caron, G; Lawrence, R; Longo, D (2004). "Docking studies on NSAID/COX-2 isozyme complexes using contact statistics analysis". Journal of Computer-aided Molecular Design. 18 (11): 683–96. doi:10.1007/s10822-004-6258-1. PMID 15865061.
- ^ Walker, M. C.; Kurumbail, R. G.; Kiefer, J. R.; Moreland, K. T.; Koboldt, C. M.; Isakson, P. C.; Seibert, K; Gierse, J. K. (2001). "A three-step kinetic mechanism for selective inhibition of cyclo-oxygenase-2 by diarylheterocyclic inhibitors". The Biochemical Journal. 357 (Pt 3): 709–18. doi:10.1042/bj3570709. PMC 1222000. PMID 11463341.
- ^ a b c d 버크, A, E. 스미스 외(2005).제26장: 진통 항균제, 통풍 약리치료.치료법의 약리학적 근거. L. L. Brunton, J. S. Lazo 및 K. L. Parker, McGraw-Hill 회사: 679-680 및 702-705.
- ^ Davies, N. M.; McLachlan, A. J.; Day, R. O.; Williams, K. M. (2000). "Clinical pharmacokinetics and pharmacodynamics of celecoxib: A selective cyclo-oxygenase-2 inhibitor". Clinical Pharmacokinetics. 38 (3): 225–42. doi:10.2165/00003088-200038030-00003. PMID 10749518.
- ^ a b Karim, A; Laurent, A; Slater, M. E.; Kuss, M. E.; Qian, J; Crosby-Sessoms, S. L.; Hubbard, R. C. (2001). "A pharmacokinetic study of intramuscular (i.m.) parecoxib sodium in normal subjects". Journal of Clinical Pharmacology. 41 (10): 1111–9. doi:10.1177/00912700122012607. PMID 11583480.
- ^ Takemoto, J. K.; Reynolds, J. K.; Remsberg, C. M.; Vega-Villa, K. R.; Davies, N. M. (2008). "Clinical pharmacokinetic and pharmacodynamic profile of etoricoxib". Clinical Pharmacokinetics. 47 (11): 703–20. doi:10.2165/00003088-200847110-00002. PMID 18840026.
- ^ Agrawal, N. G.; Porras, A. G.; Matthews, C. Z.; Rose, M. J.; Woolf, E. J.; Musser, B. J.; Dynder, A. L.; Mazina, K. E.; Lasseter, K. C.; Hunt, T. L.; Schwartz, J. I.; McCrea, J. B.; Gottesdiener, K. M. (2003). "Single- and multiple-dose pharmacokinetics of etoricoxib, a selective inhibitor of cyclooxygenase-2, in man". Journal of Clinical Pharmacology. 43 (3): 268–76. doi:10.1177/0091270003251122. PMID 12638395.
- ^ Mangold, J. B.; Gu, H; Rodriguez, L. C.; Bonner, J; Dickson, J; Rordorf, C (2004). "Pharmacokinetics and metabolism of lumiracoxib in healthy male subjects". Drug Metabolism and Disposition. 32 (5): 566–71. doi:10.1124/dmd.32.5.566. PMID 15100180.
- ^ Halpin, R. A.; Geer, L. A.; Zhang, K. E.; Marks, T. M.; Dean, D. C.; Jones, A. N.; Melillo, D; Doss, G; Vyas, K. P. (2000). "The absorption, distribution, metabolism and excretion of rofecoxib, a potent and selective cyclooxygenase-2 inhibitor, in rats and dogs". Drug Metabolism and Disposition. 28 (10): 1244–54. PMID 10997947.
- ^ Jaksch, W; Dejaco, C; Schirmer, M (2008). "4 years after withdrawal of rofecoxib: Where do we stand today?". Rheumatology International. 28 (12): 1187–95. doi:10.1007/s00296-008-0650-4. PMID 18663451.
- ^ a b c d Baron, J. A.; Sandler, R. S.; Bresalier, R. S.; Lanas, A; Morton, D. G.; Riddell, R; Iverson, E. R.; Demets, D. L. (2008). "Cardiovascular events associated with rofecoxib: Final analysis of the APPROVe trial". The Lancet. 372 (9651): 1756–64. doi:10.1016/S0140-6736(08)61490-7. PMID 18922570.
- ^ a b c d e f Salinas, G; Rangasetty, U. C.; Uretsky, B. F.; Birnbaum, Y (2007). "The cycloxygenase 2 (COX-2) story: It's time to explain, not inflame". Journal of Cardiovascular Pharmacology and Therapeutics. 12 (2): 98–111. doi:10.1177/1074248407301172. PMID 17562780.
- ^ a b "Archived copy" (PDF). Archived from the original (PDF) on 17 April 2012. Retrieved 4 January 2015.
{{cite web}}: CS1 maint: 타이틀로 보관된 사본(링크) - ^ a b Ferrario, C. M. (2008). "On the selective inhibitors of Cyclooxygenase-2: Do we have a last word?". Therapeutic Advances in Cardiovascular Disease. 2 (2): 75–8. doi:10.1177/1753944708091000. PMID 19124410.
- ^ a b c Li, H; Hortmann, M; Daiber, A; Oelze, M; Ostad, M. A.; Schwarz, P. M.; Xu, H; Xia, N; Kleschyov, A. L.; Mang, C; Warnholtz, A; Münzel, T; Förstermann, U (2008). "Cyclooxygenase 2-selective and nonselective nonsteroidal anti-inflammatory drugs induce oxidative stress by up-regulating vascular NADPH oxidases". Journal of Pharmacology and Experimental Therapeutics. 326 (3): 745–53. doi:10.1124/jpet.108.139030. PMID 18550689.
- ^ Förstermann, U; Münzel, T (2006). "Endothelial nitric oxide synthase in vascular disease: From marvel to menace". Circulation. 113 (13): 1708–14. doi:10.1161/CIRCULATIONAHA.105.602532. PMID 16585403.


