직접 트롬빈 억제제 발견 및 개발
Discovery and development of direct thrombin inhibitors다이렉트 트롬빈 억제제(DTIs)는 각종 질병으로 인한 색전 및 혈전을 예방하고 치료하는데 사용할 수 있는 항응고제 일종이다.그것들은 응고 폭포에 많은 방법으로 영향을 미치는 세린 프로테아제인 트롬빈을 억제한다.DTI는 90년대 이후 급속한 발전을 거듭해 왔다.유전공학에서의 기술적 진보로 재조합형 히루딘의 생산이 가능해져 이 새로운 약물 그룹의 문을 열었다.DTI를 사용하기 전에는 잘 알려진 단점이 있는 헤파린 유도체와 와파린의 사용으로 50년 이상 항응고 치료법과 프로필락스가 그대로 유지되었다.DTI는 아직 개발 중이지만, 연구 초점은 인자 Xa 억제제, 또는 심지어 억제 인자 IIa(트롬빈)와 Xa 둘 다에 의해 보다 광범위한 작용 메커니즘을 갖는 이중 트롬빈과 fXa 억제제 쪽으로 이동했다.트롬빈 억제제에 대한 특허와 문헌의 최근 검토는 알로스테리 및 다중 메커니즘 억제제의 개발이 보다 안전한 항응고제로의 길을 안내할 수 있다는 것을 보여주었다.[1]
역사
항응고 치료는 오랜 역사를 가지고 있다.1884년 존 베리 헤이크래프트는 거머리들, 히루도 약효의 침에서 발견되는 물질로 항응고 효과를 가지고 있다고 기술했다.그는 이 물질을 라틴어 이름에서 '히루딘'이라고 명명했다.약용 거머리 사용은 고대 이집트까지 거슬러 올라갈 수 있다.[2]20세기 초 제이 맥린, L. 에밋 홀트 주니어, 윌리엄 헨리 하웰은 간(hepar)에서 격리된 항응고제 헤파린을 발견했다.[3]헤파린은 여전히 가장 효과적인 항응고제 중 하나로 남아있으며, 정맥 투여가 필요하고 상당한 단백질 결합으로 인해 용량-반응 곡선이 가변적이라는 단점이 있지만 오늘날에도 여전히 사용되고 있다.[4]1980년대에 저분자-중량 헤파린(LMWH)이 개발되었다.효소성 또는 화학적 고농축에 의해 헤파린에서 파생되며 헤파린보다 약동성질이 좋다.[5]1955년에 비타민 K 대항제인 와파린의 첫 임상 사용이 보고되었다.와파린은 원래 1948년 쥐약으로 사용되어 인간에게 안전하지 않다고 생각되었으나, 자살 시도는 인간에게 비교적 안전하다는 것을 암시했다.비타민K 길항제는 오늘날 가장 흔히 사용되는 경구 항응고제, 와파린은 1999년[3] 미국에서 11번째로 가장 많이 처방된 약이었으며 실제로 세계적으로 가장 널리 처방된 경구 항응고제다.[6]그러나 와파린은 헤파린과 마찬가지로 좁은 치료지표와 다수의 식품과 약물 상호작용과 같은 단점이 있으며, 정기적인 항응고 감시와 투여량 조정이 필요하다.[4][7]헤파린과 와파린 둘 다 단점이 있기 때문에 대체 항응고제를 찾는 작업이 계속되고 있으며 DTI는 가치 있는 경쟁자로 입증되고 있다.첫번째 DTI는 실제로 히루딘이었고, 이것은 유전공학에 더 쉽게 이용가능해졌다.현재 레피루딘(Refludin, Refludan)과 데시루딘(Revasc, Iprivask)으로 재조합 형태로 이용할 수 있다.다른 DTI의 개발은 히루딘 아날로그, 비발루딘, 그리고 그 다음으로 작은 분자 DTI가 뒤따랐다.[4]그러나 그러한 DTI는 출혈 합병증이나 간 독성 같은 부작용도 생기고 있었고, 장기적 효과는 의심스러웠다.[citation needed]
작용기전
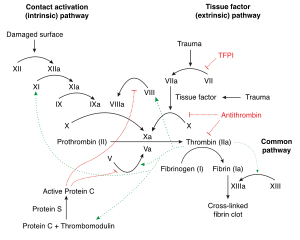
응혈 캐스케이드
혈관이 파열되거나 다쳤을 때, 인자 VII는 혈액 응고 폭포라고 불리는 과정을 시작하는 조직 인자와 접촉한다.출혈을 멈추고 조직 손상을 수리하는 것이 목적이다.여러 가지 문제로 인해 이 과정이 너무 활발해지면 혈전이나 색전증의 위험이 높아진다.이름에서 캐스케이드를 나타내듯이, 캐스케이드의 각 단계에서 다양한 프로엔자임(주로 세린 프로테아제)을 활성화하여 주력 제품 트롬빈을 만드는 다단계 절차다.트롬빈은 여러 가지 목적을 가지고 있지만 주로 가용성 피브리노겐을 불용성 피브린 복합체로 전환시킨다.[8]게다가, 그것은 모두 Arginine (Arg)과 Gly (Gly) 사이에서 선택적으로 GlyGlyGlyValarG-GlyPro와 PhePeSerAlaArg-GlyHis의 시퀀스를 분리함으로써 V, VIII, XI 인자를 활성화시킨다.[9]이러한 요소들은 더 많은 트롬빈을 생성한다.트롬빈은 또한 피브린 콤플렉스를 안정시키는 인자 XII를 활성화하여 응고 작용을 돕는 혈소판을 자극한다.이 광범위한 트롬빈의 작용을 고려할 때 헤파린, 와파린, DTI와 같은 항응고제 약물과 아스피린 같은 항혈소판제의 좋은 약물 표적이 된다.[8][10][11]
바인딩 사이트
트롬빈은 세린 프로테아제과에 속한다.그것은 트롬빈 금지 약물이 결합하는 3개의 바인딩 도메인을 가지고 있다.그러한 프로테아제는 두 개의 β-바렐 하위 도메인으로 구성된 활성 결합 부위로 기질 펩타이드를 결합하는 표면 간격을 구성한다.이 틈새의 표면은 강직 장애물에 의해 분자에 대한 접근을 제한하는 것으로 보이며, 이 결합 부위는 3개의 아미노산, Asp-102, His-57 및 Ser-195로 구성되어 있다.[9][12]트롬빈은 또한 두 개의 엑소사이트(1과 2)를 가지고 있다.트롬빈은 엑소사이트 1이 음이온 결합형이고 피브린과 다른 유사한 기질에 결합되는 반면 엑소사이트 2는 헤파린 결합형 영역이기 때문에 다른 세린 단백질과는 조금 다르다.[8][9]
DTI 억제
.
DTI는 두 가지 방법으로 트롬빈을 억제한다. 즉, 활성 사이트와 외부 사이트 1을 동시에 차단하고 피브린의 경쟁적 억제제 역할을 하는 반면,[13] 비생산적 DTI는 활성 사이트만 차단하므로 결합되지 않은 트롬빈과 피브린 결합형 트롬빈을 억제할 수 있다.이와는 대조적으로 헤파린 약물은 엑소사이트 2에서 결합하여 체내에 형성된 천연 항응고제 기질인 트롬빈과 안티트롬빈 사이에 가교를 형성하고 그 기능을 강하게 촉매한다.그러나 헤파린은 또한 헤파린-안티트롬빈 복합체의 억제 기능으로부터 트롬빈을 보호하고 피브린에 대한 트롬빈의 친화력을 증가시키는 엑소사이트 1에 결합되는 트롬빈과 피브린 사이의 다리를 형성할 수 있다.[8]음이온 결합 부위에 결합하는 DTI는 피브린에서 트롬빈을 분리하지 않고 트롬빈을 비활성화하는 것으로 나타났으며, 피브린은 별도의 결합 부위를 가리킨다.[12]DTI는 앤트롬빈과 같은 공작용제에 의존하지 않아 트롬빈을 억제할 수 있을 뿐만 아니라 헤파린과 달리 피브린 결합 트롬빈을 억제할 수 있다.[10]그 억제는 되돌릴 수 없거나 되돌릴 수 있다.되돌릴 수 있는 억제는 종종 출혈의 위험을 줄이는 것과 관련이 있다.DTI의 이러한 작용으로 인해 두 가지 모두 전색증/외색 치료뿐만 아니라 예방에도 사용할 수 있다.[8][10]
활성 사이트 포켓
활성 결합 부위에 맞는 DTI는 기본 사이드 체인을 인식하는 하단에 아스파르트산 잔류물이 들어 있는 소수성 포켓(S1)에 장착해야 한다.S2 사이트는 트립토판 주위에 고리가 있으며, 이는 더 큰 알립토잔 잔류물을 인식할 수 있는 소수성 주머니를 포함하고 있다.S3 부지는 평평하고 S4 부지는 소수성이며, 뤼신과 이솔레우신이 줄지어 있는 트립토판을 가지고 있다.[9]
Nα-(2-나프틸-설포닐-글리실)-DL-p-아미디노페닐라닐-피페리딘(NAPAP)은 트롬빈을 S1, S2, S4 포켓에서 결합한다.NAPAP의 아미딘 집단은 S1 포켓 깊숙이 아스프를 넣은 바이덴테 소금 다리를 형성하고, 피페리딘 집단은 프롤라인 잔여물 역할을 맡아 S2 포켓에 결합하며, 분자의 나프틸 링은 S4 포켓에 있는 Trp와 친수성 교감을 형성한다.제약회사들은 NAPAPP의 구조적 지식을 DTI 개발에 활용해왔다.NAPAP과 마찬가지로 Dabigatran은 S1, S2, S4 포켓에 묶는다.다비가트란 구조의 벤자미딘 그룹은 S1 포켓 깊숙이 결합하고 메틸벤츠미다졸은 소수성 S2 포켓에 잘 맞고 S4 포켓 하단의 일레와 리우는 다비가트란의 향기로운 그룹에 결합한다.[9]
약물 개발
히루딘 파생상품
히루딘 파생상품은 모두 이변성 DTI로, 되돌릴 수 없는 1:1 스토오치메트릭 콤플렉스에서 활성현장과 엑소사이트 1을 모두 차단한다.[4]활성 부지는 구상 아미노-단자 영역의 결합 부지로 엑소사이트 1은 산성 카르복시-단자 영역의 결합 부지다.[14]65-아미노산 폴리펩타이드인 토종 히루딘은 약용 거머리의 파라파린지샘에서 생산된다.[15]오늘날 히루딘은 효모를 이용한 재조합 생명공학에 의해 생산된다.이 재조합형 히루딘은 Tyr-63에서 황산염 그룹이 없으므로 데설파토히루딘이라고 불린다.토종 히루딘에 비해 트롬빈에 대한 결합 친화력이 10배 낮지만, 트롬빈에 대한 매우 구체적인 억제제로 남아 있고 피코몰라 범위에서 트롬빈에 대한 억제 상수가 있다.[14][15]데설파토히루딘의 전신적 간극에는 신간소거와 열화가 대부분을 차지하며 만성 신장질환 환자에게는 약물이 축적되어 있다.효과를 되돌릴 수 있는 특정 해독제가 없기 때문에 이러한 약물은 신장 기능이 손상된 환자에게 사용해서는 안 된다.[14]히루딘은 대개 정맥주사로 자궁경부 주사를 맞는다.히루딘의 80%는 외혈관 구획에 분포하고 혈장에서는 20%만 발견된다.오늘날 가장 흔한 데술파토히루딘은 레피루딘과 데시루딘이다.[15]
히루딘
급성관상동맥증후군(ACS) 치료에서 히루딘과 기타 DTI 대 헤파린을 포함하는 11개의 무작위 임상실험을 메타분석한 결과, 히루딘이 헤파린에 비해 출혈 발생률이 현저히 높은 것으로 나타났다.따라서 히루딘은 ACS 치료에 권장되지 않으며 현재 임상적 징후가 없다.[4]
레피루딘
레피루딘은 미국, 캐나다, 유럽, 호주에서 헤파린 유도 혈소판감소증(HIT) 치료를 승인받았다.HIT는 헤파린과 관련된 매우 심각한 부작용이며, 비록 후자의 경우에는 덜하지만, 굴절되지 않은 헤파린과 LMWH 둘 다에서 발생한다.이것은 헤파린이 혈소판 인자 4(PF4)와 상호작용으로 촉발된 혈소판 활성 면역 반응에서 비롯되는 면역 매개 프로트롬보틱스 합병증이다.[16]PF4-헤파린 복합체는 혈소판을 활성화할 수 있으며 정맥 및 동맥 혈전증을 일으킬 수 있다.[8]레피루딘이 트롬빈에 결합하면 프로트롬빈 활동을 방해한다.[16]HIT 치료에서 레피루딘과 역사적 대조군을 비교한 헤파린-협회-트롬보시토페니아(HAT)1,2,3라는 3가지 선행 연구가 수행됐다.세 가지 연구 모두 레피루딘의 사용으로 새로운 혈전증의 위험은 감소했지만, 주요 출혈의 위험은 증가했다는 것을 보여주었다.[15]주요 출혈의 높은 발생률은 너무 높았던 승인된 투여 요법의 결과라고 생각되며, 결과적으로 권장 선량은 초기 투여량보다 절반으로 줄어들었다.[4]유일한 레피루딘 주사제 제조업체인 바이엘헬스케어는 2012년 5월 현재 생산을 중단했다.그들은 도매상으로부터의 물량이 2013년 중반에 고갈될 것으로 예상하고 있다.[17]
데시루딘
데시루딘은 유럽에서 정맥 혈전증(VTE) 치료 승인을 받았으며 현재 미국에서는 다상3기 임상시험이 진행 중이다.[4]데시루딘과 에녹사파린(LMWH) 또는 불굴절 헤파린을 비교하는 두 가지 연구가 수행되었다.두 연구 모두에서 데시루딘은 VTE 예방에 탁월한 것으로 간주되었다.데시루딘은 근위부 심맥 혈전증 발생률도 낮췄다.출혈률은 데시루딘과 헤파린과 비슷했다.[4][8]
비발루딘
비발리루딘(Bivalirudin)은 20 아미노산 폴리펩타이드로 히루딘의 합성 아날로그다.히루딘처럼 그것은 또한 이변성 DTI이다.아미노-단자 D-Phe-Pro-Arg-Pro 도메인을 가지고 있으며, 4개의 글리 잔류물을 통해 히루딘의 카르복시-단자 아날로그 도데카펩타이드에 연결된다.아미노-단자 영역은 활성 사이트에 바인딩되고 카복시-단자 영역은 트롬빈의 엑소사이트 1에 바인딩된다.히루딘과는 다르게, 한번 바운드된 트롬빈은 비발루딘의 아미노 단자에서 아르그프로 결합을 분해하고 그 결과 효소의 활성 부위로 기능을 회복시킨다.비발루딘의 카르복시-단자영역은 여전히 트롬빈에 1 엑소사이트로 묶여 있지만, 아미노-단자 방출 후에는 결합의 친화력이 떨어진다.이것은 기판에 있는 기판이 트롬빈의 엑소사이트 1에 접근하기 위해 갈라진 비발루딘과 경쟁할 수 있게 한다.[14]비발루딘의 사용은 대부분 급성 관상동맥증후군의 설정에서 연구되어 왔다.몇몇 연구는 비발루딘이 헤파린에 비해 비발루딘이 비발루딘이며, 비발루딘은 낮은 출혈률과 관련이 있다는 것을 보여준다.[4]히루딘과 달리 비발루딘은 신장에 의해 일부(약 20%)만 배설되며 간대사, 프로테롤리시스 등 다른 부위들도 신진대사에 기여해 신장장애 환자에게는 더 안전하게 사용할 수 있지만, 중증 신장손상에서는 선량 조정이 필요하다.[8][16]
소분자 직접 트롬빈 억제제
소분자 직접 트롬빈 억제제(smDTIs)는 트롬빈 분자의 활성 부위에 결합하여 구체적이고 역행적으로 자유 및 응고 결합 트롬빈 모두를 억제하는 비펩타이드 소형 분자다.그들은 고관절과 무릎 교체 수술을 받는 환자들에게서 VTE를 예방한다.[10]이러한 유형의 DTI의 장점은 모니터링이 필요하지 않고 치료 지수가 넓고 구강 투여 경로의 가능성이 높다는 것이다.이들은 이론적으로 비타민 K의 대항제나 LMWH보다 더 편리하다. 그러나 연구는 사용의 지표와 그들의 안전성을 보여주어야 할 것이다.[18]
아르기닌 자체의 P1 잔여물(예: 아르가트로반) 또는 벤자미딘(예:[9] NAPAP)과 같은 아르기닌 유사 기판 중 하나를 사용하여 펩티도미메틱 설계를 사용하여 파생된 smDTI.
아르가트로반
아르가트로반은 아르기닌의 P1 잔류물로 형성된 작은 단발성 DTI이다.트롬빈의 활성 사이트에 바인딩된다.[10]X선 결정 구조는 피페리딘 링이 S2 포켓에서 결합하고 구아니딘 그룹은 아스프189와 함께 수소 결합으로 S1 포켓에 결합하는 것을 보여준다.pKa 13을 가진 매우 기초적인 구아니딘이 위장관으로부터 흡수되는 것을 막아주기 때문에 정맥 볼루스로 주어진다.[19]혈장 반감기는 대략 45분이다.아르가트로반은 간통로를 통해 대사되고 담도계를 통해 주로 배설되기 때문에 간통장애 환자에게는 선량 조정이 필요하지만 신장손상은 아니다.아르가트로반은 HIT 환자에서 혈전증 치료를 위해 2000년부터 미국에서, 2002년부터 HIT 이력이 있거나 경피적 관상동맥 중재술(PCI)을 받는 환자의 항응고 치료를 위해 승인되어 왔다.[10][19]말초혈관 질환 치료를 위해 1990년 일본에서 처음 도입됐다.[19]
시멜라가트란
NAPAP-fIIA 결정 구조의 간행은 트롬빈 억제제에 대한 많은 연구를 촉발시켰다.NAPAP는 활성 사이트 트롬빈 억제제다.나프탈렌과 피페리딘 그룹으로 S3와 S2 포켓을 채운다.아스트라제네카는 멜라가트란을 개발하기 위해 이 정보를 이용했다.이 화합물은 구술로는 사용할 수 없었지만, 리노베이션 후 그들은 이중 프로드러브를 얻었는데, 이는 임상 실험에서 최초의 경구 DTI인 시멜라가트란이었다.[9]시멜라가트란은 유럽 시장에 약 20개월 동안 나와 있다가 중단되었다.연구는 35일 이상 치료는 간 독성의 위험과 관련이 있다는 것을 보여주었다.[18]그것은 FDA의 승인을 받은 적이 없다.[20]

다비가트란 이텍스균
Boehringer Ingelheim의 연구자들 또한 NAPAPP-fIIA 결정 구조에 대한 공개된 정보를 이용했는데,[9] NAPAPP 구조는 극지방 화합물이며 따라서 구두로 활동하지 않는 다비가트란을 발견하게 되었다.아미디늄을 카바마이트-에스테르로 가린 후 카르복시산염을 에스테르로 만들어 혈장 반감기가 약 12시간인 고지방 지방흡수성, 위장관흡수성, 구강생리성 이중제인 시멜라가트란 등을 만들 수 있었다.[21][9]다비가트란 이질체는 빠르게 흡수되며 사이토크롬 P450 효소와의 상호작용이 부족하고 다른 식품 및 약물과의 상호작용이 없어 정기적인 모니터링이 필요 없고 넓은 치료지표와 고정된 투여량도 있어 와파린에 비해 안전성이 뛰어나다.[4]시멜라가트란과 달리 다비가트란 이텍스틸렌의 장기 치료는 신장에 의해 약물이 주로 제거되는 방식(>80%)으로 보아 간 독성과 연관성이 없다.다비가트란 이텍스틸은 2008년 캐나다와 유럽에서 고관절과 무릎 수술을 받는 환자의 VTE 예방 승인을 받았다.2010년 10월 미국 FDA는 심방세동(AF) 환자의 뇌졸중 예방을 위해 dabigatran etexal을 승인했다.[6][10]많은 제약회사들이 구강 생체이용 DTI 의약품을 개발하려고 시도했지만 시장에 진출한 것은 다비가트란 이텍스틸뿐이다.[9]
2012년 메타분석 다비가트란은 광범위한 환자 스펙트럼에서 서로 다른 제어장치에 대해 시험했을 때 심근경색(MI) 또는 ACS의 위험 증가와 관련이 있었다.[22]
표 1: DTI 특성 요약
| 이변성/단일성[4] | 행정경로[10] | 신진대사[10] | 활성 사이트 및/또는 exosite 1에[4] 바인딩 | 적응증 | 제한 사항 | 이점 | |
| 네이티브 히루딘 | B | (파렌터럴) | 아무런 조짐도 없다. | ||||
| 레피루딘 | B | 파렌터럴(iv/sc) | 레날 | 되돌릴 수 없는 | HIT[16] 환자에 대한 추가 혈전 예방 | 좁은 TI, 잠재적 출혈 증가, 항히루이드 항체는 환자의 40%에 형성되며 체중 기준 투약[10] 필요 | |
| 데시루딘 | B | 파렌터럴(iv/sc) | 레날 | 되돌릴 수 없는 | 유럽: VTE[4] USA 치료: 고관절 교체 수술을[23] 받는 환자의 DVT 예방 | sc 투여로[10] 인해 레피루딘에 비해 체중 기반 선량 및 정기적 모니터링의 필요성 감소 | |
| 비발루딘 | B | 파렌테랄(iv) | 단백질 분해능, 간, 20% 신장 | 가역성 | 불안정한 협심증이 있고, PTCA 또는 PCI가[24] 진행 중이거나 HIT의 위험이 있는 환자의 급성 허혈성 합병증 예방 | 심각한 신장 손상에[16] 선량 조정이 필요하다. | 되돌릴 수 있는 바인딩으로 인한 출혈 위험 감소,[4] r-히루딘에 비해 안전 프로필 개선, 신속한 조치[10] 개시 |
| 아르가트로반 | U | 파렌테랄(iv) | 간, 대부분 담도 | 가역성 | HIT[10] 환자들의 혈전 예방 및 치료 | 조영제 투여가 필요하지[10] 않음 | |
| 시멜라가트란 | U | 구강 | 간체 | 가역성 | 유럽: VTE[10] 예방 USA: FDA는 승인을[20] 하지 않았다. | 장기요법(장기요법)은 간독성과 관련이 있음 - 유럽[18] 시장 진출 | |
| 다비가트란 이텍스균 | U | 구강 | 주로 신장, 나머지는 간에서 글루쿠론산과 결합한다. | 가역성 | AF환자의[25] 뇌졸중 및 색전증 예방 | 빠른 조치 개시, CYP450, 식품 또는 의약품과의 상호작용 부족, 넓은 TI, 고정 투여량 및 양호한 안전 프로필, 장기 사용을[10] 위한 간독성과는 관련이 없음 |
iv: intravenous, sc: subcutaneous, HIT: heparin-induced thrombocytopenia, VTE: Venous thromboembolism, DVT: Deep vein thrombosis, PTCA: Percutaneous transluminal coronary angioplasty, PCI: percutaneous coronary intervention, FDA: Food and Drug Administration, AF: Atrial fibrillation, TI: Therapeutic index
2014년 현황
2014년, dabigatran은 유일하게 승인된 경구[9] DTI로 남아 있으며, 따라서 비타민 K 대항제들에 대한 유일한 DTI 대안이다.그러나 현재 임상발달의 초기단계와 진보단계에 있는 몇 가지 새로운 구강항응고제들이 있다.그러한 약의 대부분은 직접 인자 Xa 억제제 등급이지만, AZD0837이라는 DTI가 하나 있는데,[26] AstraZeneca가 개발하고 있는 시멜가트란의 후속 화합물이다.그것은 ARH0637이라 불리는 자유 및 섬유 결합 트롬빈에 대한 강력하고 경쟁적이며 되돌릴 수 있는 억제제의 약이다.[18]AZD 0837 개발은 중단된다.확장 릴리즈된 AZD0837 의약품의 장기적 안정성 한계로 인해 비발상 심방세동 환자의 뇌졸중 예방에 대한 AHEL의 후속 연구가 2년 후인 2010년에 조기 마감되었다.와파린에 대한 사망률도 수적으로 높았다.[27][28][29]AF에 대한 2단계 실험에서 평균 혈청 크레아티닌 농도는 치료 중단 후 기준치로 복귀한 AZD0837로 치료된 환자의 기준치보다 약 10% 증가했다.[30]미쓰비시 타나베 제약사의 소피그라트란 등 다른 경구 DTI의 개발이 중단됐다.[26]경구용 항응고제를 개발하는 또 다른 전략은 보링거 인겔하임 등 일부 제약사가 신고한 이중 트롬빈과 fXa 억제제다.이 화합물들은 체외에서 좋은 항응고 활성을 보여준다.[9]
참고 항목
참조
- ^ Mehta, AY; Jin, Y; Desai, UR (Jan 2014). "An update on recent patents on thrombin inhibitors (2010 - 2013)". Expert Opinion on Therapeutic Patents. 24 (1): 47–67. doi:10.1517/13543776.2014.845169. PMID 24099091.
- ^ Whitacker, I.S.; Rao, J.; Izadi, D.; Butler, P.E. (2004). "Historical Article: Hirudo medicinalis: ancient origins of, and trends in the use of medicinal leeches throughout history". British Journal of Oral and Maxillofacial Surgery. 42 (2): 133–137. doi:10.1016/S0266-4356(03)00242-0. PMID 15013545.
- ^ a b Shapiro, Sandor S. (2003). "Treating Thrombosis in the 21st Century". New England Journal of Medicine. 349 (18): 1762–1764. doi:10.1056/NEJMe038152. PMID 14585945.
- ^ a b c d e f g h i j k l m n O’Brien, P. Joshua; Mureebe, Leila (2012). "Direct Thrombin Inhibitors". Journal of Cardiovascular Pharmacology and Therapeutics. 17 (1): 5–11. doi:10.1177/1074248410395941. PMID 21335484.
- ^ Hirsh, Jack; Raschke, Robert (2004). "Heparin and Low-Molecular-Weight Heparin The Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy". Chest. 126 (3_suppl): 188S–203S. doi:10.1378/chest.126.3_suppl.188s. PMID 15383472.
- ^ a b Thethi, Indermohan; Lewis, Bruce; Fareed, Jawed (1 January 2012). "Oral Factor Xa and Direct Thrombin Inhibitors". Journal of Burn Care & Research. 33 (4): 453–461. doi:10.1097/BCR.0b013e318248bc4c.
- ^ Kendoff, D. (30 December 2011). "Oral Thromboprophylaxis Following Total Hip or Knee Replacement: Review and Multicentre Experience with Dabigatran Etexilate". The Open Orthopaedics Journal. 5 (1): 395–399. doi:10.2174/1874325001105010395. PMC 3263520. PMID 22276081.
- ^ a b c d e f g h Di Nisio, Marcello J.; Middeldorp, Saskia; Büller, Harry R. (2005). "Direct Thrombin Inhibitors". New England Journal of Medicine. 353 (10): 1028–1040. doi:10.1056/NEJMra044440. PMID 16148288.
- ^ a b c d e f g h i j k l Nar, Herbert (2012). "The role of structural information in the discovery of direct thrombin and factor Xa inhibitors". Trends in Pharmacological Sciences. 33 (5): 279–288. doi:10.1016/j.tips.2012.03.004. PMID 22503439.
- ^ a b c d e f g h i j k l m n o p Lee, Catherine J.; Ansell, Jack E. (2011). "Direct Thrombin Inhibitors". British Journal of Clinical Pharmacology. 72 (4): 581–592. doi:10.1111/j.1365-2125.2011.03916.x. PMC 3195735. PMID 21241354.
- ^ Patrono, C (May 5, 1994). "Aspirin as an antiplatelet drug". New England Journal of Medicine. 330 (18): 1287–1294. doi:10.1056/NEJM199405053301808. PMID 8145785. WOS:A1994NJ51200008.
- ^ a b Lefkovits, J.; Topol, E.J (1994). "Direct thrombin inhibitors in cardiovascular medicine". Circulation. 90 (3): 1522–1536. doi:10.1161/01.CIR.90.3.1522. PMID 8087958.
- ^ Thomas, edited by Simon Redwood, Nick Curzen, Martyn R. (2010). Oxford textbook of interventional cardiology (1. publ. ed.). Oxford: Oxford University Press. ISBN 978-0-19-956908-3.
{{cite book}}:first=일반 이름 포함(도움말) - ^ a b c d Weitz, Jeffery I.; Crowther, Mark (2002). "Direct Thrombin Inhibitors". Thrombosis Research. 106 (3): 275–284. doi:10.1016/S0049-3848(02)00093-2. PMID 12356489.
- ^ a b c d Greinacher, Andreas; Warkentin, Theadore E. (2008). "The direct thrombin inhibitor hirudin". Thrombosis and Haemostasis. 99 (5): 819–829. doi:10.1160/TH07-11-0693. PMID 18449411.
- ^ a b c d e Sakr, Yasser (2011). "Heparin-induced thrombocytopenia in the ICU: an overview". Critical Care. 15 (2): 211. doi:10.1186/cc9993. PMC 3219407. PMID 21457505.
- ^ "Lepirudin Injection". American Society of Health-System Pharmacists. Retrieved 18 September 2012.
- ^ a b c d Squizzato, A; Dentali F.; Steidi L.; Ageno W. (2009). "New direct thrombin inhibitors". Intern Emerg Med. 4 (6): 479–484. doi:10.1007/s11739-009-0314-8. PMID 19756950.
- ^ a b c Kikelj, Danijel. (2004). "Peptidomimetic Thrombin Inhibitors". Pathophysiology of Haemostasis and Thrombosis. 33 (5–6): 487–491. doi:10.1159/000083850. PMID 15692265.
- ^ a b heartwire. "FDA opts not to approve ximelagatran". Retrieved 19 September 2012.
- ^ Hauel, Norbert H.; Nar, Herbert; Priepke, Henning; Ries, Uwe; Stassen, Jean-Marie; Wienen, Wolfgang (2002). "Structure-Based Design of Novel Potent Nonpeptide Thrombin Inhibitors". Journal of Medicinal Chemistry. 45 (9): 1757–1766. doi:10.1021/jm0109513. PMID 11960487.
- ^ Uchino, K.; Hernandez, A. V. (9 January 2012). "Dabigatran Association With Higher Risk of Acute Coronary Events: Meta-analysis of Noninferiority Randomized Controlled Trials". Archives of Internal Medicine. 172 (5): 397–402. doi:10.1001/archinternmed.2011.1666. PMID 22231617.
- ^ "Iprivask 15 mg" (PDF). Retrieved 18 September 2012.
- ^ "Angiomax Injection" (PDF). Retrieved 18 September 2012.
- ^ "FDA approves Pradaxa to prevent stroke in people with atrial fibrillation". Retrieved 18 September 2012.
- ^ a b Ahrens, Ingo; Karlheinz Peter; Gregory Y.H. Lip; Christoph Bode (2012). "Development and Clinical Applications of Novel Oral Anticoagulants. Part II. Drugs Under Clinical Investigation". Discovery Medicine. 13 (73): 445–450.
- ^ "AZD0837". Astrazenecaclinicaltrials.com. Retrieved 2012-10-16.
- ^ 아스트라제네카 장기요법 비타민-K 길항작용제 AZD0837과 비교한 비타민-K 길항작용제인 AstraZeneca 장기요법은 비발상 심방세동 환자에게 뇌졸중 예방과 뇌졸중 및 전신 색전증 사건에 대한 하나 이상의 위험요인으로 한다.5년 후속 연구 코드 D1250C0004221 2010년 1월 시험 D1250C00042 2013년 11월 10일 웨이백 기계에 보관
- ^ Eikelboom JW, Weitz JI (2010). "Update on Antithrombotic Therapy: New Anticoagulants". Circulation. 121 (13): 1523–32. doi:10.1161/CIRCULATIONAHA.109.853119. PMID 20368532.
- ^ Lip GY, Rasmussen LH, Olsson SB, Jensen EC, Persson AL, Eriksson U, Wåhlander KF (December 2009). "Oral direct thrombin inhibitor AZD0837 for the prevention of stroke and systemic embolism in patients with non-valvular atrial fibrillation: a randomized dose-guiding, safety, and tolerability study of four doses of AZD0837 vs. vitamin K antagonists". Eur. Heart J. 30 (23): 2897–907. doi:10.1093/eurheartj/ehp318. PMC 2785945. PMID 19690349.