트립탄의 발견과 개발
Discovery and development of triptans트립탄(Triptans)은 선택적 5-히드록시트리프타민1B/1D/세로토닌1B/1D(5-HT) 작용제인 항이민제 종류에 흔히 쓰이는 말이다.[1]편두통은 인구의 약 15%에 영향을 미치는 복잡한 질병으로, 매우 불능화될 수 있다.[2]트립탄은 선택적 약리학, 잘 확립된 안전기록, 증거에 근거한 처방지침 등 에르고타민과 디히드로에르고타민에 비해 장점이 있다.그러므로 트립탄은 종종 편두통에서 더 선호된다.[1]
역사
1972년 글락소에서 시작된 신종 편두통 치료제에 대한 검색.1960년대 연구는 5-HT, 에르고타민, 노르아드레날린으로부터의 혈관수축이 편두통 발작을 줄일 수 있다는 것을 보여주었다.또한 편두통 중에는 혈소판 5-HT 수치가 감소한다는 연구 결과가 나왔다.5-HT를 약물로 사용하기에는 부작용이 너무 많기 때문에, 과학자들은 5-HT 수용체에 대한 보다 구체적인 작용제를 발견하고 개발하기 위해 5-HT 수용체에 대한 연구를 시작했다.5-HT 수용체와 그 효과에 대한 연구는 5-HT의 몇 가지 유형과 하위 유형을 발견하게 했다.AH24167은 나중에 5-HT라는7 이름을 부여받은 다른 유형의 5-HT 수용체에 작용제 효과로 인해 혈관 수축 대신 혈관 수축 효과를 보였다.AH25086은 두 번째로 개발된 화합물로 혈관 수축 효과를 보였으나 구강당 생체이용률이 낮아 약물로 출시되지 않았다.지속적인 연구로 인해 혈관 수축 효과는 물론 구강 생체이용률도 개선된 최초의 트리프탄 약인 수마티프탄이 발견되었다.수마트립탄은 1991년 네덜란드에서 처음 출시되었고 1993년 미국에서 출시되었다.[3]
메커니즘
트립탄은 5-HT1 수용체에 대한 구체적이고 선택적인 작용제다.수마트립탄은[4] 5-HT1D 수용체, 졸미트리프탄,[5] 리자트리프탄,[6] 나라트리프탄,[7] 알모트리프탄,[8] 프로바트리프란[9][10] 5-HT1B/1D1B/1D/1F 수용체에 결합한다.트립탄은 혈관수축을 통해 그 효과를 발휘하여 삼위일체 복합체의 2차 뉴런을 통해 뇌혈류, 말초신경 억제 또는 전달 억제에 영향을 주지 않고 경동맥 순환을 감소시킨다고 여겨진다.[1]
수용체
5-HT 수용체는 리간드 게이트 이온 채널인 5-HT를3 제외한 모든 G-단백 결합 수용체(GPCR)이다.편두통에 관여하는 것으로 밝혀진 수용체는 5-HT1B, 5-HT1D, 5-HT1F 수용체로서 뇌막동맥에서 5-HT의1B 작용이 발견되고, 5-HT의1B 작용은 두개신경에서 혈관수축증을 일으킨다.5-HT1D 수용체는 주로 중추신경계(CNS)의 삼차신경에 위치한다.그것들은 또한 혈관 매끄러운 근육에서 발견되며, 수축을 매개한다.5-HT1D 수용체의 작용은 염증 유발 신경 자극제의 방출을 억제한다.수용체에 대한 리간드의 결합에 기여하는 아미노산은 아스파르트산(Asp), 페닐알라닌(Ph), 세린(Ser), 트레로닌(Thr), 트립토판(Trp), 티로신(Tyr)이다.인간의 5-HT1B 수용체와 5-HT1D 수용체 모두 결합 성질의 유사성을 보여주는 매우 유사한 아미노산 구조를 가지고 있는 것으로 나타났다.[11][12][13]
디자인
모든 트립탄은 신경전달물질 5-HT와 동일한 세뇌 구조를 가지고 있다.고전적인 트립탄 구조물은 인도레 링에 사이드 체인을 포함하고 있으며, 인도레 구조로부터 비슷한 거리에 기본 질소가 있다.트립탄의 주요 구조적 차이는 설폰아미드 위치와 그것에 부착된 사이드 체인의 위치(그림 1과 표 1 참조)이다.리자트립탄과 졸미트립탄은 각각 설포나미드 대신 트라이아졸과 2-옥사졸리돈을 함유하고 있다.고전적 구조의 또 다른 예외는 인도레 링에 연결된 질소 알킬 체인을 디메틸-피롤리딘으로 대체하는 엘렉트판과 질소 알킬 체인을 1-메틸-피페리딘 링으로 대체하는 나라트립탄에서 볼 수 있다.
프로바트립탄 사이드 체인 중 하나가 인도레와 함께 추가 링을 형성하여 카바졸 링 시스템을 형성한다.
삼쌍둥이의 구조
| 트립탄 | R1 | R2 | 트립탄 | R1 | R2 |
|---|---|---|---|---|---|
| 수마트립탄 | 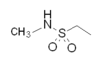 |  | 엘렉트로판 |  |  |
| 리자트립탄 |  |  | 나라트립탄 |  |  |
| 알모트립탄 |  |  | 프로바트립탄 |  |  |
| 졸미트립탄 |  |  | – | – | – |
5-HT1B/D 약리학

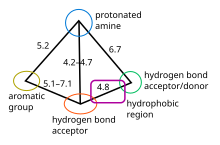
5-HT1B 수용체와 5-HT1D 수용체는 매우 유사한 것으로 간주되며, 아미노산 호몰로학을 공유하며, 이들의 라이간드는 유사한 결합 특성을 노출하므로 약리학적 특성이 유사하다.이러한 수용체 리간드에 대한 약리학적 모델은 질적이며 중요한 집단의 상대적 위치를 규정한다.그것은 5가지 주요 특징으로 정의된다: 방향족 그룹(일반적으로 인도), 양성자 아민(수소 결합의 기증자), 수소 결합의 수용자, 추가 수소 결합 사이트(공여자와 수용자 모두), 그리고 두 수소 결합 사이트 사이에 위치한 소수성 영역(그림 2 참조).[11][14]주요 구속점은 양성자 아민과 수소 결합 부지로 결론 났다.이 일련의 화합물에서 작용하기 위해서는 세뇌의 이중 결합 영역이 필요하다는 것이 관찰되었다.그림 3은 5-HT1D 작용제의 C 및 N 연계 유사점을 사용하여 서로 다른 약물이 약물에 얼마나 적합한지를 보여준다.그림에 표시된 부위가 친화력을 책임진다.[14][15]약리학자는 암페타틱으로 특징지어질 수 있는데, 이는 그 구조가 소수성 그룹과 소수성 그룹을 모두 가지고 있다는 것을 의미한다.[16]
삼판 및 수용체 결합의 관련 구조적 특징
트립탄 구조는 5-HT 수용체에 대한 친화력을 얻기 위해 5-HT 구조로 설계되었으며, 따라서 동일한 배아 구조로 설계되었다.5-HT의 위치 C의3 위치 C의 위치 C에 있는 히드록실 그룹(-OH)과 인도레 코어의 헥산느에 있는 히드록실 그룹(-OH)은 설포나미드 또는 아졸링 구조화 파생물과 다른 아민알킬 사이드 체인과 같은 다른 화합물로 대체되었다.전기 음성 그룹은 수용기의 주머니에 있는 Thr과 수소 결합을 형성할 수 있다.인도레 구조물의 헥산 링에 부착된 설포나미드 유도체는 전기 음성 성질을 가지며, 리자트립탄과 졸미트립탄의 트라이아졸과 2-옥사졸리돈도 각각 있다.이것은 특히 5-HT1D 수용체에서 화합물의 결합 능력과 효능을 증가시킬 수 있다.[11]
5-HT1D 수용체에 대한 수마트립탄 결합의 개략적인 도면을 그림 4에서 볼 수 있다.한 연구는[11] 양성자 질소 원자가 있는 사이드 체인을 인도레 구조 위로 다시 접었을 때 수마트립탄이 수용체의 결합 부위에 더 잘 맞는다는 것을 보여주었다.이러한 정렬은 결합 부위의 Sulfonamine의 질소와 Ser138 사이의 수소 결합에 기여한다.또한 설포나민 산소와 스르202 산소 사이의 수소 결합 형성에 유리하다.결합 부위의 포켓에 있는 다른 결합은 트립탄과 아미노산 Ser352의 인도레 구조의 펜틴 링에 있는 질소 원자와 함께 발생한다.이렇게 활발하게 작용제의 유리한 위치는 결합부위의 다른 세르에 대한 리간드의 추가 결합을 가능하게 하고, 결합부위의 포켓에 있는 페와 작용제의 수양 사이에 추가적인 닻을 내릴 수 있게 한다.페와 트립탄의 결합은 인도와 아미노산의 π 적층 상호작용에 의해 발생하며, 이 상호작용에 대한 추가적인 영향은 아미노산 류신(Leu; 그림 4에 표시되지 않음)의 분산 효과 때문이다.아미노산 Trp343과 Tyr346은 둘 다 방향족 구조 안에 전자 농후한 π-systems를 가지고 있다.결합 부위에서 그들의 위치를 가지고 그들은 삼분의 C 위치에3 있는 사이드 체인의 양성 질소 원자 주위에 일종의 방향족 케이지(이 질소 원자는 생리적 조건에서 양성됨)를 만들어내고, 따라서 질소 원자가 아스파르산 카복시산과 형성한 이온 결합을 안정화시킨다.주변 아미노산의 사이드 체인은 질소 원자의 결합에 영향을 줄 수 있으며, 주로 3 Peh는 질소 원자에 묶인 메틸 그룹에 영향을 미칠 수 있다(그림 4에 나와 있지 않음).[11][12][13]
엘렉트립탄은 수용체에 대한 친화력이 더 높으며, 이것은 아마도 구조물의 부피가 큰 대체물의 결과일 것이다.[citation needed]아민은 생리학적 pH 조건에서 양성되어 더 잘 흡수되도록 유도된다.[16][17]작용제의2 섭취율은 R의 아민이 1차인지 2차인지 3차인지에 따라 다르지만 후자는 최상의 결과를 주는 것 같다.R1 대체물의 경우 전자 풍부한 설폰아미드 그룹과 아미드 그룹이 수용체 결합과 활성에서 최상의 결과를 보였다.[16]흡수와 분자 크기 사이에 관계가 있다는 것이 관찰되어 왔기 때문에 더 큰 친수성 분자는 흡수가 잘 되지 않는 경향이 있었다.트립탄의 빠른 구강 생체이용성을 유지하기 위해서는 작은1 R 대체물이 필요하다.[15]
5-HT 작용제를 전자-퇴출 그룹 또는 큰 그룹을 인도레 구조물의 위치 C에2 배치하여 길항제(the antior)로 변환한다.이는 인도레 링이 결합 부위의 방향족 부분을 차지하지 못하기 때문인 것으로 생각된다.[12]
트립탄 약품
제형의 속성
수마트립탄은 이 반에서 선구적인 약이었다.졸미트립탄, 나랏크립탄, 리자트립탄, 알모트립탄, 엘렉트립탄, 프로바트립탄 등 2세대의 트립탄이 곧 보급됐다.[18]서로 다른 3등분 형식과 강도에 따라 사용할 수 있다(표 2 참조).그것들은 피하 주사, 구강 알약, 구강 분해 알약, 비강 스프레이 및 직장용 부설물로 제조되었다.3인조 배달 시스템은 행동의 시작에 중요한 역할을 할 수 있다.환자 대상 이동방지제 선정은 증상에 따라 달라진다.최초의 선택적 5-HT1B/1D 작용제인 수마티프탄은 피하주사로 합성된 후 구강 알약으로, 최근에는 비강 스프레이로 일부 국가에서도 사용 가능하다.피하주사는 빠르게 진행되고 있는 편두통 공격을 막는 가장 빠른 방법이다.수마트립탄 비강 스프레이는 알약보다 더 빠른 행동의 시작을 제공하지만, 2시간에도 비슷한 두통 반응을 일으킨다.일부 환자들은 비강 스프레이가 알약보다 더 빨리 작용하고 피하 주사만큼 많은 부작용을 일으키지 않기 때문이다.비강 스프레이는 모든 환자에게는 적합하지 않지만, 일부 환자들은 맛이 없고 반응의 일관성이 결여되어 있기 때문이다.졸미트립탄은 수마트립탄보다 흡수가 빠르고 혈액뇌장벽을 넘을 수 있는 능력이 뛰어난 지방성 화합물을 만들겠다는 전략으로 개발됐다.그것은 일부 국가에서는 알약, 구강 분해 알약 및 비강 스프레이로 사용할 수 있다.리자트립탄은 타블렛과 경구 분해 타블렛으로 제공되지만 현재는 나라트립탄, 알모트립탄, 엘렉트립탄, 프로바트립탄만 타블렛으로 제공되고 있다.[19]
| 포괄적인 | 공식화[19] | 선량(mg)[19] | 최대 일용량(mg)[19] | 시작 작용(최소)[20] | 기간 활동적인[20] | 선호도(pKI in nM) | 신진대사[21] | 배설[20] |
|---|---|---|---|---|---|---|---|---|
| 수마트립탄 | 태블릿 | 25, 50, 100 | 200 | 짧다 | 7.9–8.5 | 마오에이 | 소변(57%) | |
| 졸미트립탄 | 태블릿 | 2.5, 5 | 10 | 45 | 짧다 | 9.2 | CYP1A2 | 소변(65%) |
| 나라트립탄 | 태블릿 | 1, 2.5 | 5 | 60–180 | 긴 | 8.3 | CYPa | 오줌 |
| 리자트립탄 | 태블릿 | 5, 10 | 30 | 30–120 | 짧다 | 7.7 | 마오에이 | 오줌 |
| 알모트립탄 | 태블릿 | 6.25, 12.5 | 25 | 60–180 | 짧다 | 7.8 | 마오에이 | 소변(40%) |
| 엘렉트로판 | 태블릿 | 20, 40 | 80 | <60[23] | – | 8.9 | CYP3A4 | – |
| 프로바트립탄 | 태블릿 | 2.5 | 7.5 | 60–120 | 긴 | 8.4 | CYP1A2 | 소변(40%) |
a 특정 효소는 아직 보고되지 않았다.
미국 식품의약국(FDA)은 2008년 4월 15일 수마트라탄 85mg과 나프록센 500mg(NSAID)을 혼합한 신약을 승인했다.[24]트립탄과 NSAIDs는 편두통에 관련된 뚜렷한 메커니즘을 연구하기 때문에 함께 관리했을 때 개선된 치료를 제공할 수 있다.[25]
약동학
신약이 개발될 때 약동학 특성(표 3)이 중요하다.[26]
환자들은 두통을 완화하기 위해 빠른 행동의 시작을 찾는다.상대적으로 짧은 tmax, 좋은 생체이용률과 지방질성은 빠른 행동의 시작과 관련이 있는 약동학적 특성이다.혈액뇌장벽을 넘나드는 좋은 능력과 비교적 긴 말단 제거 반감기가 두통 재발률을 낮출 수 있다는 추측이 나왔다.수마트립탄과 리자트리프탄은 먼저 간대사를 통과해 생체이용률이 낮아진다.[18]
| 포괄적인 | 생체이용률(%)[26] | 지방질성[19] | 단백질 바인딩(%)[20] | t1/2 (h)[26] | tmax (h)[22] | CLR (mL min-1)[27] | 로그pH7.4[28] D | 브이D[20] |
|---|---|---|---|---|---|---|---|---|
| 수마트립탄 | 14 | 낮음 | 10–21 | 2–2.5 | 2–2.5 | 260 | -1.5 | 2.4–3.3 L/kg |
| 졸미트립탄 | 40 | 중간 | 25 | 3 | 2 | 193 | -1.0 | 7.0 L/kg |
| 나라트립탄 | 63(M) / 74(F) | 높은 | 28–31 | 5–6 | 2–3 | 220 | -0.2 | 2.4 L/kg |
| 리자트립탄 | 47 | 중간 | 14 | 2–2.5 | 1.3 | 414 | -0.7 | 140(M) / 110(F) L |
| 알모트립탄 | 69 | – | 35 | 3.6 | 1.4–3.8 | – | -2.1 | 180-200L |
| 엘렉트로판 | 50 | 높은 | 85[10] | 4–5 | 1–2 | 597 | 0.5 | 138 L[10] |
| 프로바트립탄 | 24(M) / 30(F) | 낮음 | 20–30 | 25[18][26] | 2–4 | 216(M) / 132(F)[9] | -1.0[29] | 4.2(M) / 3.0(F) L/kg |
t1/2 = 제거 반감기, tmax = 혈장 약물 농도에 도달하는 시간, ClR = 신장 간극, LogDpH7.4 = pH 7.4에서 지방질 측정값. 숫자가 증가하면 용해성이 더 커지며, VD = 분포 볼륨이 증가한다.
M = 남성, F = 여성
미래연구
대부분의 삼쌍둥이는 1990년대에 개발되어 소개되었다.더 나은 행동 지속 기간, 효과 및 안전 프로파일을 가진 새로운 삼두근의 개발과 관련하여 더 많은 연구들이 많은 가능성을 보여주지 못했다.따라서 더 이상의 변형이 개발될 것 같지 않고 새로운 항이민제에도 또 다른 작용기전이 있을 것 같다.[29]
참조
- ^ a b c Ferrari, M. D.; Goadsby, P.J.; Roon, K. I.; Lipton, R.B. (2002), "Triptans (serotonin, 5-HT1B/1D agonists) in migraine: detailed results and methods of a meta-analysis of 53 trials", Cephalalgia, 22 (8): 633–658, doi:10.1046/j.1468-2982.2002.00404.x, PMID 12383060, archived from the original on 2012-12-17
- ^ Goadsby, Peter J. (2006), "Recent advances in understanding migraine mechanism, molecules and therapeutics", Trends in Molecular Medicine, 13 (1): 39–44, doi:10.1016/j.molmed.2006.11.005, PMID 17141570
- ^ Humphrey, Patrick P.A. (2007), "The Discovery of a New Drug Class for the Acute Treatment of Migraine", Headache, 47 [Suppl 1]: 10–19, doi:10.1111/j.1526-4610.2007.00672.x, PMID 17425704[데드링크]
- ^ "Imigran Tablets 50mg Imigran Tablets 100mg". Retrieved 2008-11-09.
- ^ "Zomig Tablets 2.5mg". Retrieved 2008-11-09.
- ^ "Maxalt 5mg, 10mg Tablets, Maxalt Melt 10mg Oral Lypophilisates". Archived from the original on 2008-05-02. Retrieved 2008-11-09.
- ^ "Naramig Tablets 2.5mg". Retrieved 2008-11-09.
- ^ "Axert". Retrieved 2008-11-09.
- ^ a b "Migard". Retrieved 2008-11-09.
- ^ a b c "Relpax – 20 mg and 40 mg". Retrieved 2008-11-09.
- ^ a b c d e Bremner, DH; Ringan, NS; Wishart, G (1997), "Modeling of the agonist binding site of serotonin human 5-HT1A, 5-HTDα and 5-HTDβ receptors", European Journal of Medicinal Chemistry, 32 (1): 59–69, doi:10.1016/S0223-5234(97)84362-0
- ^ a b c Bojarski, Andrzej J. (2006), "Pharmacophore Models for Metabotropic 5-HT Receptor Ligands", Current Topics in Medicinal Chemistry, 6 (18): 2005–2026, doi:10.2174/156802606778522186, PMID 17017971
- ^ a b Terzioglu, Nalan; Höltje, Hans-Dieter (2005), "Receptor-based 3D QSAR Analysis of Serotonin 5-HT1D receptor agonists", Collection of Czechoslovak Chemical Communications, 70 (9): 1482–1492, doi:10.1135/cccc20051482
- ^ a b c Buckingham, Janet; Glen, Robert C.; Hill, Alan P.; Hyde, Richard M.; Martin, Graeme R.; Robertson, Alan D.; Woollard, Patrick M. (1995). "Computer-Aided Design and Synthesis of 5-Substituted Tryptamines and Their Pharmacology at the 5-HT1D Receptor: Discovery of Compounds with Potential Anti-Migraine Properties". Journal of Medicinal Chemistry. 38 (18): 3566–3580. doi:10.1021/jm00018a016.
- ^ a b Jandu, K. S.; Barrett, V.; Brockwell, M.; Cambridge, D.; Farrant, D. R.; Foster, C.; Selwood, D. L. (2001). "Discovery of 4-[3-(trans-3-Dimethylaminocyclobutyl)-1H-indol-5-ylmethyl]- (4S)-oxazolidin-2-one (4991W93), a 5HT1B/1D Receptor Partial Agonist and a Potent Inhibitor of Electrically Induced Plasma Extravasation". Journal of Medicinal Chemistry. 44 (5): 681–693. doi:10.1021/jm000956k.
- ^ a b c Cheng, Ziqiang; Liu, Houfu; Yu, Na; Wang, Fei; An, Gang; Xu, Yan; Ayrton, Andrew (2012). "Hydrophilic anti-migraine triptans are substrates for OATP1A2, a transporter expressed at human blood-brain barrier". Xenobiotica. 42 (9): 880–890. doi:10.3109/00498254.2012.675455. PMID 22509823.
- ^ Street, Leslie J.; Baker, Raymond; Castro, Jose L.; Chambers, Mark S.; Guiblin, Alexander R.; Hobbs, Sarah C.; Beer, Margaret S. (1993). "Synthesis and serotonergic activity of 5-(oxadiazolyl)tryptamines: potent agonists for 5-HT1D receptors". Journal of Medicinal Chemistry. 36 (11): 1529–1538. doi:10.1021/jm00063a003. PMID 8496922.
- ^ a b c Mathew, Ninan T.; Loder, Elizabeth W. (2005), "Evaluating the triptans", The American Journal of Medicine, 118 (12): 28–35, doi:10.1016/j.amjmed.2005.09.014, PMID 16356805
- ^ a b c d e Bigal, Marcelo E.; Bordini, Carlos A.; Antoniazzi, Ana L.; Speciali, José G (2003), "The triptan formulations, A critical evaluation" (PDF), Arquivos de Neuro-Psiquiatria, 61 (2A): 313–320, doi:10.1590/s0004-282x2003000200032, PMID 12806521
- ^ a b c d e "Drug class review: Oral 5HT1 Receptor agonists" (PDF). U.S. Department of Veterans Affairs. Archived from the original (PDF) on 2009-01-14. Retrieved 2008-11-03.
- ^ Armsterong, Scott C.; Cozza, Kelly L. (2002), "Triptans", Psychosomatics, 43 (6): 502–504, doi:10.1176/appi.psy.43.6.502, PMID 12444236, archived from the original on 2003-07-12
- ^ a b c d e Rapoport, Alan M.; Tepper, Stewart J.; Sheftell, Fred D.; Kung, Edna; Bigal, Marcelo E. (2006), "Which triptan for which patient?", Neurological Sciences, 27: 123–129, doi:10.1007/s10072-006-0586-y, PMID 16688615
- ^ Färkkilä, M.; Dalhlöf, C.; Stovner, L.J.; Bruggen, J.P ter; Rasmussen, S.; Muirhead, N.; Sikes, C.; Sikes, C (2003), "Eletriptan for the treatment of migrain in patients with previous poor response or toletance to oral sumatriptan", Cephalalgia, 23 (6): 463–471, doi:10.1046/j.1468-2982.2003.00554.x, PMID 12807526, archived from the original on 2012-12-17
- ^ "press release - Treximet (sumatriptan and naproxen sodium) tablets approved by FDA for acute treatment of migraine". GlaxoSmithKline. Archived from the original on 2008-12-04. Retrieved 2008-11-09.
- ^ Smith, Timothy R.; Sunshine, Abraham; Stark, Stuart R.; Littlefield, Diane E.; Spruill, Susan E.; Alexander, W. James (2005), "Sumatriptan and Naproxen Sodium for the Acute Treatment of Migraine", Headache, 45 (8): 983–991, doi:10.1111/j.1526-4610.2005.05178.x, PMID 16109111, archived from the original on 2012-12-18
- ^ a b c d Jhee, Stanford S.; Shiovitz, Thomas; Crawford, AAron W.; Cutler, Neal R. (2001), "Pharmacokinetics and pharmacodynamics of the triptan antimigraine agents", Clinical Pharmacokinetics, 40 (3): 189–205, doi:10.2165/00003088-200140030-00004, PMID 11327198
- ^ Saxena, Pramod R.; Tfelt-Hansen, Peer (2001), "Success and failure of triptans", The Journal of Headache and Pain, 2: 3–11, doi:10.1007/s101940170040
- ^ Pascual, Julio; Muñoz, Pedro (2005), "Correlation between lipophilicity and triptan outcomes", Headache, 45 (1): 3–6, doi:10.1111/j.1526-4610.2005.05003.x, PMID 15663606[데드링크]
- ^ a b Lambert, Geoffrey A. (2005), "Preclinical Neuropharmacology of Naratriptan", CNS Drug Reviews, 11 (3): 289–316, doi:10.1111/j.1527-3458.2005.tb00048.x, PMC 6741765, PMID 16389295[데드링크]