TRPV1 길항자 발견 및 개발
Discovery and development of TRPV1 antagonists만성적인 고통으로부터의 구제는 아직 인정되지 않은 의학적 필요성으로 남아 있다.이에 따라 새로운 진통제 발굴은 제약업계에서 집중적으로 연구되고 있다.TRPV1 수용체는 많은 유형의 통증의 중재로 관여되어 가장 광범위하게 연구된 이온 채널이다.최초의 경쟁 상대인 Capsazepine은 1990년에 처음 설명되었는데, 그 이후 소설 TRPV1 적대자들의 개발이 크게 진전되었다.이러한 노력으로 임상시험에 들어간 여러 TRPV1 길항제들을 진통제로 식별하게 되었다.만약 이 새로운 화학 물질들이 만성적인 고통의 증상을 완화시킨다면, 이 종류의 화합물들은 수년에 걸쳐 고통을 치료하기 위한 최초의 새로운 메커니즘 중 하나를 제공할 수 있을 것이다.[1][2]
역사
고추의 활성 성분인 캡사이신은 1세기 전에 처음 격리되었다.1919년에 캡사이신의 정확한 화학 구조가 결정되었고 10년 후에 이 화합물의 완전한 합성이 이루어졌다.캡사이신은 수십 년 동안 진통제로 사용되어 왔지만, 캡사이신의 치료 잠재력은 1850년 초기에 처음으로 인정되었다.[3]자극성 화학물질인 캡사이신은 리간드 게이트 이온 채널 TRPV1을 통해 매개된다.이러한 지식은 TRPV1 수용체의 기능에 대한 추가 연구의 장을 마련했고 임상 전 연구는 수많은 인간 질병에서 그 중요성에 대한 증거를 보여주었다.[1][4]이들은 이 메커니즘에 의해 작용하는 첫 번째 요원으로서 가능한 진통제로써 그들의 사용에 대한 평가를 위해 클리닉에 진출했고 따라서 약물 개발의 중요한 목표들을 위한 것이다.TRPV1 적대자들에 대한 진통 외에 잠재적 치료적 응용의 범위 측면에서, 그리고 분자 메커니즘에 대한 완전한 이해가 있었던 것은 지난 10년 동안뿐이라는 점에서 많은 발견이 아직 이루어지지 않았다.앞으로 몇 년 동안 TRPV1 적대자들이 그들의 잠재력을 발휘할 수 있을지는 더 분명해질 것이다.[1][5][6]
바닐로이드 수용체 1(VR1/TRPV1 수용체)
바닐로이드 수용체(TRPV1)는 과도 수용체 전위 채널(TRP) 슈퍼 패밀리에 속하는 6개의 서브 멤버 중 하나이다.TRPV1은 최초로 발견된 포유류 부재로 칼슘이 침투할 수 있는 비선택적 양이온 통로다.수용체는 각각 S1-S6라는 6개의 투과형 세그먼트를 가진 4개의 동일한 서브유닛으로 구성되며, 5번째와 6번째 세그먼트 사이에 수공극이 있다.이 부위는 채널 전도성 모공을 형성하며 세포막의 세포질 쪽에 N-와 C-termini를 포함하고 있다.[7]캡사이신과 RTX는 감각신경 엔딩에 표현되는 비선택적 양이온 채널을 활성화하여 화끈거리는 통증을 유도한다.캡사이신이 임상 전 연구에서 진통 효과가 있는 것으로 밝혀졌을 때 캡사이신이 결합되어 활성화되는 수용체/채널 연구에 많은 중점을 두었다.[6][8]또한 TRPV1은 캡사이신(capsaicin)에 의해 활성화되는 것 외에도 42°C 이상의 열과 양성자(acid, pH<6)와 같은 물리적 자극뿐만 아니라 광범위한 외생성 및 내생성 화학 리간드에도 반응한다.또한 TRPV1은 막 전위의 변화에 의해 규제 대상이 되며, 이러한 내적 전압 의존성은 나트륨과 칼슘 이온의 유입을 초래하는 이 비선택적 양이온 채널의 탕구 메커니즘에 기초한다고 생각된다.중요한 것은 TRPV1 활성도 또한 G-단백 결합 수용체 신호와 같은 세포내 신호 캐스케이드에 의해 조절되며, 이는 녹조성 물질, 염증 매개체 및 부상에 대한 반응에 관여한다.[1]
작용기전
TRPV1은 주로 작은 몰염화되지 않은 중간 크기, 등근의 감각 신경세포와 감각 신경세포가 군집하는 삼차성 신경세포에 의해 표현된다.TRPV1 수용체들은 근육, 관절, 방광, 신장에서도 발견된다.TRPV1의 기능적 활성은 중추신경계 내에서 시상하부, 소뇌, 로쿠스 코울레우스, 과격뇌회색 및 피질을 포함한 뇌의 특정 부위와 척수에서 입증되었다.TRPV1의 활성화는 칼슘과 나트륨 이온의 유입을 유발하며, 이는 결국 막 탈분극화, 신경 발화 및 신경 자극의 전도를 초래하는 일련의 사건을 촉발한다.TRPV1 인산염은 여러 가지 알제리에 대한 반응으로서 채널 활성화의 낮은 임계값을 초래한다.브래디키닌, 신경성장인자, 양성자와 같은 일부 물질은 TRPV1 수용체를 감작하는 것으로 보고되었다.TRPV1이 활성화되면 프로-Nociceptive 펩타이드가 분비되는데, 이는 TRPV1 길항제 치료 시 감소한다.일반적으로 대부분의 채널 길항제들은 4개 채널의 4개 모노머 모두의 잔류물과 상호작용하면서 모공 부위에서 결합한다.[2][9][10]
바인딩
TRPV1 수용체의 리간드는 세포 내측에서 작용하는 것처럼 보인다.이것은 TRPV1의 특이한 성질로서, 대부분의 다른 리간드 게이트 채널의 리간드가 세포외 공간에서 결합한다.캡사이신은 지방질이 많아 혈장막을 쉽게 통과할 수 있다.캡사이신은 활성화되기 전에 세포내측에서 TRPV1 수용체에 작용하여 결합하는 것이 일반적으로 받아들여진다.캡사이신 결합의 임계 부위는 각각 수용기의 N-와 C-termini의 Arg 114와 Glu 761이다.이 두 개의 아미노산이 충전되어 TRPV1 수용체의 세포질 부분에 위치하기 때문에, 두 부위는 TRPV1과 캡사이신, RTX와 같은 바닐로이드의 친수성 상호작용에 관여할 가능성이 있다.TRPV1의 N-와 C-termini에 있는 이러한 사이트들 외에도, 'TM3 지역'이라고 불리는 트랜섬브레인 영역에 배치된 세포내 연결기에 있는 영역은 바닐로이드와의 소수성 상호작용에 중요한 것으로 나타났다.TM3 영역은 바닐로이드에 결합하는 데 필요한 것으로 간주된다.플라즈마 막에 위치하기 때문에 소수성 환경에 둘러싸여 있다.지금은 캡사이신과의 소수성 상호작용에서 중요한 연결고리로 인식되고 있다.Binding 사이트 Arg 114와 Glu 761과 TRPV1의 TM3 지역은 함께 Banilloid에 대한 Binding Pocket으로 구성되어 있다.[9][2]
약물 설계
고민자
자연적으로 발생하는 바닐로이드인 캡사이신(Capsaicin, 그림 2)은 가장 잘 알려진 TRPV1 작용제다.레진시페라톡신(RTX)은 TRPV1 작용 활성을 보이는 또 다른 자연발생 반닐로이드다.캡사이신보다 더 강력하며 현재 감각신경감소제로 개발 중이다.[7]초기에 작용제는 수용체 감응화에 따른 진통 효과로 TRPV1 리간드 발달의 주요 초점이었다.그러나 캡사이신을 포함한 모든 천연 바닐로이드 수용체 작용제의 초기 연소 효과 때문에 치료는 복잡해지고 아마도 효과적이지 않을 것이다.흥분 효과와 진통 효과의 분리가 좋은 합성작용제를 만들려는 시도는 성공하지 못했다.TRPV1 작용제들의 이러한 지속되는 부작용을 피하기 위해 경쟁상대들을 새로운 진통제로서 집중적인 고려가 이루어졌다.[8]
반목자
경쟁적 및 비경쟁적 TRPV1 적대자를 설계하기 위한 치열한 노력이 수행되었다.작용제 결합 사이트에 묶고 폐쇄적이고 비전도적인 상태로 채널을 고정시키는 적대자들은 경쟁적 적대자들이다.이와는 대조적으로 작용제에 의한 수용체 개방을 막거나 수용체 구조의 추가 결합 부위와 상호작용하는 길항제들은 비경쟁적 길항제들이다.개방형 채널 차단제 역할을 하는 비경쟁적 길항제들은 지나치게 활성화된 TRPV1 채널을 인식해 원치 않는 부작용의 가능성을 줄일 수 있어 치료적으로 매력적이다.[7]
약리학
TRPV1 길항제 약리학적 모델은 수소 본드 수용체, 수소 본드 기증자, 고리 특징의 세 가지 필수 특징으로 구성된다.또한 TRPV1 길항제들은 TRPV1 공극의 부피에 들어갈 수 있도록 중첩되어 있다.호몰로지 모델을 고려할 때 수용체 모공에서 적절한 상호작용 부위가 발견된다.리간드의 수소 본드 수용기는 수소 본드 기증자로서 수용체 위의 Tyr 667 (헬릭스 S6)과 상호작용하는 것을 제안하고, 리간드의 수소 본드 기증자는 수소 본드 수용체로서 수용체 위의 테트라머의 반대편 모노머에 있는 Tyr 667과 상호작용하는 것을 제안한다.약리성의 고리 특징은 4개의 단량체의 Tyr 667 잔여물의 방향족 고리에 의해 형성된 소수성 공간에 맞도록 제안된다.TPRV1 길항제 약리소어의 핵심 요소와의 상호작용에서 Tyr 667이 수행한 중요한 역할과 일치하여, 현장 지향 돌연변이 유발 연구에서는 이 티로신을 랫드 TRPV1 수용체에서 알라닌과 교환하면 TRPV1의 기능 활성이 폐기된다는 것을 보여주었다.길항제 내 지방질 단부는 성격과 부피가 다양하며 트랜스템브레인 헬리코인 S5와 S6의 하단 단부와 상호작용한다.이러한 나선형의 세포내 끝은 막을 지나 확장되기 때문에 유연성이 높고 채널 개폐 과정의 일부일 수 있다.고도로 최적화된 TRPV1 길항제로부터 조립된 약리학적 모델의 사용과 단백질의 호몰로지 모델의 결합은 현재 TRPV1 길항제들의 많은 일련의 관찰된 구조-활동 관계에 대한 이해를 강화시켰으며, 새로운 종류의 길항제 발견에 유용해야 한다.[2]
구조활동관계
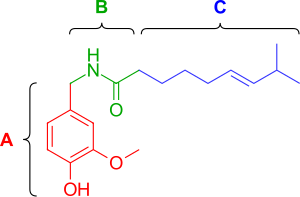
캡사이신(3-메톡시 4-하이드록시벤질) 그룹이 최적인 방향족 A 영역, 에스테르 또는 아미드 링커로 알려진 B 영역, 지방질 옥타닐 계수가 가장 높은 효력과 연관된 알리파티 C 영역 등 3가지 기능 영역이 있다.호모바닐 모티브와 아미드 결합 영역은 수소 결합 상호작용에 관여하는 2극 그룹을 포함한다.[11]
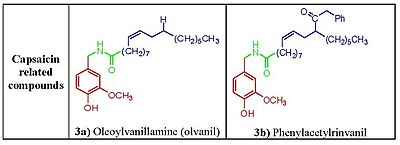
페놀 수산화물과 아미드 모이에티는 캡사이신 반응을 유도하는 데 중요한 것으로 보인다.캡사이신 아날로그에서 페놀 수산화물 또는 아미드 결합을 제거하면 효력이 감소한다.캡사이신의 페놀 수산화물과 아미드 모이티는 TRPV1 수용체와 잠재적 다중 수소 결합 상호작용을 공유한다.캡사이니코이드와 캡시노이드의 특징은 아미드(캡사이니코이드) 또는 에스테르(캡시노이드) 링커를 통해 지방질 아틸 그룹에 산소화된 방향족 모이티로 묶인 것이다.바닐라와 카보닐 링커는 활동에 필수적인 수소 결합을 형성할 수 있는 극성 그룹을 포함하고 있는 반면, 지방질 매이티는 TRPV1의 바닐로이드 결합 부위의 해당 구획과 상호작용한다.캡사이신(capsaicin)의 중간 크기 브랜딩 지방산을 긴 지방산으로 대체하는 것은 활동에 해를 끼치지만 [12]불포화성 회복 및 활성(예: oleoylvanillamine(olvanil)(그림 3a)))이 TRPV1 활성화 측정에서 캡사이신보다 10배 더 강력하다.[13]
1,3-Di(아릴랄킬)thioureas
노바티스 그룹이 보고한 [14][9]최초의 경쟁적 반닐로이드 길항제인 캡사제핀(그림 4a)은 캡사이신의 지방질 C영역에 대한 순응적 제약의 영향을 평가하기 위한 것이었다.캡사제핀에서 캡사이신의 아미드 결합은 방향족 바닐라 2-탄소 A 링과 B-링커 아미드 질소 사이의 티우레아 모이티와 프로필리덴 링커로 대체된다.[15]이 제약조건은 오랫동안 반닐로이드 반목의 특징으로 여겨져 왔다.[16]Capsazepine은 TRPV1의 캡사이신 결합 부위를 위해 경쟁하지만, 낮은 신진대사 안정성과 열악한 약동학적 특성 때문에 이 화합물이 임상 개발에 도달하지 못했다.[17]나중에 이 테더가 이 구조적 특징으로부터 자유로운 강력한 길항제들이 개발되었고 1,3-di(arylalkyl)thioureas가 TRPV1 길항제 중 가장 유망한 비반닐로이드 등급 중 하나로 부상하여 통증 조절에 탁월한 치료 잠재력을 보이는 것으로 관찰되었다.이들 화합물 내에서 캡사이시노이드의 과이실계(guaacyl moiety)를 3-플루오로-4-술포닐라미도 그룹으로 대체하는 것은 활동 복귀에 매우 중요한 것으로 밝혀졌다.이는 RTX에서 모방한 C-region moiety의 설계로 이어졌고, 그림 4b에서 보이는 화합물로 이어졌으며, 이는 마우스에서 뛰어난 진통 활성을 보였다.[18][19]지방질 C 부위의 대체 최적화는 또 다른 유망 임상 후보인 JYL1421(그림 4c)으로 이어졌다.[20]
디(아릴랄킬)- 및 아릴(아릴라킬)유레아스
요소 유형의 여러 캡사이신 아날로그는 호모바닐릴리아민 및 4-(α-피리딜)피페리딘-1-아킬염소화물이 다른 관련 아민들의 아틸화에 의해 개발되었다.capsacinoids의 소수성 C 영역에 극성 아미노 모이성의 존재는 효력과 소수성을 결합하는데 결정적이었다. 올바닐로부터 페닐라세틸린바닐(그림 3b)이 발견되는 유사한 관찰을 모방했다(그림 3a).페닐라세틸린바닐은 현재까지 보고된 가장 강력한 캡사이신(capsaicinoid)[21]으로 캡사이신보다 약 500배 더 강력하다.몇몇 다른 요소들은 눈에 띄게 활발한 TRPV1 적대자로 부상했다.Capsazepine과 비교했을 때, 피페라즈비닐 요소(그림 5a 및 5b)는 다양한[22] 효소와 채널에 대해 높은 선택성 프로파일을 보인 반면, 매우 강력하고 구체적인 TRPV1 길항제 A-425619(그림 5c)는 쥐의 염증 및 조직손상과 관련된 통증을 줄일 수 있었다.[23]추가 연구로 인해 TRPV1의 다양한 소분자 길항제들은 임상시험에 들어간 요소인 SB-705498(그림 5d), SB-452533(그림 5e)[16,17] 및 ABT-102(그림 5f)를 포함하게 되었다.[24]
미나미데스
N-아릴신나미드는 TRPV1 길항제들의 강력하고 중요한 등급으로 부상했으며 복합 SB-366791 (그림 6a)는 인간과 랫드 TRPV1 수용체 모두에서 경쟁적이고 구체적인 활성도를 캡사제핀보다 훨씬 잘 보여준다.[25][26]이 화합물 시리즈 내에서 AMG-9810(그림 6b)은 랫드에서 좋은 경구 생체이용률과 유망한 약동학 프로파일을 보여주는 높은 길항제 효력이 보여 임상적 효용성에 좋은 징조를 보였다.[27]이 그룹의 또 다른 강력한 차단기는 수술 후 통증 실험에서 캡사이신 유도 열과 기계적 고농축증을 감소시키고 중앙 TRPV1 수용체를 차단할 수 있는 것으로 나타난 AMG0347(그림 6c)이다.[28]
카르복사미데스
카복사미드 유형의 TRPV1 길항원 여러 명이 발견되었다.이들은 니코틴아미드 파생상품 SB-782443(그림 7a), 티아조일카박스아미드(그림 7b), 테트라하이드롭리딜카박스아미드(그림 7c)의 비교에서 예시하듯 구조적으로 상당히 이질적이다.[29]SB-782443(그림 7a)은 인간, 기니피그, 랫드 TRPV1에 탁월한 효능을 보였으며, 시험관내 약물대사 및 약물역동학 프로필에 호의적이며 염증성 통증 모델에서 현저한 생체내 활성도를 보였다.[30][31]시험관 내 프로파일에 기초하여, 이 세분류의 여러 화합물이 임상 전 발달에 적합했다.[29]
기타파생상품
비클래식 길항제들은 고전적인 TRPV1 리간드의 전형적인 요소, 티우레아 또는 아미드 그룹이 부족하다.비종교적 적대행위자의 두 가지 주요 구조유형이 발견되었다.먼저 이미다졸 파생상품이 있다.4,6개의 분해된 벤지미다졸 납 구조에서 시작하여, TRPV1 배출 중국 햄스터 난소 세포에서 캡사이신과 산성유발 칼슘 유입을 모두 차단할 수 있는 4,5-바이리미다졸 시리즈.Imidazole(그림 8a)은 매우 강력하고 생물학적으로 이용 가능한 TRPV1로 식별되었다.[32]또 다른 수업은 다이어리 에테르와 아민이다.퀴나졸린 시리즈의 화합물은 생물아릴라미드 시리즈의 순응적으로 제한된 아날로그로 간주될 수 있다.비록 그것은 여전히 강력하게 블록 캅사이신, 양성잔 카르보닐 모티프가 부족한 활동의 관점에서 볼 때 5-isoquinoline 가장 활발한 가운데5-isoquinoline의 순서로 8-quinoline >, 8-quinazoline >, 8-isoquinoline ≥cinnoline>프탈라진>퀴녹살린>5-quinoline[33]예를 들어 AMG-517(무화과이다. 8b)위, 발견되었다., 그리고 열 활성화시험관내 TRPV1의 좋은 허용가능성 프로파일을 보여준다.[34]또한 Janssen, Abbott 및 Merck 제약사의 임상 후보자들(그림 8c)은 공통 특징으로 5-아미노소퀴놀린 그룹을 가지고 있어 TRPV1 길항제 활성을 위한 수용체 현장에서 이 그룹의 주요 교호작용이 있음을 시사한다.[33]
현재 상태
2009년 11월 FDA는 사후 신경통에 대한 쿠텐자(캡사이신, 국소 패치 8%)를 승인했다.[35]
임상시험
2009년 말 현재 이용 가능한 공공 정보는 상당수의 사람들이 임상실험에 참여하고 있음을 시사한다.몇몇 생명공학 및 제약회사들이 TRPV1 리간드를 개발하고 있으며, 그 중점은 고통받는 사람과 적대하는 사람 모두에게 있는 것 같다.비록 고민자들은 임상 발달에 있어 더 나아 보인다.[1]
고민자
NeurogesX는 1차 연구 엔드포인트를 만족시킨 쿠텐자(NGX-4010)의 3단계 임상 연구를 성공적으로 완료했다.쿠텐자는 합성 트랜스 캡사이신이며, 약품 전달은 NeurogesX가 2010년 11월 상반기에 쿠텐자를 미국에서 출시할 계획인 신속 납품 패치 적용 시스템에[36] 의한 것이다.[37]또 다른 생명공학 회사인 아네시바는 주입식 캡사이신인 아들레아(ALGRX 4975)의 2단계 임상시험을 마쳤다.아들리아는 진통제로서[38] 유망하며 두 실험 모두 부작용, 상처 치유, 상처 감각 기능에 대한 아들라의 안전 프로파일이 연구 기간 동안 위약과 유사하다는 것을 보여주었다.[39]
반목자
적어도 7개의 구강 활성 TRPV1 길항제 물질이 임상 개발로 진전되었으며, 몇 가지 더 많은 물질이 임상 전 발달 중이다.일라이 릴리와 컴퍼니 글렌마크가 만든 리간드 GRC-6211은 가장 발전된 것으로 현재 임상 2상 단계에 있다.GlaxoSmithKline, Merck-Neurogen, Amgen, AstraZeneca는 모두 TRPV1 길항제1호를 개발하고 있으며 모두 1상 시험을 성공적으로 완료한 물질을 개발하고 있다.[1]
참고 항목
참조
- ^ a b c d e f Gunthorpe MJ, Chizh BA (January 2009). "Clinical development of TRPV1 antagonists: targeting a pivotal point in the pain pathway". Drug Discovery Today. 14 (1–2): 56–67. doi:10.1016/j.drudis.2008.11.005. PMID 19063991.
- ^ a b c d Kym PR, Kort ME, Hutchins CW (August 2009). "Analgesic potential of TRPV1 antagonists". Biochemical Pharmacology. 78 (3): 211–6. doi:10.1016/j.bcp.2009.02.014. PMID 19481638.
- ^ Szallasi A, Blumberg PM (June 1999). "Vanilloid (Capsaicin) receptors and mechanisms". Pharmacological Reviews. 51 (2): 159–212. PMID 10353985.
- ^ Immke DC, Gavva NR (October 2006). "The TRPV1 receptor and nociception". Seminars in Cell & Developmental Biology. 17 (5): 582–91. doi:10.1016/j.semcdb.2006.09.004. PMID 17196854.
- ^ Rami H, Gunthorpe M (2004). "The therapeutic potential of TRPV1 (VR1) antagonists: clinical answers await". Drug Discovery Today: Therapeutic Strategies. 1: 97–104. doi:10.1016/j.ddstr.2004.08.020.
- ^ a b Wong GY, Gavva NR (April 2009). "Therapeutic potential of vanilloid receptor TRPV1 agonists and antagonists as analgesics: Recent advances and setbacks". Brain Research Reviews. 60 (1): 267–77. doi:10.1016/j.brainresrev.2008.12.006. PMID 19150372. S2CID 9951052.
- ^ a b c Messeguer A, Planells-Cases R, Ferrer-Montiel A (January 2006). "Physiology and pharmacology of the vanilloid receptor". Current Neuropharmacology. 4 (1): 1–15. doi:10.2174/157015906775202995. PMC 2430674. PMID 18615132.
- ^ a b Gomtsyan A, Bayburt EK, Schmidt RG, Zheng GZ, Perner RJ, Didomenico S, Koenig JR, Turner S, Jinkerson T, Drizin I, Hannick SM, Macri BS, McDonald HA, Honore P, Wismer CT, Marsh KC, Wetter J, Stewart KD, Oie T, Jarvis MF, Surowy CS, Faltynek CR, Lee CH (February 2005). "Novel transient receptor potential vanilloid 1 receptor antagonists for the treatment of pain: structure-activity relationships for ureas with quinoline, isoquinoline, quinazoline, phthalazine, quinoxaline, and cinnoline moieties". Journal of Medicinal Chemistry. 48 (3): 744–52. doi:10.1021/jm0492958. PMID 15689158.
- ^ a b c Suh YG, Oh U (2005). "Activation and activators of TRPV1 and their pharmaceutical implication". Current Pharmaceutical Design. 11 (21): 2687–98. doi:10.2174/1381612054546789. PMID 16101449.
- ^ Gunthorpe MJ, Szallasi A (2008). "Peripheral TRPV1 receptors as targets for drug development: new molecules and mechanisms". Current Pharmaceutical Design. 14 (1): 32–41. doi:10.2174/138161208783330754. PMID 18220816.
- ^ Pearce LV, Petukhov PA, Szabo T, Kedei N, Bizik F, Kozikowski AP, Blumberg PM (August 2004). "Evodiamine functions as an agonist for the vanilloid receptor TRPV1". Organic & Biomolecular Chemistry. 2 (16): 2281–6. doi:10.1039/b404506h. PMID 15305207.
- ^ Morita A, Iwasaki Y, Kobata K, Iida T, Higashi T, Oda K, Suzuki A, Narukawa M, Sasakuma S, Yokogoshi H, Yazawa S, Tominaga M, Watanabe T (November 2006). "Lipophilicity of capsaicinoids and capsinoids influences the multiple activation process of rat TRPV1". Life Sciences. 79 (24): 2303–10. doi:10.1016/j.lfs.2006.07.024. PMID 16950406.
- ^ Vriens J, Appendino G, Nilius B (June 2009). "Pharmacology of vanilloid transient receptor potential cation channels". Molecular Pharmacology. 75 (6): 1262–79. doi:10.1124/mol.109.055624. PMID 19297520. S2CID 52863171.
- ^ Suh YG, Lee YS, Min KH, Park OH, Kim JK, Seung HS, Seo SY, Lee BY, Nam YH, Lee KO, Kim HD, Park HG, Lee J, Oh U, Lim JO, Kang SU, Kil MJ, Koo JY, Shin SS, Joo YH, Kim JK, Jeong YS, Kim SY, Park YH (September 2005). "Novel potent antagonists of transient receptor potential channel, vanilloid subfamily member 1: structure-activity relationship of 1,3-diarylalkyl thioureas possessing new vanilloid equivalents". Journal of Medicinal Chemistry. 48 (18): 5823–36. doi:10.1021/jm0502790. PMID 16134949.
- ^ Szallasi A, Appendino G (May 2004). "Vanilloid receptor TRPV1 antagonists as the next generation of painkillers. Are we putting the cart before the horse?". Journal of Medicinal Chemistry. 47 (11): 2717–23. doi:10.1021/jm030560j. PMID 15139748.
- ^ Tominaga M, Caterina MJ, Malmberg AB, Rosen TA, Gilbert H, Skinner K, Raumann BE, Basbaum AI, Julius D (September 1998). "The cloned capsaicin receptor integrates multiple pain-producing stimuli". Neuron. 21 (3): 531–43. doi:10.1016/S0896-6273(00)80564-4. PMID 9768840. S2CID 2054891.
- ^ Walker KM, Urban L, Medhurst SJ, Patel S, Panesar M, Fox AJ, McIntyre P (January 2003). "The VR1 antagonist capsazepine reverses mechanical hyperalgesia in models of inflammatory and neuropathic pain". The Journal of Pharmacology and Experimental Therapeutics. 304 (1): 56–62. doi:10.1124/jpet.102.042010. PMID 12490575. S2CID 14847633.
- ^ Lee J, Lee J, Kang M, Shin M, Kim JM, Kang SU, Lim JO, Choi HK, Suh YG, Park HG, Oh U, Kim HD, Park YH, Ha HJ, Kim YH, Toth A, Wang Y, Tran R, Pearce LV, Lundberg DJ, Blumberg PM (July 2003). "N-(3-acyloxy-2-benzylpropyl)-N'-[4-(methylsulfonylamino)benzyl]thiourea analogues: novel potent and high affinity antagonists and partial antagonists of the vanilloid receptor". Journal of Medicinal Chemistry. 46 (14): 3116–26. doi:10.1021/jm030089u. PMID 12825950.
- ^ Lee J, Kang SU, Kil MJ, Shin M, Lim JO, Choi HK, Jin MK, Kim SY, Kim SE, Lee YS, Min KH, Kim YH, Ha HJ, Tran R, Welter JD, Wang Y, Szabo T, Pearce LV, Lundberg DJ, Toth A, Pavlyukovets VA, Morgan MA, Blumberg PM (September 2005). "Analysis of structure-activity relationships for the 'A-region' of N-(4-t-butylbenzyl)-N'-[4-(methylsulfonylamino)benzyl]thiourea analogues as TRPV1 antagonists". Bioorganic & Medicinal Chemistry Letters. 15 (18): 4136–42. doi:10.1016/j.bmcl.2005.06.009. PMID 16005215.
- ^ Wang Y, Szabo T, Welter JD, Toth A, Tran R, Lee J, Kang SU, Suh YG, Blumberg PM, Lee J (October 2002). "High affinity antagonists of the vanilloid receptor". Molecular Pharmacology. 62 (4): 947–56. doi:10.1124/mol.62.4.947. PMID 12237342.
- ^ Appendino G, De Petrocellis L, Trevisani M, Minassi A, Daddario N, Moriello AS, Gazzieri D, Ligresti A, Campi B, Fontana G, Pinna C, Geppetti P, Di Marzo V (February 2005). "Development of the first ultra-potent "capsaicinoid" agonist at transient receptor potential vanilloid type 1 (TRPV1) channels and its therapeutic potential". The Journal of Pharmacology and Experimental Therapeutics. 312 (2): 561–70. doi:10.1124/jpet.104.074864. PMID 15356216. S2CID 816699.
- ^ Pomonis JD, Harrison JE, Mark L, Bristol DR, Valenzano KJ, Walker K (July 2003). "N-(4-Tertiarybutylphenyl)-4-(3-cholorphyridin-2-yl)tetrahydropyrazine -1(2H)-carbox-amide (BCTC), a novel, orally effective vanilloid receptor 1 antagonist with analgesic properties: II. in vivo characterization in rat models of inflammatory and neuropathic pain". The Journal of Pharmacology and Experimental Therapeutics. 306 (1): 387–93. doi:10.1124/jpet.102.046268. PMID 12721336. S2CID 11111018.
- ^ McDonald HA, Neelands TR, Kort M, Han P, Vos MH, Faltynek CR, Moreland RB, Puttfarcken PS (October 2008). "Characterization of A-425619 at native TRPV1 receptors: a comparison between dorsal root ganglia and trigeminal ganglia". European Journal of Pharmacology. 596 (1–3): 62–9. doi:10.1016/j.ejphar.2008.07.063. PMID 18755179.
- ^ Surowy CS, Neelands TR, Bianchi BR, McGaraughty S, El Kouhen R, Han P, Chu KL, McDonald HA, Vos M, Niforatos W, Bayburt EK, Gomtsyan A, Lee CH, Honore P, Sullivan JP, Jarvis MF, Faltynek CR (September 2008). "(R)-(5-tert-butyl-2,3-dihydro-1H-inden-1-yl)-3-(1H-indazol-4-yl)-urea (ABT-102) blocks polymodal activation of transient receptor potential vanilloid 1 receptors in vitro and heat-evoked firing of spinal dorsal horn neurons in vivo". The Journal of Pharmacology and Experimental Therapeutics. 326 (3): 879–88. doi:10.1124/jpet.108.138511. PMID 18515644. S2CID 2042292.
- ^ Gunthorpe MJ, Rami HK, Jerman JC, Smart D, Gill CH, Soffin EM, Luis Hannan S, Lappin SC, Egerton J, Smith GD, Worby A, Howett L, Owen D, Nasir S, Davies CH, Thompson M, Wyman PA, Randall AD, Davis JB (January 2004). "Identification and characterisation of SB-366791, a potent and selective vanilloid receptor (VR1/TRPV1) antagonist". Neuropharmacology. 46 (1): 133–49. doi:10.1016/S0028-3908(03)00305-8. PMID 14654105. S2CID 21048603.
- ^ Patwardhan AM, Jeske NA, Price TJ, Gamper N, Akopian AN, Hargreaves KM (July 2006). "The cannabinoid WIN 55,212-2 inhibits transient receptor potential vanilloid 1 (TRPV1) and evokes peripheral antihyperalgesia via calcineurin". Proceedings of the National Academy of Sciences of the United States of America. 103 (30): 11393–8. Bibcode:2006PNAS..10311393P. doi:10.1073/pnas.0603861103. PMC 1544096. PMID 16849427.
- ^ Doherty EM, Fotsch C, Bo Y, Chakrabarti PP, Chen N, Gavva N, Han N, Kelly MG, Kincaid J, Klionsky L, Liu Q, Ognyanov VI, Tamir R, Wang X, Zhu J, Norman MH, Treanor JJ (January 2005). "Discovery of potent, orally available vanilloid receptor-1 antagonists. Structure-activity relationship of N-aryl cinnamides". Journal of Medicinal Chemistry. 48 (1): 71–90. doi:10.1021/jm049485i. PMID 15634002.
- ^ Wu C, Gavva NR, Brennan TJ (June 2008). "Effect of AMG0347, a transient receptor potential type V1 receptor antagonist, and morphine on pain behavior after plantar incision". Anesthesiology. 108 (6): 1100–8. doi:10.1097/ALN.0b013e31817302b3. PMID 18497612.
- ^ a b Westaway SM, Brown SL, Conway E, Heightman TD, Johnson CN, Lapsley K, Macdonald GJ, MacPherson DT, Mitchell DJ, Myatt JW, Seal JT, Stanway SJ, Stemp G, Thompson M, Celestini P, Colombo A, Consonni A, Gagliardi S, Riccaboni M, Ronzoni S, Briggs MA, Matthews KL, Stevens AJ, Bolton VJ, Boyfield I, Jarvie EM, Stratton SC, Sanger GJ (December 2008). "The discovery of biaryl carboxamides as novel small molecule agonists of the motilin receptor". Bioorganic & Medicinal Chemistry Letters. 18 (24): 6429–36. doi:10.1016/j.bmcl.2008.10.072. PMID 19006669.
- ^ Westaway SM, Chung YK, Davis JB, Holland V, Jerman JC, Medhurst SJ, Rami HK, Stemp G, Stevens AJ, Thompson M, Winborn KY, Wright J (September 2006). "N-Tetrahydroquinolinyl, N-quinolinyl and N-isoquinolinyl biaryl carboxamides as antagonists of TRPV1". Bioorganic & Medicinal Chemistry Letters. 16 (17): 4533–6. doi:10.1016/j.bmcl.2006.06.026. PMID 16806913.
- ^ Brown BS, Keddy R, Zheng GZ, Schmidt RG, Koenig JR, McDonald HA, Bianchi BR, Honore P, Jarvis MF, Surowy CS, Polakowski JS, Marsh KC, Faltynek CR, Lee CH (September 2008). "Tetrahydropyridine-4-carboxamides as novel, potent transient receptor potential vanilloid 1 (TRPV1) antagonists". Bioorganic & Medicinal Chemistry. 16 (18): 8516–25. doi:10.1016/j.bmc.2008.08.005. PMID 18722778.
- ^ Gore VK, Ma VV, Tamir R, Gavva NR, Treanor JJ, Norman MH (November 2007). "Structure-activity relationship (SAR) investigations of substituted imidazole analogs as TRPV1 antagonists". Bioorganic & Medicinal Chemistry Letters. 17 (21): 5825–30. doi:10.1016/j.bmcl.2007.08.044. PMID 17851073.
- ^ a b Blum CA, Zheng X, Brielmann H, Hodgetts KJ, Bakthavatchalam R, Chandrasekhar J, Krause JE, Cortright D, Matson D, Crandall M, Ngo CK, Fung L, Day M, Kershaw M, De Lombaert S, Chenard BL (August 2008). "Aminoquinazolines as TRPV1 antagonists: modulation of drug-like properties through the exploration of 2-position substitution". Bioorganic & Medicinal Chemistry Letters. 18 (16): 4573–7. doi:10.1016/j.bmcl.2008.07.036. PMID 18662872.
- ^ Gavva NR, Bannon AW, Hovland DN, Lehto SG, Klionsky L, Surapaneni S, Immke DC, Henley C, Arik L, Bak A, Davis J, Ernst N, Hever G, Kuang R, Shi L, Tamir R, Wang J, Wang W, Zajic G, Zhu D, Norman MH, Louis JC, Magal E, Treanor JJ (October 2007). "Repeated administration of vanilloid receptor TRPV1 antagonists attenuates hyperthermia elicited by TRPV1 blockade". The Journal of Pharmacology and Experimental Therapeutics. 323 (1): 128–37. doi:10.1124/jpet.107.125674. PMID 17652633. S2CID 8085707.
- ^ "FDA Approves New Drug Treatment for Long-Term Pain Relief after Shingles Attacks". www.fda.gov. Archived from the original on 2009-11-18.
- ^ "http://www.neurogesex.com". Archived from the original on 2009-08-30. Retrieved 2009-10-20.
{{cite web}}:외부 링크 위치title= - ^ http://www.bio-medicine.org
- ^ Aids, T. (2009). "Capsaicin: Risks and Benefits". US Pharm. 7: 20.
- ^ http://www.anesiva.com 2009년 3월 6일 웨이백 머신에 보관