ACE 억제제 발견 및 개발
Discovery and development of ACE inhibitors뱀독에서 구강 활성 펩타이드의 발견은 혈압을 조절하는 데 있어 안지오텐신 변환 효소(ACE) 억제제의 중요한 역할을 확립했다.이로써 최초의 ACE 억제제인 캡토프릴이 개발되었다.Captopril의 부작용이 명백해졌을 때 새로운 파생물이 설계되었다.그 후, ACE의 두 활성 사이트인 N-도메인과 C-도메인을 발견한 후, 도메인별 ACE 억제제 개발이 시작되었다.[1][2]
1세대 ACE 억제제 개발
원래 브라질의 핏바이퍼 투롭스 자라카의 독에서 격리되었던 비옵티드 테프로티드(Glu-Trp-Pro-Arg-Pro-Gln-Ile-Pro)의 개발은 고혈압에서 ACE의 중요성을 크게 명확히 했다.그러나 구강활동의 부족은 치료적 효용성을 제한했다.[3][4]
L-벤질수신산(2(R)-벤질-3-카르복시프로피온산)은 1980년대 초 카르복시펩티다아제 A의 가장 강력한 억제제로 설명되었다.저자들은 이를 부산물 아날로그라고 언급했고 수시닐 카복실 그룹과 카보닐 그룹을 통해 카복시펩타이드제 A의 활성 부지에 바인딩하자고 제안했다.그들의 연구 결과는 L-벤질수치신산이 카복시펩티다제 A의 활성 부위의 단일 로커스에 결합되어 있다는 것을 입증했다.저자들은 카복실산 함수가 활성 현장에 존재하는 촉매 기능 아연 이온에 결합할 수 있다는 제안을 논의했지만 기각했다.그러나 나중에 이 사실이 밝혀졌다.[3][5][6]
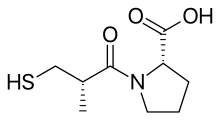
캡토프릴(황수)의 약물설계
2000개 이상의 화합물이 기니피그 글룸 테스트에서 무작위로 테스트되었으며, 숙시닐-L-프로라인은 특정 ACE 억제제의 특성을 가지고 있는 것으로 밝혀졌다.안지오텐신Ⅰ과 브래디키닌이 안지오텐신Ⅱ에 아무런 영향을 미치지 않고 억제효과를 보였다.그리고 나서 연구자들은 ACE의 활성 부지와 화합물의 특정 화학적 상호작용에 기초하여 억제를 설명할 모델을 찾기 시작했다.[5]ACE의 기질 및 억제제를 사용한 이전 연구에서는 아연이 함유된 야금단백질 및 췌장 카복시펩티다아제 A와 유사한 카르복시펩티다아제임을 시사했다.그러나 ACE는 펩타이드 기판의 C-terminus에서 단일 아미노산이 아닌 디펩티드를 방출한다.그리고 그들의 행동 메커니즘과 활동 사이트 둘 다 비슷할 수 있다고 가정되었다.활성 현장에서 양극으로 충전된 Arg는145 펩타이드 기질의 음극으로 충전된 C-단자 카르복실 그룹과 결합하는 것으로 생각되었다.또한 ACE는 수소 본딩으로 기질의 비가습 펩타이드 본딩인 단자에 결합하는 것이 제안되었다.[3]
그러나 ACE는 카복시펩티다아제 A와 달리 디펩타이드 카복시펩티다아제이기 때문에, 양이온 카복시델 바인딩 부위와 아연 원자 사이의 거리는 아미노산 잔류물 1개 길이만큼 커야 한다.프롤린은 티프로티드의 카복시 단자 아미노산 잔류물과 뱀 정맥에서 발견된 다른 ACE 억제제로 존재하기 때문에 아미노산 혼합물로 선택되었다. 11개의 다른 아미노산이 테스트되었지만 그 중 어느 것도 더 억제되지 않았다.그래서 숙시닐아미노산 파생상품이 ACE 억제제여야 한다는 제안이 나왔고 숙시닐-L-프로라인이 그러한 억제제라는 것이 밝혀졌다.[3][5][7]
ACE용 펩타이드 기질의 페놀티메이트 아미노산 잔류물의 성질이 효소 결합에 영향을 미치는 것으로도 알려져 있다.카르복살카노일 아미노산의 아틸 그룹은 효소의 아연 이온을 결합하고, ACE의 활성 부위에서 페놀티미트와 같은 위치를 차지하고 있다.따라서, 아틸 그룹의 대체물은 효소에 대한 결합에도 영향을 미칠 수 있다.D 구성으로 대체한 2-메틸이 약 15배의 숙시닐-L-프로라인의 억제 효능을 향상시키는 것으로 밝혀졌다.그리고 더 나은 아연 제본 그룹을 찾기 시작했다.질소가 함유된 기능성(아민, 아미드 또는 구아니딘)에 의한 숙시닐 카복실 그룹의 교체는 억제 활성을 강화하지 않았다.그러나 카복실 그룹을 효소 결합 아연 이온에 대한 친화력이 더 높은 그룹인 황하이드릴 함수(SH)로 대체함으로써 효력 돌파를 달성했다.이것은 수시닐-L-프로라인보다 1000배 더 강력한 억제제를 생산했다.[3][7]프로라인의 메르카프토알카노일 유도체의 최적 아킬 체인 길이는 3-메르코프로파노일-L-프로라인으로 2-메르카프토알카노일 유도체의 5배, 4-메르카프토알카노일 유도체의 50배인 것으로 나타났다.그래서 D-3-Mercapto-2-methylpropanoyl-L-proline 또는 Captopril이 가장 강력한 억제제였다.후에, 연구원들은 몇몇 메르카프토아미노산 억제제를 비교했고, 효소에 대한 억제제의 결합은 아미드 카보닐의 산소와 효소의 기증 부위 사이의 수소 결합을 수반한다는 결론을 내렸다. 아미드 카보닐은 기질에 대해 예측된 것과 매우 유사하다.[3][8]
기타 1세대 ACE 억제제의 약물 설계
캡토프릴의 가장 흔한 부작용인 피부 발진과 미각 상실은 메르카프토 함유 페니실라민에 의한 것과 같다.따라서, 한 그룹의 연구자들은 메르카프토(SH) 기능을 포함하지 않고 더 약한 킬레이트 기능을 갖는 강력한 선택적 ACE 억제제를 찾는 것을 목표로 했다.그들은 카복실 화합물들과 함께 일하기 시작했고 대체된 N-카복시메틸-디펩타이드들을12 일반 구조물로 사용하기 시작했다.이전의 연구에 따르면, 그들은 반복적인 이미노산이 디펩타이드의 카복실 종단부에 대체될 경우 좋은 효력이 발생할 것이라고 가정했다.따라서 A를2 프롤라인으로 대체한 것이 좋은 결과를 낳았다.그들은 또한 카복실 종단 옆의 위치에 있는 효소의 특이성 이미노산에 따르면 강력한 화합물을 주지 않을 것이라는 점에 주목했다.R과 A1 그룹을 소수성 및 기본 잔류물로 대체하면 강력한 화합물을 얻을 수 있다.일반 구조에서 –NH를 대체함으로써 효소가 기판의 해당 위치에서 a -NH를 필요로 하는 효소의 필요성과 일치하는 효소의 효력이 상실되었다.결과는 두 가지 활성 억제제인 에날포왓과 리시노프릴이었다.이들 화합물은 모두 효소의 S1 홈을 차지하는 R 위치에 페닐알라닌을 가지고 있다.따라서 결과는 아연 조정에 의한 카복실 그룹인 에날포왓과 리시노프릴과 같은 두 개의 새롭고 강력한 삼펩타이드 유사점이었다.[1][9]
C-도메인 및 N-도메인 2개의 활성 사이트 검색
오늘날 시판되고 있는 ACE 억제제의 대부분은 효소 내 아연 원자와 억제제의 강한 킬레이트 그룹 사이의 강한 상호작용에 주로 기초하기 때문에 ACE의 두 활성 부위에 대해 선택적이지 않다.체성 ACE의 C-도메인에 해당하는 활성 부지가 1개뿐인 제르미날 ACE의 3D 구조해결은 구조기반 설계접근법에 대한 구조적 프레임워크를 제공한다.N-영역과 C-영역은 ACE 가수 분해의 체외에서 유사한 비율을 가지고 있지만, 체내 C-영역은 주로 혈압을 조절하는 역할을 하는 것으로 보인다.이는 C-도메인 선택적 억제제가 현재 비선택적 억제제와 유사한 프로파일을 가질 수 있음을 나타낸다.Angiotensin I는 주로 체내 C-domain에 의해 가수분해되지만 Bradykinin은 양쪽 활성 부위에 의해 가수분해된다.따라서 C-영역 선택적 억제제를 개발하면 N-영역에 의한 브래디키닌의 일부 저하가 허용될 수 있으며, 이러한 저하는 혈관부종 공격 중에 관찰된 과잉 브래디키닌의 축적을 방지하기에 충분할 수 있다.C-영역 선택적 억제는 혈관조영제 관련 부작용을 줄이면서 혈압을 전문적으로 제어하는 결과를 초래할 수 있다.반면 N-도메인 선택적 억제제는 새로운 치료 영역을 열 가능성을 준다.보아하니 N영역은 혈압을 조절하는 데 큰 역할을 하지 않지만 자연적인 혈액순환 호르몬인 AcSDkP의 주요 대사 효소인 것 같다.[1][10][11]
Keto-ACE와 Ketomethylene파생물의 약물설계
케톤과 같은 다른 카보닐 함유 집단이 ACE 억제제 안에서 Phe와 Gly를 연결하는 아미드 결합을 대체할 수 있다는 사실이 밝혀졌다.1980년에 처음 기술된 Keto-ACE는 C-domain 특정 ACE 억제제의 잠재적 납 화합물로 부상했다.페글리프로의 트리펩타이드 아날로그 케토-ACE는 부피가 큰 P와1 P 벤질2 링을 함유하고 있으며, C 도메인을 통해 안지오텐신 1호와 브래디키닌의 가수분해를 억제하는 것으로 나타났다.Keto-ACE 아날로그를 P의2 위치에서 Trp 또는 Peh와 합성한 결과 C-도메인 선택성이 현저하게 증가하였지만, 알리파틱 P2 그룹의 도입으로 N-도메인 선택성이 부여되었다.억제1 효력은 P' 위치에 있는 페닐 그룹과 같은 소수성 대체물의 통합에 의해 더욱 강화될 수 있다.S-스테레오케미컬을 대체한 P1'의 R-카운터 부품보다 억제 효력이 더 큰 것으로 나타났다.[2][8][12][13]
케토-ACE는 케토메틸렌 유도체 설계의 근거로 사용되었다.그것의 유사성에는 활성 현장의 단백질 반응의 사면체 전이 상태를 모방한 것으로 여겨지는 가위 결합에서 케토메틸렌 이소스테레 대체물이 포함되어 있다.초기 효소 분석에서 억제 활성을 보인 단순한 3중화 피알라프로에 초점을 맞췄다.알라닌을 글리신(glycin)으로 대체하면 페알라프로의 억제 활성도의 1/14로 3중으로 증식되었다.페글리프로의 벤조일화 파생상품은 Bz-Phe-Gly-Pro의 두 배 활성이었다.케토메틸렌 억제제의 펩티드 특성을 줄이기 위해 P와1 P의2 대체물을 사이클링하여 락탐을 형성할 수 있으며, 여기서 억제 효력과 링 크기 사이에 상관관계가 있을 수 있다.2001년에는 질소에 α를 대체하고 A58365A의 3-메틸 대체 아날로그를 만드는 것이 ACE 억제 활성을 가진 스트렙토미세스 크로모푸스쿠스균의 발효 육수로부터 격리된 피리돈산이 강체 또는 소수성 효과에 의해 생물학적 활동 수준에 영향을 미칠 수 있다고 가정했다.C3의 이온또한 A58365A에 대한 합성 작업 중에 잠재적 전구체가 5-membed 링의 산화에 민감하므로 3-methyl 아날로그가 이 점에서 더 안정적일 수 있다는 것이 주목되었다.[2][14][15]
실란데디올의 약품설계
탄소 및 실리콘의 특성이 유사하지만 서로 다른 점이 있다는 사실은 탄소를 아연 킬레이트 집단의 중심으로서 사일란데디올로 대체하는 것에 대한 관심을 유발했다.실리콘은 실록산 중합체가 형성되지 않도록 충분히 방해되는 다이얼킬실란데디올 화합물을 형성한다.실란데디올은 탄소다이올보다 안정성이 높아 반감기가 더 길 것으로 예상된다.실란데디올은 생리학적 pH에서도 중성이다(이온화하지 않는다).페-알라 실란데디올의 스테레오 4개를 케톤계 억제제와 비교한 결과 실란데디올은 케톤 아날로그에 비해 4배 낮은 위력을 보였다.실란데디올은 케톤에 비해 아연 킬레이터가 약하기 때문이다.실란데디올을 메틸실라노 그룹으로 대체하는 것은 효소 억제를 거의 하지 않았다.이것은 사일란데디올 그룹이 ACE와 전환 상태 아날로그로서 상호작용하고 그 상호작용이 케톤과 유사한 방식으로 이루어지는 것을 확인한다.[16][17]벤질 그룹의 실란데디올을 i-butyl 그룹으로 대체하면 더 약한 ACE 억제제를 준다.소수성 메틸 페닐의 도입은 Tert-butyl-group이 P에1 있는 아날로그보다 조금 더 많은 효력을 준다.이는 메틸페닐이 테르트부틸 그룹보다 S1을 더 잘 인지할 수 있음을 시사한다.[2]
인산 펩타이드
인산 펩타이드란 펩타이드 아날로그 시퀀스에서 인산2 결합(PO-CH-)이 펩타이드 결합을 대체한 사이비 펩타이드다.어느 정도 인산 펩타이드의 화학적 구조는 단백질 분해 효소에 의한 펩타이드의 가수분해에서 생성되는 매개체의 구조와 유사하다.이러한 사이비 펩타이드들이 전이 상태에서 효소 기질 구조를 모방한다는 가설과 인산 펩타이드와 함께 복합적으로 아연 프로테아제의 결정학은 그 가설을 뒷받침한다.[10]
RXP 407 의약설계
RXP 407은 최초의 N-도메인 선택적 인광 펩타이드로 인광 펩타이드 라이브러리를 선별해 검출됐다.RXP 407이 발견되기 전에는 P2' 위치에 있는 무료 C-terminal 카르복실산 그룹이 ACE 억제제의 효력에 필수적이라는 주장이 오랫동안 제기되어 왔기 때문에 이것이 N-도메인 선택적 ACE 억제제의 발견을 지연시켰다고 생각할 수 있다.RXP 407이 발견되었을 때, 연구자들은 각각 2개의 미확인 아미노산을 함유한 3가지의 다른 일반식을 가진 인산 펩타이드들을 조사했을 때, 이 일반 공식들 중 오직 1개만이 강력한 억제(Ac-Ya-Peaa (PO-CH22)Ala-Ya'-NH2)를 보여주었다.펩타이드 혼합물이 만들어졌고, Yaa와 Yaa'를 다른 아미노산으로 대체하여 효소의 N-도메인 또는 C-도메인을 억제할 수 있는 강력한 억제제가 있는지 확인하려고 노력했다.그 결과 화합물 Ac-Asp-Phene(L)(PO-CH22)(L)Ala-Ala-NH는2 N-domain을 적극적으로 억제하고 RXP 407이라는 이름이 부여되었다.구조 기능 관계는 C-terminus 카르복사미드 그룹이 ACE의 N-도메인 선택성에 결정적인 역할을 했다는 것을 보여주었다.또한 억제제의 N-도메인 선택성에 있는 P2 포지션의 N-아세틸 그룹과 아스파르트 사이드 체인은 보조한다.이러한 특징들은 억제제를 C-도메인에게는 접근할 수 없게 하지만 N-도메인에게는 좋은 효력이 생기게 하며, 이는 세 가지 정도 크기의 활성 현장의 억제 효력에 차이를 가져온다.또한 이러한 결과는 N-도메인이 C-도메인보다 더 넓은 선택성을 가지고 있음을 나타낸다.오래된 ACE 억제제와 RXP 407 사이의 또 다른 차이점은 화합물의 분자 크기다.이전 ACE 억제제는 대부분 S1, S2, S1 하위 사이트와 상호 작용했지만 RXP 407은 S 하위2 사이트와 추가적으로 상호 작용한다.이는 아스파르트 사이드 체인과 N-아세틸 그룹이2 P 위치에 있으므로 억제제의 선택성에도 중요하다.[18]
RXPA 380의 약물 설계
RXPA380은 ACE의 C-도메인 선택성이 높은 최초의 억제제로, Phe-Pep-Pro-Trp라는 공식을 가지고 있다.[1]이 화합물의 개발은 일부 브래디키닌-분산 펩타이드들이 C-도메인 선택성을 보이며 모두 그 구조에 몇 가지 프로라인이 있다는 연구 결과를 바탕으로 이루어졌다.이러한 관찰을 통해 연구자들은 P의1 위치에 프롤라인 잔류물을 함유한 인산 펩타이드들을 합성하게 되며, 이러한 화합물을 평가한 결과 RXPA380이 발견되었다.[19]연구자들은 RXPA380의 잔류물 역할을 연구하기 위해 RXPA380의 7가지 유사물을 만들었다.만들어진 모든 화합물은 2개 또는 4개의 디쓰레기 제거제를 혼합하여 얻었지만 모두 쉽게 해결되었고 그 중 하나만 강력했다.이는 초기 RXPA380 모델 연구와 일치하며, 이 연구에서는 오직 한 개의 이질성분해체만이 제라민 ACE의 활성 부위에서 수용될 수 있다는 것을 보여주었다.유사 프로라인 또는 트립토판 잔류물이 대체된 아날로그는 RXPA380보다 선택성이 낮았다.이것은 아마도 이 두 가지 유사점이 RXPA380보다 N-도메인에 더 큰 효력을 가지고 있기 때문일 것이다.이 두 가지 잔류물을 모두 대체하는 것은 큰 효과를 주지만 선택성은 없다.이것은 유사 프로라인과 트립토판 잔류물이 C-도메인에서는 잘 수용되지만 N-도메인에서는 잘 수용되지 않음을 보여준다.P 위치에서1 의사-프로라인과 트립토판 둘 다와 유사하지만 의사-페닐알라닌 잔류물이 누락된 2가지 더 많은 유사점은 RXPA380과 유사한 N-도메인에 대한 낮은 효력을 보였다.이는 C-도메인 선택성에서 이 두 잔류물의 중요한 역할을 지원한다.또한 이 두 가지 유사점은 C-도메인(C-domain)에 대한 효력이 적으며, 이는 C-도메인(C-domain)이 P 위치에1 있는 의사-페닐알라닌(phenylalanine) 그룹을 선호한다는 것을 보여준다.RXPA380-ACE 복합체를 모델링한 결과 억제제의 유사프로라인 잔류물이 N-도메인과 유사한 아미노산으로 둘러싸여 있어 S2' 도메인과의 상호작용은 RXPA380의 선택성에 영향을 미치지 않을 수 있다. 트립토판을 둘러싼 12개의 아미노산 중 7개는 C-도메인과 N-도메인에서 동일하며 가장 큰 차이는 2이다.C-도메인에서 부피가 크고 소수성 아미노산이 N-도메인에서 2개의 작은 극성 아미노산으로 대체되었다.이것은2 N-도메인에 대한 RXPA380의 낮은 효력이 트립토판 사이드 체인을 수용하지 않기 때문이 아니라 트립토판 사이드 체인과 C-도메인의 아미노산 사이에 중요한 상호작용이 누락된다는 것을 나타낸다.트립토판 사이드 체인과 아스프1029 사이의 근접성에 기초하여, 아스펜의1029 카복시탈과 C-도메인 NH수동 링 사이에 수소 결합이 가능하지만, 이러한 상호작용은 N-도메인에서는 훨씬 약하다.[1]
참조
- ^ a b c d e Acharya, K.R.; Sturrock, E.D.; Riodan, J.K.; Ehlers, M.R. (2003), "ACE revisited: A New Target for Structure-Based Dug Design.", Nature Reviews Drug Discovery, 2 (11): 891–902, doi:10.1038/nrd1227, PMC 7097707, PMID 14668810
- ^ a b c d Redelinghuys, P.; Nchinda, A.T.; Sturrock, E.D. (2005), "Development of Domain-Selective Enzyme Inhibitors.", Annals of the New York Academy of Sciences, 1056: 160–175, doi:10.1196/annals.1352.035, PMID 16387685, S2CID 25407204
- ^ a b c d e f Cushman, D.W.; Cheung, H.S.; Sabo, E.F.; Ondetti, M.A. (1977), "Design of Potent Competitive Inhibitors of Angiotensin-Converting Enzye. Carboxyalkanoyl and Mercaptoalkanoyl Amino Acid.", Biochemistry, 16 (25): 5484–5491, doi:10.1021/bi00644a014, PMID 200262
- ^ Crantz, F.R.; Swartz, S.L.; Hollenberg, N.K.; Moore, T.J.; Dluhy, R.G.; Williams, G.H. (1980), "Differences in response to the peptidyldipeptide hydrolase inhibitors SQ 20,881 and SQ 14,225 in normal-renin essential hypertension.", Hypertension, 2 (5): 604–609, doi:10.1161/01.hyp.2.5.604, PMID 6158478
- ^ a b c Cushman, D.W.; Ondetti, M.A. (1991), "History of the design of captopril and related inhibitors of angiotensin converting enzyme.", Hypertension, 17 (4): 589–592, doi:10.1161/01.hyp.17.4.589, PMID 2013486
- ^ Byers, L.D.; Wolfenden, R. (1973), "Binding of the By-Product Analog Benzylsuccinic Acid by Carboxypeptidase A.", Biochemistry, 12 (11): 2070–2078, doi:10.1021/bi00735a008, PMID 4735879
- ^ a b Ondetti, M.A.; Rubin, B.; Cushman, D.W. (1977), "Design of Specific Inhibitors of Angiotensin-Converting Enzyme: New Class of Orally Active Antihypertensive Agents.", Science, 196 (4288): 441–444, Bibcode:1977Sci...196..441O, doi:10.1126/science.191908, PMID 191908
- ^ a b Condon, M.E.; et al. (1982), "Angiotensin-Converting Enzyme Inhibitors: Importance of the Amide Carbonyl of Mercaptoacyl Amino Acids for Hydrogen Bonding to the Enzyme", Journal of Medicinal Chemistry, 25 (3): 250–258, doi:10.1021/jm00345a011, PMID 6279843
- ^ Patchett, A.A.; et al. (1980), "A new class of angiotensin-converting enzyme inhibitors", Nature, 288 (5788): 280–283, Bibcode:1980Natur.288..280P, doi:10.1038/288280a0, PMID 6253826, S2CID 4246377
- ^ a b Dive, V.; et al. (2004), "Review: Phosphinic peptides as zinc metalloproteinase inhibitors", Cellular and Molecular Life Sciences, 61 (16): 2010–2019, doi:10.1007/s00018-004-4050-y, PMID 15316651, S2CID 30797568
- ^ Gerogiadis, D.; Guniasse, P.; Cotton, J.; Yiotakis, A.; Dive, V. (2004), "Structural Determinants of RXPA380, a Potent and Highly Selective Inhibitor of the Angiotensin-Converting Enzyme C-domain", Biochemistry, 43 (25): 8048–8054, doi:10.1021/bi049504q, PMID 15209500
- ^ Nchinda, A.T.; Chibale, K.; Redelinghuys, P.; Stirrock, E.D. (2006), "Synthesis of novel keto-ACE analogues as domain-selective angiotensin I-converting enzyme inhibitors", Bioorganic & Medicinal Chemistry Letters, 16 (17): 4612–4615, doi:10.1016/j.bmcl.2006.06.003, PMID 16784850
- ^ Redelinghuys, P.; Nchinda, A.T.; Chibale, K.; Sturrock, E.D. (2006), "Novel ketomethylene inhibitors of angiotensin I-converting enzyme (ACE): inhibition and molecular modelling", Biological Chemistry, 387 (4): 461–466, doi:10.1515/BC.2006.061, PMID 16606345, S2CID 30710745
- ^ Almquist, R.G.; Chao, W.R.; Ellis, M.E.; Johnson, H.L. (1980), "Synthesis and Biological Activity of a Ketomethylene Analogue of a Tripeptide Inhibitor of Angiotensin-Converting Enzyme", Journal of Medicinal Chemistry, 23 (12): 1392–1398, doi:10.1021/jm00186a020, PMID 6256550
- ^ Clive, D.L.J.; Yang, H.; Lewanczuk, E.Z. (2001), "Synthesis and in vitro activity of a non-epimerizable analog of the angiotensin-converting enzyme inhibitor A58365A", Chemistry, 4 (6): 505–512, doi:10.1016/s1387-1609(01)01263-4
- ^ Kim, J.; Sieburth, S.M. (2004), "Silanediol peptidomimetics. Evaluation of four diastereomeric ACE inhibitors", Bioorganic & Medicinal Chemistry Letters, 14 (11): 2853–2856, doi:10.1016/j.bmcl.2004.03.042, PMID 15125946
- ^ Kim, J.; Hewitt, G.; Carroll, P.; Sieburth, S.M. (2005), "Silanediol Inhibitors of Angiotensin-Converting Enzyme. Synthesis and Evaluation of Four Diastereomers of Phe[Si]Ala Dipeptide Analogues", Journal of Organic Chemistry, 70 (15): 5781–5785, doi:10.1021/jo048121v, PMID 16018669
- ^ Dive, V.; et al. (1999), "RXP 407, a phosphinic peptide, is a potent inhibitor of angiotensin I converting anzyme able to differentiate between its two active sites", PNAS, 96 (8): 4330–4335, Bibcode:1999PNAS...96.4330D, doi:10.1073/pnas.96.8.4330, PMC 16332, PMID 10200262
- ^ Georgiadis, D.; Beau, F.; Czarny, B; Cottin, J; Yiotakis, A; Dive, V (2003), "Roles of the Two Active Sites of Somatic Angiotensin-Converting Enzyme in the Cleavage of Angiotensin I and Bradykinin: Insights From Selective Inhibitors", Circulation Research, 93 (2): 148–154, doi:10.1161/01.RES.0000081593.33848.FC, PMID 12805239