양성자 펌프 억제제 발견 및 개발
Discovery and development of proton pump inhibitors양성자 펌프 억제제(PPI)는 위 수소 칼륨 ATPase(H+/K+ ATPase)를 차단하고 위산 분비를 억제한다. 이들 약물은 위내식 역류성 질환(GERD), 소화성 궤양 질환 등 산 관련 질환의 선택 치료제로 떠올랐다. 또한 PPI는 암세포에서 발생하는 것과 같은 다른 유형의 양성자 펌프에 결합할 수 있으며, 암세포 산 유출 감소와 화학요법 약물 내성의 저감에 응용할 수 있다.
역사
두정세포의 분비막에서 새로 발견된 양성자펌프(H+/K+ ATPase)가 산성분비의 마지막 단계였다는 증거가 1970년대 말까지 나왔다.[1] 마취 스크리닝에서 얻은 문헌은 잠재적인 항바이러스 화합물 피리딜티오아세타미드에 주목하게 했으며, 추가 검사 후에 티모프라졸이라고 불리는 작용 메커니즘을 알 수 없는 항비밀화합물에 초점을 맞추었다.[2][3][4] 티모프라졸은 피리딜메틸설필설비닐벤지마졸로 단순한 화학구조와 놀라울 정도로 높은 수준의 항비밀 활동으로 어필했다.[5]
대체된 벤지미다졸의 최적화 및 그 항균작용을 피리딘의 더 높은 pKa 값을 얻기 위해 새로 발견된 양성자 펌프에 연구하여 두정세포 내 축적을 촉진하고 활성중재로의 산 매개 변환 속도를 증가시켰다. 이러한 최적화 결과 최초의 양성자 펌프 억제제인 오메프라졸이 시중에 출시되었다.[4][6] 랜소프라졸과 팬토프라졸과 같은 다른 PPI들은 그들 자신의 발전 과정을 거쳐 번창하는 시장에서 그들의 몫을 주장하면서 그 전철을 밟을 것이다.
기본구조
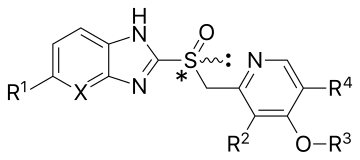
PPI는 기본 구조에 따라 두 그룹으로 나눌 수 있다. 모든 구성원이 대체 피리딘 부분을 가지고 있지만, 한 그룹은 다양한 벤지미다졸과 연결되었고, 다른 그룹은 대체된 이미다조피리딘과 연결되었다. 시판되는 모든 PPI(오메프라졸, 랜소프라졸, 팬토프라졸)는 벤지미다졸 그룹에 속한다.
양성자 펌프 억제제는 약물이며, 실제 억제 형태는 다소 논란의 여지가 있다. 산성 용액에서 황산은 효소의 루미나 표면에서 접근할 수 있는 하나 이상의 시스테인과 반응하기 전에 격리된다. 이것은 평면 분자여서 PPI의 모든 에반토머는 활성화 시 입체감을 잃는다.[7]
이러한 약물의 효력은 두 가지 요인 즉, 산성분비의 마지막 단계를 담당하는+ H/K+ ATPase에서 발생한다. 따라서, 산성분비에 대한 그들의 작용은 히스타민, 아세틸콜린 또는 아직 발견되지 않은 다른 자극제의 자극과는 무관하다. 또한, 그들의 작용 메커니즘은 효소에 활성 약물을 공밸런트로 결합하여 혈장 반감기를 초과하는 작용 지속시간을 초래한다.[7][8]
위 ATPase
사람의 위장에 의한 산성분비는 1.4의 중앙분리대 pH를 초래한다. 이 매우 큰 (>10배6) H+ 구배는 ATP 구동 양성자 펌프인 위 H+/K+ ATPase에 의해 발생한다. 하나의 ATP 분자의 가수분해효소는 위막을 통해 두 개의 세포질 양성자에 대한 두 개의 내강 칼륨 이온의 전기적 교환을 촉진하기 위해 사용된다.[9]
구조
양성자 펌프인 H+/K+ ATPase는 α,β-히테로디메릭 효소다. 촉매 α 서브유닛은 TM4, TM5, TM6, TM8의 중간에 위치하는 장내 카복시 아미노산 클러스터가 있는 10개의 트랜섬브레인 세그먼트를 가지고 있으며, β 서브유닛은 세포질 영역에 N 종단부가 있는 하나의 트랜섬브레인 세그먼트를 가지고 있다. β 서브유닛의 세포외 영역에는 효소 결합, 성숙 및 분류에 중요한 6~7개의 N연계 글리코실화 부위가 포함되어 있다.[10]
함수
이온 전달은 두 주요 반응 상태인 E1과 E2 사이에서 효소의 주기적인 순응적 변화에 의해 이루어진다. 세포질-개방 E1과 발광-개방 E2 상태는 H와+ K에+ 대한 친화력이 높다.[9] 160 mM(pH 0.8) 농도에서 양성자를 배출하면 E2P 구성에서 라이신 791이 이온 결합 부지로 이동하게 된다.[10]
디스커버리
1975년, 티모프라졸은 자극, 세포외, 세포내 분비를 억제하는 것으로 밝혀졌다.[7] 티모프라졸에 관한 연구는 흉선의 위축뿐만 아니라 요오드 흡수를 억제함으로써 갑상선의 확대가 나타났다고 밝혔다. 문헌 조사 결과 일부 대체 물질은 요오드 섭취에 아무런 영향을 주지 않았으며, 그러한 대체 물질을 티모프라졸에 도입하면 항균작용을 줄이지 않고 독성 효과를 제거한다는 결과가 나왔다.[6] 1979년 티모프라졸인 오메프라졸의 파생상품이 발견돼 위 내 산성분비를 제어하는 신약 중 처음으로 양성자펌프억제제(PPI)가 나왔다.[11][12] 또한 오메프라졸의 벤지미다졸 모이에 5메톡시 대체물을 첨가하여 중성 pH에서 훨씬 더 안정감을 주었다.[6] 1980년에는 조사신약(IND) 신청이 접수되었고 1982년에는 오메프라졸이 3단계 인간 실험에 투입되었다.[6] 산성 관련 질병의 치료에 대한 새로운 접근법이 도입되었고, 오메프라졸은 히스타민 H2 수용체 길항제보다 임상적으로 우수한 것으로 빠르게 보여져 1988년 유럽에서는 로텍으로, 1990년에는 미국에서는 프릴로섹으로 출시되었다. 1996년, 로섹은 지금까지 세계에서 가장 많이 팔린 약품이 되었고, 2004년까지 8억 명 이상의 환자들이 전세계적으로 이 약으로 치료를 받았다. 1980년대 동안 약 40개의 다른 회사들이 PPIs 분야에 진출했지만, 시장 성공을 거둔 기업은 거의 없었다. 란소프라졸을 가진 다케다, 판토프라졸을 가진 바이크 굴덴(현 나이코메드), 라베프라졸을 가진 아이사이(현 니코메드), 모두 오메프라졸의 유사점이었다.[7][8]
개발
팬토프라졸
판토프라졸의 발견 이야기는 PPI의 단계적 발전을 보여주는 좋은 예다. 티모프라졸의 수정의 주된 초점은 그 구조의 벤지미다졸 부분이었다. 벤지미다졸 모이에 트라이플루오로메틸 그룹을 추가하면 용액 안정성이 다양한 일련의 매우 활성 화합물이 생성되었다. 일반적으로 플루오르 대체물이 부착된 지점에서 신진대사를 차단하는 것으로 나타났다. 후에 고지방 지방질 및 전자 추출이 강한 트리플루오로메틸 대체제 대신 보다 균형 잡힌 형광색소 대체제는 반감기가 길고 용액 안정성이 높은 활성 화합물로 이어졌다.[5]
활동이 어떻게든 해결의 불안정성과 연관되어 있다는 것을 깨달은 다음 산성 조건에서 형성된 순환성 황화물이 PPI의 활성 원리라는 결론에 도달했다. 마지막으로, 티모프라졸의 등뼈에 생긴 겉보기에는 작은 변화가 전혀 일어나지 않는 것으로 이해되었고, 등뼈에 있는 대체물들에 초점을 맞추어야 했다. 그러나, 필요한 분자 내 벤지미다졸을 황페나미드로 재배열하는 것은 심각한 기하학적 제약을 초래했다. 최적 화합물은 중성 pH에서는 안정적이지만 낮은 pH에서는 빠르게 활성화된 화합물이다.[5]
복잡한 다단계 화학에서 계단식 각 단계에 대한 대체물의 영향이 다를 수 있고 따라서 전제 산 활성화의 전체 속도에 대해 예측할 수 없기 때문에 활성 억제제의 명확한 설계는 여전히 가능하지 않았다. 1984년 중반에 Byk Gulden과 협력한 Smith Kline과 French는 추가 개발의 기준을 결정하는 데 크게 도움을 주었다. 1985년부터는 중성 pH에서 안정성이 우수한 화합물을 식별하여 pH 5까지 높은 안정성을 유지하되, 높은 수준의 H+/K+ ATPase 억제와 결합하여 낮은 pHs에서 빠르게 활성화가 가능하도록 하는 것이 목표였다.[13] 이러한 기준을 충족시킨 수많은 합성 및 시험 화합물 중에서 가장 유망한 후보물질은 팬토프라졸과 그 소금인 팬토프라졸 나트륨이었다.[5]
1986년에 판토프라졸 세스키하이드레이트 나트륨이 합성되었고 1987년부터 판토프라졸의 발달은 나트륨 염으로 전환되어 더욱 안정적이고 약물 제형에 사용된 다른 활성제와 더 잘 호환된다.
판토프라졸은 거의 7년간의 연구 끝에 확인되었고, 7년간의 추가 개발 끝에 임상 용도로 등록되었으며, 마침내 1994년 독일에서 첫 시장에 도달했다. 팬토프라졸에 대한 연구 과정에서 650개 이상의 PPI가 합성되고 평가되었다.[5] Pantoprazole은 개발 과정에서 높은 선택 기준을 얻었는데, 특히 다른 약물과 상호작용할 수 있는 낮은 잠재력에 관한 기준이다. 팬토프라졸의 양호한 용해성과 매우 높은 솔루션 안정성으로 인해 중환자실에서 정맥주사용으로 시판된 최초의 PPI가 되었다.[5]
에솜프라졸
오메프라졸은 개인간 변동성을 보였으며 따라서 산 관련 질환을 가진 환자의 상당수는 증상 완화와 치유를 달성하기 위해 더 높은 용량 또는 다중 용량을 필요로 했다. 아스트라는 1987년에 새로운 아날로그-오메프라졸의 상호간 변동성이 적은 새로운 아날로그-오메프라졸을 식별하기 위한 새로운 연구 프로그램을 시작했다. 오직 하나의 화합물만이 오메프라졸보다 우수하다는 것이 증명되었으며, 그것은 마그네슘 소금으로 개발된 (----)-(--)-이소머, 에솜프라졸이었다. 에소메프라졸 마그네슘(브랜드명 넥시움)은 2000년 첫 승인을 받아 오메프라졸에 비해 산분비 억제와 환자 간 변동성이 덜했다. 2004년에 넥시움은 이미 2억 명 이상의 환자를 치료하는데 사용되었다.[7][8]
벤지미다졸레
- 오메프라졸(브랜드명 Lostc, Prilosec, Zegerid, Ocid, Lomac, Omepral, Omez, Ultop, Ortanol, 위스톨)
오메프라졸은 1988년에 시판된 최초의 PPI였다. 티모프라졸의 등뼈 구조를 가진 1:1 경주마 약이지만 메톡시 2개, 메틸 2개로 대체된다. 메톡시 그룹 중 하나는 벤소이미다졸의 6위, 다른 하나는 피리딘의 4위, 메틸 그룹은 피리딘의 3위와 5위 위치에 있다. 오메프라졸은 장내코팅 알약, 캡슐, 씹을 수 있는 알약, 경구정지를 위한 파우더, 정맥주사를 위한 파우더로 이용할 수 있다.
- 란소프라졸(브랜드명: 프레바시드, 조톤, 억제리톨, 레반트, 루피졸, 란시드, 란소프톨, 에피쿠르)
란소프라졸은 PPI 약품 중 두 번째로 시판되었으며, 1991년 유럽, 1995년 미국에서 출시되었다. 벤지미다졸에는 대체물이 없고 피리딘에는 2개, 위치 3에는 메틸 그룹, 위치 4에는 트라이플루오로에트폭시 그룹이 있다. 그 약은 에반토머 덱슬란소프라졸과 레볼란소프라졸의 1:1 경주 동료다. 그것은 씹을 수 있는 알약뿐만 아니라 위 내성 캡슐과 알약으로도 이용 가능하다.
- 판토프라졸(브랜드명: 프로토닉스, 소맥, 판톨록, 판토졸, 주르칼, 젠트로, 판, 놀파자, 콘트롤록, 선프라스)
팬토프라졸은 세 번째 PPI였으며 1994년 독일 시장에 소개되었다. 벤지미다졸 부분에 디플루오로알톡시 사이드그룹과 피리딘에 위치 3과 4에 위치하는 메톡시 그룹 2개가 있다. 팬토프라졸은 1985년 4월 소규모 스케일업 화학자들에 의해 처음 준비되었다. 그것은 형광색소 대체 물질인 벤지미다졸에 결합된 디메톡시 대체 피리딘이다.[5] 팬토프라졸 나트륨은 위 내성 또는 지연 방출 알약과 정맥주사용 라오필화 분말로 이용할 수 있다.
- 라베프라졸(브랜드명: 제친, 라베키드, Nzole-D, AcipHex, Pariet, Rabeloc, Zulbex, Ontime, Noflux)
라베프라졸은 미국에서 1999년부터 시중에 유통되고 있는 신기한 벤지미다졸 화합물이다. 란소프라졸의 벤지미다졸 부분과 피리딘의 현장 3에 메틸 그룹이 없다는 점에서 란소프라졸과 유사하며, 유일한 차이는 란소프라졸의 트라이플루오로에톡시 그룹 대신 현장 4의 메톡시프로폭시 대체물이다. 라베프라졸은 라베프라졸 나트륨 소금으로 시판된다. 장입코팅된 알약으로 구입할 수 있다.
- Esomeprazole(브랜드 이름: 넥시움, 에소트렉스, 이매뉴얼라, 네오-제스트)
2001년에 미국에서 esomeprazole이 출시되었는데, emeprazole 특허의 후속작이다. 에솜프라졸은 (S)-(-)-(--)-프로브라졸의 항산화 물질로, 위산 조절 측면에서 (R)-(+)-프로브라졸의 항산화 물질에 비해 높은 생체이용률과 개선된 효능을 제공한다. 이론적으로, 순수 에솜프라졸을 사용함으로써 양성자 펌프에 대한 영향은 모든 환자에서 동일할 것이며, 경주 동료인 오메프라졸의 "불량 대사제 효과"는 제거될 것이다. 그것은 정맥주사/유입을 위한 지연유출 캡슐이나 알약으로, 그리고 에솜프라졸 나트륨으로 이용할 수 있다. 구강 에솜프라졸 준비물은 위장의 산성 상태에서 약물의 급속한 저하로 인해 장내 코팅이 되어 있다. 이것은 다단위 펠릿 시스템을 사용하여 캡슐을 형성함으로써 달성된다. (S)-(-)-(-)-이소머가 인간에게 더 강력하지만, (R)-(+-)-이소머는 쥐의 실험에 더 강력하며, 반면에 항균제는 개에서 등전성이 없다.[14]
- 덱슬란소프라졸(브랜드명: 카피덱스, 덱실란트)
덱슬란소프라졸은 란소프라졸 후속으로 2009년에 출시되었다. 덱슬란소프라졸은 (R)-(+--) 란소프라졸의 항산화 물질로, 덱실란트로 시판되고 있다. 경혈 랜소프라졸의 경구 기구 후 순환 약물은 80% 덱스랜소프라졸이다. 더욱이 두 항산화제는 양성자 펌프에 유사한 영향을 미친다.[15] 따라서 덱실란트의 가장 큰 장점은 항산화 물질이라는 사실이 아니라는 점이다. 첫 번째 퀵 릴리즈는 도포 후 약 1시간 후 혈장 피크 농도를 생성하고, 두 번째 지연 릴리즈는 약 4시간 후 또 다른 피크를 생성하는 이중 릴리즈 기술을 기반으로 한 이 약물의 제약 제형이 장점이다.[16]
이미다조피리딘
이미다조피리딘 양성자 펌프 억제제인 테나토프라졸(TU-1999)은 플라즈마 반감기(7시간)가 실질적으로 장기화되는 새로운 화학 물질로 설계됐지만, 그 외 다른 PPI와 유사한 활성도를 지닌 새로운 화합물이다.[17]
벤지미다졸 PPI에 비해 테나토프라졸의 구조적 백본의 차이는 이미다조[4,5-b]피리딘 모이에티로 신진대사 속도를 줄여 플라즈마 체류시간이 길지만 현재의 PPI에 비해 퓨전된 이미다졸 N의 pKa도 감소한다.[18] 테나토프라졸은 오메프라졸과 동일한 대체물을 가지고 있으며, 이미다조피리딘의 6위치와 피리딘 부분의 4위치에 있는 메톡시 그룹과 피리딘의 3위와 5위 위치에 있는 두 개의 메틸 그룹을 가지고 있다.
테나토프라졸의 생물학적 이용가능성은 개의 자유로운 형태와 비교했을 때 (S)-(---tenatoprazole sodium salthydrate for the (-)의 두 배다. 이러한 생체이용가능성의 증가는 두 형태의 결정구조와 소수성의 차이 때문에 순수(S)-(---)항산화물질로 마케팅될 가능성이 더 높다.
PPI 바인딩 모드
억제제의 이황화 결합은 H+/K+ ATPase의 발광 부분에서 발생하며 활성 사이트 H+/K+ ATPase의 1 mol당 2 mol의 억제제가 결합된다.[19][20] 모든+ PPI는 H/K+ ATPase의 TM5와 TM6 사이의 루프에서 시스테인 813과 반응하여 E2 구성에서 효소를 고정시킨다. 오메프라졸은 시스틴 813과 892와 반응한다. 라베프라졸은 시스틴 813과 892와 321에 결합한다. 란소프라졸은 시스틴 813, 시스틴 321과 반응하는 반면 팬토프라졸과 테나토프라졸은 시스틴 813, 822와 반응한다.[18][21][22][23] 시스틴 822와의 반응은 공동 억제 효소에 다소 특별한 성질을 부여하며, 즉 환원제로의 불가역성을 부여한다. 첫 번째 단계는 시스틴 813으로 화합물의 피리딘에 프로드롭 양성자를 결합하는 것이다. 그런 다음 H+/K+ ATPase에 의해 산성수송으로 두 번째 양성자를 첨가하고 화합물이 활성화된다. 최근의 자료에 따르면, 수성 황산은 펌프 표면에 묶인 모노프로톤 벤지미다졸로부터 직접 형성되는 반응성 종이라고 한다.[7]
위 ATPase 포화상태
음식 섭취가 산성분비를 촉진하고 산성분비가 PPI를 활성화한다고 해도 PPI가 모든 펌프를 억제할 수는 없다. PPI는 반감기가 짧고 모든 펌프 효소가 활성화되지 않기 때문에 펌프 효소의 약 70%가 억제된다. 활성 펌프의 공밸런트 억제, 혈액에서 약물이 제거된 후 비활성 펌프의 후속 자극, 새로운 펌프의 디노보합성 사이에 균형이 잡히기 때문에 산성 분비의 정상 상태 억제까지 약 3일이 걸린다.[8]
임상 약리학
약물 오메프라졸, 란소프라졸, 팬토프라졸, 라베프라졸은 공통 구조와 작용 방식을 공유하지만 각각 임상 약리학에서 다소 차이가 있다.[24] 피리딘과 벤지미다졸 대체물이 다르면 작지만 잠재적으로 유의미하게 다른 물리적, 화학적 특성을 갖게 된다. 판토프라졸 나트륨을 다른 분비물 약물과 직접 비교한 결과 H수용체2 길항제보다 훨씬 효과적이며 임상적으로 사용되는 다른 PPI보다 동등하거나 우수한 것으로 나타났다.[5] 또 다른 연구는 라베프라졸이 오메프라졸, 랜소프라졸, 판토프라졸보다 더 큰 pH 범위에 걸쳐 활성화되어 이 세 가지 약물들 중 어떤 것보다 더 빠르게 설페나미드 형태로 전환된다고 밝혔다.[23] 대부분의 구강 PPI 준비물은 위 산성의 조건에서 약물의 급속한 저하로 인해 장입 코팅을 한다. 예를 들어, 오메프라졸은 pH 1~3에서 반감기가 2분인 산에서는 불안정하지만, pH 7에서는 훨씬 더 안정적이다(반감기 ca. 20 h). 산성 보호 코팅은 위장의 발광에서 활성 원리로의 전환을 방지하며, 이는 식품에서 이용 가능한 황하이드릴 그룹과 반응하여 분비물 운하액의[10] 발광에 침투하지 않는다.
PPI의 경구 생체이용률은 팬토프라졸 77%, 랜소프라졸 80~90%, 에솜프라졸 89%로 높다. 테나토프라졸을 제외한 모든 PPI는 대부분 CYP2C19와 CYP3A4에 의해 간에서 빠르게 대사된다. PPI는 CYP 효소에 민감하고 약동학 프로파일이 다르다. PPI의 효능을 비교한 연구에 따르면 에솜프라졸과 테나토프라졸은 보다 긴 기간 동안 조직 내 pH(pH > 4)로 산 억제가 강하다고 한다.[25][26][27][28][29]
표류쥐와 급성 위주걱쥐와 같은 체내 동물 모델에서 테나토프라졸이 산 분비에 미치는 영향에 대한 연구는 전메프라졸에 비해 2배에서 4배 더 강력한 억제 활성을 보였다. 보다 강력한 억제 활성은 유도 위병변의 여러 모델에서도 나타났다.[30] 백인 건강 과목뿐만 아니라 아시아에서도 테나토프라졸은 기존 H+/K+ ATPase 억제제보다 7배 긴 반감기를 보였다.[31] 따라서 반감기가 길어질수록 특히 밤중에 위산 분비를 더욱 오래 억제하게 된다는 가설이 성립된다. 약리역학 연구에서 24시간 내 pH를 모니터링하여 측정한 위산 억제 정도와 지속시간 사이에 강한 관계가 명시되어 있으며, 보고된 치유율과 증상 완화의 비율도 명시되어 있다. 한 임상 연구에 따르면 야행성 산 돌파 지속시간이 에솜프라졸 40mg보다 테나토프라졸 40mg에서 현저하게 짧았으며, 테나토프라졸이 야간 에솜프라졸보다 훨씬 더 강력하다는 결론을 내렸다. 비록 이 약리학적 이점의 치료적 관련성은 더 연구할 가치가 있다.[17]
PPI는 서로 다른 PPI 기반 요법 사이에 큰 차이가 없는 헬리코박터균 박리 근절을 위해 클라리트로마이신, 아목시실린을 탑재한 트리플 테라피 연대에 성공적으로 사용되어 왔다.[10]
| 화합물[18][21][22][23] | 대체품 | 형태 | 사이스틴 바인딩 | pka | 최초승인 | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| X | R1 | R2 | R3 | R4 | pkaa1 | pkaa1 | 연도 | |||
| 오메프라졸 | CH | OCH3 | CH3 | CH3 | CH3 | 인종 혼합물 | 813년과 892년 | 4.06 | 0.79 | 1989년 미국에서 |
| 에솜프라졸 | CH | OCH3 | CH3 | CH3 | CH3 | (S)-(-----오메프라졸의 항산화 물질 | 813년과 892년 | 4.06 | 0.79 | 2001년 미국 |
| 란소프라졸 | CH | H | CH3 | CH2CF3 | H | 인종 혼합물 | 813년과 321년 | 3.83 | 0.62 | 1991년 유럽서 |
| 덱슬란소프라졸 | CH | H | CH3 | CH2CF3 | H | (R)-(+)-랜소프라졸의 항산화 물질 | 813년과 321년 | 3.83 | 0.62 | 2009년 미국 |
| 팬토프라졸 | CH | OCHF2 | OCH3 | CH3 | H | 인종 혼합물 | 813년과 822년 | 3.83 | 0.11 | 1994년 독일서 |
| 라베프라졸 | CH | H | CH3 | (CH2)3OCH3 | H | 인종 혼합물 | 813, 892, 321 | 4.53 | 0.62 | 1999년 미국 |
| 테나토프라졸 | N | OCH3 | CH3 | CH3 | CH3 | 인종 혼합물 | 813년과 822년 | 4.04 | –0.12 | — |
미래 연구 및 차세대 PPI
칼륨-경쟁산 차단제 또는 산성펌프 길항제
PPI가 GERD의 치료에 혁명을 일으켰음에도 불구하고, 산성 환경으로부터 독립된 작용 방식뿐만 아니라 양성자 펌프의 억제도 개선될 여지가 여전히 있다.[8] 따라서 새로운 종류의 PPI, 칼륨 경쟁산 차단제(P-CABs) 또는 산성 펌프 길항제(APAs)는 지난 몇 년 동안 개발되어 왔으며 위 활동을 억제하는 차세대 약품이 될 가능성이 가장 높다.[32] 이러한 새로운 작용제는 가역적이고 경쟁적인 방법으로 두정세포 위 H+/K+ ATPase에 대한 K+ 결합과 관련하여 위산분비의 마지막 단계를 억제할 수 있다. 즉+, K 채널의 현장이나 그 근처에 결합하여 H+/K+ ATPase의 작용을 차단한다. 바인딩이 경쟁적이고 되돌릴 수 있기 때문에 이러한 작용제는 PPI에 비해 산성분비의 억제와 작용 지속시간을 더 오래 달성하여 증상 완화 및 치유를 더 빠르게 할 수 있는 잠재력을 가지고 있다.[33][34] 이미다조피리딘에 기반을 둔 화합물 SCH28080은 이 등급의 원형이었고, 간독성으로 판명되었다.[35] 현재 개발 중인 새로운 에이전트로는 CS-526, 리나프라잔, 소라프라잔, 레바프라잔 등이 있으며, 리나프라잔은 임상시험에 도달했다. 이들 화합물 또는 다른 관련 화합물이 유용해질 수 있는지 여부를 결정하기 위한 연구가 남아 있다.[34][36] 유한양행은 2006년 6월 한국 FDA로부터 레바프라잔(브랜드명 레바넥스)을 위염 치료에 사용한 것에 대해 승인을 받았다.[37] 보노프라잔은 일본에서 시판되고 있다.[38]
참고 항목
참조
- ^ Forte, JG; Lee, HC (1977). "Gastric adenosine triphosphatases: A review of their possible role in HCl secretion". Gastroenterology. 73 (4 Pt 2): 921–6. doi:10.1016/S0016-5085(19)31737-8. PMID 20386.
- ^ Snaeder, W. (1996). Drug prototypes and their exploitation. Wiley. pp. 414–5.
- ^ Hemenway, Jeffrey N. (2007). "Case Study: Omeprazole (Prilosec)". Prodrugs. Biotechnology: Pharmaceutical Aspects. pp. 1313–21. doi:10.1007/978-0-387-49785-3_49. ISBN 978-0-387-49782-2.
- ^ a b Olbe, L; Carlsson, E; Lindberg, P (February 2003). "A proton-pump inhibitor expedition: the case histories of omeprazole and esomeprazole". Nature Reviews. Drug Discovery. 2 (2): 132–9. doi:10.1038/nrd1010. PMID 12563304. S2CID 205474918.
- ^ a b c d e f g h Senn-Bilfinger, Jörg; Sturm, Ernst (2006). "The Development of a New Proton-Pump Inhibitor: The Case History of Pantoprazole". Analogue-based Drug Discovery. pp. 115–36. doi:10.1002/3527608001.ch6. ISBN 978-3-527-60800-3.
- ^ a b c d Lindberg, Per; Carlsson, Enar (2006). "Esomeprazole in the Framework of Proton-Pump Inhibitor Development". Analogue-based Drug Discovery. pp. 81–113. doi:10.1002/3527608001.ch5. ISBN 978-3-527-60800-3.
- ^ a b c d e f Shin, Jai Moo; Munson, Keith; Vagin, Olga; Sachs, George (2008). "The gastric HK-ATPase: Structure, function, and inhibition". Pflügers Archiv: European Journal of Physiology. 457 (3): 609–22. doi:10.1007/s00424-008-0495-4. PMC 3079481. PMID 18536934.
- ^ a b c d e Sachs, George; Shin, Jai Moo; Vagin, Olga; Lambrecht, Nils; Yakubov, Iskandar; Munson, Keith (2007). "The Gastric H,K ATPase as a Drug Target". Journal of Clinical Gastroenterology. 41 (Suppl 2): S226–42. doi:10.1097/MCG.0b013e31803233b7. PMC 2860960. PMID 17575528.
- ^ a b Abe, Kazuhiro; Tani, Kazutoshi; Nishizawa, Tomohiro; Fujiyoshi, Yoshinori (2009). "Inter-subunit interaction of gastric H+/K+ ATPase prevents reverse reaction of the transport cycle". The EMBO Journal. 28 (11): 1637–43. doi:10.1038/emboj.2009.102. PMC 2693145. PMID 19387495.
- ^ a b c d Shin, Jai Moo; Sachs, George (2008). "Pharmacology of proton pump inhibitors". Current Gastroenterology Reports. 10 (6): 528–34. doi:10.1007/s11894-008-0098-4. PMC 2855237. PMID 19006606.
- ^ Fellenius, Erik; Berglindh, Thomas; Sachs, George; Olbe, Lars; Elander, Berit; Sjöstrand, Sven-Erik; Wallmark, Björn (1981). "Substituted benzimidazoles inhibit gastric acid secretion by blocking (H+ + K+) ATPase". Nature. 290 (5802): 159–61. Bibcode:1981Natur.290..159F. doi:10.1038/290159a0. PMID 6259537. S2CID 4368190.
- ^ Munson, Keith; Garcia, Rachel; Sachs, George (2005). "Inhibitor and Ion Binding Sites on the Gastric H,K-ATPase†". Biochemistry. 44 (14): 5267–84. doi:10.1021/bi047761p. PMID 15807521.
- ^ Kohl, Bernhard; Sturm, Ernst; Senn-Bilfinger, Joerg; Simon, W. Alexander; Krueger, Uwe; Schaefer, Hartmann; Rainer, Georg; Figala, Volker; Klemm, Kurt (1992). "(H+, K+)-ATPase inhibiting 2-[(2-pyridylmethyl)sulfinyl]benzimidazoles. 4. A novel series of dimethoxypyridyl-substituted inhibitors with enhanced selectivity. The selection of pantoprazole as a clinical candidate". Journal of Medicinal Chemistry. 35 (6): 1049–57. doi:10.1021/jm00084a010. PMID 1313110.
- ^ Silverman, Richard B. (2004). "Receptors". The organic chemistry of drug design and drug action (2nd ed.). Academic Press. p. 148. ISBN 9780126437324.
- ^ 슈베르트-즈실라베츠, M, 워글릭스, M, Neue Arzneimittel 2009[page needed]
- ^ Metz, D. C.; Vakily, M.; Dixit, T.; Mulford, D. (2009). "Review article: Dual delayed release formulation of dexlansoprazole MR, a novel approach to overcome the limitations of conventional single release proton pump inhibitor therapy". Alimentary Pharmacology & Therapeutics. 29 (9): 928–37. doi:10.1111/j.1365-2036.2009.03984.x. PMID 19298580. S2CID 29286087.
- ^ a b Galmiche, J. P.; Bruley Des Varannes, S.; Ducrotte, P.; Sacher-Huvelin, S.; Vavasseur, F.; Taccoen, A.; Fiorentini, P.; Homerin, M. (2004). "Tenatoprazole, a novel proton pump inhibitor with a prolonged plasma half-life: Effects on intragastric pH and comparison with esomeprazole in healthy volunteers". Alimentary Pharmacology and Therapeutics. 19 (6): 655–62. doi:10.1111/j.1365-2036.2004.01893.x. PMID 15023167.
- ^ a b c Shin, Jai Moo; Homerin, Michel; Domagala, Florence; Ficheux, Hervé; Sachs, George (2006). "Characterization of the inhibitory activity of tenatoprazole on the gastric H+,K+-ATPase in vitro and in vivo". Biochemical Pharmacology. 71 (6): 837–49. doi:10.1016/j.bcp.2005.11.030. PMID 16405921.
- ^ Kaminski, James J.; Doweyko, Arthur M. (1997). "Antiulcer Agents. 6. Analysis of the in Vitro Biochemical and in Vivo Gastric Antisecretory Activity of Substituted Imidazo[1,2-a]pyridines and Related Analogues Using Comparative Molecular Field Analysis and Hypothetical Active Site Lattice Methodologies". Journal of Medicinal Chemistry. 40 (4): 427–36. doi:10.1021/jm950700s. PMID 9046332.
- ^ Lindberg, Per; Brändström, Arne; Wallmark, Björn; Mattsson, Hillevi; Rikner, Leif; Hoffmann, Kurt-Jürgen (1990). "Omeprazole: The first proton pump inhibitor". Medicinal Research Reviews. 10 (1): 1–54. doi:10.1002/med.2610100102. PMID 2404184. S2CID 8637440.
- ^ a b J M Shin; Sachs, G (1994-03-25). "Identification of a region of the H,K-ATPase alpha subunit associated with the beta subunit". Journal of Biological Chemistry. 269 (12): 8642–6. doi:10.1016/S0021-9258(17)37015-1. PMID 8132592.
- ^ a b Shin, Jai Moo; Besancon, Marie; Simon, Alexander; Sachs, George (1993). "The site of action of pantoprazole in the gastric H+/K+-ATPase". Biochimica et Biophysica Acta (BBA) - Biomembranes. 1148 (2): 223–33. doi:10.1016/0005-2736(93)90133-K. PMID 8389196.
- ^ a b c Primi, M.P.; Bueno, L.; Baumer, P.; Berard, H.; Lecomte, J.M. (1999). "Racecadotril demonstrates intestinal antisecretory activity in vivo". Alimentary Pharmacology and Therapeutics. 13 (Suppl 6): 3–7. doi:10.1046/j.1365-2036.13.s6.3.x. PMID 10646045. S2CID 25832405.
- ^ Horn, John (2000). "The proton-pump inhibitors: Similarities and differences". Clinical Therapeutics. 22 (3): 266–80, discussion 265. doi:10.1016/S0149-2918(00)80032-6. PMID 10963283.
- ^ Jorgensen, Peter L.; Håkansson, Kjell O.; Karlish, Steven J. D. (2003). "Structure and mechanism of Na, K-ATPase: functional sites and their interactions". Annual Review of Physiology. 65: 817–49. doi:10.1146/annurev.physiol.65.092101.142558. PMID 12524462. S2CID 334802.
- ^ Blostein, R.; Dunbar, L; Mense, M; Scanzano, R; Wilczynska, A; Caplan, MJ (1999). "Cation Selectivity of Gastric H,K-ATPase and Na,K-ATPase Chimeras". Journal of Biological Chemistry. 274 (26): 18374–81. doi:10.1074/jbc.274.26.18374. PMID 10373442.
- ^ McIntosh, D. B.; Clausen, JD; Woolley, DG; MacLennan, DH; Vilsen, B; Andersen, JP (2004). "Roles of Conserved P Domain Residues and Mg2+ in ATP Binding in the Ground and Ca2+-activated States of Sarcoplasmic Reticulum Ca2+-ATPase". Journal of Biological Chemistry. 279 (31): 32515–23. doi:10.1074/jbc.M403242200. PMID 15133025.
- ^ Pont, JAN Joep H. H. M.; Swarts, Herman G. P.; Willems, Peter H. G. M.; Koenderink, JAN B. (2003). "The E1/E2-Preference of Gastric H,K-ATPase Mutants". Annals of the New York Academy of Sciences. 986 (1): 175–82. Bibcode:2003NYASA.986..175P. doi:10.1111/j.1749-6632.2003.tb07157.x. PMID 12763793. S2CID 35413255.
- ^ Reuben, Michael A.; Lasater, Linda S.; Sachs, George (1990). "Characterization of a β Subunit of the Gastric H+/K+ Transporting ATPase". Proceedings of the National Academy of Sciences. 87 (17): 6767–71. Bibcode:1990PNAS...87.6767R. doi:10.1073/pnas.87.17.6767. JSTOR 2355381. PMC 54618. PMID 2168558.
- ^ Uchiyama, K.; Wakatsuki, D.; Kakinoki, B.; Takeuchi, Y.; Araki, T.; Morinaka, Y. (1999). "The Long-lasting Effect of TU-199, a Novel H+,K+-ATPase Inhibitor, on Gastric Acid Secretion in Dogs". Journal of Pharmacy and Pharmacology. 51 (4): 457–64. doi:10.1211/0022357991772510. PMID 10385219. S2CID 41561851.
- ^ Domagala, Florence; Ficheux, Herve (2003). "Pharmacokinetics of tenatoprazole, a novel proton pump inhibitor, in healthy male Caucasian volunteers". Gastroenterology. 124 (4, Supplement 1): A231. doi:10.1016/S0016-5085(03)81159-9.
- ^ Scarpignato, C; Hunt, R (2008). "Proton pump inhibitors: The beginning of the end or the end of the beginning?". Current Opinion in Pharmacology. 8 (6): 677–84. doi:10.1016/j.coph.2008.09.004. PMID 18840545.
- ^ Shin, J. M. & Sachs, G. (2009). "Long lasting inhibitors of the gastric H,K-ATPase". Expert Review of Clinical Pharmacology. 2 (5): 461–468. doi:10.1586/ecp.09.33. PMC 2995460. PMID 21132072.
- ^ a b Nayana, M. Ravi Shashi; Sekhar, Y. Nataraja; Nandyala, Haritha; Muttineni, Ravikumar; Bairy, Santosh Kumar; Singh, Kriti; Mahmood, S.K. (2008). "Insight into the structural requirements of proton pump inhibitors based on CoMFA and CoMSIA studies". Journal of Molecular Graphics and Modelling. 27 (3): 233–43. doi:10.1016/j.jmgm.2008.04.012. PMID 18676164.
- ^ Ravinder Reddy, B; Basavaraja, H S; Shivaprasad LV J, S. "Reversible Proton Pump Inhibitors: A Superior Edge — Features". Pharmabiz.com. Saffron Media Pvt. Ltd I. Retrieved 7 December 2015.
- ^ Nelson, Wendel L (2008). "Antihistamines and Related Antiallergic and Antiulcer Agents". In Lemke, Thomas L.; Williams, David A. (eds.). Foye's Principles of Medicinal Chemistry (6th ed.). pp. 1004–27. ISBN 978-0-7817-6879-5.
- ^ "Revaprazan Yuhan registered, South Korea (gastritis)". R & D Focus Drug News. September 25, 2006. Archived from the original on April 29, 2014.
- ^ Garnock-Jones KP (2015). "Vonoprazan: first global approval". Drugs. 75 (4): 439–43. doi:10.1007/s40265-015-0368-z. PMID 25744862. S2CID 43293048.