안지오텐신 수용체 차단기의 발견 및 개발
Discovery and development of angiotensin receptor blockers안지오텐신 수용체 차단제(ARBs)는 안지오텐신(AT1) 수용체 길항제 또는 사탄이라고도 하며 체내 안지오텐신2호(Angiotensin II) 호르몬의 효과를 차단하여 작용하여 혈압을 낮추는 항고혈압제군이다.이들의 구조는 앙 II와 유사하며, 억제제로서 앙 II 수용체와 결합한다(예: [리스 헬스케어 T24]).
ARB는 오늘날 임상 환경에서 널리 사용되는 약으로, 그들의 주요 적응증은 경증에서 중증의 고혈압, 만성적인 심장마비, 2차 뇌졸중 예방, 당뇨병성 신혈병이다.[1]
ARB의 발견과 개발은 현대 이성적 약물 설계의 실증적 사례로서, 어떻게 설계를 사용하여 생리학적 시스템에 대한 지식을 더 얻을 수 있는지, 이 경우, 앙 II 수용체의 하위 유형의 특성화를 들 수 있다.[2]
역사
1898년 생리학자 로버트 타이거스테트와 그의 제자 페르 베르그만이 토끼에게 신장 추출물을 주입하여 실험하였다.그들의 결과는 신장이 혈압 상승을 유발하는 레닌이라는 단백질을 생산했다는 것을 암시했다.1930년대에 골드블라트는 개들의 신장 혈류를 수축시키는 실험을 했다; 그는 이 빈혈 신장이 혈관수축을 일으키는 화학물질을 분비한다는 것을 발견했다.1939년 레닌은 혈압 상승을 유발하지 않고, 원인이 되는 물질인 안지오텐신 1(Angiotensin I)과 앙 2(Ang II)의 형성을 촉진하는 효소였다.[3]
1970년대 과학자들은 심장과 신장을 해치는 앙2를 처음 관찰했고, 혈장 내 레닌 활성도가 높은 개인은 심근경색과 뇌졸중 위험이 높았다.[4]1970년대 후반에 안지오텐신 전환 효소(ACE) 억제제가 도입되면서, Ang II가 혈압과 전해질 및 유체 균형 조절에 중요한 역할을 하는 것으로 확인되었다.[5]
그 이전에는 유용한 Ang II 수용체 길항제 개발을 시도했으며, 초기에는 안지오텐신 펩타이드 아날로그에 주안점을 두었다.Saralasin과 다른 Ang II 유사 물질은 강력한 Ang II 수용체 차단제였지만 주요 문제는 경구 생체이용성의 부족이었다.[2]
1980년대 초에는 일련의 이미다졸-5-아세트산 유도체가 쥐의 Ang II에 대한 혈압 반응을 감소시켰다는 것이 주목되었다.S-8307과 S-8308이라는 두 화합물은 나중에 매우 구체적이고 전도유망한 비펩타이드 Ang II 수용체 길항제인 것으로 밝혀졌지만 분자 모델을 사용하면 그들의 구조가 Ang II의 약리성을 보다 가깝게 모방해야 할 것으로 보였다.구조변경이 이루어졌고 구강 활성, 강력, 선택적 비펩타이드 AT1 수용체 차단제 로사르탄(losartan)이 개발되었다.1995년에 Losartan은 미국에서 임상 용도로 승인되었고 그 이후로 6개의 추가 ARB가 승인되었다.[6]이들 약물은 뛰어난 부작용 프로파일로 알려져 있는데 임상시험이 위약과 유사한 것으로 나타났다.[7]
안지오텐신2 수용체
Ang II의 작용은 angiotensin1 수용체 AT와2 AT에 의해 매개된다.이 수용체들은 7개의 투과형 나선형인 G 단백질 결합 수용체 계열의 구성원으로 세포외 루프와 세포내 루프를 서로 바꾸어 연결된다.[8][9]
각각의 G단백질 결합 수용체는 특정 G단백질에 결합되어 특수 이펙터 시스템의 활성화를 이끈다.예를1 들어 AT 수용기는 주로 G-단백질 Gq/11 그룹을 통해 결합된다.[9]
AT와3 AT의4 두 가지 안지오텐신 수용체가 더 설명되었지만, 그 역할은 아직 알려져 있지 않다.[10]
체내 분포
AT1 수용기는 주로 심장, 부신, 뇌, 간, 신장 등에서 발견된다.[10][11]그들의 주된 역할은 혈압뿐만 아니라 유체와 전해질 균형을 조절하는 것이다.
발육하는 태아에서는2 AT 수용기가 고도로 발현되지만 출생 후에는 급격히 감소한다.[10]성인의 경우 AT2 수용기는 낮은 수준에서만 존재하며 주로 심장, 부신, 자궁, 난소, 신장, 뇌에서 발견된다.[4][11]
기능들
Ang II의 알려진 작용의 대부분은 AT1 수용체를 통해 매개된다. 예를 들어, 혈관 수축, 알도스테론 방출, 신장 나트륨 재흡수, 바소프레신 분비 등이 그것이다.AT2 수용체도 혈압과 신장 기능 조절에 참여하지만1 AT 수용체에 비해 길항 효과를 매개한다.[8][10][11][12]
바인딩 포켓
Ang II는 다양한 결합 사이트를 통해 AT1 수용체에 결합한다.[1]1차 결합 부위는 AT1 수용체의 세포외 영역에 있으며, 여기서 Ang II는 AT1 수용체의 N-terminus 및 그것의 첫 번째와 세 번째 세포외 루프에 있는 잔류물과 상호작용을 한다.또한 투과성 나선은 수용체 헬리렉스 5의 상부에서 라이스와199 상호작용하는 C-terminalcarboxyl 그룹을 통해 결합에 기여한다. 자세한 내용은 그림 1을 참조한다.[8]
리스와199 앙2의 페8 잔여물의 카르복실 단자군 사이에 형성된 이온교는 Trp253 잔여물에 의해 안정화되었을 가능성이 크다.또한 투과성 나선 6의 Peh와259 Asp263, 투과성 나선 3의 외부 영역의 Lys와102 Ser도105 앙 2의 결합에 연루되었다.이 지역은 수용체 비준의 안정화와 내부 결합 주머니 형성에 참여할 수 있다.[8][13]
작용기전
혈압과 유체 및 전해질 동토사시는 레닌-안지오텐신-알도스테론 시스템에 의해 조절된다.[1]신장에서 방출되는 효소인 레닌은 비활성 혈장단백질 안지오텐시노겐을 안지오텐신 1(Angiotensin I)로 전환한다.그 후 Ang I는 Angiotensin 변환 효소(ACE)로 Ang II로 변환된다(그림 2 참조).그런 다음 혈장의 Ang II가 AT-리셉터에 결합한다.[6]
ARB는 레닌-안지오텐신 경로의 마지막 부분을 차단하고 있으며 ACE 억제제보다 더 구체적으로 경로를 차단하고 있다.[1]
AT1 수용체는 Ang II를 매개하여 심장 수축성 증가, 나트륨 재흡수, 혈관 수축 등을 유발하며, 이는 모두 혈압 상승을 초래한다.AT1 수용체를 차단함으로써 ARB는 혈압을 낮추게 된다.[14]
아무리 Ang II의 농도가 높더라도 ARB가 있는 상태에서 Ang II의 최대 반응을 복원할 수 없을 때 AT1 수용체의 극복할 수 없는 억제가 달성된다.[6]안지오텐신 수용체 차단기는 수용체와 분리되는 속도에 따라 경쟁적으로 극복할 수 있고, 극복할 수 있거나 경쟁적이지 않은 방식으로 수용체를 억제할 수 있다.[1]
약물 발견 및 개발
사랄라신에서 로사르탄 및 에프로사르탄으로의 개발
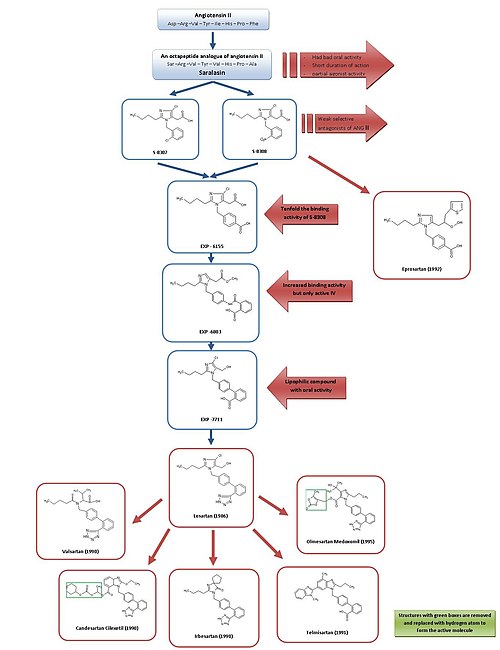
ARB 개발에 대한 간단한 개요는 그림 3을 참조하십시오.
첫 번째 앙2 대항제인 사랄라신과 첫 번째 ACE 억제제 캡토프릴의 개발로 인해, 앙2 수용체 길항제들이 효과적인 고혈압 치료제로서 유망할 수 있다는 것이 일반적으로 인정되었다.[2][7]
사랄라신은 1970년대 초 개발된 앙2의 옥타펩타이드 아날로그로 아미노산 아스프1, 일레55, 페가8 각각 세르1, 발, 알라로8 대체됐다.[7]사랄라신은 경구적으로 생물학적 이용이 불가능하고 작용기간이 짧으며 부분작용제 활성을 보여 약물로 적합하지 않았다.[2]
따라서 유사한 억제와 결합 기능을 가진 더 작은 비펩티드 물질을 개발하는 것이 목표였다.이때 듀폰의 한 단체는 이미 화학도서관의 기존 물질을 이용해 앙2의 비펩타이드 모사품 심사에 착수했다.[2]
다케다 연구진은 1982년 1-벤지리미다졸-5-아세트산 유도체에서 약한 비펩타이드 앙 2세의 적대자 S-8307과 S-8308을 발견했다.[7]S-8307과 S-8308은 중간 정도의 효력, 짧은 활동 기간, 제한된 경구 생체이용률을 가지지만, 부분작용제 활성이 없는 선택적이고 경쟁력 있는 AT1 수용체 길항제들이다.[1]듀폰의 한 단체는 앙 2세와 다케다 지휘자 모두 같은 수용체 현장에 묶여 있다고 가정했다.[7]이 두 물질은 AT1 수용체 차단기의 추가 최적화를 위한 납 화합물 역할을 했다.[1]
앙 2세의 공간 구조에 대한 핵자기 공명 연구를 이용하여, 듀폰트의 과학자들은 다케다 구조물이 훨씬 더 큰 펩타이드 앙 2를 더 가깝게 닮기 위해 특정한 위치에서 확대되어야 한다는 것을 발견했다.[2]컴퓨터 모델링은 S-8308과 S-8307을 Ang II와 비교하기 위해 사용되었고, Ang II에는 NH2 종단부 근처에 두 개의 산성 잔류물이 포함되어 있는 것으로 확인되었다.이 그룹들은 다케다 지도에 의해 모방되지 않았고 따라서 산성 기능 그룹들이 화합물에 추가되어야 할 것이라는 가설이 제기되었다.
4-카복시-파생 EXP-6155는 S-8308보다 10배 큰 구속력을 가지고 있어 이 가설을 더욱 강화시켰다.[7]
4-카복시 그룹을 2-카복시-벤자미도-모이로 대체함으로써 복합 EXP-6803을 합성했다.그것은 결합 친화력이 매우 높았으나 정맥주사를 투여할 때만 활성화되었다.
2-카르복시-벤자미도 그룹을 2-카르복시-페닐 그룹으로 대체하면 지방질비페닐 함유 EXP-7711이 생성되어 구강 활성도는 좋았지만 AT1 수용체에 대한 친화력은 약간 떨어졌다.[1]
그 후 극지방 카르복실 그룹은 구강 생체이용률과 작용 기간을 더 늘리기 위해 지방질 테트라졸 그룹으로 대체되었고, 그렇게 형성된 화합물은 로사르탄이라는 이름이 붙여졌다.이 개발은 1986년에 이루어졌고 로사르탄은 1995년 미국에서와 같이 승인된 최초의 성공적인 앙2 길항제 약물이 되었고 머크에 의해 시판되었다.[1][7]
이러한 개발은 광범위한 프로그램이었으며, 타케다 구조에서 최종 물질인 로사르탄에 이르는 과정은 생물학적 실험과 화학적 수정에서 50년 이상의 시간이 소요된 것으로 추정된다.[2]최근 유럽 연합의 로사르탄 행정부에서 3.5년간 25억 유로의 의료 서비스 제공 비용을 절감할 수 있을 것으로 추정했다는 점에서 이는 훌륭한 투자를 의미한다.[15]
S-8308과 다른 리드를 사용해, Eprosartan은 1992년에 SmithKline Beecham에 의해 개발되었다.Eprosartan은 비페닐-메틸 구조를 가지고 있지 않지만, Ang II의 C-단자 끝을 모방하기 위해 5-아세트산 그룹은 a-티엔닐아크릴산과 4-카복시-매티로 대체되었다.[7]Eprosartan은 선택적이고, 강력하며, 경쟁적인 AT1 대항마로, AT1 수용체에 대한 결합은 빠르고, 되돌릴 수 있으며, 포화도가 높고 친화력이 높다.[1][4]
Losartan에서 다른 약으로 발전
로사르탄, 발사르탄, 칸데사르탄, 이르베사르탄, 텔미사르탄, 올메사르탄은 모두 비페닐메틸 그룹을 포함하고 있다.
Losartan은 부분적으로 5-카르복실산 대사물 EXP 3174에 대사되며, 이는 모화합물보다[16] 더 강력한 AT1 수용체 길항제로서 여러 다른 ARB의 지속적인 개발을 위한 모델이었다.[1]
발사르탄, 칸데사르탄, 이르베사르탄은 모두 1990년에 개발되었다.
노바티스가 처음 시판한 발사르탄은 비테로사이클릭 ARB로, 로사르탄의 이미다졸이 아킬화 아미노산으로 대체되었다.[1]
이르베사르탄은 사노피 리서치에 의해 개발되어 발사르탄, 로사르탄보다 더 오래 활동하며, 이미다졸리논 링을 가지고 있는데, 이 링은 로사르탄의 히드록시메틸 그룹 대신 카보닐 그룹이 수소 결합 수용자로 기능한다.Irbesartan은 비경쟁적 억제제다.[4]
칸데사르탄 킬렉세틸(Candesartan cilexetil, TCV 116)은 다케다에서 개발된 벤지미다졸로, 에스테르 탄산염 프로드약이다.체내에서는 훨씬 더 강력한 7-카르복실산인 칸데사르탄으로 빠르게 전환된다.칸데사르탄과 AT1 수용기의 상호작용에서 벤지미다졸 링의 카르복실 그룹은 중요한 역할을 한다.칸데사르탄과 그 프로드약은 EXP 3174와 로사르탄보다 혈압을 낮추는 효과가 더 강하다.[1]
1991년 보링거 인겔하임이 발굴해 개발한 텔미사르탄은 비페닐 산성군으로 카르복실산을 갖고 있다.ARB 중 가장 긴 제거 반감기를 가지고 있으며 약 24시간이다.[4]
올메사르탄 메독소밀은 1995년 산쿄가 개발했으며 2002년 시판된 최신 ARB이다.그것은 캔데사르탄 킬렉세틸과 같은 에스테르 프로드약이다.체내에서는 프로드러브를 활성산 형태인 올메사르탄(RNH-6270)까지 완전하고 빠르게 가수분해한다.카복실 그룹 외에 이미다졸 링에 연결된 히드록시이소프로필 그룹이 있다.[1]
약리호포 및 구조-활동 관계
약리학
ARB의 생체 활동을 위해 가장 중요한 부분인 세 가지 기능 그룹이 있다. 자세한 내용은 그림 1을 참조하십시오.
첫 번째는 나선 7(Asn295)에서 아미노산에 결합하는 이미다졸 링이다.두 번째 그룹은 나선형 6과 7(Phe301, Phe300, Trp253, His256) 양쪽의 아미노산에 결합하는 비페닐-메틸 그룹이다.세 번째 것은 헬리코 4와 5 (Arg와167 Lys199)에서 아미노산과 상호작용하는 테트라졸 그룹이다.
테트라졸 그룹은 텔미사르탄의 경우와 마찬가지로 카르복실산 그룹에 의해 성공적으로 대체되었다.[1][7][8][17]
구조-활동 관계(SAR)
대부분의 ARB는 동일한 약리학적 효과를 가지고 있기 때문에 생화학적 효과와 생리적 효과의 차이는 대부분 다른 대체 물질에 기인한다.약물의 활성은 기판 부지에 대한 친화력과 부지에 결합하는 기간에 따라 달라진다.이미다졸 링 위의 2개 위치에 있는 선형 알킬 그룹과 같은 지방질 대체물은 수용기의 소수성 주머니와 연관되는 비페닐-메틸 그룹과 함께 사용된다.비페닐-메틸 그룹의 1위치에 있는 테트라졸, COH2 또는 NHSOCF와23 같은 산성 그룹은 수용체 내의 기본 위치에 결합되며, 잠재적인 적대적 활동에 필요하다.[18]
발사르탄에서는 로사르탄의 이미다졸 링이 아킬화 아미노산으로 대체되었다.[4]
이미다졸 링의 4번과 5번 위치에서 여러 명의 대체품을 시험해 보았다.다른 ARB는 이러한 기능 그룹을 소유하지 않고 로사탄과 유사하거나 더 나은 결합 친화력을 가지기 때문에 로사탄의 이러한 위치에 연결된 클로로와 히드록시메틸 그룹은 아마도 수용체 결합에서 그다지 중요하지 않을 것이다.이르베사르탄은 5위치에 카보닐 그룹이 있어 로사르탄의 히드록시메틸 그룹 대신 수소 결합 수용기로 기능해 수용체에 대한 결합이 길어진다.[1][4][18]
eprosartan의 구조는 다른 ARB와 가장 다른 구조로 통상적인 biphenyl-methyl 그룹은 Ang II의 Tyr4 그룹의 페놀 몰이성을 보다 가깝게 모방한 카복시 벤질 그룹으로 대체되었다.이러한 변화는 수용체에 더 강한 결합을 초래하지만 생리적, 생리적 효과는 크게 개선되지 않는다.[1]
텔미사르탄은 비페닐-메틸 그룹의 2개 위치에 카르복실산을 가지고 있으며 테트라졸 아날로그보다 더 강력하다.[1]
히드록시메틸과 카복시군이 4~5위 자리에 있는 이미다졸은 히드록시메틸군의 수소결합과 친수성에 의해 유발되는 잠재적 적대적 활동을 가진 것으로 알려졌다.[18]
또한 이미다졸 링 위의 4위 위치에 있는 히드록시 그룹이 결합 친화력에 중요한 역할을 하며 부피가 큰 알킬 그룹의 지방질 단점을 보완한다고 보고되었다.[18]
이 결과 CMeOH, CMeOH2 등 중형 히드록시 알킬 그룹이 이미다졸 링에서 4위 자리를 대체하는 데 유리한 것으로 나타났다.더욱이 이온화 가능한 집단은 결합 친화력에 유리하다.[18]
칸데사르탄과 올메사르탄은 AT1 수용체에 대한 친화력이 가장 높으며 이르베사르탄과 에프로사르탄이 그 뒤를 이었다.발사르탄, 텔미사르탄, EXP 3174는 칸데사르탄보다 약 10배 적은 유사 친화력을 가지고 있다.로사탄은 친화력이 가장 낮다.[6]AT2 수용체에 대한 ARB의 친화력은 일반적으로 AT1 하위 유형보다 훨씬 낮다(또는 약 10,000배 낮음).따라서 AT2 수용체에 대한 억제되지 않은 자극을 허용한다.[19]
약물 비교 및 약동학
| 마약 | 생물학적 반감기 [h] | 단백질 결합 [%] | 생체이용가능성 [%] | 신장/열간격[%] | 식품효과 | 일일 복용량 [mg] |
|---|---|---|---|---|---|---|
| 로사르탄 | 2 | 98.7 | 33 | 10/90 | 미니멀 | 50-100 |
| EXP 3174 | 6-9 | 99.8 | - | 50/50 | - | - |
| 칸데사르탄 | 9 | >99 | 15 | 60/40 | 아니요. | 4-32 |
| 발사르탄 | 6 | 95 | 25 | 30/70 | 40-50% 감소 | 80-320 |
| 이르베사르탄 | 11-15 | 90-95 | 70 | 1/99 | 아니요. | 150-300 |
| 텔미사르탄 | 24 | >99 | 42-58 | 1/99 | 아니요. | 40-80 |
| 에프로사탄 | 5 | 98 | 13 | 30/70 | 아니요. | 400-800 |
| 올메사르탄 | 14-16 | >99 | 29 | 40/60 | 아니요. | 10-40 |
| 출처:[4][7][19][20][21] | ||||||
ARB는 치료 지수가 크므로 (대부분 낮은) 경구 생체이용률은 임상적으로 중요하지 않은 것으로 보인다.[7]표 1에서 볼 수 있듯이, 이 약들은 혈장 단백질에 매우 구속되어 있으므로 하루에 한 번 구강 투여는 충분한 고혈압 효과를 제공해야 한다.[1]경구 섭취한 로사탄의 약 14%는 5-카르복실산 대사물 EXP 3174에 대사된다.앞에서 언급한 바와 같이 칸데사르탄 치렉세틸과 올메사르탄 메독소밀은 위장관으로부터 흡수되는 동안 에스테라제에 의해 활동적인 형태로 완전히 가수분해되는 비활성 에스테르 프로드약이다.이 세 대사물은 프로드약보다 AT1 수용체 길항제다.다른 ARB에는 활성 대사물이 없다.[1][6]
발사르탄과 올메사르탄을 제외한 모든 ARB는 인간의 간에서 발견되는 시토크롬 P450(CYP) 효소 2C9에 의해 어떤 방식으로 대사된다.예를 들어 CYP2C9은 로사르탄에서 EXP 3174까지의 대사작용을 담당하고 발사르탄과 칸데사르탄의 신진대사가 비활동적인 대사물에 대한 느린 대사작용을 담당한다.반면에 텔미사르탄은 부분적으로 글루쿠로니드화에 의해 대사되며 올메사르탄은 변하지 않는 약물로 배설된다.[22]텔미사르탄은 혈압-뇌 장벽을 넘을 수 있는 유일한 ARB로, 따라서 Ang II의 중앙 집중적인 매개 효과를 억제하여 혈압 조절을 더욱 향상시키는 데 기여할 수 있다.[1]
모든 ARB는 동일한 작용 메커니즘을 가지고 있으며 효력의 차이는 각기 다른 약동학적 프로파일과 관련될 수 있다.몇 가지 임상적 머리 대 머리 비교가 이루어졌고 캔데사르탄, 이르베사르탄, 말단사르탄은 혈압을 낮추는 데 로사르탄보다 약간 더 효과적인 것으로 보인다.[4]이 차이는 수용체 결합의 지속시간과 강도 등 수용체 수준에서 서로 다른 활동 강도와 관련이 있을 수 있다.[21]
개발 중인 ARB
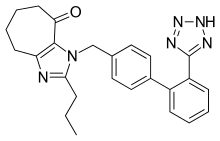
몇 개의 새로운 비펩타이드 ARB가 임상시험을 진행 중이거나 임상 전 개발 단계에 있다.그 중에는 엠부사탄(Bay 10-6734 또는 Bay 10-6734), KRH-594, 폰사탄(HR 720), 프라토사탄(KT3-671) 등이 있다.[1]예를 들어 프라토사르탄은 새로운 구조를 가지고 있는데, 이미다졸 링(그림 4)에 융합된 황소모양(C=O)이 들어 있는 7mmb의 링이며, AT1 수용체에 대한 친화력은 로사르탄보다 약 7배 높다.[1]oxo 그룹의 목적은 다른 ARB에 있는 카복실산 그룹의 목적과 유사하다.[23]
텔미사르탄이 지질 및 포도당 대사에 미치는 긍정적 효과와 요산 수치를 낮추는 로사르탄의 영향 등 ARB의 다른 속성도 조사 중이다.[23]그러한 영향은 이러한 약물에 대한 새로운 징후로 이어질 수 있지만 더 많은 연구가 필요하다.
참고 항목
참조
- ^ a b c d e f g h i j k l m n o p q r s t u v w Aulakh GK, Sodhi RK, Singh M; Sodhi; Singh (August 2007), "An update on non-peptide angiotensin receptor antagonists and related RAAS modulators", Life Sci., 81 (8): 615–39, doi:10.1016/j.lfs.2007.06.007, PMID 17692338
{{citation}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ a b c d e f g Adam, M. (2005), "Integrating research and development: the emergence of rational drug design in the pharmaceutical industry" (PDF), Studies in History and Philosophy of Biological and Biomedical Sciences, 36 (3): 513–37, doi:10.1016/j.shpsc.2005.07.003, PMID 16137601
- ^ Van Epps, H. L. (2005). "Harry Goldblatt and the discovery of renin". Journal of Experimental Medicine. 201 (9): 1351. doi:10.1084/jem.2019fta. ISSN 0022-1007. PMC 2213196. PMID 15940810.
- ^ a b c d e f g h i Burnier, M.; Brunner, H.R. (2000), "Angiotensin II receptor antagonists", Lancet, 355 (9204): 637–645, doi:10.1016/S0140-6736(99)10365-9, PMID 10696996[영구적 데드링크]
- ^ Nicolaï, E.; Curé, G.; Goyard, J.; Kirchner, M.; Teulon, J.M.; Versigny, A.; Cazes, M.; Vironeoddos, A.; Caussade, F.; et al. (1995), "Synthesis and angiotensin II receptor antagonist activity of C-linked pyrimidine derivatives", European Journal of Medicinal Chemistry, 30 (5): 365–375, doi:10.1016/0223-5234(96)88246-8
- ^ a b c d e Goodman & Gilman의 치료법의 약리학적 근거 11번째 에디션 (Renin and Angiotensin; Jackson E.K, 789-821) 편집자; Brunton L.L, Lazo J.S, Parker K.L. New York McGraw Hill 2006.ISBN 0-07-142280-3
- ^ a b c d e f g h i j k 아날로그 기반 약물 발견(Angiotensin 수용체 차단기에 의한 고혈압 치료 최적화; Farsang, C, Fisher, J, 페이지 157-167) 편집자; Fischer, J, Ganellin, R. Wiley-VCH 2006.ISBN 978-3-527-31257-3
- ^ a b c d e De Gasparo, M.; Catt, K.J.; Inagami, T.; Wright, J.W.; Unger, Th. (2000), "International Union of Pharmacology. XIII. The Angiotensin II Receptors", Pharmacological Reviews, 52 (3): 415–472, PMID 10977869
- ^ a b Hunyady, L.; Ji, H.; Jagadeesh, G.; Zhang, M.; Gáborik, Z.; Mihalik, B.; Catt, K (1998), "Dependence of AT1 Angiotensin Receptor Function on Adjacent Asparagine Residues in the Seventh Transmembrane Helix", Molecular Pharmacology, 54 (2): 427–434, doi:10.1124/mol.54.2.427, PMID 9687585, S2CID 12034239
- ^ a b c d Dihn, D.T.; Frauman, A.G.; Johnston, C.I.; Fabiani, M.E. (2001), "Angiotensin receptors: distribution, signalling and function", Clinical Science, 100 (5): 481–492, doi:10.1042/CS20000263, PMID 11294688
- ^ a b c Matsubara, H. (1998), "Pathophysiological Role of Angiotensin II Type 2 Receptor in Cardiovascular and Renal Diseases", Circulation Research, 83 (12): 1182–1191, doi:10.1161/01.RES.83.12.1182, PMID 9851935
- ^ Vinson, G.P.; Ho, M.M.; Puddefoot, J. R. (1995), "The distribution of angiotensin II type 1 receptors, and the tissue renin–angiotensin systems", Molecular Medicine Today, 1 (1): 35–39, doi:10.1016/1357-4310(95)80018-2, PMID 9415136
- ^ Clément, M.; Martin, S.S.; Beaulieu, M.; Chamberland, C.; Lavigne, P.; Leduc, R.; Guillemette, G; Escher, E (2005), "Determining the environment of the ligand binding pocket of the angiotensin II hAT1 receptor using methionine proximity assay", Journal of Biological Chemistry, 280 (29): 27121–27129, doi:10.1074/jbc.M413653200, PMID 15890659
- ^ Levy, B.I. (2005), "How to Explain the Differences Between Renin Angiotensin System Modulators", American Journal of Hypertension, 18 (9 Pt 2): 134–141, doi:10.1016/j.amjhyper.2005.05.005, PMID 16125050
- ^ Gerth, W.C.; Remuzzi, G.; et, al.; Hannedouche, Thierry; Martinez-Castelao, Alberto; Shahinfar, Shahnaz; Carides, George W.; Brenner, Barry (2002), "Losartan reduces the burden and cost of ESRD: Public health implications from the RENAAL study for the European Union", Kidney International, 62 (82): S68–S72, doi:10.1046/j.1523-1755.62.s82.14.x, PMID 12410859
- ^ Sachinidis, Agapios; Ko, Yon; Weisser, Peter; zu BricBkwedde, Maria-Katharina Meyer; Düsing, Rainer; Christian, Roger; Wieczorek, Andreas J.; Vetter, Hans (1993). "EXP3174, a metabolite of losartan (MK954, DuP753) is more potent than losartan in blocking the angiotensin ll-induced responses in vascular smooth muscle cells". Journal of Hypertension. 11 (2): 155–162. doi:10.1097/00004872-199302000-00007. ISSN 0263-6352. PMID 8385175.
- ^ Miura, S.; Kiya, Y.; Kanasawa, T.; Imaizumi, S.; Fujino, M.; Matsuo, Y.; Karnik, SS; Saku, K (2008), "Differential Bonding Interactions of Inverse Agonists of Angiotensin II Type 1 Receptor in Stabilizing the Inactive State", Journal of Molecular Endocrinology, 22 (1): 139–146, doi:10.1210/me.2007-0312, PMC 2725753, PMID 17901125
- ^ a b c d e Yanagiasawa, H.; Amemiya, Y.; Kanazaki, T.; Shimoji, Y.; Fujimoto, K.; Kitahara, Y.; Sada, T.; Mizuno, M.; Ikeda, M.; Miyamoto, S.; Furukawa, Y.; Koike, H. (1996), "Nonpeptide Angiotensin II Receptor Antagonists: Synthesis, Biological Activities, and Structure-Activity Relationships of Imidazole-5-carboxylic Acids Bearing Alkyl, Alkenyl, and Hydroxyalkyl Substituents at the 4-Position and Their Related Compounds", Journal of Medicinal Chemistry, 39 (1): 323–338, doi:10.1021/jm950450f, PMID 8568823
- ^ a b Brousil, J.A.; Burke, J.M. (2003), "Olmesartan Medoxomil: An Angiotensin II-Receptor Blocker", Clinical Therapeutics, 25 (4): 1041–1055, doi:10.1016/S0149-2918(03)80066-8, PMID 12809956[영구적 데드링크]
- ^ Brunner, H.R. (2002), "The new oral angiotensin II antagonist olmesartan medoxomil: a concise overview", Journal of Human Hypertension, 16 (2): 13–16, doi:10.1038/sj.jhh.1001391, PMID 11967728, ProQuest 219966061
- ^ a b Zusman, R.M.; Jullien, V; Lemetayer, P; Jarnier, P; Clementy, J (1999), "Are There Differences Among Angiotensin Receptor Blockers?", American Journal of Hypertension, 12 (2 Pt 1): 231–235, doi:10.1016/S0895-7061(99)00116-8, PMID 10090354[영구적 데드링크]
- ^ Kamiyama, E.; Yoshigae, Y.; Kasuya, A.; Takei, M.; Kurihara, A.; Ikeda, T. (2007), "Inhibitory Effects of Angiotensin Receptor Blockers on CYP2C9 Activity in Human Liver Microsomes", Drug Metabolism and Pharmacokinetics, 22 (4): 267–275, doi:10.2133/dmpk.22.267, PMID 17827781
- ^ a b Ogihara, T.; Saruta, T.; Shimamoto, K.; Matsuoka, H.; Rakugi, H. (2008), "Clinical Efficacy of a New Angiotensin II Type 1 Receptor Blocker, Pratosartan, in Hypertensive Patients", Hypertension Research, 31 (2): 281–287, doi:10.1291/hypres.31.281, PMID 18360048