어거니스트
Agonist작용제는 생물학적 반응을 만들기 위해 수용체를 활성화시키는 화학 물질이다.수용체는 세포가 현재 하고 있는 일을 수정하도록 활성화하는 세포 단백질이다.반면 길항제에서는 작용제의 작용을 차단하고 역작용제는 작용제와 반대되는 작용을 일으킨다.
어원학
From the Greek αγωνιστής (agōnistēs), contestant; champion; rival < αγων (agōn), contest, combat; exertion, struggle < αγω (agō), I lead, lead towards, conduct; drive
작용제의 종류
수용체는 내인성 작용제(호르몬 및 신경전달물질 등) 또는 외인성 작용제(약물 등)에 의해 활성화되어 생물학적 반응을 일으킬 수 있다.생리작용제는 같은 신체반응을 일으키지만 같은 수용체에 결합하지 않는 물질이다.
- 특정 수용체용 내인성 작용제는 그 수용체에 결합되어 활성화되는 신체에 의해 자연적으로 생성되는 화합물이다.예를 들어 세로토닌 수용체의 내인성 작용제는 세로토닌이고 도파민 수용체의 내인성 작용제는 [1]도파민이다.
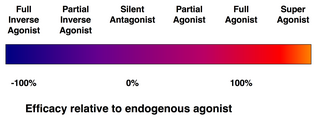
- 완전작용제는 작용제가 수용체에서 유도할 수 있는 최대 반응으로 수용체에 결합하고 활성화한다.완전한 작용제로 작용할 수 있는 약물의 한 예는 β 아드레날린 수용체에서 아드레날린의 작용을 모방하는 이소프로테레놀이다.또 다른 예는 중추신경계 전체의 μ-opioid 수용체에서 엔돌핀의 작용을 모방하는 모르핀이다.그러나 약물은 수용체의 상대적인 수와 [medical citation needed]수용체 결합의 차이에 따라 일부 조직에서는 완전한 작용제로, 다른 조직에서는 부분 작용제로 작용할 수 있다.
- 공동 행동주의자는 다른 공동 행동주의자와 함께 원하는 효과를 낸다.NMDA 수용체 활성화는 글루탐산염, 글리신 및 D-세린 공동작용제의 결합을 필요로 한다.칼슘은 또한 IP3 수용체에서 공동 작용제로 작용할 수 있다.
- 선택작용제는 특정 유형의 수용체에 대해 선택적이다.예: 부스피론은 세로토닌 5-HT1A에 대한 선택적 작용제이다.
- 부분작용제(예: 부스피론, 아리피프라졸, 부프레놀핀 또는 노르클로자핀)도 주어진 수용체와 결합 및 활성화되지만, 수용체 점유율이 최대일 때에도 전체 작용제에 비해 수용체에서의 부분적인 효과만 가진다.이러한 이유로 부프레놀핀과 같은 약물은 낮은 의존성 및 남용 잠재력으로 오피오이드 수용체에 더 약한 효과를 일으키기 때문에 아편 의존성 치료에 사용됩니다.
- 역작용제는 해당 수용체에 대한 작용제와 동일한 수용체 결합 부위에 결합하고 수용체의 구성 활성을 저해하는 약제이다.역작용제는 단순히 길항제에서 볼 수 있는 작용제 효과의 부재가 아니라 수용체 작용제와 반대되는 약리학적 효과를 발휘한다.예를 들어 칸나비노이드 역작용제 리모나반트가 있다.
- 슈퍼고니스트는 표적수용체에 대한 내생작용제보다 더 큰 반응을 일으킬 수 있는 화합물을 식별하기 위해 일부에 의해 사용되는 용어이다.내인성 작용제는 단순히 그 조직의 부분 작용제일 뿐이라고 주장할 수 있다.
- 비가역작용제는 공유결합의 형성을 통해 수용체에 영구적으로 결합하는 작용제의 일종이다.파라세타몰을[citation needed] 포함한 [2][3]이들 중 몇 가지가 기술되었다.
- 바이어스 작용제는 동일한 신호 전달 경로에 영향을 주지 않고 수용체에 결합하는 약제이다.올리세리딘은 β-아레스틴2 [4]경로에서 벗어나 G 단백질에 대해 기능적으로 선택적인 것으로 기술된 γ-오피오이드 수용체 작용제이다.
약리학의 종래의 정의를 넓히는 새로운 발견은 리간드가 이펙터 경로나 조직 유형에 따라 동일한 수용체에서 작용제와 길항제 역할을 동시에 할 수 있다는 것을 보여준다.이러한 현상을 설명하는 용어는 "기능적 선택성", "단백질 작용"[5][6][7][8] 또는 선택적 수용체 조절제입니다.
작용 메커니즘
앞서 설명한 바와 같이 작용제는 작용제의 [9]종류와 수용체의 종류에 따라 다른 위치와 방식으로 결합할 수 있는 잠재력을 가지고 있다.결합 과정은 수용체-고니스트 관계에 따라 다르지만 결합은 구조 변화를 유도하고 [9][10]수용체를 활성화한다.이러한 구조 변화는 종종 작용제가 [10][11]결합되었을 때 전하의 작은 변화나 단백질 접힘의 변화로 인해 발생한다.이러한 과정을 보여주는 두 가지 예는 무스카린성 아세틸콜린 수용체와 NMDA 수용체 및 각각의 작용제이다.
G단백질결합수용체[10](GPCR)인 무스카린성 아세틸콜린수용체는 아세틸콜린이다.이 신경전달물질의 결합은 세포에 [10]신호를 전파하는 구조 변화를 일으킨다.구조 변화는 작용제의 주요 효과이며 작용제의 결합 친화력 및 작용제 [9][12]효과와 관련이 있다.이 수용체에 결합하는 다른 작용제는 특이 결합 친화력과 유효성에 따라 위에서 언급한 작용제의 다른 범주 중 하나에 속하게 된다.
NMDA 수용체는 활성화를 위해 공동작용제를 필요로 하기 때문에 NMDA 수용체는 다른 작용 메커니즘의 한 예이다.NMDA 수용체는 단일 특정 작용제를 필요로 하는 것이 아니라 내생 작용제인 N-메틸-D-아스파르트산(NMDA)과 글리신을 [11]모두 필요로 한다.이러한 공동 작용제는 모두 NMDA 수용체가 이온 채널(이 경우 칼슘)[11]을 통해 흐를 수 있도록 하는 데 필요한 구조 변화를 유도하기 위해 필요합니다.NMDA 수용체에 의해 증명된 측면은 작용제의 메커니즘 또는 반응이 다양한 화학적 및 생물학적 [11]요인에 의해 차단될 수 있다는 것이다.NMDA 수용체는 세포가 탈분극을 [11]경험하지 않는 한 마그네슘 이온에 의해 구체적으로 차단된다.
이러한 차이는 작용제가 활성화된 수용체와 [9][10]필요한 반응에 따라 고유한 작용 메커니즘을 갖는다는 것을 보여준다.그러나 목표와 과정은 일반적으로 일치하며,[9][12] 작용제의 결합을 필요로 하는 주요 메커니즘과 수용체에서 원하는 반응을 일으키기 위한 구성 변화가 필요하다.위에서 설명한 바와 같이 이 반응은 이온의 흐름을 허용하는 것에서부터 GPCR을 활성화하고 [9][10]셀에 신호를 전송하는 것까지 다양할 수 있습니다.
활동
효력
효력은 원하는 반응을 이끌어내기 위해 필요한 작용제의 양이다.작용제의 효력은 그 EC50 값과 반비례한다.EC는50 작용제의 최대 생물학적 반응의 절반을 유도하는 데 필요한 작용제의 농도를 결정함으로써 특정 작용제에 대해 측정할 수 있다.EC50 값은 생리적으로 유사한 효과를 내는 유사한 효능을 가진 약물의 효력을 비교하는 데 유용하다.EC 값이50 작을수록 작용제의 효력이 커지며 생물학적 반응을 최대화하는 데 필요한 약물의 농도가 낮아진다.
치료 지수
치료적으로 약물을 사용할 때, 원하는 효과에 필요한 선량과 원하지 않고 위험한 부작용을 일으키는 선량 사이에 존재하는 안전 한계를 이해하는 것이 중요하다(TD50, 개인의 50%에서 독성을 생성하는 선량으로 측정).치료 지수라고 불리는 이 관계는 비율50 TD로 정의된다.ED50. 일반적으로 이 마진이 좁을수록 약물이 원치 않는 효과를 낼 가능성이 높아집니다.치료지수는 약물의 유용성을 결정할 때 효력과 구별되는 안전성의 한계의 중요성을 강조한다.
「 」를 참조해 주세요.
레퍼런스
- ^ Goodman and Gilman's Manual of Pharmacology and Theraputics. (11판, 2008년)p14. ISBN0-07-144343-6
- ^ De Mey JGR, Compeer MG, Meens MJ (2009). "Endothelin-1, an Endogenous Irreversible Agonist in Search of an Allosteric Inhibitor". Mol Cell Pharmacol. 1 (5): 246–257.
- ^ Rosenbaum DM, Zhang C, Lyons JA, Holl R, Aragao D, Arlow DH, et al. (January 2011). "Structure and function of an irreversible agonist-β(2) adrenoceptor complex". Nature. 469 (7329): 236–240. Bibcode:2011Natur.469..236R. doi:10.1038/nature09665. PMC 3074335. PMID 21228876.
- ^ DeWire SM, Yamashita DS, Rominger DH, Liu G, Cowan CL, Graczyk TM, et al. (March 2013). "A G protein-biased ligand at the μ-opioid receptor is potently analgesic with reduced gastrointestinal and respiratory dysfunction compared with morphine". The Journal of Pharmacology and Experimental Therapeutics. 344 (3): 708–717. doi:10.1124/jpet.112.201616. PMID 23300227. S2CID 8785003.
- ^ Kenakin T (March 2001). "Inverse, protean, and ligand-selective agonism: matters of receptor conformation". FASEB Journal. 15 (3): 598–611. CiteSeerX 10.1.1.334.8525. doi:10.1096/fj.00-0438rev. PMID 11259378. S2CID 18260817.
- ^ Urban JD, Clarke WP, von Zastrow M, Nichols DE, Kobilka B, Weinstein H, et al. (January 2007). "Functional selectivity and classical concepts of quantitative pharmacology". The Journal of Pharmacology and Experimental Therapeutics. 320 (1): 1–13. doi:10.1124/jpet.106.104463. PMID 16803859. S2CID 447937.
- ^ De Min A, Matera C, Bock A, Holze J, Kloeckner J, Muth M, et al. (April 2017). "A New Molecular Mechanism To Engineer Protean Agonism at a G Protein-Coupled Receptor". Molecular Pharmacology. 91 (4): 348–356. doi:10.1124/mol.116.107276. PMID 28167741.
- ^ Smith CL, O'Malley BW (February 2004). "Coregulator function: a key to understanding tissue specificity of selective receptor modulators". Endocrine Reviews. 25 (1): 45–71. doi:10.1210/er.2003-0023. PMID 14769827.
- ^ a b c d e f Colquhoun D (January 2006). "Agonist-activated ion channels". British Journal of Pharmacology. 147 (S1): S17–S26. doi:10.1038/sj.bjp.0706502. PMC 1760748. PMID 16402101.
- ^ a b c d e f Kruse AC, Ring AM, Manglik A, Hu J, Hu K, Eitel K, et al. (December 2013). "Activation and allosteric modulation of a muscarinic acetylcholine receptor". Nature. 504 (7478): 101–106. Bibcode:2013Natur.504..101K. doi:10.1038/nature12735. PMC 4020789. PMID 24256733.
- ^ a b c d e Zhu S, Stein RA, Yoshioka C, Lee CH, Goehring A, Mchaourab HS, Gouaux E (April 2016). "Mechanism of NMDA Receptor Inhibition and Activation". Cell. 165 (3): 704–714. doi:10.1016/j.cell.2016.03.028. PMC 4914038. PMID 27062927.
- ^ a b Strange PG (April 2008). "Agonist binding, agonist affinity and agonist efficacy at G protein-coupled receptors". British Journal of Pharmacology. 153 (7): 1353–1363. doi:10.1038/sj.bjp.0707672. PMC 2437915. PMID 18223670.