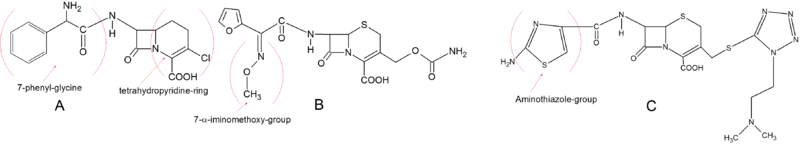세팔로스포린 발견 및 개발
Discovery and development of cephalosporins세팔로스포린은 β-락탐 링을 포함하고 다른 β-락탐 항생제(예: 페니실린, 카바페넴, 모노박탐)와 구조적 유사성과 작용 메커니즘을 공유하는 광범위한 종류의 살균 항생제다.[1]세팔로스포린(및 다른 β-락탐)은 결국 삼투성 용해와 박테리아 세포의 사망을 초래하는 박테리아 세포벽 합성의 필수적인 단계를 억제하여 박테리아를 죽일 수 있는 능력을 가지고 있다.[2]세팔로스포린은 임상 효율성과 바람직한 안전 프로필 때문에 널리 사용되는 항생제다.[3]
세팔로스포린은 항균 스펙트럼, 용해성, 산성 허용성, 경구 생체이용성, 생물학적 반감기 및 기타 특성이 다양하다.따라서 세팔로스포린은 항균 활동, 발명의 시기, 구조적 기준에 따라 세대로 더욱 분류될 수 있다.
세팔로스포린 기본구조
기본 세팔로스포린 분자의 코어는 디하이드로시아진 링으로 응축된 β-락탐 링을 포함하는 두 개의 링 시스템으로 구성된다.코어 자체는 천연 화합물인 세팔로스포린 C에서 가수분해로 파생될 수 있는 7-아미노페팔로스포란산이라고도 할 수 있다.이 노심을 함유한 화학성분들은 산 가수분해와 β-락타마제에 대한 내성이 비교적 안정적이다.세팔로스포린 C는 D-아미노아디프산에서 파생된 사이드 체인을 함유하고 있다.관련 위치의 사이드 체인을 개조하여 완전히 새로운 종류의 세팔로스포린 항생제를 만들었다.락탐 링의 위치 7에서 측면 체인을 수정하면 항균 활성에 영향을 미치는 반면 디히드로시아닌 링의 위치 3은 약동학적 특성과 수용체 결합 친화력을 변화시킨다.[4][5]
디스커버리
세팔로스포린 그룹의 첫 화학성분들은 주세페 브로츠가 1948년 사르디니아 해안에서 떨어진 하수구에서 처음 발견한 세팔로스포린을 생성하는 균인 세팔로스포륨 아크레모늄으로부터 격리되었다.[1]세팔로스포륨 아크레모늄 배양균의 조잡한 필트레이트로 부터 과학자들은 새로운 항균 활동을 얻었다.조잡한 여과물이 포도상구균의 성장을 억제할 수 있다는 점에 주목했다.[3]
조사
에드워드 에이브러햄 경과 가이 뉴턴에 의한 추가 조사는 영국에서 이루어졌고 사르디니아 균으로부터 배양액을 격리시킨 결과 세팔로스포린 P, N, C가 나왔다.이러한 천연 화합물은 항균제로 사용할 수 있을 정도로 강력하지는 않지만 화학적 방법과 자연적인 사이드 체인을 제거함으로써 부자연스러운 사이드 체인과 더욱 잘 맞을 수 있는 7-아미노세팔로판산(7-ACA)을 생산할 수 있었다. 7-ACA는 6-아미노펜실란산(6-APA)과 유사하다.여러 종류의 페니실린을 만드는 [1]것
1959년에 아브라함은 그의 세팔로스포린 C의 N-페닐라세틸 유도체가 모화합물보다 포도상구균에 훨씬 더 강하다고 보고했다.이 파생상품은 나중에 벤질피닐린의 세팔로스포린 아날로그인 세팔로람으로 명명되었다.
일라이 릴리는 세팔로스포린 C의 α-아미노아디포일 사이드 체인을 클리어한 것을 바탕으로 7-ACA를 생산하는 방법을 개발했다.[6]로버트 모린의 추가 연구는 페니실린으로부터 3-데아세톡시-7-ACA (7-ADCA)의 반합성을 이끌어냈는데, 페니실린은 세팔로스포린보다 더 쉽게 발효될 수 있기 때문에 편리하다.예를 들어 7-ADCA는 페녹시메틸피니실린의 7가지 화학 반응 단계에서 반사이즈될 수 있다.[1]
결과.
세팔로신(Cephalothin)은 1964년 미국에서 환자가 사용할 수 있게 된 최초의 세팔로스포린이다.그것은 일라이 릴리에서 준비된 일련의 7-ACA 파생상품들 중에서 임상시험용으로 선택되었다.[7]두 번째 자궁내막용 세팔로스포린은 조금 후에 출시되었고 세팔로리딘이라는 이름으로 미국에서 시판되었다.이 두 세팔로스포린의 임상적 성공은 연구자들에게 약리학적 특성을 개선하고 더 많은 작용제를 개발하도록 촉구하였다.[8][9]오늘날 우리는 그 두 가지 시작 재료의 화학에 대한 집중적인 연구를 통해 얻은 지식을 바탕으로 천연 세팔로스포린 화합물의 수천 개의 반사이즈 유사점을 가지고 있다.[1]
작용기전
β-락탐 항생제의 살균 효과는 박테리아 세포벽 합성의 억제를 통해 달성된다.그램 양성 박테리아와 그램 음성 박테리아의 세포벽은 서로 긴밀하게 결합되고 교차 연결된 펩티도글리칸 네트워크로 박테리아의 성장과 세포분열, 세포구조에 필수적이다.따라서 박테리아는 박테리아 성장과 세포분열 과정에서 세포벽을 갈라놓을 수 있는 효소가 필요하다.박테리아의 세포벽은 세포 바깥으로부터 두 단계로 쌓인다.첫 번째 단계에서, 끝부분에 있는 펩타이드와 연결된 이당류 단위의 분자들은 박테리아의 세포질에서 운반되어 트랜스글리콜라제에 의해 벽의 바깥쪽에서 함께 결합된다.두 번째 단계에서, 트랜스펩티드는 펩타이드 결합을 통해 서로 연결된 긴 다당류 사슬을 연결한다.D-알라닐-D-알라닌의 아미노산 염기서열은 펩타이드 체인의 끝에 있는 트랜스펩티다아제에 의해 인식된다.효소는 단자 끝의 알라닌을 분리하고 나머지를 인접한 다당류에서 펩타이드 체인으로 결합한다.[10]이러한 전이 반응은 세팔로스포린과 같은 β-락탐 항생제에 의해 억제된다.이러한 억제 때문에 항생제는 박테리아가 성장의 로그 단계에 있을 때 가장 효과적이며, 거기서 그들은 세포벽을 합성한다.만약 박테리아가 성장 정지 단계에 있다면, 현재 진행 중인 벽 합성도 없고 항생제 효과도 훨씬 낮다.[3]
β-락탐 항생제에 대한 작용 메커니즘이 완전히 알려진 것은 아니지만, 트랜스펩티드가 D-알라닐-D-알라닌 수열에 결합되었을 때 화학 반응의 전환 상태 구조를 모방하여 작용 메커니즘을 발휘하는 것으로 생각된다.[10]이러한 단백질은 흔히 페니실린 결합 단백질(PBP)이라고 불린다.효소 결합 부위의 세린 잔류물에 의한 β-락탐 링의 개방은 효소의 활성 부위와 항생제 분자의 공동 결합으로 이어진다.그 결과는 세포벽 합성이 더 이상 불가능하고 삼투석으로 인해 세포가 죽게 되는 되돌릴 수 없는 결합 효소 복합체다.[2][10][11]
약물 설계
구조활동관계
세팔로스포린의 분자 구조는 체외 안정성, 항균 활성 및 β-락타마제에 대한 저항성을 향상시키기 위해 다양한 방법으로 변화될 수 있다.위의 산성 조건에서 체외 안정성은 세팔로스포린 구조의 α1과 α2 위치에 아미노와 수소를 첨가함으로써 향상될 수 있다.이것은 기본적인 화합물인 암모늄 이온을 생성하여 해당 조건에서 양성하여 보다 안정적인 β-락탐을 제공하여 경구 활성 약물로 이어진다.A2가 수소 대신 알코시 그룹이라면 항균 활성을 높일 수 있다.7-아미노 그룹은 항균 활동에 매우 중요하다.어떤 경우에는 위치 A2에 메톡시 그룹을 추가하면 β-락타마아제 쪽으로 세팔로스포린 안정성이 향상된다.A1 위치에서는 유황과 산소를 링에 넣을 수 있다.유황은 항균 활성이 더 좋아지지만 산소는 β-락타마제 쪽으로 더 나은 안정성을 보인다.위치 C6에서는 수소가 생물학적 활동에 매우 중요하다.위치 A3에서는 A3가 6mb가 아닌 5mb가 된 이형종일 때 항균 활성도가 더 크다.위치 α1과 α2에서 L-이소머는 D-이소머보다 β-락타마아제 쪽으로 30~40배 더 안정적이다.β-락타마아제에 대한 안정성은 메톡스효소 첨가로 약 100배 증가할 수 있다.Z-oxime은 E-oxime보다 거의 2만배 더 안정적이다.[1]
바인딩 사이트
재조합 단백질 공학 및 발현, 단백질 정화, NMR, X선 결정학, 계산 화학 분야의 발전은 단백질 리간드 복합체의 3차원 구조에 수집된 데이터를 활용할 수 있는 약제 설계자들의 능력을 향상시켰다.[12]
대부분의 박테리아 종은 효소 기능, 분자량, β-락탐 항생제에 대한 친화력 등 다양한 방식으로 PBP의 종류를 가지고 있다.β-락탐, PBP 및 β-락타마제의 결합 부위와 관련하여 특히 흥미로운 두 가지 유형의 효소가 있다.PBP 결합 부위의 표적 변경은 포도상구균, 장구균, 폐렴구균과 같은 박테리아들 사이에서 β-락탐의 높은 저항성을 가져왔다.[13]예를 들어 네이세리아 고노르후아에 있는 PBP2의 결합 부위는 구조적으로 결정되었으며 거의 모든 β-락탐 상호작용 효소에서 볼 수 있는 세 가지 시퀀스 모티브가 있다.
- SXXK 모티브는 α2 나선형의 N단자 끝에 위치하며 효소 기능에 중요한 두 개의 잔류물을 포함한다.
- SXN 모티브(Ser-362, Ser-363 및 Asn-364 포함)
- Lys-497, Thr-498 및 글리-499를 포함하는 KTG 모티브
연구는 또한 PBP 간에 차이가 있는 활성 사이트 인접 지역이 β-락탐 아틸화 속도에 상당한 영향을 미친다는 것을 암시한다.[14]
항균 저항성
세팔로스포린 화합물에 대한 박테리아 저항성은 세 가지 메커니즘에 의해 발생할 수 있다.
- 대상 PBP 수정
- 박테리아 β-락타마아제에 의한 약물 불활성화
- 박테리아 세포에서 목표 PBP에 도달하지 못하는 약물
세팔로스포린은 목표 PBP에 도달하기 위해 박테리아 세포벽을 통과해야 한다.이에 비해 그램 양성균의 세포벽은 그램 음성균의 세포벽보다 침투가 쉽다.그램 양성 박테리아의 세포벽 구조는 세팔로스포린 크기의 분자를 통과시킬 수 있는 펩티도글리칸에 의해 일상적으로 형성된다.그램 음성세균의 세포벽 구조는 다당류, 지질, 단백질로 구성되어 있어 더 복잡하고 침투하기 어렵다.입자는 물이 채워진 통로, 즉 전막 단백질인 포린을 통해 외부 막을 통과한다.[15]세팔로스포린에 노출되는 동안 박테리아는 스스로 또는 돌연변이에 의해 번식한 후 다음 세대의 박테리아 선택으로 저항을 형성할 수 있다.[16]폐렴구균이나 메닌고코치 같은 박테리아 종은 외생 유전 물질을 획득할 수 있고, 이를 자신의 염색체에 통합할 수 있어 항균 저항성이 생긴다.[17]그러한 방식으로 목표 PBP를 변경하여 세팔로스포린과 다른 β-락탐 항생제에 대한 매력을 낮출 수 있다.[18][19]이 박테리아는 또한 베타락탐 항생제에 취약한 PBP를 덜 취약한 PBP로 대체할 수 있다.[20]β-lactam 항생제는 박테리아에 의해 생성되는 많은 종류의 β-lact아마제에 의해 비활성화될 수 있다.효소는 β-락탐 링의 탄소 원자와 질소 원자의 결합을 가수 분해한다.기질 특이성과 숙주 범위가 다른 베타 락타마제가 많다.[21][22]효소 활성 부위는 수력적으로 쉽게 재생되기 때문에 여러 번 재사용할 수 있는데, 그런 식으로 비교적 적은 양의 베타 락타마제가 다량의 약물을 파괴할 수 있다.포도상구균과 같은 그램 양성 박테리아는 세포벽 밖에서 약물을 만나는 세포외 공간으로 베타 락타마제의 방출량이 높다.반면에 그램 음성 박테리아는 더 보수적인 과정을 따른다.이들은 베타락타마제를 내막과 외막 사이의 경막 공간에 분비해 세포외 공간으로 쉽게 빠져나가지 못하고, 대량으로 생합성할 필요가 없다.[1]
약물 개발
이 절에서는 세대 간의 구조적 차이를 강조하면서 한 세대에서 다음 세대로의 약물 개발을 검토한다.세대 분류 체계는 세팔로스포린을 그램 음성 대 그램 양성 박테리아에 대한 화학적 특성과 상대적 활동으로 나누는 것에 의존한다.[5][14]1세대 세팔로스포린에서 3세대까지 그램 양성 박테리아에 대한 효과가 더 높은 것에서 그램 음성 박테리아에 대한 효과와 그램 양성 박테리아에 대한 효과가 각각 떨어지는 것으로 발전하고 있다.그러나 이 활동은 4세대에서 그램 음성 및 그램 양성 박테리아에 대해 균형 잡힌 효과로 돌아온다.[23]
세팔로스포린 분류
세팔로스포린 클래스는 매우 광범위하기 때문에 서로 다른 세팔로스포린을 구별하기 위해 좋은 분류 시스템이 필요하다.분류에 사용될 수 있는 화학적 및 활성 특성(예: 화학적 구조, 사이드 체인 특성, 약동학, 활동 스펙트럼 또는 임상적 특성)은 거의 없다.이러한 가변적 특징에도 불구하고 세팔로스포린에 대한 가장 일반적인 분류 체계는 그것들을 세대로 나누는 것이다.세대 시스템은 서로 다른 세팔로스포린에 의해 보여지는 다른 항균 활동에 기초한다.[3][4][24]
1세대 세팔로스포린
1세대 세팔로스포린은 시장에 나온 첫 세팔로스포린이다.그들은 그램 양성 박테리아에 대한 항균 활동은 좋지만 그램 음성 종에 대한 활동은 제한적이다.[25]1세대 세팔로스포린의 화학 구조는 꽤 간단하다.예를 들어 이 등급의 세 가지 약물(Cephalexin, Cephradine, Cefadroxil)은 모두 C-3 위치에 단일 메틸 그룹을 가지고 있다.1등급 세팔로스포린에 대한 C-3의 일반적인 사이드 그룹은 메틸과 같은 작은 무충전 그룹이다.[5]위치 C-3의 메틸 그룹은 일반 PBP에 낮은 친화력을 제공하며, 이는 부분적으로 이러한 첫 번째 약물의 상대적으로 낮은 활성도를 설명할 수 있다.그러나 Cepaclor는 PBP에 더 잘 결합하여 항균 활동을 더 잘 할 수 있는 C-3 위치에 Cl 그룹을 가지고 있다.C-3 포지션의 Cl 그룹 때문에 1세대 세팔로스포린을 1세대 세팔로스포린으로 분류하는 것에 대한 합의는 없지만, 2세대보다 1세대와 더 관련이 있는 C-7 사이드 체인 때문에 종종 그렇게 분류된다.1세대 세팔로스포린 모두 위치 C-7에 α-아미노 그룹이 있다.이 구조는 β-락타마아제에 의한 가수분해에 취약하게 만든다.[5][9]
2세대 세팔로스포린
초기 2세대 세팔로스포린은 1세대와 기본구조가 매우 비슷하다.그러나 로라카르베프는 일반적인 디하이드로시아진 링을 가지고 있지 않지만 유황 원자가 테트라히드롭피리딘 링을 만드는 대신 링 안에 탄소 원자가 들어 있는 카바세프헴이다.이 화학적 특성은 로라카르베프가 경구 흡수 특성과 PBP와의 결합 친화성을 유지하면서 혈장 안정성을 더 높여준다.7페닐글리신(Phenyl-Glycine)은 구강으로 사용할 수 있게 하고, 위치 C-3의 염소는 세파클러처럼 활동하게 한다.2세대 세팔로스포린 개발에서 중요한 구조적 변화는 C-7 사이드 체인에 α-이미노메트홀록시 그룹을 도입하는 것이었다.이를 통해 베타 락탐 링의 입체 화학적 차단으로 β-락타마아제에 대한 저항이 높아졌다.세푸로시메는 이 사이드 체인을 통합한 최초의 세팔로스포린이었다.2세대에서 매우 중요한 또 다른 그룹은 C-3 사이드 체인으로 가는 아미노티아졸 링이다.이 개발은 PBP에 대한 결합 친화력을 급격히 증가시켰고 항균 활동을 증가시켰다.아미노티아졸레 고리는 세포티암의 구조에서 볼 수 있다.[5][9]
3세대 세팔로스포린
3세대 세팔로스포린 중 대다수는 아미노티아졸 그룹이 위치 C-7에 있다.7 α-이미노하이드록시, 7 α-이미노메트록시 등 7 α-위치에서 서로 다른 집단이 발견된다.그러나 세프티부텐은 7α-에틸리딘 그룹을 소유하고 있다.이 그룹은 향상된 스펙트럼 β-락타마아제에 대해 더 높은 저항을 제공한다.구강 3세대 세팔로스포린 중 상당수는 파렌탈 형태의 에스테르로 소화관(세프테람피복실)의 에스테라스에 의해 가수분해된다.3세대 약품 중 일부는 에스테르화 없이도 구두로 흡수할 수 있다.예를 들어, C-3 위치에 비닐 그룹을 놓음으로써 세픽시메와 세프디니르를 처리한 것이다.[5][9]
4세대 세팔로스포린
4세대 세팔로스포린은 2세대와 3세대보다 그램 음성 박테리아에 대한 활동성이 더 크다.이 차이는 그들이 이온성 이온성 zwitterion 화합물들이기 때문이다.C-7 사이드 체인은 3세대 세팔로스포린과 유사하며, 이미네트호옥시-아미노티아졸 집단을 함유하거나 세프클리딘 아미노티아졸의 경우와 유사하다.C-3 사이드 체인의 양전하 쿼터나리 질소 때문에 4세대 세팔로스포린은 그램 음성 박테리아 막을 통해 이전 세팔로스포린보다 더 쉽게 확산될 수 있다.양전하가 포린 채널의 입구까지 약 분자의 방향을 맞춘다고 생각된다.[26]
5세대 세팔로스포린
현재 이 범주에는 세프토비프로와 세프타롤린 두 가지 약만 있다.이들 신약은 메티실린 내성 스타필로코쿠스 아우레우스(MRSA)에 효과적인 유일한 β-락탐 항생제다.Ceftobiprole은 피롤리디논-3-ylidenemethyl cephem이다.C-3 사이드 체인은 PBP2a와 PBP2x에 강한 결합 친화력을 갖도록 특별히 설계되었다. PBP2a는 다른 β-락탐 약물에 포도상구균 저항성을 부여하고 PBPx는 폐렴구균에도 동일하게 작용하는 것으로 알려져 있다.Ceftobiprole은 또한 C-7 위치에 아미노티아조일하이드록시미노 사이드 체인을 가지고 있는데, 이 체인은 S. aureus의 β-락타마아제에 좋은 저항을 주는 것으로 알려져 있다.이 활동적인 그룹들은 함께 Ceftobiprole을 MRSA에 살균작용으로 만든다. Ceftobiprole은 낮은 용해성을 가지고 있으며 따라서 Ceftobiprole 메도카릴이라고 불리는 에스테르 프로드러로서 정맥주사를 투여한다.그것은 플라즈마 에스테라제들에 의해 활동적인 Ceftobiprole로 빠르게 분해된다.[27]세프타롤린은 4세대 세팔로스포린 세포조프란으로부터 개발되었다.초기 세대부터 C-7 위치에 알톡시미노군을 보유하고 있어 β-락타마제가 많이 존재해도 상당히 안정적이다.MRSA와 페니실린 내성인 스트렙토코쿠스 진폐증은 각각 새로운 형태의 PBP, PBP2a, PBP2x에 대한 내성을 가지고 있기 때문에, 세프타롤린과 세프토비프로레 모두 이러한 새로운 PBP를 결합하도록 특별히 설계된 C-3 사이드 체인을 가지고 있다.Ceftarolin의 경우 이 사이드 체인은 안티 MRSA 활동에 최적화된 2-thioazolythio 스페이서 링크를 포함하고 있다.세프타롤린은 용해도가 낮지만 이 분자에 N-인산노아미노 그룹을 부착해 정맥주사제인 세프타롤린 포사밀을 만들어 이 문제를 극복했다.프로드러그는 플라즈마에서 탈인산화 되어 활동적인 세프타롤린을 형성한다.[28]
현재 상태
항균저항은 새로운 항균제 개발의 원동력이다.저항 메커니즘의 복잡성과 다양성은 새롭고 개선된 β-락탐 항생제의 필요성을 정의했다.[29]세팔로스포린은 넓은 스펙트럼으로 경구 생체이용성이 부족한 경우가 많지만 β-락탐 화학요법을 지배하게 되었다.[9]
2010년 10월 29일, 새로운 세팔로스포린 제제인 세프타롤린이 식품의약품안전청(FDA)의 승인을 받았다.테플라로(Ceftaroline fosamil)는 급성 세균성 피부 및 피부구조 감염증(ABSSI)과 지역사회 후천성 세균성 폐렴(CABP)을 앓고 있는 성인을 치료하기 위한 주사 가능한 항생제 프로약제다.
Ceftobiprole은 유럽 12개국, 캐나다, 스위스에서 병원 후천성 폐렴(EVAP 제외)과 지역사회 후천성 폐렴으로 성인 환자에 대한 치료 승인을 받았다.[30][31]
참고 항목
참조
- ^ a b c d e f g Lemke, Thomas (2008). Foye's principles of medicinal chemistry. Philadelphia: Lippincott Williams & Wilkins. pp. 1028–1082. ISBN 978-0-7817-6879-5.
- ^ a b Klein, Lansing M. Prescott, John P. Harley, Donald A. (2005). Microbiology (6. ed.). Boston, Mass.: McGraw-Hill Higher Education. ISBN 978-0-07-111217-8.
- ^ a b c d Singh, Jasjit; Arrieta (January 1999). "New Cephalosporins". Seminars in Pediatric Infectious Diseases. 10 (1): 14–22. doi:10.1016/S1045-1870(99)80005-3.
- ^ a b Goodman & Gilman's The pharmacological basis of therapeutics (12th ed.). New York: McGraw-Hill Medical. 2010-12-20. ISBN 978-0-07-162442-8.
- ^ a b c d e f García-Rodríguez, J.A.; Muñoz Bellido, J.L.; García Sánchez, J.E. (1995). "Oral cephalosporins: current perspectives". International Journal of Antimicrobial Agents. 5 (4): 231–243. doi:10.1016/0924-8579(95)00015-Z. ISSN 0924-8579. PMID 18611674.
- ^ Hamilton-Miller, J.M.T. (1 March 2008). "Development of the semi-synthetic penicillins and cephalosporins". International Journal of Antimicrobial Agents. 31 (3): 189–192. doi:10.1016/j.ijantimicag.2007.11.010. PMID 18248798.
- ^ David Greenwood (21 February 2008). Antimicrobial Drugs: Chronicle of a Twentieth Century Medical Triumph. OUP Oxford. pp. 128–. ISBN 978-0-19-953484-5.
- ^ Hara, Takuji (2003). Innovation in the pharmaceutical industry : the process of drug discovery and development. Cheltenham [u.a.]: Elgar. ISBN 978-1-84376-050-4.
- ^ a b c d e Sader, H (1 December 1992). "Historical overview of the cephalosporin spectrum: Four generations of structural evolution". Antimicrobic Newsletter. 8 (12): 75–82. doi:10.1016/0738-1751(92)90022-3.
- ^ a b c Bohlin, Gunnar Samuelsson, Lars (2009). Drugs of natural origin : a treatise of pharmacognosy (6., rev. ed.). Stockholm: Apotekarsocieteten. ISBN 978-91-976510-5-9.
- ^ Miguet, Laurence; Zervosen, Astrid; Gerards, Thomas; Pasha, Farhan A.; Luxen, André; Distèche-Nguyen, Martine; Thomas, Aline (2009). "Discovery of New Inhibitors of ResistantStreptococcus pneumoniaePenicillin Binding Protein (PBP) 2x by Structure-Based Virtual Screening". Journal of Medicinal Chemistry. 52 (19): 5926–5936. doi:10.1021/jm900625q. ISSN 0022-2623. PMID 19746934.
- ^ King, Frank D., ed. (2002). Medicinal chemistry : principles and practice (2. ed.). Cambridge: Royal Soc. of Chemistry. ISBN 978-0-85404-631-7.
- ^ Malouin, F.; Blais, J.; Chamberland, S.; Hoang, M.; Park, C.; Chan, C.; Mathias, K.; Hakem, S.; Dupree, K.; Liu, E.; Nguyen, T.; Dudley, M. N. (1 February 2003). "RWJ-54428 (MC-02,479), a new cephalosporin with High Affinity for Penicillin-Binding Proteins, Including PBP 2a, and Stability to Staphylococcal Beta-Lactamases". Antimicrobial Agents and Chemotherapy. 47 (2): 658–664. doi:10.1128/Aac.47.2.658-664.2003. PMC 151748. PMID 12543674.
- ^ a b Powell, A. J.; Tomberg, J.; Deacon, A. M.; Nicholas, R. A.; Davies, C. (28 October 2008). "Crystal Structures of Penicillin-binding Protein 2 from Penicillin-susceptible and -resistant Strains of Neisseria gonorrhoeae Reveal an Unexpectedly Subtle Mechanism for Antibiotic Resistance". Journal of Biological Chemistry. 284 (2): 1202–1212. doi:10.1074/jbc.M805761200. PMC 2613624. PMID 18986991.
- ^ Gutmann, L; Williamson, R; Collatz, E (October 1984). "The possible role of porins in bacterial antibiotic resistance". Annals of Internal Medicine. 101 (4): 554–7. doi:10.7326/0003-4819-101-4-554. PMID 6089637.
- ^ Sanders, CC; Sanders WE, Jr (March 1985). "Microbial resistance to newer generation β-lactam antibiotics: clinical and laboratory implications". The Journal of Infectious Diseases. 151 (3): 399–406. doi:10.1093/infdis/151.3.399. PMID 2982957.
- ^ Spratt, Brian G. (10 March 1988). "Hybrid penicillin-binding proteins in penicillin-resistant strains of Neisseria gonorrhoeae". Nature. 332 (6160): 173–176. doi:10.1038/332173a0. PMID 3126399. S2CID 4342621.
- ^ Fontana, R; Grossato, A; Rossi, L; Cheng, YR; Satta, G (November 1985). "Transition from resistance to hypersusceptibility to β-lactam antibiotics associated with loss of a low-affinity penicillin-binding protein in a Streptococcus faecium mutant highly resistant to penicillin". Antimicrobial Agents and Chemotherapy. 28 (5): 678–83. doi:10.1128/aac.28.5.678. PMC 176356. PMID 3853962.
- ^ Hartman, BJ; Tomasz, A (May 1984). "Low-affinity penicillin-binding protein associated with β-lactam resistance in Staphylococcus aureus". Journal of Bacteriology. 158 (2): 513–6. doi:10.1128/jb.158.2.513-516.1984. PMC 215458. PMID 6563036.
- ^ Handwerger, S; Tomasz, A (January 1986). "Alterations in penicillin-binding proteins of clinical and laboratory isolates of pathogenic Streptococcus pneumoniae with low levels of penicillin resistance". The Journal of Infectious Diseases. 153 (1): 83–9. doi:10.1093/infdis/153.1.83. PMID 3941290.
- ^ Bush, K; Jacoby, GA; Medeiros, AA (June 1995). "A functional classification scheme for beta-lactamases and its correlation with molecular structure". Antimicrobial Agents and Chemotherapy. 39 (6): 1211–33. doi:10.1128/AAC.39.6.1211. PMC 162717. PMID 7574506.
- ^ Livermore, DM (October 1995). "beta-Lactamases in laboratory and clinical resistance". Clinical Microbiology Reviews. 8 (4): 557–84. doi:10.1128/CMR.8.4.557. PMC 172876. PMID 8665470.
- ^ Harrison, C. J.; Bratcher, D. (1 August 2008). "Cephalosporins: A Review". Pediatrics in Review. 29 (8): 264–273. doi:10.1542/pir.29-8-264. PMID 18676578.
- ^ Perez-Inestrosa, E; Suau, R; Montañez, MI; Rodriguez, R; Mayorga, C; Torres, MJ; Blanca, M (August 2005). "Cephalosporin chemical reactivity and its immunological implications". Current Opinion in Allergy and Clinical Immunology. 5 (4): 323–30. doi:10.1097/01.all.0000173788.73401.69. PMID 15985814. S2CID 13346333.
- ^ Kalman, D; Barriere, SL (1990). "Review of the pharmacology, pharmacokinetics, and clinical use of cephalosporins". Texas Heart Institute Journal. 17 (3): 203–15. PMC 324918. PMID 15227172.
- ^ FUNGTOMC, J (1 August 1997). "Fourth-generation cephalosporins". Clinical Microbiology Newsletter. 19 (17): 129–136. doi:10.1016/S0196-4399(97)82485-3.
- ^ Chahine, Elias B.; Nornoo, Adwoa O. (1 February 2011). "Ceftobiprole: The First Broad-Spectrum Anti–methicillin-resistant Staphylococcus aureus Beta-Lactam". Journal of Experimental & Clinical Medicine. 3 (1): 9–16. doi:10.1016/j.jecm.2010.12.007.
- ^ Kaushik, Darpan; Rathi, Sudeep; Jain, Ankit (1 May 2011). "Ceftaroline: a comprehensive update". International Journal of Antimicrobial Agents. 37 (5): 389–395. doi:10.1016/j.ijantimicag.2011.01.017. PMID 21420284.
- ^ Theuretzbacher, Ursula (1 October 2011). "Resistance drives antibacterial drug development". Current Opinion in Pharmacology. 11 (5): 433–438. doi:10.1016/j.coph.2011.07.008. PMID 21862408.
- ^ 바실레아 메디컬제품 특성 요약: 주입 용액용 농축액용 제베라 500mg 분말.의약품 및 의료 제품 규제 기관.http://www.mhra.gov.uk/spc
- ^ "Public Assessment Report" (PDF). mhra.gov.uk.