히드록시노르케타민
Hydroxynorketamine | |||
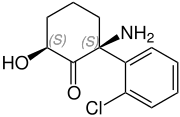 히드록시노르케타민의 가능한 4가지 스테레오이오머 | |||
| |||
| 임상자료 | |||
|---|---|---|---|
| 기타 이름 | HNK; 6-하이드록시노르케타민; 6-HNK | ||
| ATC 코드 |
| ||
| 식별자 | |||
| |||
| CAS 번호 | |||
| 펍켐 CID | |||
| 켐스파이더 | |||
| CompTox 대시보드 (EPA) | |||
| 화학 및 물리적 데이터 | |||
| 공식 | C12H14CLNO2 | ||
| 어금질량 | 239.70 g·190−1 | ||
| 3D 모델(JSmol) | |||
| |||
| |||
히드록시노르케타민(HNK, 6-hydroxynorketamine)은 마취제, 탈부착제, 항우울제 케타민의 소대사물이다.[1] 케타민의 또 다른 대사물인 중간 노르케타민의 히드록시화에 의해 형성된다.[1] 2019년 말 현재 우울증 치료를 위해 (2R,6R)-HNK가 임상시험 중이다.[2]
케타민의 주요 대사물은 노케타민(80%)[3]이다. 노르케타민은 2차적으로 4-, 5-, 6-hydroxynorketamines (15%)로 전환되며, 주로 HNK(6-hydroxynorketamine)로 전환된다.[3] 케타민도 히드록시케타민(5%)[3]으로 변한다. 이와 같이 생체활성화된 HNK는 케타민 1회분의 15% 미만으로 구성된다.[3]
약리학
케타민이나 노르케타민과는 대조적으로 HNK는 마취제, 정신운동제로서 활동성이 없다.[4][5] 이에 따라 NMDA 수용체에 대한 친화력은 매우 약할 뿐이다(각각 (2S,6S)-HNK의 경우 Ki = 21.19μM, 100μM 이상).[6] 그러나 HNK는 α-니코틴ic7 아세틸콜린 수용체(IC50 < 1μM)의 강력하고 선택적인 음의 알로스테리학적 모듈레이터 역할을 하는 것으로 밝혀져 여전히 생물학적 활동을 보이고 있다.[6] Moreover, (2S,6S)-HNK was tested and was found to increase the function of the mammalian target of rapamycin (mTOR), a marker of the antidepressant activity of ketamine, far more potently than ketamine itself (0.05 nM for (2S,6S)-HNK, 10 nM for (S)-norketamine, and 1,000 nM for (S)-ketamine (esketamine), respectively), an action that was observed α-니코틴7 수용체 아세틸콜린 수용체를 억제하는 능력과 밀접한 상관관계를 갖는다.[7][8][9] 이 발견은 케타민의 빠른 항우울제 효과와 그 메커니즘에 대한 이해의 재평가로 이어졌다.[10] 그러나 후속 연구에서는 HNK와 유사한 α-니코틴7 아세틸콜린 수용체의 강력한 선택적 길항제인 디드로노르케타민이 생쥐의 최대 50mg/kg 용량에서 강제 수영 테스트에서 비활성화된다는 사실이 밝혀졌으며, 이는 10mg/kg, 50mg/kg 용량에서 효과가 있는 케타민과 노케타민과는 대조적이다.얄밉게[11]
In May 2016, a study published in the journal Nature determined that HNK, specifically (2S,6S;2R,6R)-HNK, is responsible for the antidepressant-like effects of ketamine in mice; administration of (2R,6R)-HNK demonstrated ketamine-type antidepressant-like effects, and preventing the metabolic conversion of ketamine into HNK blocked the antidepressan모화합물의 t-유사한 효과.[12][13] (2R,6R)-HNK는 케타민과 달리 NMDA 수용체 길항제도 아니고, 해부작용이나 희열효과를 일으키지 않기 때문에 결과적으로 케타민의 항우울제 효과는 사실상 NMDA 수용체를 통해 매개되지 않을 수 있다는 결론이 내려졌다.[12][13] 이는 연구결과가 인간에게 전달된다는 확증이 여전히 필요하므로 잠정적이지만 공개된 인간 데이터는 케타민과 플라즈마(2S,6S;2R,6R)-HNK 수준의 항우울제 반응 사이에 긍정적인 연관성을 보인다는 점이 주목할 만하다.[14][12][13] 케타민의 항우울제 효과는 NMDA 수용체가 책임지지 않는다는 개념에 따라 케타민이 하는 NMDA 수용체에서 동일한 부위와 결합해 차단하는 디조실핀(MK-801)은 항우울제 같은 효과가 없다.[12] 더욱이 이번 연구결과는 메만틴, 라니케민, 트랙소프로딜과 같은 다른 NMDA 수용체 길항제들이 지금까지 인간 임상시험에서 케타민 같은 항우울제 효과를 입증하지 못한 이유를 설명할 수 있을 것이다.[12] NMDA 수용체 봉쇄를 통해 작용하는 대신에 (2R,6R)-HNK는 현재 알려지지 않은/불확실한 메커니즘을 통해 AMPA 수용체 활성화를 증가시킨다.[10][12] 이 화합물은 현재 NIMH의 연구원들이 임상적 사용 가능성을 적극적으로 조사하고 있으며, 대신 HNK를 사용하면 우울증 치료에 케타민 자체를 사용하는 여러 가지 우려(남용, 탈구제 등)를 완화시킬 수 있을 것으로 알려졌다.[12][13]
| 화합물 | IC50(μM) | Ki(μM) | % 억제 100 μM로 |
|---|---|---|---|
| (+-MK-801) | 0.00493 | 0.00348 | 100 |
| (R,S)-케타민 | 0.35 | 0.25 | 91 |
| (R)-노르케타민 | 0.85 | 0.6 | 90 |
| (S)-노르케타민 | 1.23 | 0.87 | 99 |
| (R)-DHNK | 59.7 | 42.1 | 68 |
| (S)-DHNK | 42 | 29.7 | 66 |
| (2R,6R)-HNK | >100 | >100 | 24 |
| (2S,6S)-HNK | 10.4 | 7.34 | 85 |
| (2R,6S)-HNK | >100 | >100 | 8 |
| (2S,6R)-HNK | >100 | >100 | 24 |
| (2R,5R)-HNK | >100 | >100 | 12 |
| (2S,5S)-HNK | >100 | >100 | 27 |
| (2R,5S)-HNK | >100 | >100 | 10 |
| (2S,5R)-HNK | >100 | >100 | 35 |
| (2R,4S)-HNK | >100 | >100 | 23 |
| (2S,4R)-HNK | >100 | >100 | 34 |
| (2R,4R)-HNK | >100 | >100 | 3 |
| (2S,4S)-HNK | >100 | >100 | 11 |
그러나 2017년 6월 연구에서는 (2R,6R)-HNK가 케타민과 유사하게 NMDA 수용체를 사실상 차단한다는 사실이 밝혀졌다.[16][17] 이러한 연구 결과는 (2R,6R)-HNK의 항우울제 유사 효과가 실제로 NMDA 수용체에 독립적이지 않을 수 있으며 케타민과 유사한 방식으로 작용할 수 있음을 시사한다.[16][17]
케타민, (2R,6R)-HNK, (2S,6S)-HNK는 에스트로겐 수용체 ERα(각각50 IC = 2.31, 3.40, 3.53μM)의 리간드가 가능한 것으로 밝혀졌다.[18]
임상발달
(2R,6R)-HNK는 미국 국립정신건강연구소(NIMH)에서 우울증 치료를 위해 개발 중이다.[2] 2019년 말 현재 이 적응증에 대한 임상 1상이다.[2]
참고 항목
참조
- ^ a b Ronald D. Miller; Lars I. Eriksson; Lee A Fleisher; Jeanine P. Wiener-Kronish; William L. Young (24 June 2009). Anesthesia. Elsevier Health Sciences. pp. 743–. ISBN 978-1-4377-2061-7.
- ^ a b c Hashimoto, Kenji (2019). "Rapid‐acting antidepressant ketamine, its metabolites and other candidates: A historical overview and future perspective". Psychiatry and Clinical Neurosciences. 73 (10): 613–627. doi:10.1111/pcn.12902. ISSN 1323-1316. PMC 6851782. PMID 31215725.
- ^ a b c d Mion, Georges; Villevieille, Thierry (2013). "Ketamine Pharmacology: An Update (Pharmacodynamics and Molecular Aspects, Recent Findings)". CNS Neuroscience & Therapeutics. 19 (6): 370–380. doi:10.1111/cns.12099. ISSN 1755-5930. PMC 6493357. PMID 23575437.
- ^ Leung, Louis Y.; Baillie, Thomas A. (1986). "Comparative pharmacology in the rat of ketamine and its two principal metabolites, norketamine and (Z)-6-hydroxynorketamine". Journal of Medicinal Chemistry. 29 (11): 2396–2399. doi:10.1021/jm00161a043. ISSN 0022-2623. PMID 3783598.
- ^ Wainer, Irving W. (2014). "Are basal D-serine plasma levels a predictive biomarker for the rapid antidepressant effects of ketamineand ketamine metabolites?". Psychopharmacology. 231 (20): 4083–4084. doi:10.1007/s00213-014-3736-6. ISSN 0033-3158. PMID 25209678. S2CID 38125308.
- ^ a b Moaddel, Ruin; Abdrakhmanova, Galia; Kozak, Joanna; Jozwiak, Krzysztof; Toll, Lawrence; Jimenez, Lucita; Rosenberg, Avraham; Tran, Thao; Xiao, Yingxian; Zarate, Carlos A.; Wainer, Irving W. (2013). "Sub-anesthetic concentrations of (R,S)-ketamine metabolites inhibit acetylcholine-evoked currents in α7 nicotinic acetylcholine receptors". European Journal of Pharmacology. 698 (1–3): 228–234. doi:10.1016/j.ejphar.2012.11.023. ISSN 0014-2999. PMC 3534778. PMID 23183107.
- ^ Paul, Rajib K.; Singh, Nagendra S.; Khadeer, Mohammed; Moaddel, Ruin; Sanghvi, Mitesh; Green, Carol E.; O’Loughlin, Kathleen; Torjman, Marc C.; Bernier, Michel; Wainer, Irving W. (2014). "(R,S)-Ketamine Metabolites (R,S)-norketamine and (2S,6S)-hydroxynorketamine Increase the Mammalian Target of Rapamycin Function". Anesthesiology. 121 (1): 149–159. doi:10.1097/ALN.0000000000000285. ISSN 0003-3022. PMC 4061505. PMID 24936922.
- ^ van Velzen, Monique; Dahan, Albert (2014). "Ketamine Metabolomics in the Treatment of Major Depression". Anesthesiology. 121 (1): 4–5. doi:10.1097/ALN.0000000000000286. ISSN 0003-3022. PMID 24936919.
- ^ Hymie Anisman (6 May 2015). Stress and Your Health: From Vulnerability to Resilience. John Wiley & Sons. pp. 256–. ISBN 978-1-118-85028-2.
- ^ a b Singh, Nagendra S; Zarate, Carlos A; Moaddel, Ruin; Bernier, Michel; Wainer, Irving W (2014). "What is hydroxynorketamine and what can it bring to neurotherapeutics?". Expert Review of Neurotherapeutics. 14 (11): 1239–1242. doi:10.1586/14737175.2014.971760. ISSN 1473-7175. PMC 5990010. PMID 25331415.
- ^ Sałat K, Siwek A, Starowicz G, Librowski T, Nowak G, Drabik U, Gajdosz R, Popik P (2015). "Antidepressant-like effects of ketamine, norketamine and dehydronorketamine in forced swim test: Role of activity at NMDA receptor". Neuropharmacology. 99: 301–7. doi:10.1016/j.neuropharm.2015.07.037. PMID 26240948. S2CID 19880543.
- ^ a b c d e f g Zanos, Panos; Moaddel, Ruin; Morris, Patrick J.; Georgiou, Polymnia; Fischell, Jonathan; Elmer, Greg I.; Alkondon, Manickavasagom; Yuan, Peixiong; Pribut, Heather J.; Singh, Nagendra S.; Dossou, Katina S. S.; Fang, Yuhong; Huang, Xi-Ping; Mayo, Cheryl L.; Wainer, Irving W.; Albuquerque, Edson X.; Thompson, Scott M.; Thomas, Craig J.; Zarate Jr, Carlos A.; Gould, Todd D. (2016). "NMDAR inhibition-independent antidepressant actions of ketamine metabolites". Nature. 533 (7604): 481–486. Bibcode:2016Natur.533..481Z. doi:10.1038/nature17998. ISSN 0028-0836. PMC 4922311. PMID 27144355.
- ^ a b c d NIH/국립정신보건원. (2016년 5월 4일) 케타민은 신진대사의 부산물을 통해 우울증을 완화시킨다. 팀은 마우스 스터디에서 빠르게 작용하는 비독점 에이전트를 찾는다. 사이언스데일리 2016년 5월 7일 회수
- ^ Collins, Francis (2016-05-10). "Fighting Depression: Ketamine Metabolite May Offer Benefits Without the Risks". Director's Blog. National Institutes of Health. Retrieved 2016-05-14.
- ^ Morris PJ, Moaddel R, Zanos P, Moore CE, Gould T, Zarate CA, Thomas CJ (2017). "Synthesis and N-Methyl-d-aspartate (NMDA) Receptor Activity of Ketamine Metabolites". Org. Lett. 19 (17): 4572–4575. doi:10.1021/acs.orglett.7b02177. PMC 5641405. PMID 28829612.
- ^ a b Suzuki K, Nosyreva E, Hunt KW, Kavalali ET, Monteggia LM (2017). "Effects of a ketamine metabolite on synaptic NMDAR function". Nature. 546 (7659): E1–E3. Bibcode:2017Natur.546E...1S. doi:10.1038/nature22084. PMID 28640258. S2CID 4384957.
- ^ a b Kavalali ET, Monteggia LM (2018). "The Ketamine Metabolite 2R,6R-Hydroxynorketamine Blocks NMDA Receptors and Impacts Downstream Signaling Linked to Antidepressant Effects". Neuropsychopharmacology. 43 (1): 221–222. doi:10.1038/npp.2017.210. PMC 5719113. PMID 29192654.
- ^ Ho MF, Correia C, Ingle JN, Kaddurah-Daouk R, Wang L, Kaufmann SH, Weinshilboum RM (June 2018). "Ketamine and ketamine metabolites as novel estrogen receptor ligands: Induction of cytochrome P450 and AMPA glutamate receptor gene expression". Biochem. Pharmacol. 152: 279–292. doi:10.1016/j.bcp.2018.03.032. PMC 5960634. PMID 29621538.