17α-하이드록시프로게스테론
17α-Hydroxyprogesterone | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 17α-Hydroxypregn-4-ene-3,20-dione | |
| 체계적 IUPAC 이름 (1R,3aS,3bR,9aR,9bS,11aS)-1-Acetyl-1-hydroxy-9a,11a-dimethyl-1,2,3,3a,3b,4,5,8,9,9a,9b,10,11,11a-tetradecahydro-7H-cyclopenta[a]phenanthren-7-one | |
| 기타이름 히드록시프로게스테론()INN | |
| 식별자 | |
3D 모델(Jsmol) | |
| ChEBI | |
| CHEMBL | |
| 켐스파이더 | |
| ECHA 인포카드 | 100.000.636 |
| KEGG | |
펍켐 CID | |
| 유니아이 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C21H30O3 | |
| 어금니 질량 | 330.46g/mol |
| 융점 | 219.5 |
달리 명시된 경우를 제외하고는 표준 상태(25°C [77°F], 100kPa)에 있는 재료에 대한 데이터가 제공됩니다. | |
17α-하이드록시프로게스테론(17α-Hydroxy progesterone, 17-OH progesterone, 17-OH progesterone)[1] 또는 하이드록시프로게스테론(hydroxy progesterone, OHP)[2][3][4]은 프로게스테론과 관련된 내인성 프로게스테론 스테로이드 호르몬입니다. 또한 신경스테로이드뿐만 아니라 안드로겐, 에스트로겐, 글루코코르티코이드, 미네랄로코르티코이드를 포함한 많은 다른 내인성 스테로이드의 생합성에서 화학적 중간생성물입니다.
생물학적 활동
17α-OHP는 프로게스테론과 유사하게 프로게스테론 수용체(PR)의 작용제입니다.[5] 또한, 프로게스테론과 유사하게 후자의 부위에서 매우 낮은 효능(코티솔에 비해 EC50 >100배 적은)을 가지고 있지만, 그것은 mineralocorticoid receptor (MR)[6]의 길항제이자 글루코코르티코이드 수용체 (GR)의 부분 작용제입니다.[5][7][8]
| 컴파운드 | hPR-A | hPR-B | rbPR | rbGR | rbER | |||
|---|---|---|---|---|---|---|---|---|
| 프로게스테론 | 100 | 100 | 100 | <1 | <1 | |||
| 17α-하이드록시프로게스테론 | 1 | 1 | 3 | 1 | <1 | |||
| 히드록시프로게스테론 카프로에이트 | 26 | 30 | 28 | 4 | <1 | |||
| 히드록시프로게스테론 아세테이트 | 38 | 46 | 115 | 3 | ? | |||
| 참고: 값은 백분율(%)입니다. 참조 리간드(100%)는 의 경우 프로게스테론, 의 경우 덱사메타손, 의 경우 에스트라디올이었습니다. 출처: 템플릿 참조. | ||||||||
생화학
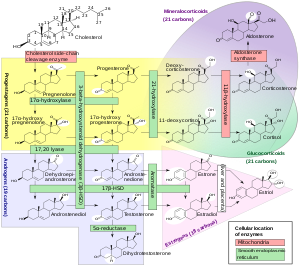
생합성
17α-OHP는 17α-하이드록실라제(CYP17A1에 의해 암호화됨)[citation needed]를 통해 프로게스테론으로부터 유도됩니다.
17α-OHP는 주로 태아의 부신 생성으로 인해 임신 3기에 증가합니다.[citation needed]
이 스테로이드는 주로 부신과 생식선, 특히 난소의 황체에서 어느 정도 생성됩니다. 정상 수치는 소아에서는 3-90ng/dl, 여성에서는 배란 전 20-100ng/dl, 황체기에서는 100-500ng/dl입니다.[9][10]
측정.
17α-OHP의 수치를 측정하면 결함이 있는 전형적인 효소, 즉 21-하이드록실라제 및 11β-하이드록실라제가 17α-OHP의 축적으로 이어지기 때문에 선천성 부신 과형성이 의심되는 환자의 평가에 유용합니다. 대조적으로, 17α-하이드록실라제 결핍증을 가진 희귀한 환자는 17α-OHP의 매우 낮거나 감지할 수 없는 수준을 가질 것입니다. 17α-OHP 수준은 또한 프로게스테론으로서 임신 중 황체의 프로게스테론 활동의 기여를 측정하는 데 사용될 수 있지만, 17α-OHP는 태반에 의해 기여됩니다.[citation needed]
17α-OHP를 임상적으로 결정하기 위해 사용되는 RIA(radioimmuno assay) 또는 IRMA(immunoradiometric assay)와 같은 면역 분석은 17α-OHP 스테로이드 전구체 및 이의 황화 결합체와 교차 반응하기 쉽습니다. 기체 또는 액체 크로마토그래피 및 질량 분석(예: LC-MS/MS)은 면역 분석보다 더 큰 특이성을 달성합니다.[11][12]
LC-MS/MS에 의한 17α-OHP의 측정은 21-하이드록실라제 결핍으로 인한 신생아의 선천성 부신 비대증에 대한 스크리닝을 개선합니다. 왜냐하면 17α-OHP 스테로이드 전구체 및 그들의 황화 결합체는 출생 후 첫 2일 동안 존재하고 조산아에서 더 오래 존재하고 17α-OHP와 면역분석에서 교차 반응하기 때문입니다. 거짓으로 높은 17α-OHP 수치를 제공합니다.[11][12]
약리학
약동학
17α-OHP는 약물로 사용되지 않았지만 약동학이 연구되고 검토되었습니다.[13]
의료용
히드록시프로게스테론 카프로에이트 및 훨씬 덜하지만 히드록시프로게스테론 아세테이트 및 히드록시프로게스테론 헵타노에이트와 같은 17α-OHP의 에스테르는 프로게스틴으로서 의학에 사용되었습니다.[2][3][4] "하이드록시프로게스테론"이 의학적 사용의 관점에서 언급될 때, 일반적으로 언급되는 것은 실제로, 일반적으로 하이드록시프로게스테론 카프로에이트입니다.[citation needed]
화학
17α-OHP(17α-hydroxypregn-4-ene-3,20-dione)는 17α-hydroxypregn-4-ene-3,20-dione라고도 알려져 있으며, 자연적으로 발생하는 임신성 스테로이드입니다. C3 및 C20 위치의 케톤기, C17α 위치의 하이드록실기, C4 및 C5 위치 사이의 이중 결합을 특징으로 합니다.[citation needed]
17α-OHP는 17α-하이드록시프로게스테론 유도체로 지칭되는 프로게스틴류의 모체 화합물입니다.[14][15][16] 그 중에서도 클로르마디논 아세테이트, 사이프로테론 아세테이트, 하이드록시프로게스테론 카프로에이트, 메드록시프로게스테론 아세테이트, 메스트롤 아세테이트 등이 있습니다.[14][15][16]
사회와 문화
총칭
하이드록시프로게스테론은 17α-OHP와 그의 총칭입니다.[2][3][4]
참고 항목
- 11α-하이드록시프로게스테론
- 5α-디하이드로프로게스테론
- 20-디하이드로프로게스테론
- 11-데옥시코르티코스테론
- 11-데옥시코르티솔
- 17α-메틸프로게스테론
- 19-노르프로게스테론
- 19-노테스토스테론
참고문헌
- ^ "17-hydroxyprogesterone (17OHP)".
- ^ a b c J. Elks (14 November 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. pp. 664–665. ISBN 978-1-4757-2085-3.
- ^ a b c I.K. Morton; Judith M. Hall (6 December 2012). Concise Dictionary of Pharmacological Agents: Properties and Synonyms. Springer Science & Business Media. pp. 146–. ISBN 978-94-011-4439-1.
- ^ a b c Index Nominum 2000: International Drug Directory. Taylor & Francis. January 2000. pp. 532–. ISBN 978-3-88763-075-1.
- ^ a b Attardi BJ, Zeleznik A, Simhan H, Chiao JP, Mattison DR, Caritis SN (2007). "Comparison of progesterone and glucocorticoid receptor binding and stimulation of gene expression by progesterone, 17-alpha hydroxyprogesterone caproate, and related progestins". Am. J. Obstet. Gynecol. 197 (6): 599.e1–7. doi:10.1016/j.ajog.2007.05.024. PMC 2278032. PMID 18060946.
- ^ Mooij CF, Parajes S, Pijnenburg-Kleizen KJ, Arlt W, Krone N, Claahsen-van der Grinten HL (April 2015). "Influence of 17-Hydroxyprogesterone, Progesterone and Sex Steroids on Mineralocorticoid Receptor Transactivation in Congenital Adrenal Hyperplasia" (PDF). Horm Res Paediatr. 83 (6): 414–421. doi:10.1159/000374112. PMID 25896481. S2CID 24727940.
- ^ Pijnenburg-Kleizen KJ, Engels M, Mooij CF, Griffin A, Krone N, Span PN, van Herwaarden AE, Sweep FC, Claahsen-van der Grinten HL (2015). "Adrenal Steroid Metabolites Accumulating in Congenital Adrenal Hyperplasia lead to Transactivation of the Glucocorticoid Receptor". Endocrinology. 156 (10): 3504–3510. doi:10.1210/en.2015-1087. PMID 26207344.
- ^ Sun, Kang; Lei, Kaiyu; Chen, Li; Georgiou, Ektoras X.; Sooranna, Suren R.; Khanjani, Shirin; Brosens, Jan J.; Bennett, Phillip R.; Johnson, Mark R. (2012). "Progesterone Acts via the Nuclear Glucocorticoid Receptor to Suppress IL-1β-Induced COX-2 Expression in Human Term Myometrial Cells". PLOS ONE. 7 (11): e50167. Bibcode:2012PLoSO...750167L. doi:10.1371/journal.pone.0050167. ISSN 1932-6203. PMC 3509141. PMID 23209664.
- ^ 임신 중 기준값
- ^ "normal ranges for hormone tests in women". Archived from the original on 2020-11-08. Retrieved 2011-08-07.
- ^ a b de Hora MR, Heather NL, Patel T, Bresnahan LG, Webster D, Hofman PL (March 2020). "Measurement of 17-Hydroxyprogesterone by LCMSMS Improves Newborn Screening for CAH Due to 21-Hydroxylase Deficiency in New Zealand". International Journal of Neonatal Screening. 6 (1): 6. doi:10.3390/ijns6010006. PMC 7422986. PMID 33073005.
- ^ a b Bialk ER, Lasarev MR, Held PK (September 2019). "Wisconsin's Screening Algorithm for the Identification of Newborns with Congenital Adrenal Hyperplasia". International Journal of Neonatal Screening. 5 (3): 33. doi:10.3390/ijns5030033. PMC 7510207. PMID 33072992.
- ^ Die Gestagene. Springer-Verlag. 27 November 2013. pp. 276–277. ISBN 978-3-642-99941-3.
- ^ a b Jeffrey K. Aronson (21 February 2009). Meyler's Side Effects of Endocrine and Metabolic Drugs. Elsevier. pp. 289–. ISBN 978-0-08-093292-7.
- ^ a b Robert Alan Prentky; Ann Wolbert Burgess (31 July 2000). Forensic Management of Sexual Offenders. Springer Science & Business Media. pp. 219–. ISBN 978-0-306-46278-8.
- ^ a b H. J. Smith; Hywel Williams (1 January 1983). Introduction to the Principles of Drug Design. Elsevier. pp. 187–. ISBN 978-1-4831-8350-3.

