라듐
Radium | |||||||||||||||||||||||||||||||
| 라듐 | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 발음 | /ˈreɪdiəm/ | ||||||||||||||||||||||||||||||
| 외관 | 은백색의 금속성. | ||||||||||||||||||||||||||||||
| 질량수 | [226] | ||||||||||||||||||||||||||||||
| 주기율표의 라듐 | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| 원자번호 (Z) | 88 | ||||||||||||||||||||||||||||||
| 그룹 | 그룹 2(지중금속) | ||||||||||||||||||||||||||||||
| 기간 | 7주기 | ||||||||||||||||||||||||||||||
| 블록 | s-블록 | ||||||||||||||||||||||||||||||
| 전자 구성 | [Rn] 7초2 | ||||||||||||||||||||||||||||||
| 셸당 전자 | 2, 8, 18, 32, 18, 8, 2 | ||||||||||||||||||||||||||||||
| 물리적 성질 | |||||||||||||||||||||||||||||||
| 위상 STP서 | 실체가 있는 | ||||||||||||||||||||||||||||||
| 녹는점 | 973K(700°C, 1292°F) (분산) | ||||||||||||||||||||||||||||||
| 비등점 | 2010 K(1737 °C, 3159 °F) | ||||||||||||||||||||||||||||||
| 밀도 (근처 ) | 5.5g/cm3 | ||||||||||||||||||||||||||||||
| 융해열 | 8.5 kJ/mol | ||||||||||||||||||||||||||||||
| 기화열 | 113 kJ/mol | ||||||||||||||||||||||||||||||
증기압
| |||||||||||||||||||||||||||||||
| 원자성 | |||||||||||||||||||||||||||||||
| 산화 상태 | +2(강력한 기초 산화물 포함) | ||||||||||||||||||||||||||||||
| 전기성 | 폴링 척도: 0.9 | ||||||||||||||||||||||||||||||
| 이온화 에너지 |
| ||||||||||||||||||||||||||||||
| 공동 반지름 | 221±2pm | ||||||||||||||||||||||||||||||
| 반데르발스 반지름 | 오후 283시 | ||||||||||||||||||||||||||||||
| 라듐의 스펙트럼 라인 | |||||||||||||||||||||||||||||||
| 기타 속성 | |||||||||||||||||||||||||||||||
| 자연발생 | 쇠퇴하여 | ||||||||||||||||||||||||||||||
| 결정구조 | 신체 중심 입방체(BCc) | ||||||||||||||||||||||||||||||
| 열전도도 | 18.6 W/(m³K) | ||||||||||||||||||||||||||||||
| 전기저항도 | 1µΩ⋅m(20°C) | ||||||||||||||||||||||||||||||
| 자기순서 | 비자기성의 | ||||||||||||||||||||||||||||||
| CAS 번호 | 7440-14-4 | ||||||||||||||||||||||||||||||
| 역사 | |||||||||||||||||||||||||||||||
| 디스커버리 | 피에르와 마리 퀴리 (1898) | ||||||||||||||||||||||||||||||
| 제1격리듬 | 마리 퀴리(1910) | ||||||||||||||||||||||||||||||
| 라듐 주 동위 원소 | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
라듐은 라 기호와 원자 번호 88을 가진 화학 원소다.주기율표 2군에서 여섯 번째 원소로 알칼리성 토금속이라고도 한다.순수 라듐은 은백색이지만 공기 노출 시 질소(산소보다 질소)와 쉽게 반응해 질화 라듐(RaN32)의 검은 표면층을 형성한다.라듐의 모든 동위원소는 방사능이 매우 높으며, 가장 안정된 동위원소는 라듐-226으로 반감기가 1600년이고 라돈 가스로 분해된다(특히 라돈-222 동위원소).라듐이 분해되면 전리방사선이 부산물로 형광물질을 자극해 방사광 발광을 유발할 수 있다.
라듐은 염화 라듐 형태로 1898년 마리와 피에르 퀴리에 의해 야치모프에서 채굴된 광석에서 발견되었다.그들은 천왕성에서 라듐 화합물을 추출했고 5일 후 프랑스 과학 아카데미에서 이 발견을 발표했다.라듐은 1911년 마리 퀴리와 안드레 루이스 데비에른에 의해 염화 라듐 전기분해를 통해 금속 상태로 고립되었다.[1]
자연에서 라듐은 우라늄에서 발견되고 토륨 광석은 천왕나이트 1톤당 7분의 1그램 정도로 미량이다.라듐은 살아있는 유기체에는 필요하지 않으며, 방사능과 화학 반응성 때문에 생화학 공정으로 편입되면 건강에 악영향을 미칠 가능성이 높다.현재, 라듐은 핵의학에서 사용하는 것 외에 상업적 용도가 없다; 이전에는 방사능 발광 장치의 방사능 공급원으로 사용되었고, 또한 치료력이 있다고 여겨지는 방사능 돌팔이에도 사용되었다.오늘날, 라듐의 독성이 알려졌기 때문에 이러한 이전의 애플리케이션들은 더 이상 유행하지 않고 있으며, 방사선 발광 장치에 대신 덜 위험한 동위원소가 사용된다.
대량 속성
라듐은 가장 무겁다고 알려진 알칼리성 흙 금속으로 그 그룹의 유일한 방사성 물질이다.그것의 물리적, 화학적 특성은 그것의 가벼운 원추형 바륨과 가장 흡사하다.[2]
순수한 라듐은 휘발성 은백색의 금속으로, 비록 그것의 가벼운 착향료인 칼슘, 스트론튬, 바륨은 약간의 노란 색조를 가지고 있다.[2]이 틴트는 공기에 노출되면 빠르게 사라지며, 질화 라듐(RaN32)을 검은 층으로 만든다.[3]용해점은 700 °C(1,292 °F) 또는 960 °C(1,760 °F)[a]이며 비등점은 1,737 °C(3,159 °F)이다.이 두 값 모두 바륨 값보다 약간 낮아 그룹 2 원소의 주기적인 추세를 확인하게 된다.[4]바륨과 알칼리 금속과 마찬가지로 라듐은 표준 온도와 압력에서 체중 중심의 입방 구조로 결정되는데 라듐-라듐 결합 거리는 514.8피코미터다.[5]라듐은 5.5 g/cm의3 밀도로 바륨보다 높으며, 다시 주기적인 추세를 확인시켜 준다; 라듐-바륨 밀도 비는 두 원소의 유사한 결정 구조로 인해 라듐-바륨 원자 질량 비율에 필적한다.[6][6][7]
동위 원소
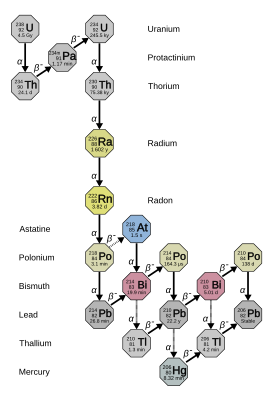
라듐은 33개의 알려진 동위원소를 가지고 있으며, 질량 번호는 202부터 234까지이며, 모두 방사성 물질이다.[8]이 중 4개 – Ra (반감기 11.4일), Ra (3.64일), Ra (1600년), Ra (5.75년) – 원초기 토륨-232, 우라늄-235, 우라늄-238 (Ra-235, 우라늄-238, 나머지 2개)의 붕괴 사슬에서 자연적으로 발생한다.223그럼에도 불구하고 이러한 동위원소는 원시 방사성핵종이 되기에는 너무 짧은 반감기를 가지고 있으며 이러한 붕괴 사슬에서만 자연에 존재한다.[9]Np의 미세한 흔적들의 붕괴 산물로만 자연에서 발생하는 대부분 인공 Ra(15d)와 함께 이들은 라듐의 5가지 가장 안정적인 동위 원소다.[10][11]다른 알려진 라듐 동위원소는 모두 2시간 미만의 리브가 있고, 대다수가 1분 미만의 리브가 있다.[8]적어도 12개의 핵 이소머가 보고되었다. 그 중 가장 안정된 것은 라듐-205m이고, 반감기는 130에서 230밀리초 사이인데, 이것은 24개의 지상 라듐 동위원소보다 여전히 짧다.[8]
방사능 연구의 초기 역사에서 라듐의 서로 다른 천연 동위원소에는 다른 이름이 붙여졌다.이 계획에서 라는 액티늄 X(AcX), 라토륨 X(ThX), 라 라듐(Ra), 라 메소토륨 1(MsTh1)으로 명명되었다.[9]이 모든 것이 같은 원소의 동위원소라는 것을 깨달았을 때, 이 이름들 중 다수가 쓰이지 않게 되었고, '라듐'은 라만이 아닌 모든 동위원소를 가리키게 되었다.라듐-226의 부패 제품 중 일부는 라듐 A에서 라듐 G에 이르는 "라듐"을 포함한 역사적 이름을 받았으며, 이 문자는 그들이 부모인 Ra로부터 사슬 아래로 대략 얼마나 떨어져 있었는지를 나타낸다.라듐 방출 = Rn, RaA = Po, RaB = Pb, RaC = Bi, RaC1 = Po, RaC2 = Tl, RaD = Pb, RaE = Bi, RaF = Po, RaG = Pb.[11][12]
226Ra는 라듐의 가장 안정적인 동위원소로서 우라늄-238의 붕괴 체인(4n + 2)의 마지막 동위원소로, 반감기가 1천년 이상인 것으로, 거의 모든 천연 라듐을 구성하고 있다.그것의 즉각적인 붕괴 산물은 고밀도 방사능 고귀한 가스 라돈(특히 동위원소 Rn)으로, 환경 라듐의 위험의 상당 부분을 담당한다.[13]반감기가 비례적으로 짧아 같은 어금니 양의 천연우라늄(대부분 우라늄-238)보다 270만 배나 많은 방사성 물질이다.[14][15]
라듐 금속의 표본은 그것이 방출하는 방사선, 즉 알파 입자, 베타 입자, 감마선 때문에 주변보다 높은 온도에서 자신을 유지한다.구체적으로는 천연 라듐(대부분 Ra)이 알파 입자를 방출하지만, 붕괴 사슬의 다른 단계(우라늄 또는 라듐 시리즈)에서는 알파나 베타 입자를 방출하고, 거의 모든 입자 방출은 감마선을 동반한다.[16]
2013년 CERN에서 라듐-224의 핵이 쿨롱 흥분이라는 기술을 이용해 배 모양이라는 사실이 밝혀졌다.이것은 비대칭 핵의 첫 발견이었다.[17]이것은 어떤 무겁고 불안정한 원자핵이 왜곡된 핵, 이 경우 배 모양이라는 강력한 정황증거다.[18]
화학
라듐은 바륨과 마찬가지로 반응성이 높은 금속으로 항상 +2의 그룹 산화 상태를 나타낸다.[3]수용액에서 무색의 라2+ 양이온을 형성하는데, 이는 매우 기초적이며 쉽게 콤플렉스를 형성하지 않는다.[3]대부분의 라듐 화합물은 따라서 단순한 이온 화합물이지만,[3] 상대론적 효과로 인해 6s와 6p 전자(발랑 7s 전자에 더하여)의 참여가 기대되며, RaF와2 RaAt와2 같은 라듐 화합물의 공밸런트 특성을 강화시킬 것이다.[19]이 때문에 반반작용 Ra2+ (aq) + 2e− → Ra (s)의 표준 전극 전위는 -2.916V로 바륨의 값 -2.92V보다 약간 낮지만, 이전에는 그룹 내(Ca: -2.84V; Sr: -2.89V; Ba:2.92V) 값이 부드럽게 증가했었다.[20]바륨과 라듐의 값은 더 무거운 알칼리 금속 칼륨, 루비듐, 세슘의 값과 거의 정확히 같다.[20]
화합물
고체 라듐 화합물은 라듐 이온이 특정한 색을 제공하지 않기 때문에 흰색을 띠지만, 라듐의 알파 붕괴로 인한 자기방사성분해로 인해 점차 노란색을 띠다가 시간이 지남에 따라 어두워진다.[3]불용성 라듐 화합물은 모든 바륨, 대부분의 스트론튬, 그리고 대부분의 납 화합물과 함께 코레시피테이트한다.[21]
산화물(Radium oxide, RaO)은 다른 알칼리성 접지 금속의 공통 화합물임에도 불구하고 그 존재를 훨씬 지나도록 특성화되지 않았다.라듐 수산화물(Ra(OH))2은 알칼리성 접지 수산화물 중에서 가장 쉽게 용해되며 바륨 콘제너인 바륨 수산화물보다 강한 베이스다.[22]또한 액티늄 수산화물과 토륨 수산화물보다 용해성이 더 높다. 이 세 가지 인접한 수산화물은 암모니아로 침전시켜 분리할 수 있다.[22]
염화 라듐(RaCl2)은 무색의 발광 화합물이다.해독할 때 라듐으로 방출되는 알파 방사선에 의한 자기 손상으로 얼마 후 노란색이 된다.소량의 바륨 불순물이 화합물에 장미색을 부여한다.[22]염화바륨보다는 덜하지만 물에 용해되며 염산 농도가 높아지면서 용해도가 감소한다.수용액에서 결정하여 수산화물이 RaCl2/2가 된다.HO2, 바륨 아날로그와 이형성.[22]
라듐브로마이드(Radium2 Bromide, RaBr)도 무색의 발광 화합물이다.[22]물속에서는 염화 라듐보다 용해성이 높다.염화 라듐과 마찬가지로 수용액에서 결정화하면 이수소 RaBr2·2가 나온다.HO2, 바륨 아날로그와 이형성.브롬화 라듐이 내뿜는 이온화 방사선은 공기 중의 질소 분자를 흥분시켜 빛을 발하게 한다.라듐이 방출하는 알파 입자는 순식간에 두 개의 전자를 얻어 중립 헬륨이 되고, 이 헬륨은 내부에 축적되어 브롬화 라듐 결정체를 약화시킨다.이 효과는 때때로 결정들이 깨지거나 심지어 폭발하게 한다.[22]
질산 라듐(Radium nitrate, Ra(NO3))2은 질산에 탄산 라듐을 녹여 만들 수 있는 흰색 화합물이다.질산 농도가 높아짐에 따라 질산 라듐의 용해도가 감소하는데, 이는 라듐의 화학적 정화에 중요한 특성이다.[22]
라듐은 그것의 가벼운 착향료 바륨과 거의 동일한 불용성 염분을 형성한다: 그것은 불용성 황산염(RaaS4, 가장 불용성인 것으로 알려진 RaCrO4), 탄산염(RaCO), 요오드산염(Ra3(IO3),2 테트라플루오로베렐레이트(RaBeF4), 질산염(NO3)2을 형성한다.탄산염을 제외하고, 이 모든 것들은 상응하는 바륨염보다 물에 덜 녹지만, 바륨에 대해서는 모두 등구조적이다.또한 라듐 인산염, 옥살산염, 황산염도 해당 불용성 바륨염과 함께 흡수되기 때문에 아마도 불용성일 것이다.[23]황산 라듐의 불용성(20°C에서 물 1kg에서 2.1mg만 용해된다)은 생물학적으로 덜 위험한 라듐 화합물 중 하나임을 의미한다.[24]라2+(148pm)의 큰 이온반경은 높은 pH가 아닐 때 수성용액에서 라듐을 약하게 복잡하게 만들고 추출하지 못하게 한다.[25]
발생
라듐의 모든 동위원소는 지구의 나이보다 훨씬 짧은 반감기를 가지고 있기 때문에 어떤 원시적인 라듐도 오래 전에 부패했을 것이다.라듐은 동위 원소인 라, 라, 라, 라가 천연 토륨과 우라늄 동위 원소의 부패 사슬의 일부분이기 때문에 여전히 환경에서 발생한다. 토륨과 우라늄은 반감기가 매우 길기 때문에, 이 딸들은 계속해서 부패에 의해 재생되고 있다.[9]이 4개 동위원소 중 수명이 가장 긴 것은 천연 우라늄의 부패 산물인 라(반감기 1600년)이다.상대적인 장수 때문에, Ra는 원소의 가장 흔한 동위원소로서, 지구 표면의 약 1조분의 1을 차지한다; 본질적으로 모든 천연 라듐은 Ra이다.[26]그러므로 라듐은 우라늄 광석 천왕성과 다양한 다른 우라늄 광물에서 소량으로 발견되며 토륨 광물에서는 더 작은 양으로도 발견된다.피치블렌드 1톤은 일반적으로 라듐 1g의 7분의 1가량을 생산한다.[27]지구 지각의 1킬로그램은 약 900개의 피코그램의 라듐을 함유하고 있으며, 1리터의 바닷물은 약 89 펨토그램의 라듐을 함유하고 있다.[28]
역사
라듐은 1898년 12월 21일 마리 스케도프스카 퀴리와 그녀의 남편 피에르 퀴리에에 의해 야치모프로부터 천왕성 무한(피치블렌드) 샘플로 발견되었다.[29]앞서 이 광물을 연구하던 중 퀴리족은 우라늄을 제거했고 남은 물질이 여전히 방사능에 노출돼 있다는 사실을 발견했다.1898년 7월, 피치블렌드를 연구하던 중, 그들은 비스무트와 비슷한 원소를 분리했는데, 그것은 폴로늄으로 판명되었다.그리고 나서 그들은 두 가지 성분으로 구성된 방사능 혼합물을 분리했다: 눈부신 녹색 불꽃 색깔을 주는 바륨의 화합물과 전에는 기록되지 않았던 카르미네 스펙트럼 라인을 주는 알려지지 않은 방사능 화합물들.퀴리 부부는 방사능 화합물이 용해성이 낮다는 점을 제외하고는 바륨 화합물과 매우 유사하다는 것을 발견했다.이 발견으로 퀴리족은 방사성 화합물을 분리하고 그 안에서 새로운 원소를 발견하는 것이 가능해졌다.퀴리 부부는 1898년 12월 26일 프랑스 과학 아카데미에 그들의 발견을 발표했다.[30][31]라듐의 명칭은 약 1899년으로, 반지름(레이)에서 현대 라틴어로 형성된 프랑스어 라듐(Radium)에서 유래한다. 이는 라듐이 광선의 형태로 에너지를 방출하는 힘을 인정하기 위한 것이었다.[32][33][34]
1910년 9월 마리 퀴리와 안드레 루이스 데비에른은 수은 음극을 이용한 순수 염화 라듐(RaCl2) 용액의 전기분해를 통해 라듐을 순수 금속으로서 격리시켜 라듐-머큐리 아말감을 생산했다고 발표했다.[35]이 아말감은 수소가스 대기에서 가열되어 수은을 제거하여 순수한 라듐 금속을 남겼다.[36]같은 해 말 E. E. Eoler는 아지드인 Ra(N3)의 열분해로 라듐을 분리했다.2[9]라듐메탈은 20세기 초 벨기에 올렌 공장에서 유니온 미니에르 뒤 하우트 카탕가(UMHK)의 자회사 비라코가 산업적으로 처음 생산한 것이다.[37]
방사능에 대한 일반적인 역사적 단위인 퀴리는 라의 방사능을 기초로 하고, 라듐 1g이 방출하는 방사능의 양은 퀴리 1개에 해당한다.[38]
과거 응용 프로그램
발광 도료
라듐은 과거 시계, 핵패널, 항공기 스위치, 시계, 계기 다이얼 등에 사용되는 자체 발광 페인트에 사용되었다.라듐 페인트를 사용하는 대표적인 자가용 시계는 약 1마이크로그램의 라듐을 함유하고 있다.[39]1920년대 중반, 시계와 시계의 다이얼에 라듐 기반의 야광 페인트를 칠한 다이얼 화가인 "라듐 걸스" 5명이 미국 라듐공사를 상대로 소송을 제기했다.다이얼 화가는 붓을 핥아 미세한 포인트를 주도록 지시받아 라듐을 섭취했다.[40]라듐에 대한 그들의 노출은 심각한 건강 영향을 야기시켰는데, 여기에는 상처, 빈혈, 그리고 뼈 암이 포함된다.몸이 라듐을 칼슘으로 취급해 뼈에 침전시켜 방사능이 골수를 저하시키고 골수 세포를 변이시킬 수 있기 때문이다.[13]
소송 과정에서 회사의 과학자와 경영진이 방사능의 영향으로부터 자신을 보호하기 위해 상당한 예방조치를 취했다고 판단했지만 직원들을 보호하는 것 같지는 않았다.게다가, 몇 년 동안 그 회사들은 라듐 걸스가 대신 매독에 걸렸다고 주장함으로써 그 효과를 은폐하고 책임을 회피하려고 시도했다.직원 복지를 완전히 무시한 것은 직업병 노동법 제정에 큰 영향을 미쳤다.[41]
소송 결과 방사능의 부작용이 널리 알려졌고, 라듐 다이얼 화가에게 적절한 안전 예방 조치를 지시하고 보호 장비를 제공했다.특히 다이얼 화가는 더 이상 페인트 붓을 핥아 모양을 만들어 내지 않는다(그 때문에 라듐 염분이 다소 섭취되었다).라듐은 1960년대까지만 해도 다이얼에 사용되었지만, 다이얼 화가에게 더 이상의 부상은 없었다.이는 라듐걸스에 대한 해악을 쉽게 피할 수 있었다는 점을 부각시켰다.[42]
1960년대부터 라듐 페인트의 사용이 중단되었다.많은 경우, 빛에 의해 흥분되는 비방사성 형광 물질로 발광 다이얼을 구현했다; 그러한 장치는 빛에 노출된 후 어둠 속에서 빛나지만 빛은 희미해진다.[13]어둠 속에서 오래 지속되는 자기 진도가 요구되는 경우, 더 안전한 방사능 프로메튬-147(반감기 2.6년) 또는 삼중수소(반감기 12년) 페인트가 사용되었고, 두 가지 모두 오늘날에도 계속 사용되고 있다.[43]이것들은 라듐과 달리 시간이 지남에 따라 인광을 분해하지 않는다는 부가적인 이점을 가지고 있었다.[44]삼중수소는 라듐의 침투 감마선보다는 [45]피부를 관통할 수 없는 매우 낮은 에너지 베타 방사선(프로메튬이 방출하는 베타 방사선보다 더 낮은 에너지)[8]을 방출하며, 더 안전한 것으로 간주된다.[46]
20세기 전반의 시계, 시계, 그리고 계기들은 종종 군사용으로 사용되었을 때 방사능 빛 페인트로 칠해졌을지도 모른다.그것들은 보통 더 이상 빛을 발하지 않지만, 이것은 라듐의 방사능 붕괴(반감기가 1600년) 때문이 아니라 라듐으로부터의 방사선에 의해 닳아 없어지는 황화 아연 형광 매체의 형광 때문이다.[47]이 시기부터 장치에 자주 두꺼운 녹색 또는 노란색 갈색 페인트 층이 나타나는 것은 방사능 위험을 암시한다.온전한 장치의 방사선량은 상대적으로 낮고 일반적으로 급성 위험은 아니지만, 페인트를 방출하고 흡입하거나 섭취하면 위험하다.[48][49]
상업용
라듐은 한때 치약, 헤어크림, 심지어 음식물의 치료력 때문에 첨가제였다.[50]그러한 제품들은 곧 유행에서 벗어나서 많은 나라의 당국에 의해 건강에 심각한 악영향을 미칠 수 있다는 사실이 밝혀진 후 금지되었다.(예를 들어 라디토르 또는 레비게이터 유형의 "라듐 워터" 또는 "표준 라듐 솔루션"을 참조하십시오.)[47]라듐이 풍부한 물을 특징으로 하는 스파는 일본 돗토리 미사사의 스파처럼 여전히 때때로 유익하다고 선전되고 있다.미국에서도 1940년대 후반부터 1970년대 초반까지 중이어 문제나 편도선 확대를 막기 위해 어린이들에게 코방사선 조사를 실시하였다.[51]
의료용
라듐(보통 염화 라듐 또는 브롬화 라듐 형태의)은 라돈 가스를 생산하기 위해 약에 사용되었고, 이는 암 치료제로 사용되었으며, 예를 들어 1920년대와 1930년대에 캐나다에서 이러한 라돈 공급원 중 몇 개가 사용되었다.[48][52]그러나 1900년대 초반에 사용되었던 많은 치료법은 브롬화 라듐 노출로 인한 유해성 때문에 더 이상 사용되지 않는다.이러한 효과의 몇 가지 예로는 빈혈, 암, 그리고 유전적 돌연변이가 있다.[53]비용이 적게 들고 더 많은 양을 사용할 수 있는 Co와 같은 안전한 감마 방출기는 이 애플리케이션에서 라듐의 과거 사용을 대체하기 위해 일반적으로 오늘날 사용된다.[25]
1900년대 초 생물학자들은 돌연변이를 유도하고 유전학을 연구하기 위해 라듐을 사용했다.1904년 대니얼 맥두걸은 라듐이 갑자기 큰 돌연변이를 일으키고 큰 진화적 변화를 일으킬 수 있는지를 판단하기 위해 라듐을 사용했다.토마스 헌트 모건은 라듐을 사용해 변화를 유도하여 흰 눈의 과일 파리를 일으켰다.노벨상 수상자인 생물학자 헤르만 뮬러는 라듐이 과일파리 돌연변이에 미치는 영향을 간략히 연구한 뒤 보다 저렴한 엑스레이 실험으로 눈을 돌렸다.[54]
존스 홉킨스 병원의 창립의사 중 한 명인 하워드 앳우드 켈리는 암을 치료하기 위해 라듐을 사용하는 의학의 주요한 선구자였다.[55]그의 첫 환자는 1904년 자신의 이모였는데, 수술 직후 사망했다.[56]켈리는 각종 암과 종양을 치료하기 위해 라듐을 과다하게 사용한 것으로 알려졌다.그 결과 그의 환자들 중 일부는 라듐 노출로 사망했다.[57]라듐을 도포하는 그의 방법은 라듐 캡슐을 환부 근처에 삽입한 다음 라듐 "점"을 종양에 직접 봉합하는 것이었다.[57]이것은 원래 헬라 세포의 숙주인 헨리에타 랙스를 자궁경부암으로 치료할 때와 같은 방법이었다.[58]현재, 대신 더 안전하고 이용 가능한 방사성 동위원소가 사용된다.[13]
생산

우라늄은 19세기 후반에 대규모의 적용이 없었으며 따라서 대규모 우라늄 광산이 존재하지 않았다.초기에 우라늄 광석의 큰 공급원은 오스트리아-헝가리(현 체코 공화국)의 야치모프에 있는 은광산뿐이었다.[29]우라늄 광석은 채굴 활동의 부산물일 뿐이었다.[59]
라듐의 첫 추출에서 퀴리는 피치블렌드에서 우라늄을 추출한 후 잔류물을 사용했다.우라늄은 황산에 용해되어 황산 라듐을 남김으로써 추출되었는데, 이는 황산 바륨과 비슷하지만 잔류물에서 용해성은 더욱 떨어진다.또한 잔류물에는 상당히 많은 양의 황산바륨이 포함되어 있어 황산 라듐의 매개체 역할을 했다.라듐 추출 공정의 첫 단계는 수산화나트륨으로 끓인 후 염산 처리하여 다른 화합물의 불순물을 최소화하는 것이었다.그 후 남은 잔여물은 탄산나트륨으로 처리하여 황산바륨을 탄산바륨으로 변환(라듐을 운반)하여 염산에 용해되게 하였다.용해 후 바륨과 라듐은 황산염으로 다시 회수되었다. 그리고 이것은 황산 혼합물을 더욱 정화시키기 위해 반복되었다.불용성 황화물을 형성하는 일부 불순물은 염화물 용액을 황화수소로 처리한 후 여과하여 제거하였다.황산 혼합물이 충분히 순수하면, 한 번 더 혼합염소화물로 변환되었다; 바륨과 라듐은 분광기(녹색 바륨 선과 대조적으로 특징적인 붉은 선을 나타냄)와 전기 스코프를 사용하여 진행 과정을 관찰하면서 분절 결정화에 의해 분리되었다.[60]
마리와 피에르 퀴리가 야치모프로부터 우라늄 광석으로부터 라듐을 분리시킨 후, 몇몇 과학자들은 라듐을 소량 분리하기 시작했다.이후 중소기업들은 자치모프 광산에서 광산 꼬리표를 구입해 라듐을 분리하기 시작했다.1904년 오스트리아 정부는 광산을 국유화하고 원광의 수출을 중단했다.라듐 생산이 증가한 1912년까지 라듐 가용성은 낮았다.[59]
오스트리아 독점의 형성과 다른 나라들의 라듐에 대한 접근권한강박은 전세계적으로 우라늄 광석을 찾는 것으로 이어졌다.미국은 1910년대 초에 주요 생산국으로 자리를 잡았다.콜로라도의 카르노타이트 모래는 그 원소의 일부를 제공하지만, 더 풍부한 광석은 콩고, 그레이트 베어 호수와 캐나다 북서부의 그레이트 슬레이브 호수 지역에서 발견된다.라듐을 얻기 위해 채굴된 것은 아니지만 우라늄 함량은 채굴을 수익성 있게 만든다.[29][61]
퀴리의 과정은 1940년 산업용 라듐 추출에 여전히 사용되었으나, 혼합 브로미드가 분획에 사용되었다.만약 우라늄 광석의 바륨 함량이 충분히 높지 않다면 라듐을 운반하기 위해 몇 개를 첨가하는 것은 쉽다.이 과정들은 높은 등급의 우라늄 광석에 적용되었지만 낮은 등급의 광석에서 잘 작동하지 않을 수 있다.[62]
1990년대까지만 해도 이 혼합강수법과 이온교환법에 의해 우라늄광석에서 소량의 라듐을 추출했지만,[26] 오늘날에는 사용후핵연료에서만 추출된다.[63]1954년 전 세계 정제 라듐의 총 공급량은 약 5파운드(2.3kg)[39]에 달하며, 오늘날에도 이 범위에 있는 반면 순수 라듐 화합물의 연간 생산량은 1984년 현재 총 100g 정도에 불과하다.[26]주요 라듐 생산국은 벨기에, 캐나다, 체코, 슬로바키아, 영국, 러시아 등이다.[26]생산되는 라듐의 양은 항상 상대적으로 적으며, 예를 들어, 1918년에 미국에서 13.6 g의 라듐이 생산되었다.[64]금속은 1200 °C의 진공에서 알루미늄 금속으로 산화 라듐을 감소시켜 격리된다.[25]
최신 애플리케이션
원자, 분자, 광물리학 연구
라듐은 원자, 분자, 광학 물리학 분야에서 사용이 증가하고 있다.대칭파단력은 3{\ Z[65][66]에 비례하여 스케일링되는데, 이것은 가장 무거운 알칼리성 대지 원소인 라듐을 표준 모델을 넘어 새로운 물리학을 구속하는 데 잘 적합하게 만든다.라듐-225와 같은 일부 라듐 동위 원소에는 스타일 ^{Hg에 비해 새로운 물리학을 위반하는 전하 패리티에 대한 민감도를 2~3배 향상시키는 옥투폴레 변형 패리티 더블릿이 있다.[67][68][69]
라듐은 갇힌 이온 광학 시계에도 유망하다.라듐 에는 7초 2 / 2개의 접지 상태에서 두 개의 하위 선폭 전환이 있어 광학 클럭의 클럭 전환 역할을 할 수 있다.[70]또한 라듐은 시계 작동에 필요한 모든 전환은 다이오드 직접 레이저로 처리할 수 있기 때문에 특히 운송 가능한 광학 클럭에 적합할 수 있다.[71]
라듐은 안정적인 동위원소가 없지만 킹 플롯의 높은 정밀도와 비교될 수 있는 반 리브 길이의 라듐 동위원소가 11개 있다.동위원소 이동은 접지 상태에서 라듐 이온 하위 헤르츠 선폭 전환 중 하나 또는 중성 라듐에서 1 ~ 의 상호결합 라인에서 높은 정밀도로 측정할 수 있었다.[72]그러한 킹 플롯에서 잠재적 비선형성의 정도는 표준 모델을 벗어난 새로운 물리학에 대한 한계를 설정할 수 있다.[73]
라듐의 몇 안 되는 실용적 사용 중 일부는 라듐의 방사능 특성에서 유래한다.코발트-60과 세슘-137과 같은 더 최근에 발견된 방사성 동위원소는 이러한 제한된 용도에서조차 라듐을 대체하고 있다. 왜냐하면 이들 동위원소들 중 몇몇은 더 강력한 방출체, 취급하기에 안전하며 더 집중된 형태로 이용 가능하기 때문이다.[74][75]
동위원소 Ra(무역명 Xofigo)는 2013년 미국 식품의약국(FDA)으로부터 뼈 전이의 암 치료제로 의약품에 사용 승인을 받았다.[76][77]소피고와의 치료의 주요 지표는 이 알파-방사선제약의 바람직한 특성 때문에 거세 저항성 전립선암에서 나온 뼈 전립선암을 치료하는 것이다.[78]225라는 딸 중 한 명으로서 라돈이 들어 있지 않은 유일한 장수 라듐 동위원소이기 때문에 치료용 조사와 관련된 실험에도 이용되어 왔다.[79]
라듐은 오늘날에도 X선 영상과 유사하게 결함이 있는 금속 부품을 검사하기 위해 일부 산업용 방사선 장비에서 방사선원으로 사용되고 있다.[13]베릴륨과 섞이면 라듐이 중성자원으로 작용한다.[47][80]라듐-베릴륨 중성자 선원은 지금도 가끔 사용되고 있지만 [13][81]폴로늄과 같은 다른 물질들이 더 흔하다. 폴로늄-베릴륨 중성자 선원은 약 1500개로 개별 활성도는 1,850Ci(68TBq)로 러시아에서 매년 사용되고 있다.이러한 RaBeF 기반4(α, n) 중성자 선원은 Am-Be 선원을 선호하여 방출하는 중성자 수(초당 1.846×10 중성자)가 많음에도 불구하고 더 이상 사용되지 않았다.[25]오늘날, 동위원소 Ra는 주로 원자로에서 중성자 조사에 의해 Ac를 형성하는데 사용된다.[25]
위험
라듐은 방사능이 높고, 직녀인 라돈가스도 방사능이 많다.섭취했을 때 섭취된 라듐의 80%는 대변을 통해 신체를 배출하고, 나머지 20%는 혈류로 들어가 대부분 뼈에 축적된다.[13]라듐과 라돈은 붕괴 시 알파선과 감마선을 방출하여 세포를 죽이고 돌연변이를 일으키기 때문에 내부든 외부의 라듐에 노출되면 암과 다른 질환을 일으킬 수 있다.[13]1944년 맨해튼 프로젝트 당시 근로자에 대한 '관용 선량'은 섭취한 라듐 0.1마이크로그램으로 설정됐다.[82][83]
라듐의 생물학적 효과로는 원소가 발견된 지 2년 후인 1900년에 보고된 "라듐-더마티스"의 첫 사례가 있다.프랑스 물리학자 앙투안 베크렐은 조끼 주머니에 작은 라듐 앰플을 6시간 동안 지니고 다녔고, 피부가 궤양에 걸렸다고 보고했다.피에르와 마리 퀴리는 방사선에 너무 흥미를 느껴서 더 많은 것을 배우기 위해 자신의 건강을 희생했다.피에르 퀴리는 라듐이 채워진 관을 팔에 10시간 동안 부착했는데, 그 결과 피부 병변이 생겨 라듐이 건강한 조직을 공격했기 때문에 암 조직을 공격하는 데 라듐을 사용할 것을 제안했다.[84]마리 퀴리가 재생불량성 빈혈로 사망한 데는 라듐 취급이 원인으로 지목됐다.라듐의 위험의 상당량은 딸 라돈에서 온다: 기체로서 라듐은 부모 라듐보다 훨씬 더 쉽게 체내로 들어갈 수 있다.[13]
오늘날 라씨는 양적 방사성원소 중 가장 독성이 강한 물질로 여겨지고 있으며, 딸 Rn이 환경으로 탈출하지 않도록 기류 순환이 상당한 타이트한 글로브 박스에서 취급되어야 한다.라듐 용액을 함유한 오래된 앰플은 물의 방사성 분해가 수소와 산소 가스의 과압을 발생시킬 수 있기 때문에 주의해서 열어야 한다.[25]세계에서 가장 많은 양의 라는 뉴욕 나이아가라 폭포에서 북쪽으로 약 9.6 mi(15.4 km) 떨어진 중간 폐기물 격납 구조 내에 저장되어 있다.[85]
참고 항목
메모들
참조
- ^ "Radium". Royal Society of Chemistry. Archived from the original on 24 March 2016. Retrieved 5 July 2016.
- ^ a b 그린우드와 어니쇼, 페이지 112
- ^ a b c d e f 커비 외, 페이지 4
- ^ Lide, D. R. (2004). CRC Handbook of Chemistry and Physics (84th ed.). Boca Raton (FL): CRC Press. ISBN 978-0-8493-0484-2.
- ^ Weigel, F.; Trinkl, A. (1968). "Zur Kristallchemie des Radiums". Radiochim. Acta. 10 (1–2): 78. doi:10.1524/ract.1968.10.12.78. S2CID 100313675.
- ^ a b Young, David A. (1991). "Radium". Phase Diagrams of the Elements. University of California Press. p. 85. ISBN 978-0-520-91148-2.
- ^ "화학 원소의 결정 구조 1바" 2014년 8월 26일 웨이백 기계에 보관.uni-bielefeld.de.
- ^ a b c d Audi, G.; Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S. (2017). "The NUBASE2016 evaluation of nuclear properties" (PDF). Chinese Physics C. 41 (3): 030001. Bibcode:2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001.
- ^ a b c d 살루츠키, M.L. & Kirby, H.W. Radium의 RADITOKHIORYURY, 보고서, 1964년 12월 1일; United States of Nortexas Libraries, UNT Digital Librarys; UNT Librarys 정부 문서부 신임.3페이지.
- ^ Peppard, D. F.; Mason, G. W.; Gray, P. R.; Mech, J. F (1952). "Occurrence of the (4n + 1) series in nature". Journal of the American Chemical Society. 74 (23): 6081–6084. doi:10.1021/ja01143a074. Archived from the original on 28 July 2019. Retrieved 6 July 2019.
- ^ a b Ropp, R.C. (2013), "The Alkaline Earths as Metals", Encyclopedia of the Alkaline Earth Compounds, Elsevier, pp. 1–23, doi:10.1016/b978-0-444-59550-8.00001-6, ISBN 978-0-444-59550-8, retrieved 30 March 2021
- ^ Kuhn, W. (1929). "LXVIII. Scattering of thorium C" γ-radiation by radium G and ordinary lead". The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 8 (52): 628. doi:10.1080/14786441108564923. ISSN 1941-5982.
- ^ a b c d e f g h i 라듐: 방사선 방호 장비.미국 환경 보호청
- ^ Soddy, Frederick (25 August 2004). The Interpretation of Radium. pp. 139–. ISBN 978-0-486-43877-1. Archived from the original on 5 September 2015. Retrieved 27 June 2015.
- ^ Malley, Marjorie C. (2011). Radioactivity. Oxford University Press. pp. 115–. ISBN 978-0-19-983178-4. Retrieved 27 June 2015.
- ^ Strutt, R. J. (7 September 2004). The Becquerel Rays and the Properties of Radium. pp. 133–. ISBN 978-0-486-43875-7. Archived from the original on 5 September 2015. Retrieved 27 June 2015.
- ^ "First observations of short-lived pear-shaped atomic nuclei – CERN". home.cern. Archived from the original on 12 June 2018. Retrieved 8 June 2018.
- ^ Gaffney, L. P.; Butler, P. A.; Scheck, M.; et al. (2013). "Studies of pear-shaped nuclei using accelerated radioactive beams". Nature. 497 (7448): 199–204. Bibcode:2013Natur.497..199G. doi:10.1038/nature12073. PMID 23657348. S2CID 4380776.
- ^ Thayer, John S. (2010), "Relativistic Effects and the Chemistry of the Heavier Main Group Elements", Relativistic Methods for Chemists, Challenges and Advances in Computational Chemistry and Physics, vol. 10, p. 81, doi:10.1007/978-1-4020-9975-5_2, ISBN 978-1-4020-9974-8
- ^ a b 그린우드와 어니쇼, 페이지 111
- ^ 커비 외, 페이지 8
- ^ a b c d e f g 커비 외, 페이지 4-8
- ^ 커비 외, 페이지 8-9
- ^ 커비 외, 페이지 12
- ^ a b c d e f Keller, Cornelius; Wolf, Walter; Shani, Jashovam. "Radionuclides, 2. Radioactive Elements and Artificial Radionuclides". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. pp. 97–98. doi:10.1002/14356007.o22_o15.
- ^ a b c d 그린우드와 어니쇼, 페이지 109–110
- ^ "라듐" 2012년 11월 15일 로스 알라모스 국립 연구소의 웨이백 머신에 보관.2009년 8월 5일 회수.
- ^ 제14절, 지구물리학, 천문학, 음향학; 지각과 바다의 원소의 풍부함, 리드의 데이비드 R. (ed.), 화학 및 물리학의 CRC 핸드북, 85판.CRC 프레스.플로리다 주 보카 라톤(2005년)
- ^ a b c 해먼드, C. R. "Radium" in
- ^ Curie, Pierre; Curie, Marie & Bémont, Gustave (1898). "Sur une nouvelle substance fortement radio-active, contenue dans la pechblende (On a new, strongly radioactive substance contained in pitchblende)". Comptes Rendus. 127: 1215–1217. Archived from the original on 6 August 2009. Retrieved 1 August 2009.
- ^ Weeks, Mary Elvira (1933). "The discovery of the elements. XIX. The radioactive elements". Journal of Chemical Education. 10 (2): 79. Bibcode:1933JChEd..10...79W. doi:10.1021/ed010p79.
- ^ Ball, David W. (1985). "Elemental etymology: What's in a name?". Journal of Chemical Education. 62 (9): 787–788. Bibcode:1985JChEd..62..787B. doi:10.1021/ed062p787.
- ^ Carvalho, Fernando P. (2011), "Marie Curie and the Discovery of Radium", The New Uranium Mining Boom, Springer Geology, pp. 3–13, doi:10.1007/978-3-642-22122-4_1, ISBN 978-3-642-22121-7
- ^ Weeks, Mary Elvira (1933). "The discovery of the elements. XIX. The radioactive elements". Journal of Chemical Education. 10 (2): 79. Bibcode:1933JChEd..10...79W. doi:10.1021/ed010p79.
- ^ Frank Moore Colby; Allen Leon Churchill (1911). New International Yearbook: A Compendium of the World's Progress. Dodd, Mead and Co. pp. 152–.
- ^ Curie, Marie & Debierne, André (1910). "Sur le radium métallique" (On metallic radium)". Comptes Rendus (in French). 151: 523–525. Archived from the original on 20 July 2011. Retrieved 1 August 2009.
- ^ Ronneau, C.; Bitchaeva, O. (1997). Biotechnology for waste management and site restoration: Technological, educational, business, political aspects. Scientific Affairs Division, North Atlantic Treaty Organization. p. 206. ISBN 978-0-7923-4769-9. Archived from the original on 5 September 2015. Retrieved 27 June 2015.
- ^ Frame, Paul W. "How the Curie Came to Be". Archived from the original on 30 May 2012. Retrieved 30 April 2008.
- ^ a b Terrill Jr, J. G.; Ingraham Sc, 2nd; Moeller, D. W. (1954). "Radium in the healing arts and in industry: Radiation exposure in the United States". Public Health Reports. 69 (3): 255–62. doi:10.2307/4588736. JSTOR 4588736. PMC 2024184. PMID 13134440.
- ^ Frame, Paul (1999). "Radioluminescent Paint". Museum of Radiation and Radioactivity. Oak Ridge Associated Universities. Archived from the original on 31 July 2014.
- ^ "Environmental history timeline – Radium Girls". 20 July 2012. Archived from the original on 2 September 2018. Retrieved 1 September 2018.
- ^ Rowland, R. E. (1995) 인간에 대한 Radium: 2011년 11월 9일 웨이백 머신에 보관된 미국 연구의 리뷰.아르곤 국립 연구소 22페이지
- ^ Tykva, Richard; Berg, Dieter (2004). Man-made and natural radioactivity in environmental pollution and radiochronology. Springer. p. 78. ISBN 978-1-4020-1860-2.
- ^ Lavrukhina, Avgusta Konstantinovna; Pozdnyakov, Aleksandr Aleksandrovich (1966). Аналитическая химия технеция, прометия, астатина и франция [Analytical Chemistry of Technetium, Promethium, Astatine, and Francium] (in Russian). Nauka. p. 118.
- ^ 핵종 안전 데이터 시트: 수소-3.ehso.emory.edu
- ^ Zerriffi, Hisham (January 1996). "Tritium: The environmental, health, budgetary, and strategic effects of the Department of Energy's decision to produce tritium". Institute for Energy and Environmental Research. Archived from the original on 13 July 2010. Retrieved 15 September 2010.
- ^ a b c Emsley, John (2003). Nature's building blocks: an A-Z guide to the elements. Oxford University Press. pp. 351–. ISBN 978-0-19-850340-8. Retrieved 27 June 2015.
- ^ a b 브리태니커 백과사전
- ^ 2013년 3월 4일 웨이백 머신에 보관된 야광 라듐 페인트.vintagewatchstraps.com
- ^ "French Web site featuring products (medicines, mineral water, even underwear) containing radium". Archived from the original on 15 March 2011. Retrieved 1 August 2009.
- ^ Cherbonnier, Alice (1 October 1997). "Nasal Radium Irradiation of Children Has Health Fallout". Baltimore Chronicle. Archived from the original on 28 September 2011. Retrieved 1 August 2009.
- ^ Hayter, Charles (2005). "The Politics of Radon Therapy in the 1930s". An Element of Hope: Radium and the Response to Cancer in Canada, 1900–1940. McGill-Queen's Press. ISBN 978-0-7735-2869-7.
- ^ Harvie, David I. (1999). "The radium century". Endeavour. 23 (3): 100–5. doi:10.1016/S0160-9327(99)01201-6. PMID 10589294.
- ^ Hamilton, Vivien (2016). "The Secrets of Life: Historian Luis Campos resurrects radium's role in early genetics research". Distillations. 2 (2): 44–45. Archived from the original on 23 March 2018. Retrieved 22 March 2018.
- ^ "The Four Founding Physicians". Archived from the original on 10 March 2015. Retrieved 10 April 2013.
- ^ Dastur, Adi E.; Tank, P. D. (2011). "Howard Atwood Kelly: much beyond the stitch". The Journal of Obstetrics and Gynecology of India. 60 (5): 392–394. doi:10.1007/s13224-010-0064-6. PMC 3394615.
- ^ a b Aronowitz, Jesse N.; Robison, Roger F. (2010). "Howard Kelly establishes gynecologic brachytherapy in the United States". Brachytherapy. 9 (2): 178–184. doi:10.1016/j.brachy.2009.10.001. PMID 20022564.
- ^ Rebecca Skloot (2 February 2010). The Immortal Life of Henrietta Lacks. Random House Digital, Inc. ISBN 978-0-307-58938-5. Archived from the original on 17 June 2013. Retrieved 8 April 2013.
- ^ a b Ceranski, Beate (2008). "Tauschwirtschaft, Reputationsökonomie, Bürokratie". NTM Zeitschrift für Geschichte der Wissenschaften, Technik und Medizin. 16 (4): 413–443. doi:10.1007/s00048-008-0308-z.
- ^ "측면 과학" 2015년 4월 2일 웨이백 머신에 보관.나중의 감각blogspot.se.2012년 11월
- ^ Just, Evan; Swain, Philip W. & Kerr, William A. (1952). "Peacetíme Impact of Atomíc Energy". Financial Analysts Journal. 8 (1): 85–93. doi:10.2469/faj.v8.n1.85. JSTOR 40796935.
- ^ Kuebel, A. (1940). "Extraction of radium from Canadian pitchblende". Journal of Chemical Education. 17 (9): 417. Bibcode:1940JChEd..17..417K. doi:10.1021/ed017p417.
- ^ Emsley, John (2011). Nature's building blocks: an A-Z guide to the elements. Oxford University Press. p. 437. ISBN 9780199605637.
- ^ Viol, C. H. (1919). "Radium Production". Science. 49 (1262): 227–8. Bibcode:1919Sci....49..227V. doi:10.1126/science.49.1262.227. PMID 17809659.
- ^ Bouchiat, Marie-Anne; Bouchiat, Claude (28 November 1997). "Parity violation in atoms". Reports on Progress in Physics. 60 (11): 1351–1396. Bibcode:1997RPPh...60.1351B. doi:10.1088/0034-4885/60/11/004 – via Institute of Physics.
- ^ Commins, Eugene D.; Jackson, J. D.; DeMille, David P. (10 May 2007). "The electric dipole moment of the electron: An intuitive explanation for the evasion of Schiff's theorem". American Journal of Physics. 75 (6): 532–536. Bibcode:2007AmJPh..75..532C. doi:10.1119/1.2710486 – via aapt.scitation.org (Atypon).
- ^ Dobaczewski, J.; Engel, J. (13 June 2005). "Nuclear Time-Reversal Violation and the Schiff Moment of $^{225}\mathrm{Ra}$". Physical Review Letters. 94 (23): 232502. arXiv:nucl-th/0503057. doi:10.1103/PhysRevLett.94.232502. PMID 16090465. S2CID 328830 – via APS.
- ^ Graner, B.; Chen, Y.; Lindahl, E. G.; Heckel, B. R. (18 April 2016). "Reduced Limit on the Permanent Electric Dipole Moment of $^{199}\mathrm{Hg}$". Physical Review Letters. 116 (16): 161601. arXiv:1601.04339. doi:10.1103/PhysRevLett.116.161601. PMID 27152789. S2CID 2230011 – via APS.
- ^ Parker, R. H.; Dietrich, M. R.; Kalita, M. R.; Lemke, N. D.; Bailey, K. G.; Bishof, M.; Greene, J. P.; Holt, R. J.; Korsch, W.; Lu, Z.-T.; Mueller, P.; O’Connor, T. P.; Singh, J. T. (9 June 2015). "First Measurement of the Atomic Electric Dipole Moment of $^{225}\mathrm{Ra}$". Physical Review Letters. 114 (23): 233002. arXiv:1504.07477. doi:10.1103/PhysRevLett.114.233002. PMID 26196797. S2CID 41982867 – via APS.
- ^ Nuñez Portela, M.; Dijck, E. A.; Mohanty, A.; Bekker, H.; van den Berg, J. E.; Giri, G. S.; Hoekstra, S.; Onderwater, C. J. G.; Schlesser, S.; Timmermans, R. G. E.; Versolato, O. O.; Willmann, L.; Wilschut, H. W.; Jungmann, K. (1 January 2014). "Ra+ ion trapping: toward an atomic parity violation measurement and an optical clock". Applied Physics B. 114 (1): 173–182. Bibcode:2014ApPhB.114..173N. doi:10.1007/s00340-013-5603-2. S2CID 119948902 – via Springer Link.
- ^ "Energy Levels of Singly Ionized Radium (Ra II)". physics.nist.gov.
- ^ Bieroń, J.; Indelicato, P.; Jönsson, P. (1 May 2007). "Multiconfiguration Dirac-Hartree-Fock calculations oftransition rates and lifetimes of the eight lowest excited levels of radium". The European Physical Journal Special Topics. 144 (1): 75–84. arXiv:physics/0701239. Bibcode:2007EPJST.144...75B. doi:10.1140/epjst/e2007-00110-3. S2CID 18380607 – via Springer Link.
- ^ Antypas, D.; Fabricant, A.; Stalnaker, J. E.; Tsigutkin, K.; Flambaum, V. V.; Budker, D. (28 February 2019). "Isotopic variation of parity violation in atomic ytterbium". Nature Physics. 15 (2): 120–123. arXiv:1804.05747. doi:10.1038/s41567-018-0312-8. S2CID 89612054 – via www.nature.com.
- ^ Committee On Radiation Source Use And Replacement, National Research Council (U.S.); Nuclear And Radiation Studies Board, National Research Council (U.S.) (January 2008). Radiation source use and replacement: Abbreviated version. p. 24. ISBN 978-0-309-11014-3. Archived from the original on 5 September 2015. Retrieved 27 June 2015.
- ^ Bentel, Gunilla Carleson (1996). Radiation therapy planning. p. 8. ISBN 978-0-07-005115-7. Archived from the original on 5 September 2015. Retrieved 27 June 2015.
- ^ "FDA OKs pinpoint prostate cancer radiation drug Xofigo from Bayer, Algeta". Archived from the original on 28 June 2013. Retrieved 1 October 2014.
- ^ "FDA, 전립선암에 대한 Xofgo 승인" cancer.org. (2013-05-15)
- ^ Maffioli, L.; Florimonte, L.; Costa, D. C.; Correia Castanheira, J.; Grana, C.; Luster, M.; Bodei, L.; Chinol, M. (2015). "New radiopharmaceutical agents for the treatment of castration-resistant prostate cancer". Q J Nucl Med Mol Imaging. 59 (4): 420–38. PMID 26222274.
- ^ Stoll, Wolfgang (2005). "Thorium and Thorium Compounds". Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. p. 717. doi:10.1002/14356007.a27_001. ISBN 978-3-527-31097-5.
- ^ l'Annunziata, Michael F. (2007). "Alpha particle induced nuclear reactions". Radioactivity: Introduction and history. Elsevier. pp. 260–261. ISBN 978-0-444-52715-8.
- ^ Holden, N. E.; Reciniello, R. N.; Hu, J. P.; Rorer, David C. (2004). "Radiation dosimetry of a graphite moderated radium-beryllium source" (PDF). Health Physics. 86 (5 Suppl): S110–2. Bibcode:2003rdtc.conf..484H. doi:10.1142/9789812705563_0060. PMID 15069300. Archived (PDF) from the original on 23 July 2018. Retrieved 25 October 2017.
- ^ Weisgall, Jonathan M. (1994). Operation crossroads: the atomic tests at Bikini Atoll. Naval Institute Press. p. 238. ISBN 978-1-55750-919-2. Retrieved 20 August 2011.
- ^ Fry, Shirley A. (1998). "Supplement: Madame Curie's Discovery of Radium (1898): A Commemoration by Women in Radiation Sciences". Radiation Research. 150 (5): S21–S29. Bibcode:1998RadR..150S..21F. doi:10.2307/3579805. JSTOR 3579805. PMID 9806606.
- ^ Redniss, Lauren (2011). Radioactive: Marie & Pierre Curie: A Tale Of Love And Fallout. New York, NY: HarperCollins. p. 70. ISBN 978-0-06-135132-7.
- ^ Jenks, Andrew (July 2002). "Model City USA: The Environmental Cost of Victory in World War II and the Cold War". Environmental History. 12 (77): 552–577. doi:10.1093/envhis/12.3.552. (필요한 경우)
참고 문헌 목록
- Kirby, H. W.; Salutsky, Murrell L. (1964). The Radiochemistry of Radium (PDF). National Academies Press.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
추가 읽기
- Albert Stwertka (1998). Guide to the Elements – Revised Edition. Oxford University Press. ISBN 978-0-19-508083-4.
- Denise Grady (6 October 1998). "A Glow in the Dark, and a Lesson in Scientific Peril". The New York Times. Retrieved 25 December 2007.
- Nanny Fröman (1 December 1996). "Marie and Pierre Curie and the Discovery of Polonium and Radium". Nobel Foundation. Retrieved 25 December 2007.
- Macklis, R. M. (1993). "The great radium scandal". Scientific American. 269 (2): 94–99. Bibcode:1993SciAm.269b..94M. doi:10.1038/scientificamerican0893-94. PMID 8351514.
- Clark, Claudia (1987). Radium Girls: Women and Industrial Health Reform, 1910–1935. University of North Carolina Press. ISBN 978-0-8078-4640-7.
- Marie Curie (1921), The Discovery of Radium: Address by Madame M. Curie at Vassar College May 14, 1921 (1st ed.), Poughkeepsie: Vassar College, Wikidata Q22920166
외부 링크
- "Lateral Science: The Discovery of Radium". 8 July 2012. Archived from the original on 9 March 2016. Retrieved 13 May 2017.
- 오클라호마 주의 라듐 워터 배스 사진
- NLM 위험 물질 데이터 뱅크 - 라듐, 방사능
- Wayback Machine에 2019년 6월 25일 보관된 핵문제 해결을 위한 Alsos Digital Library for Nuclear Issue의 라듐에 대한 주석 참고 문헌
- 주기율표 비디오에서 라듐(Nottingham University of University)














