이온화 에너지
Ionization energy물리학과 화학에서 이온화 에너지(IE)(미국식 영어 철자), 이온화 에너지(영국식 영어 철자)는 분리된 기체 원자, 양이온 또는 [1]분자의 가장 느슨하게 결합된 전자를 제거하는 데 필요한 최소 에너지입니다.첫 번째 이온화 에너지는 다음과 같이 정량적으로 표현된다.
- X(g) + 에너지 † X+(g) + e−
여기서 X는 원자 또는 분자이고+, X는 원래 원자가 단일 전자로부터 제거되었을 때의 이온이고, e는− 제거된 [2]전자이다.이온화 에너지는 중성 원자에 양성이며, 이는 이온화가 흡열 과정임을 의미합니다.대략적으로 말하면, 가장 바깥쪽에 있는 전자가 원자의 핵에 가까울수록, 원자의 이온화 에너지는 높아집니다.
물리학에서 이온화 에너지는 보통 전자볼트(eV) 또는 줄(J)로 표현됩니다.화학에서, 이것은 원자 또는 분자의 몰을 이온화하는 에너지로 표현되며, 보통 몰당 킬로줄(kJ/mol) 또는 몰당 킬로칼로리(kcal/[3]mol)로 표현된다.
주기율표에서 원자의 이온화 에너지 비교는 쿨롱 [4]흡인 법칙을 따르는 두 가지 주기적 경향을 보여준다.
후자의 경향은 외부 전자 껍질이 핵에서 점차적으로 멀어져 기둥 아래로 이동할 때 행당 하나의 내부 껍질이 추가됩니다.
n번째 이온화 에너지는 (n - 1)의 양의 전하를 가진 종에서 가장 느슨하게 결합된 전자를 제거하는 데 필요한 에너지의 양을 말한다.예를 들어 처음 3개의 이온화 에너지는 다음과 같이 정의됩니다.
- 첫 번째 이온화 에너지는 X µ X + e− 반응을+ 가능하게 하는 에너지입니다.
- 두 번째 이온화 에너지는 X µ X + e− 반응을+2+ 가능하게 하는 에너지입니다.
- 세 번째 이온화 에너지는 X µ X + e− 반응을2+3+ 가능하게 하는 에너지입니다.
이온화 에너지를 결정하는 가장 주목할 만한 영향은 다음과 같습니다.
- 전자 구성:각각의 전자 구성을 결정하는 것만으로 모든 화학적 및 물리적 특성을 확인할 수 있기 때문에, 이것은 대부분의 원소의 IE를 설명한다.
- 원자력 충전:핵 전하(원자 번호)가 크면 전자는 핵에 의해 더 단단하게 유지되므로 이온화 에너지는 더 커진다(특정 기간 내에 언급된 경향 1로 이어진다).
- 전자 껍데기의 수: 더 많은 껍데기의 존재로 인해 원자의 크기가 더 크면, 전자는 핵에 의해 덜 단단하게 유지되고 이온화 에너지는 더 작아집니다.
- 유효핵 전하(Zeff): 전자 차폐 및 투과 크기가 크면 전자는 핵, 전자의 Zeff, 이온화 에너지가 [5]작아집니다.
- 안정성:보다 안정된 전자구조를 가진 원자는 전자를 잃는 경향이 낮아져 이온화 에너지가 높아진다.
경미한 영향은 다음과 같습니다.
- 상대론적 효과:무거운 원소(특히 원자 번호가 약 70 이상인 원소)는 전자가 빛의 속도에 가까워짐에 따라 이러한 원소의 영향을 받습니다.그러므로 그들은 더 작은 원자 반지름과 더 높은 이온화 에너지를 가지고 있다.
- 란타니드 및 액티니드 수축(및 스칸디드 수축):원소의 축소는 핵의 순전하가 더 강하게 느껴지기 때문에 이온화 에너지에 영향을 미칩니다.
- 전자 쌍 에너지:서브셸이 반쯤 채워지면 일반적으로 이온화 에너지가 높아집니다.
이온화 퍼텐셜이라는 용어는 이온화 에너지를 측정하는 가장 오래된 방법은 시료를 이온화하고 정전 전위를 사용하여 제거된 전자를 가속하는 것이기 때문에 이온화 에너지라는 [7]용어는 오래되고 오래된 용어입니다[6].
이온화 에너지 측정
E로i 표기된 원자의 이온화 에너지는 최소 결합 원자 전자를 쫓아낼 알려진 에너지로 가속되는 광양자 또는 전자의 최소 에너지를 발견함으로써 측정된다[8].측정은 단일 원자에 대한 기상에서 수행됩니다.단원자 가스로는 귀한 가스만이 발생하는 반면, 다른 가스는 단일 [9]원자로 분할될 수 있습니다.또한, 많은 고체 원소들이 가열되고 단일 원자로 증발될 수 있습니다.단원자 증기는 전압원에 연결된 두 개의 병렬 전극이 있는 이전에 진공된 튜브에 포함되어 있습니다.이온화 들뜸은 튜브의 벽을 통해 도입되거나 내부에서 생성됩니다.
자외선을 사용하면 파장이 자외선 범위를 따라 내려갑니다.빛의 특정 파장(파장)과 주파수(파장=c/파장, 여기서 c는 빛의 속도)에서 에너지가 주파수에 비례하는 광량자는 최소 결합 전자를 제거하기에 충분히 높은 에너지를 가집니다.이러한 전자는 정극에 끌리고 광이온화 후 남은 정이온은 음전하 전극에 끌립니다.이 전자와 이온들은 관을 통해 전류를 형성할 것이다.이온화 에너지는 전류의 급격한 상승을 야기한 광자 hµi(h는 플랑크 상수)의 에너지이다: Ei = hµi.
고속 전자가 원자를 이온화하는데 사용될 때, 그것들은 유사한 진공관 안에서 전자총에 의해 생산된다.전자빔의 에너지는 가속도 전압에 의해 제어될 수 있습니다.이온 전류의 급격한 시작을 야기하고 튜브를 통해 방출된 전자의 에너지는 원자의 이온화 에너지와 일치할 것입니다.
원자: 가치와 경향
일반적으로 특정 원소의 (N+1)번째 이온화 에너지는 N번째 이온화 에너지보다 크다(음이온의 이온화 에너지는 일반적으로 같은 원소의 양이온 및 중성 원자의 이온화 에너지보다 작다는 점도 유의해도 좋다).다음 이온화 에너지가 동일한 전자 껍질에서 전자를 제거하는 것을 포함할 때, 이온화 에너지의 증가는 주로 전자가 제거되는 이온의 순 전하 증가에 기인합니다.더 높은 전하를 띤 이온에서 제거된 전자는 더 큰 정전기적 흡인력을 경험합니다. 따라서 이러한 제거에는 더 많은 에너지가 필요합니다.또한 다음 이온화 에너지가 낮은 전자껍질에서 전자를 제거하는 것을 포함할 때 핵과 전자 사이의 거리가 크게 감소하면 정전력과 전자를 제거하기 위해 극복해야 하는 거리도 증가한다.이 두 가지 요인 모두 이온화 에너지를 더욱 증가시킵니다.
세 번째 주기의 원소에 대한 일부 값은 다음 표에 나와 있습니다.
| 요소 | 첫번째 | 둘째 | 셋째 | 넷째 | 다섯 번째의 | 6번째 | 일곱 번째 |
|---|---|---|---|---|---|---|---|
| 나 | 496 | 4,560 | |||||
| Mg | 738 | 1,450 | 7,730 | ||||
| 알 | 577 | 1,816 | 2,881 | 11,600 | |||
| 시 | 786 | 1,577 | 3,228 | 4,354 | 16,100 | ||
| P | 1,060 | 1,890 | 2,905 | 4,950 | 6,270 | 21,200 | |
| S | 1,000 | 2,295 | 3,375 | 4,565 | 6,950 | 8,490 | 27,107 |
| 클론 | 1,256 | 2,260 | 3,850 | 5,160 | 6,560 | 9,360 | 11,000 |
| 아르 | 1,520 | 2,665 | 3,945 | 5,770 | 7,230 | 8,780 | 12,000 |
연속되는 몰 이온화 에너지는 귀가스 구성을 통과할 때 크게 상승합니다.표에서 볼 수 있는 예를 들어, 마그네슘(마그네슘 원자는 23초 전자 스트리핑)의 첫 두 분자 이온화 에너지 그것은 Mg2+의 네온 구성에서 한2p 전자를 벗기는 것을 요구한다는 세번째의,보다 더 작다.그 파운드당 2펜스 전자는 핵한테보다 가까이 있는3s 전자 previ을 제거했다.ously.
이온화 에너지는 주기율표 내에서 주기적인 경향이기도 하다.일정 기간 내에 왼쪽에서 오른쪽으로 이동하거나 그룹 내에서 위쪽으로 이동하면 첫 번째 이온화 에너지는 일반적으로 증가합니다.[10] 단, 위의 표의 알루미늄 및 황과 같은 예외는 제외됩니다.원자핵의 핵전하가 기간에 걸쳐 증가함에 따라 전자와 양성자 사이의 정전기 흡인력이 증가하여 원자반경이 감소하며, 전자, 특히 가장 바깥쪽이 더 높은 유효 핵전하에 의해 더 단단하게 유지되기 때문에 전자 구름이 원자핵에[11] 가까워진다.
주어진 그룹 내에서 아래로 이동할 때, 전자는 핵에서 더 멀리 떨어진 더 높은 주 양자 번호 n을 가진 더 높은 에너지 쉘에 유지되며, 따라서 이온화 에너지가 감소하도록 더 느슨하게 결합됩니다.유효 핵전하는 천천히 증가하기 때문에 그 효과는 [12]n의 증가보다 크다.
이온화 에너지 예외
특정 기간 내에 이온화 에너지가 증가하는 일반적인 경향에는 예외가 있습니다.예를 들어 베릴륨(
4Be
: 9.3eV)에서 붕소(
5B
: 8.3eV)로, 질소(
7N
: 14.5eV)에서 산소(
8O
: 13.6eV)로 값이 감소한다.이러한 딥은 전자 [13]배치로 설명할 수 있습니다.

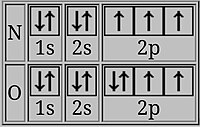
붕소는 같은 껍질에 있는 2s 전자보다 평균적으로 원자핵에서 더 멀리 떨어진 곳에 있는 2p 궤도에 마지막 전자를 가지고 있습니다.그러면 2s 전자는 핵으로부터 2p 전자를 어느 정도 차폐하고, 2p 전자를 붕소에서 제거하는 것이 베릴륨에서 2s 전자를 제거하는 것보다 쉬우며,[2] 결과적으로 B의 이온화 에너지가 낮아집니다.
산소에서 마지막 전자는 반대 스핀의 전자와 이중으로 점유된 p-궤도를 공유합니다.같은 궤도에 있는 두 개의 전자는 서로 다른 궤도에 있는 두 개의 전자보다 평균적으로 서로 더 가깝기 때문에 서로를 더 효과적으로 보호하고 하나를 제거하는 것이 더 쉬워서 이온화 에너지가 [2][14]낮아집니다.
또한 귀가스 원소마다 이온화 에너지가 급격히 감소한다.이것은 알칼리 금속의 외부 전자가 내부 껍질보다 원자로부터 제거되는 데 훨씬 적은 양의 에너지를 필요로 하기 때문에 발생합니다.이것은 또한 알칼리 [15][16][17]금속에 대한 낮은 전기음성 값을 발생시킨다.
경향과 예외는 다음 서브섹션에 요약되어 있습니다.
이온화 에너지는 다음과 같이 감소합니다.
- 새로운 시기로의 이행: 알칼리 금속은 옥텟 또는 의사 노블 가스 구성을 남기 위해 하나의 전자를 잃기 쉬우므로 IE에 대한 값은 작습니다.
- s-블록에서 p-블록으로 이동: p-궤도는 전자를 더 쉽게 잃습니다.예를 들어, 전자 구성2 1s2 2s1 2p의 베릴륨에서 붕소까지입니다.2s 전자는 고에너지 2p 전자를 핵에서 차폐하기 때문에 제거하기가 약간 쉽습니다.이는 마그네슘에서 [19]알루미늄으로도 발생합니다.
- 예를 들어 질소(
7N
: 14.5 eV)에서 산소(
8O
: 13.6 eV)로, 인(
15P
: 10.48 eV)에서 황(
16S
: 10.36 eV)으로 스핀이 있는 첫 번째 전자와 함께 p-subshell을 점유한다.그 이유는 산소, 황, 셀레늄 모두 차폐 효과 [20]때문에 침지 이온화 에너지를 가지고 있기 때문이다.그러나 이는 차폐가 너무 작아서 침하를 일으키지 못하는 텔루루로부터 중단된다. - d블록에서 p블록으로의 이동: 아연(
30Zn
: 9.4 eV)에서 갈륨(
31Ga
: 6.0 eV)의 경우와 같다. - 특수한 경우: 납(
82Pb
: 7.42 eV)에서 비스무트(
83Bi
: 7.29 eV)로 감소.이는 크기에 기인할 수 없습니다(납의 공유 반경은 146pm인 반면 비스무트의 경우는 148pm[21]).또한 6s 궤도의 상대론적 안정화에 기인할 수도 없다. 왜냐하면 이 요인은 인접한 두 요소에서 매우 유사하기 때문이다.다른 요인은 비스무트가 반쯤 채워진 궤도(추가 안정화), 주기율표에서의 위치(Bi는 더 오른쪽이므로 Pb보다 덜 금속이어야 함), 그리고 양성자([유효한] 핵 전하 [22]기여)가 하나 더 있기 때문에 더 높은 IE를 가져야 한다는 사실과 반대된다. - 특수한 경우: 라듐(
88Ra
: 5.27 eV)에서 악티늄(
89Ac: 5.17 eV)으로
감소하며, 이는 s에서 d 오비탈로의 전환이다.그러나 바륨(
56Ba
: 5.2 eV)에서 랜턴(
57La
: 5.6 eV)으로의 유사한 전환은 하향 변화를 보이지 않는다. - 루테튬(
71Lu
)과 로렌슘(
103Lr
)은 모두 이전 원소보다 이온화 에너지가 낮다.두 경우 모두 마지막으로 추가된 전자가 새로운 서브셸을 시작합니다. 전자 구성 [Xe] 4f14 5d1 6s인2 Lu의 경우 5d, 구성 [Rn] 5f4 7s2 7p인1 Lr의 경우 7p입니다.이온화 에너지의 이러한 감소는 Lu와 Lr을 랜턴(La)과 악티늄(Ac)[23][24][25][26] 대신 주기율표의 그룹 3에 배치해야 하는지에 대한 진행 중인 논쟁에서 증거로 사용되었다.
이온화 에너지가 증가하는 것은
- 그룹 18 귀금속 가스 원소 도달:이것은 완전한 전자 [27]부껍데기 때문에 이러한 원소들은 하나의 전자를 제거하기 위해 많은 양의 에너지를 필요로 합니다.
- 그룹 12:아연(
30Zn
: 9.4eV), 카드뮴(
48Cd
: 9.0eV) 및
80수은
(Hg: 10.4eV)은 각각 구리(
29Cu
: 7.7eV), 은(
47Ag
: 7.6eV), 금(
79Au
: 9.2V)과 비교하여 IE 값이 급격히 상승합니다.수은에 대해서는 6s 전자의 상대론적 안정화가 이온화 에너지를 증가시키고 외부 원자가 전자에 대한 유효 핵전하를 증가시키는 4f 전자에 의한 불충분한 차폐를 더한다고 추정할 수 있다.또한 [Ar] 3d10 4s2, [Kr] 4d5s102 및 [Xe] 4f14 5d10 6s의2 폐쇄 서브셸 전자 구성은 안정성을 향상시킵니다. - 특수 케이스: 로듐(
45Rh
: 7.5 eV)에서 팔라듐(
46Pd: 8.3 eV)으로
전환합니다.다른 10족 원소들과 달리 팔라듐은 전자 구조 때문에 이전 원자보다 이온화 에너지가 높다.니켈의 [Ar] 3d8 4s2 및 플래티넘의 [Xe14] 4f9 5d1 6s와 달리 팔라듐의 전자 구성은 [Kr10] 4d0 5s입니다(마델룽 규칙에 따르면 [Kr8] 4d2 5s).마지막으로,
47은의 낮은 IE(Ag
: 7.6 eV)는 [28]팔라듐의 높은 값을 더욱 강조한다. 단일 첨가된 s 전자는 팔라듐보다 낮은 이온화 에너지로 제거되며, 이는 팔라듐의 높은 IE를 강조한다(IE에 대한 위의 선형 표 값 참조). - 가돌리늄(
64Gd
: 6.15 eV)의 IE는 앞의
62(Sm
: 5.64 eV),
63(Eu
: 5.67 eV) 및 다음 요소(
65Tb
: 5.86 eV),
66 (Dy
: 5.94 eV)보다 다소 높다.이러한 이상 현상은 가돌리늄 원자가 d-서브셸이 원자가 f-서브셸에서 1개의 전자를 차용하기 때문이다.이제 원자가 서브셸은 d-subshell이며, f-subshell의 전자에 의한 양의 핵 전하의 불충분한 차폐로 인해, 원자가 d-subshell의 전자는 핵에 대한 더 큰 흡인력을 경험하고, 따라서 (가장 바깥쪽) 원자가 전자를 제거하는 데 필요한 에너지를 증가시킨다. - d 블록 요소로 이동:3D1 전자 구성을 가진 Sc 요소는 s 블록 및 p 블록 요소로의 이동 감소와는 달리 이전 요소(
20Ca
: 6.11 eV)보다 IP(
21Sc
: 6.56 eV)가 높다.4s 및 3d 전자는 유사한 차폐 능력을 가지고 있다: 3d 오비탈은 평균 위치가 4s 오비탈 및 n=4 쉘보다 핵에 가까운 n=3 쉘의 일부를 형성하지만, s 오비탈의 전자는 d 오비탈의 전자보다 핵에 더 많이 침투한다.그래서 3d와 4s 전자의 상호 차폐가 약하고 이온화된 전자에 작용하는 유효 핵전하가 상대적으로 큽니다.이트륨(
39Y
)은 마찬가지로 IP(6.22eV)가 Sr: 5.69eV보다 높다
.마지막 두 개의1 d 요소(
57La
: 5.18 eV)와
89(Ac
: 5.17 eV)는 앞의 요소(
56Ba
: 5.21 eV)와
88(Ra
: 5.18 eV)보다 IP가 아주 약간 낮습니다. - f-블록 원소로 이동: 위 그래프에서 볼 수 있듯이, (Cs
)에서
55
57(La
)까지의 IE 값의 급격한 상승은 f 전자가 추가됨에 따라 거의 선형적으로 증가한다.이는 랜타니드의 수축에 의한 것입니다([29][30][31]랜타니드의 경우).이온 반지름의 감소는 두 특성이 서로 [10]상관관계가 있기 때문에 이온화 에너지의 증가와 관련이 있습니다.d블록 원소는 내부 셸에 전자를 첨가하여 새로운 셸을 형성하지 않는다.추가된 궤도의 모양은 핵을 차지하는 전자가 더 적은 차폐 능력을 가지도록 핵이 핵에 침투하는 것을 막습니다.
그룹 내 이온화 에너지 이상
이온화[13] 에너지 값은 차폐가 더 많은 전자에 의해 제공되고 전체적으로 원자가 껍질은 핵으로부터 더 약한 흡인력을 경험하게 되는데, 이는[32] 그룹을 내려갈수록 증가하는 더 큰 공유 반지름에 기인한다.한 가지 예외로 그룹 10 팔라듐(
46Pd: 8.34 eV)은
테크네튬
Tc에서 제논 Xe에
이르는 원소의 일반적인 감소와는 달리 니켈(
28Ni
: 7.64 eV)보다 이온화 에너지가 높다.이러한 이상은 다음과 같이 요약됩니다.
- 그룹 1:
- 수소의 이온화 에너지는 알칼리 금속에 비해 매우 높다(13.59844 eV).이것은 핵에 가까운 단일 전자(그리고 매우 작은 전자 구름) 때문이다.마찬가지로, 차폐를 일으킬 수 있는 다른 전자가 없기 때문에, 그 단일 전자는 [33]핵의 완전한 양의 전하를 경험합니다.
- 프랑슘의 이온화 에너지는 이전의 알칼리 금속인 세슘보다 높다.이것은 상대론적 효과로 인해 라듐의 작은 이온 반지름 때문입니다.큰 질량과 크기 때문에 이는 전자가 매우 빠른 속도로 이동한다는 것을 의미하며, 이는 전자가 예상보다 핵에 더 가까이 오게 되고 결과적으로 제거하기가 더 어려워집니다(높은 IE).[34]
- 그룹 2: 라듐의 이온화 에너지는 프랑슘과 같은 이전의 알칼리 토류 금속 바륨보다 높으며, 이것도 상대론적 효과 때문이다.전자, 특히 1s 전자는 매우 높은 유효 핵 전하를 경험합니다.핵으로 떨어지는 것을 피하기 위해, 1s 전자는 매우 빠른 속도로 이동해야 하며, 이는 특수 상대론적 보정을 대략적인 고전적 모멘타보다 상당히 높게 만듭니다.불확도 원리에 따르면, 이는 1s 궤도(및 핵에 가까운 전자 밀도의 다른 궤도, 특히 ns와 np 궤도)의 상대론적 축소를 일으킨다.따라서 이것은 연속적인 전자 변화를 야기하고, 마침내 가장 바깥쪽 전자 껍질이 수축하여 핵에 가까워지는 결과를 초래합니다.
- 그룹 4:
- 하프늄은 지르코늄과 IE에서 거의 유사하다.랜타니드 수축의 효과는 랜타니드 [30]이후에도 여전히 느낄 수 있다.이는 전자의 더 작은 원자 반지름(관측 주기적 추세에 반하는 것)을 통해 볼 수 있는데, 이는 후자의 155 오후와는 다른 159[35] pm([36][37]경험적 값)이다.그 결과 이온화 에너지가 18kJ/mol−1 증가한다.
- 티타늄의 IE는 하프늄과 지르코늄보다 작다.하프늄의 이온화 에너지는 란타니드 수축으로 인해 지르코늄과 유사하다.그러나 지르코늄의 이온화 에너지가 이전 원소보다 높은 이유는 밝혀지지 않았다. 지르코늄과 하프늄이 오후 [38]15시까지 더 높기 때문에 원자 반경에 기인한다고 볼 수 없다.또한 축합 이온화 에너지는 거의 같기 때문에 호출할 수 없습니다(티타늄의 경우 [Ar] 3d2 4s2, 지르코늄의 경우 [Kr] 4d2 5s2).게다가, 우리가 비교할 수 있는 반쯤 채워진 궤도와 완전히 채워진 궤도는 없습니다.따라서 지르코늄의 완전한 전자배치인 1s2s2p3s3p3d4s4p4d5s만22626102622 [39]호출할 수 있습니다.완전한 3d 블록 하위 레벨의 존재는 4d 블록 요소(2개의 [a]전자에 불과)에 비해 높은 차폐 효율과 같습니다.
- 그룹 5: 그룹 4와 마찬가지로 니오브와 탄탈은 전자 구성과 랜타니드 수축이 후자 [40]원소에 영향을 미치기 때문에 서로 유사하다.따라서 그룹의 선두 원소인 바나듐에 비해 IE의 현저한 증가는 전자 구성과 더불어 완전한 d 블록 전자에 기인할 수 있다.또 다른 흥미로운 개념은 니오브의 반쯤 채워진 5s 궤도이다. 반발과 교환 에너지(즉, 전자를 고에너지 전자에 넣는 대신 전자를 완전히 채우기 위해 낮은 에너지 하위 레벨에 넣는 "비용") 때문에 EC는 s-와 d-(또는 f) 블록 전자 사이의 에너지 격차를 극복하고, Mad를 따르지 않는다.엘룽 규칙
- 그룹 6: 선두 그룹 4, 5와 마찬가지로 그룹 6도 하향 시 높은 값을 기록한다.텅스텐은 전자 [41]구조상 몰리브덴과 다시 비슷합니다.마찬가지로, 그것은 또한 전자 구성의 완전한 3d 궤도 덕분이다.또 다른 이유는 몰리브덴이 4d 오비탈을 절반으로 채운 것이 전자쌍 에너지로 aufbau 원리에 위배되기 때문이다.
- 제7-12류 6주기 원소(레늄, 오스뮴, 이리듐, 백금, 금 및 수은):이들 원소는 모두 각각의 그룹에서 앞의 원소에 비해 매우 높은 이온화 에너지를 가지고 있다.이것의 본질은 랜타니드 수축이 랜타니드에 미치는 영향과 더불어 6s 궤도의 상대론적 안정화 때문이다.
- 그룹 13:
- 그룹 14: 납의 비정상적으로 높은 이온화 에너지(
82Pb: 7.42 eV)는
그룹 13의 탈륨과 유사하며, 전체 5d 및 4f 서브셸의 결과물이다.란타니드 수축과 4f 전자에 의한 핵의 비효율적인 스크리닝은
50납의 이온화 에너지를 주석보다
약간 더 높게 만든다(Sn: 7.34 [42][5]eV).
수소 원자 보어 모형
수소원자( { Z의 이온화 에너지는 Bohr [43]모델에서 평가할 수 있으며, 이는 원자 에너지 n {\ n이 에너지를 갖는 것으로 예측된다.
R은H 수소 원자의 Rydberg 상수이다.의 수소의 경우 Z ({ Z 및 1({ n)이므로 이온화 전 원자의 에너지는 단순 - .6 V({ E이다.
이온화 후, 에너지는 양성자로부터 무한히 멀리 있는 움직임 없는 전자에 대해 0이 됩니다, 그래서 이온화 에너지는
- (+) - (H ) + (\ I(\(\{H.6\ \ 이는 수소 원자의 실험 값과 일치합니다.
양자역학적 설명
이 섹션은 이온화 에너지에 대한 더 많은 계산식을 사용하여 확장해야 합니다.추가해서 도움을 줄 수 있습니다. (2020년 9월) |
보다 완전한 양자역학 이론에 따르면, 전자의 위치는 전자 구름 내에서의 확률 분포, 즉 [44][45]원자 궤도로서 가장 잘 묘사된다.이 클라우드 상에 통합함으로써 에너지를 계산할 수 있습니다.구름의 근본적인 수학적 표현은 분자 스핀 [46]오비탈로 구성된 슬레이터 결정인자로 구성된 파동 함수입니다.이것들은 파울리의 배타 원리에 의해 원자 또는 분자 궤도의 반대칭 산물과 관련이 있다.
이온화 에너지를 계산하는 방법은 크게 두 가지가 있습니다.일반적으로 N번째 이온화 에너지를 계산하기 는- +1 ({ Z-N 및 - N ({ 스타일 전자계의 에너지를 계산해야 한다.이러한 에너지를 정확하게 계산하는 것은 가장 단순한 시스템(즉, 수소 및 수소 유사 요소)을 제외하고는 불가능하며, 이는 주로 전자 상관 [47]항을 통합하는 데 어려움이 있기 때문이다.따라서 경험적 데이터에 비해 복잡성(연산 시간)과 정확도가 다른 근사 방법을 일상적으로 사용한다.이것은 잘 연구된 문제가 되어 컴퓨터 화학에서 일상적으로 행해지고 있습니다.이온화 에너지를 계산하는 두 번째 방법은 주로 가장 낮은 수준의 근사치에서 사용되며, 여기서 이온화 에너지는 가장 높은 점유 분자 궤도 또는 "HOMO"와 가장 낮은 점유 분자 궤도 또는 "LUMO"를 포함하는 Koopmans의 정리에 의해 제공되며, 원자 또는 분자의 이온화 에너지는 e이다.전자가 [48]방출되는 궤도의 에너지에 적합해야 한다.이는 이온화 에너지가 HOMO 에너지와 같다는 것을 의미하며, 공식 방정식에서는 i -i {i} = - {i} = -i[49] }로 표기될 수 있습니다.
분자: 수직 및 단열 이온화 에너지

분자의 이온화는 종종 분자 기하학의 변화로 이어지며, 단열 에너지와 [50]수직 이온화 에너지의 두 가지 유형이 정의됩니다.
단열 이온화 에너지
분자의 단열 이온화 에너지는 중성 분자로부터 전자를 제거하는 데 필요한 최소 에너지 양이다. 즉, 중성 종(v" = 0 수준)의 진동 지면 상태와 양이온(v' = 0)의 에너지 차이이다.각 종의 특정한 평형 기하학은 이 값에 영향을 미치지 않는다.
수직 이온화 에너지
이온화에 의해 발생할 수 있는 분자 형상의 변화로 인해 중성종의 진동 지면 상태와 양이온의 진동 들뜸 상태 사이에 추가적인 변화가 존재할 수 있다.즉, 이온화는 진동 들뜸을 수반한다.이러한 전이의 강도는 Franck-Condon 원리에 의해 설명되며, Franck-Condon 원리는 가장 가능성이 높고 강도 높은 전이가 중성 분자와 동일한 기하학적 구조를 가진 양이온의 진동 들뜸 상태에 해당한다고 예측한다.이 전이를 "수직" 이온화 에너지라고 합니다.이는 전위 에너지 다이어그램에서 완전히 수직선으로 나타나기 때문입니다(그림 참조).
이원자 분자의 경우, 기하학은 단일 결합의 길이로 정의됩니다.결합 분자 궤도로부터 전자를 제거하면 결합이 약해지고 결합 길이가 늘어납니다.그림 1에서 낮은 퍼텐셜 에너지 곡선은 중성 분자에 대한 것이고, 위쪽 표면은 양이온에 대한 것이다.두 곡선 모두 결합 길이의 함수로 잠재적 에너지를 표시합니다.수평선은 관련된 진동파 함수와 함께 진동 수준에 해당합니다.이온은 결합이 약하기 때문에 결합 길이가 길어집니다.이 효과는 잠재 에너지 곡선의 최소값을 중립 종의 오른쪽으로 이동시킴으로써 나타난다.단열 이온화는 이온의 진동 접지 상태에 대한 대각 천이입니다.수직 이온화는 이온 상태의 진동 들뜸을 수반할 수 있으므로 더 큰 에너지를 필요로 합니다.
많은 상황에서 단열 이온화 에너지는 두 잠재적 에너지 표면 간의 에너지 차이를 설명하기 때문에 종종 더 흥미로운 물리적 양입니다.그러나 실험적인 한계로 인해 단열 이온화 에너지는 종종 측정이 어려운 반면 수직 이탈 에너지는 쉽게 식별할 수 있고 측정할 수 있다.
다른 시스템에 대한 이온화 에너지 아날로그
이 섹션은 어떠한 출처도 인용하지 않습니다.(2020년 9월 (이 및 ) |
이온화 에너지라는 용어는 주로 기상 원자, 양이온 또는 분자 종에만 사용되는 반면, 다른 물리적 시스템에서 전자를 제거하는 데 필요한 에너지의 양을 고려하는 많은 유사한 양이 있습니다.
전자 결합 에너지
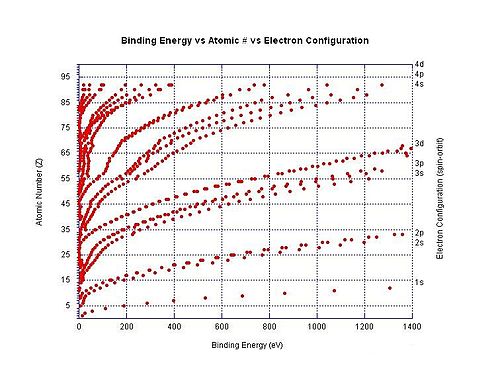
전자 결합 에너지는 양전하를 띤 [51]핵의 정전기 당김에 의해 음전하를 띤 전자가 제자리에 있기 때문에 원자 또는 이온을 위해 특정 전자 껍질에서 전자를 제거하는 데 필요한 최소 에너지를 총칭하는 것입니다.예를 들어 염화물 이온에서 3p3/2 전자를 제거하기 위한 전자결합 에너지는 염소 원자에서 전자를 제거하기 위해 필요한 최소 에너지량이다.이 특별한 예에서 전자 결합 에너지는 중성 염소 원자에 대한 전자 친화력과 같은 크기를 가진다.다른 예에서 전자결합 에너지는 디카르복실산디안OC2(CH2)8CO에서−
2 전자를 제거하기 위해 필요한 최소 에너지량을 의미한다.
오른쪽 그래프는 중성 원자의 다른 껍질에 있는 전자의 결합 에너지를 보여줍니다.이온화 에너지는 특정 원자의 결합 에너지 중 가장 낮은 에너지입니다(이러한 에너지가 그래프에 모두 나타나 있는 것은 아닙니다).
솔리드 서페이스: 작업 기능
작업 함수는 고체 표면에서 전자를 제거하는 데 필요한 최소 에너지 양입니다. 여기서 주어진 표면에 대한 작업 함수 W는 차이에[52] 의해 정의됩니다.
여기서 -e는 전자의 전하, θ는 표면 근처의 진공에서의 정전위, E는F 물질 내부의 페르미 수준(전자의 전기화학 퍼텐셜)이다.
메모
- ^ 그럼에도 불구하고, 이 단순한 추론을 입증하기 위해서는 추가적인 연구가 여전히 필요하다.
「 」를 참조해 주세요.
- 수소와 수소 유사 원소의 이온화 에너지를 결정할 수 있는 계산식인 Rydberg 방정식.이것은 이 사이트를 통해 더 자세히 설명되어 있다.
- 전자 친화력, 중성 원자 또는 분자에 전자를 추가함으로써 방출되는 에너지를 설명하는 밀접하게 관련된 개념입니다.
- 격자 에너지, 이온이 화합물을 만들기 위해 결합될 때 방출되는 에너지의 척도입니다.
- 전기음성도는 이온화 에너지와 몇 가지 유사점을 공유하는 수치다.
- 하트리에서의 예측 이온화 에너지에 관한 쿱만스의 정리-Fock 이론.
- 디퉁스텐 테트라(hpp)는 안정적인 화합물로는 가장 낮은 이온화 에너지를 가지고 있다.
- 결합이탈에너지, 두 개의 라디칼 조각 A와 B를 주고 이후 엔탈피 변화에 대한 평가를 호몰리시스에 의해 분해하여 계산한 화학결합의 강도 측정값
- 화학 결합의 강도에 대한 평균 척도인 결합 에너지는 모든 화학 결합을 개별 원자로 분해하는 데 필요한 열의 양을 통해 계산됩니다.
레퍼런스
- ^ "Periodic Trends". Chemistry LibreTexts. 2013-10-02. Retrieved 2020-09-13.
- ^ a b c Miessler, Gary L.; Tarr, Donald A. (1999). Inorganic Chemistry (2nd ed.). Prentice Hall. p. 41. ISBN 0-13-841891-8.
- ^ "Ionization Energy". ChemWiki. University of California, Davis. 2013-10-02.
- ^ "Chapter 9: Quantum Mechanics". faculty.chem.queesu.ca. January 15, 2018. Retrieved October 31, 2020.
- ^ a b c d Lang, Peter F.; Smith, Barry C. (August 2003). "Ionization Energies of Atoms and Atomic Ions". Journal of Chemical Education. 80 (8): 938. Bibcode:2003JChEd..80..938L. doi:10.1021/ed080p938.
- ^ IUPAC, 화학 용어집, 제2판('골드북') (1997).온라인 수정판: (2006–) "이온화 가능성".doi:10.1351/goldbook.I03208
- ^ Cotton, F. Albert; Wilkinson, Geoffrey (1988). Advanced Inorganic Chemistry (5th ed.). John Wiley. p. 1381. ISBN 0-471-84997-9.
- ^ Mahan, Bruce H. (1962). "Ionization Energy". College of Chemistry, University of California Berkeley. Retrieved 2020-09-13.
- ^ "Monatomic Gas - an overview ScienceDirect Topics". www.sciencedirect.com. Retrieved 2022-01-08.
- ^ a b Stone, E.G. (December 19, 2020v). "Atomic Structure : Periodic Trends". Department of Chemistry. chem.tamu.edu. 400 Bizzell St, College Station, TX 77843, Texas, United States: Texas A&M University. Retrieved December 19, 2020.
{{cite web}}: CS1 유지보수: 위치(링크) - ^ "Anomalous trends in ionization energy". Chemistry Stack Exchange. Retrieved 2020-09-20.
- ^ Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). General Chemistry (8th ed.). Prentice Hall. p. 370. ISBN 0-13-014329-4.
- ^ a b Grandinetti, Philip J. (September 8, 2019). "Ionization Energy Trends Grandinetti Group". www.grandinetti.org. Retrieved 2020-09-13.
- ^ Kent, Mr. "First Ionization Energy". kentchemistry.com. KentChemistry. Retrieved December 6, 2020.
...The addition of the second electron into an already occupied orbital introduces repulsion between the electrons, thus it is easier to remove. that is why there is a dip in the ionization energy.
- ^ "Group IA". chemed.chem.purdue.edu. Retrieved 2020-09-20.
- ^ "Alkali Metals". hyperphysics.phy-astr.gsu.edu. Retrieved 2020-09-13.
- ^ "The Alkali Metals Introduction to Chemistry". courses.lumenlearning.com. Retrieved 2020-09-13.
- ^ "Chemical elements listed by ionization energy". lenntech.com. Lenntech BV. 2018. Retrieved December 6, 2020.
The elements of the periodic table sorted by ionization energy click on any element's name for further information on chemical properties, environmental data or health effects. This list contains the 118 elements of chemistry.
- ^ Boudreaux, K.A. (August 13, 2020) [July 26, 2006]. "The Parts of the Periodic Table". Department of Chemistry and Biochemistry. angelo.edu/faculty/kboudrea/. 2601 W. Avenue N, San Angelo, TX 76909, Texas: Angelo State University. Retrieved December 19, 2020 – via angelo.edu.
{{cite web}}: CS1 유지보수: 위치(링크) - ^ "18.10: The Group 6A Elements". Chemistry LibreTexts. 2014-07-02. Retrieved 2020-09-20.
- ^ "Covalent Radius for all the elements in the Periodic Table". periodictable.com. Retrieved 2020-09-13.
- ^ Sikander (December 5, 2015). "Why is ionisation energy of bismuth lower than lead?". chemistry.stackexchange.com. Chemistry Stack Exchange. Retrieved December 5, 2020.
Why is ionisation enthalpy of Bismuth less than that of Lead for it just comes after the latter in periodic table?
- ^ Ball, Philip (April 21, 2017). "The group 3 dilemma". chemistryworld.com. Burlington House, Piccadilly, London: Chemistry World. Retrieved December 18, 2020 – via Royal Society of Chemistry.
- ^ Yirka, Bob (April 9, 2015). "Measurement of first ionization potential of lawrencium reignites debate over periodic table". General Physics. phys.org. Phys Org. Phys.org. Retrieved December 13, 2020.
Lawrencium, at this time, appears to have a dumb-bell shape. These new findings create conflicting views on where the element should be placed on the table and has reignited debate on the way the table is structured in general.
- ^ Scerri, Eric R.; Parsons, William (March 2017). "What elements belong in group 3 of the periodic table?". www.ionicviper.org. Ionic Viper. Retrieved December 7, 2020.
The question of precisely which elements should be placed in group 3 of the periodic table has been debated from time to time with apparently no resolution up to this point.
- ^ Sato, T. K.; Asai, M.; Borschevsky, A.; Stora, T.; Sato, N.; Kaneya, Y.; Tsukada, K.; Düllmann, Ch E.; Eberhardt, K.; Eliav, E.; Ichikawa, S.; Kaldor, U.; Kratz, J. V.; Miyashita, S.; Nagame, Y.; Ooe, K.; Osa, A.; Renisch, D.; Runke, J.; Schädel, M.; Thörle-Pospiech, P.; Toyoshima, A.; Trautmann, N. (April 2015). "Measurement of the first ionization potential of lawrencium, element 103". Nature. 520 (7546): 209–211. Bibcode:2015Natur.520..209S. doi:10.1038/nature14342. PMID 25855457. S2CID 4384213.
- ^ Singh, Jasvinder (1999). "Inert Gases". Sterling Dictionary of Physics. Sterling Publishers Pvt. Ltd. p. 122. ISBN 978-81-7359-124-2.
- ^ "Vanadium, Niobium and Tantalum". Chemistry of the Elements. 1997. pp. 976–1001. doi:10.1016/B978-0-7506-3365-9.50028-6. ISBN 978-0-7506-3365-9.
- ^ Housecroft, C.E.; Sharpe, A.G. (November 1, 1993). Inorganic Chemistry (eBook). Inorganic Chemistry. Vol. 3 (15th ed.). Switzerland: Pearson Prentice-Hall. pp. 536, 649, 743. doi:10.1021/ed070pA304.1. ISBN 978-0-273-74275-3. Archived from the original on December 16, 2015. Retrieved December 14, 2020.
- ^ a b Cotton, F. Albert; Wilkinson, Geoffrey (1988), Advanced Inorganic Chemistry (5th ed.), New York: Wiley-Interscience, pp. 776, 955, ISBN 0-471-84997-9
- ^ Billo, E. J. (1985). "Modern Inorganic Chemistry (Jolly, William L.)". Journal of Chemical Education. 62 (4): A137. Bibcode:1985JChEd..62..137B. doi:10.1021/ed062pA137.1.
- ^ "Patterns and trends in the periodic table - Periodicity - Higher Chemistry Revision". BBC Bitesize. Retrieved 2020-09-20.
- ^ "Ionization Energies". Chemistry LibreTexts. 2013-10-03. Retrieved 2020-09-20.
- ^ "IYPT 2019 Elements 087: Francium: Not the most reactive Group 1 element". Compound Interest. 2019-11-06. Retrieved 2020-09-20.
- ^ "Hafnium". gordonengland.co.uk. Gordon England. 2020. Retrieved December 7, 2020.
...Atomic Radius 159 pm...
- ^ "Zirconium (Element) - Atomic Radius". pubchem.ncbi.nlm.nih.gov. PubChem. Retrieved December 8, 2020.
155 pm (Empirical)
- ^ Slater, J. C. (15 November 1964). "Atomic Radii in Crystals". The Journal of Chemical Physics. 41 (10): 3199–3204. Bibcode:1964JChPh..41.3199S. doi:10.1063/1.1725697.
- ^ "WebElements Periodic Table » Titanium » radii of atoms and ions". www.webelements.com. Retrieved 2020-09-20.
- ^ Straka, J. "Periodic Table of the Elements: Zirconium - Electronic configuration". www.tabulka.cz. Retrieved 2020-09-20.
- ^ "Tantalum chemical element". Encyclopedia Britannica. Retrieved 2020-09-20.
- ^ Langård, Sverre (2015). "Chromium, Molybdenum, and Tungsten". Patty's Toxicology. doi:10.1002/0471435139.tox038. ISBN 978-0-471-12547-1.
- ^ "The Group 14 elements". Chemistry Nexus. 2015-12-02. Retrieved 2020-09-13.
- ^ Bohr, N. (July 1913). "I. On the constitution of atoms and molecules". The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 26 (151): 1–25. doi:10.1080/14786441308634955.
- ^ "Orbitals, Electron Clouds, Probabilities, and Energies". chem.libretexts.org. UC Davis ChemWiki. May 23, 2019. Retrieved November 2, 2020.
- ^ "Quantum numbers and orbitals- The quantum mechanical model of the atom". Khan Academy. Retrieved November 2, 2020.
- ^ Levine 1991, 페이지 315: "하트리-폭 근사에서 원자(또는 분자)의 파동 함수는 슬레이터 결정인자 또는 소수의 슬레이터 결정인자의 선형 조합이다."
- ^ Levine 1991, 페이지 290–291.
- ^ Levine 1991, 페이지 475
- ^ "Background Reading for Ionization Energy". shodor.org. The Shodor Education Foundation, Inc. 2000. Retrieved November 15, 2020.
... The second method is called Koopman's Theory. This method involves the HOMO.
- ^ "The difference between a vertical ionization energy and adiabatic ionization energy". Computational Chemistry Comparison and Benchmark Database. National Institute of Standards and Technology.
- ^ Murphy, Andrew; Wong, Monica (2019). "Electron binding energy". radiopaedia.org. Radiopaedia. Retrieved December 7, 2020.
The electron binding energy is the minimum energy that is required to remove an electron from an atom
- ^ Kittel, Charles (January 1, 1996) [1953]. "6". In Zainab, R.; Du, D.; Tanner, B.K.; Chambers, R.G. (eds.). Introduction to Solid State Physics. Physics Today. Vol. 7. New York, USA: John Wiley & Sons, Inc. (published 1995). pp. 18–19. Bibcode:1969Natur.224..983C. doi:10.1063/1.3061720. ISBN 978-0-471-11181-8. LCCN 95-018445. OCLC 263625446. S2CID 121571376. Archived from the original on January 13, 2017. Retrieved December 18, 2020.[페이지 필요]
원천
- Levine, Ira N. (1991). Quantum Chemistry. Prentice Hall. ISBN 978-0-205-12770-2.









 이온화 전 원자의 에너지는 단순
이온화 전 원자의 에너지는 단순