트리스(아세틸라세토나토)철(III)
Tris(acetylacetonato)iron(III)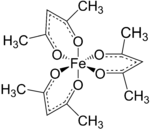 | |
 | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 트리스(2,4-dioxopentan-3-ido-κO2,O′)철 | |
| 기타 이름 철(III) 아세틸라세토나이트, 철(III) 트리스(2,4-펜타네디오나토), 페(acac)3 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.034.398 |
| EC 번호 |
|
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| Fe(C5H7O2)3 | |
| 어금질량 | 353.17 g/190 |
| 외관 | 레드 솔리드 |
| 밀도 | 1.348 g/cm3 |
| 녹는점 | 180~181°C(356~358°F, 453~454K) |
| 비등점 | 부패하다 |
| 2 g/L | |
| 위험 | |
| GHS 라벨 표시:[1] | |
  | |
| 위험 | |
| H302+H312+H332, H318 | |
| P261, P280, P301+P312, P302+P352+P312, P304+P340+P312, P305+P351+P338 | |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
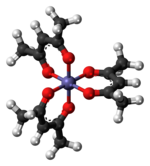
흔히 Fe(acacac)로 약칭되는 트리스(acetylacetonato) 철(III)3은 아세틸라세토나이트(acacac) 리간드가 특징인 철골 조정 복합체로 금속 아세틸라세토나이트 계열 중 하나이다. 그것은 비극성 유기 용매에 용해되는 적색 공기안정성 고체다.
준비
새로 침전된 Fe(3OH)3를 아세틸라세톤으로 처리하여 Fe(acac)를 준비한다.[2]
- Fe(OH)3 + 3 HCHO572 → Fe(CHO572)3 + 3 HO2
구조 및 특성
Fe(acc)3는 접착 거리가 약 2.00 å인 6개의 동등한 Fe-O 결합을 가진 팔면체 복합체다. 규칙적인 기하학은 고 스핀 Fe3+ 코어와 일치한다. 금속 궤도가 모두 고르게 점유되어 있기 때문에 이 단지는 얀-텔러 왜곡의 영향을 받지 않기 때문에3 D 분자 대칭을 채택한다. 이와는 대조적으로 관련 금속 아세틸라세토나이트 Mn(acacac)3은 더 왜곡된 팔면 구조를 채택한다.[3] 또한 5개의 d-전자가 손상되지 않은 경우 복합체가 파라마그네틱으로 되어 자기 모멘트가 5.90μs이다B.
Fe(acac)3는 쾌활하다. Δ-와 Δ- 에나토머는 Bayar와 Ray-Dutt를 통해 천천히 상호 변환한다. 상호 변환 속도는 그것의 항산화제가 부분적으로 해결될 수 있을 정도로 충분히 느리다.[4]
반응
Fe(acc)3는 유기화학에서 선행촉매 및 시약으로 검사되어 왔으나, 이러한 과정에서 활성 철 함유 종은 보통 확인되지 않는다. 한 예로, Fe(acacc)3는 디엔과 올레핀의 교차 결합을 촉진하는 것으로 나타났다.[5] Fe(acc)3는 이소프렌의 조광화를 촉진하여 1,5-디메틸-1,5-사이클로옥타디엔과 2,5-디메틸-1,5-사이클로옥타디엔을 혼합한다.[6]
Fe(acc)3는 또한 1,3-벤조소자신의 링 개방 중합에 촉매 작용을 한다.[7] 중합 영역을 넘어 올레핀으로 N-설포닐옥사지리딘의 반응을 촉진시켜 1,3-옥사졸리딘 제품을 형성하는 Fe(acacc)3가 검출됐다.[8]
참조
- ^ GHS: 시그마알드리히 517003
- ^ 미국 특허권 2004127690, Chaudhari, Mihir Kanti 외, "금속 아세틸라세토나이트를 만드는 과정" 2004-07-01을 발행했다.
- ^ Lawson, K.E. (1961). "The infrared absorption spectra of metal acetylacetonates". Spectrochimica Acta. 17 (3): 248–258. doi:10.1016/0371-1951(61)80071-4.
- ^ 안데르스 레나트슨 "광학적 해상도 및 [Fe(acac)]3 레이스화" Inorganica Chimica Acta 2011, vol. 365, 페이지 451–453. doi:10.1016/j.ica.2010.07.066
- ^ Takacs, J. A., L.; Madhavan, G.V.; Creswell, M.; Seely, F.; Devroy, W. (1986). "Iron-Catalyzed Aminohydroxylation of Olefins". Organometallics. 5 (11): 2395–2398. doi:10.1021/om00142a044.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Misono, A. (1966). "Oligomerization of isoprene by cobalt or iron complex catalysts". Bulletin of the Chemical Society of Japan. 39 (11): 2425–2429. doi:10.1246/bcsj.39.2425.
- ^ Sudo, A.; Hirayama, Shoji; Endo, Takeshi (2010). "Highly efficient catalysts-acetylacetonato complexes of transition metals in the 4th period for ring-opening polymerization of 1,3-benzoxazine". Journal of Polymer Science Part A: Polymer Chemistry. 48 (2): 479. doi:10.1002/pola.23810.
- ^ Williamson, K. T.; Yoon, T. (2010). "Iron-Catalyzed Aminohydroxylation of Olefins". J. Am. Chem. Soc. 132 (13): 4570–4571. doi:10.1021/ja1013536. PMC 2857537. PMID 20232850.





