페로센
Ferrocene| | |||
| | |||
| 이름 | |||
|---|---|---|---|
| 선호 IUPAC 이름 페로센[1] | |||
기타 이름
| |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 체비 | |||
| 켐스파이더 | |||
| ECHA InfoCard | 100.002.764 | ||
펍켐 CID | |||
| 유니 | |||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 특성. | |||
| C10H10Fe | |||
| 어금질량 | 186.04 g/186 | ||
| 외관 | 연한 오렌지 가루 | ||
| 냄새 | 장뇌 같은 | ||
| 밀도 | 1.107 g/cm3(0°C), 1.490 g/cm3(20°C)[2] | ||
| 녹는점 | 172.5°C(342.5°F, 445.6K)[4] | ||
| 비등점 | 249°C(480°F, 522K) | ||
| 물에 불용성, 대부분의 유기 용제에 용해성 | |||
| 로그 P | 2.04050 [3] | ||
| 구조 | |||
| D5d / D5h / D5 | |||
| 메탈로세 | |||
| 급격한 Cp 회전으로[5] 인한 영구 이중극 모멘트 없음 | |||
| 위험 | |||
| NFPA 704(화재 다이아몬드) | |||
| NIOSH(미국 건강 노출 제한): | |||
PEL(허용) | TWA 15mg/m3(총량) TWA 5mg/m3(resp)[6] | ||
REL(권장) | TWA 10mg/m3(총량) TWA 5mg/m3(resp)[6] | ||
IDLH(즉시 위험) | N.D.[6] | ||
| 관련 화합물 | |||
관련 화합물 | 코발토센, 니켈로센, 크로모센, 루테노센, 오스모센, 플럼보센 | ||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
페로센은 이 공식을 가진 유기농 화합물이다. Fe(CH55).2 분자는 중심 철 원자에 묶인 두 개의 사이클로펜타디엔틸 링으로 구성된 복합체다. 그것은 실내 온도보다 높은 향수를 가진 주황색 고체로 대부분의 유기 용매에 용해된다. 공기, 물, 강한 염기 등에 영향을 받지 않고 분해 없이 400℃까지 가열할 수 있다는 안정성이 돋보인다. 산화 조건에서는 강한 산과 역반응하여 페로세늄 양이온(CH55)+2를 형성할 수 있다.[8]
유기농 화학의 급속한 성장은 페로센의 발견으로 인한 흥분과 그 많은 유사점(메탈로세네)에 기인하는 경우가 많다.
역사
디스커버리
페로센은 우연히 세 번 발견되었다. 최초의 알려진 합성은 1940년대 후반에 유니온 카바이드의 알려지지 않은 연구자들에 의해 만들어졌을지도 모른다. 그는 뜨거운 시클로펜타디엔 증기를 쇠파이프를 통해 통과시키려고 했다. 증기는 파이프 벽과 반응하여 "노란색 슬러지"를 만들어 파이프를 막았다. 몇 년 후, E. Brim이 Kealy와 Pausson의 기사를 읽은 직후에 저장해둔 슬러지의 샘플을 입수하여 분석한 결과, 페로센으로 구성된 것으로 밝혀졌다.[8][9]
두 번째가 1950년 무렵에 S. 밀러, J. 테보스, J.가 있었다. 영국산소의 연구원인 트레메인은 하버 과정을 수정하여 탄화수소와 질소로부터 아민을 합성하려고 시도하고 있었다. 대기압에서 300 °C에서 질소로 시클로펜타디엔을 반응시키려 했을 때, 그들은 탄화수소가 철의 어떤 공급원과 반응하여 페로센을 산출하는 것을 보고 실망했다. 그들은 그것의 놀라운 안정성을 너무 관찰하면서도, 파우슨이 그의 발견을 보고한 후에야 그 관찰을 제쳐두고 발표하였다.[8][10][11] 실제로 킬리와 파우손은 밀러 외 연구진으로부터 샘플을 제공받았는데, 밀러 외 연구진은 이 제품들이 같은 화합물임을 확인했다.[9]
1951년 듀크스네 대학의 피터 L. 파우슨과 토마스 J. 킬리는 사이클로펜타디엔(CH56)의 산화적 조광화에 의해 풀발렌(CH54)2을 준비하려고 시도하였다. 이를 위해 그들은 디에틸에테르에서 그리냐드 화합물 사이클로펜타디엔틸 마그네슘 브롬화물을 산화제로 하여 반응시켰다.[8] 그러나 기대되는 풀발렌 대신 CHFe라는1010 공식과 함께 "제거할 수 있는 안정성"의 연한 오렌지색 가루를 얻었다.[9][12]
구조 결정

파우슨과 킬리는 이 화합물이 두 개의 사이클로펜타디닐 그룹을 가지고 있으며, 각각 포화 탄소 원자에서 철 원자에 이르는 단일 공동 결합을 가지고 있다고 추측했다.[8] 그러나 그 구조는 당시의 본딩 모델과 일관되지 않았고 화합물의 예기치 않은 안정성을 설명하지 못했으며, 화학자들은 정확한 구조를 찾기 위해 애썼다.[11][13]
이 구조물은 1952년에 세 그룹에 의해 독립적으로 추론되고 보고되었다.[14]
- Woodward와 Wilkinson은 페로센이[15] 벤젠과 같은 방향성 화합물의 전형적인 반응을 겪는 것을 관찰함으로써 그것을 추론했다.
- E. Fischer는 구조("더블 콘"이라고 부름)를 추론하고 니켈로세, 코발토센과 같은 다른 야금류를 합성하기도 했다.[16][17][18]
- P. F. 에일랜드와 R. Pepinsky는 엑스선 결정학을 통해 그리고 후에 NMR을 통해 그 구조를 확인했다.[11][19][20][21]
구조 이해
페로센의 "샌드위치" 구조는 충격적일 정도로 새롭고, 새로운 이론을 설명해야 했다. 두 사이클로펜타디엔아이드 음이온 CH-55 사이에 Fe2+ 중심을 가정하여 분자 궤도 이론을 적용하면 드와르-채트-던칸슨 모델에 성공하여 분자의 기하학적 구조를 정확하게 예측할 수 있을 뿐만 아니라 그 놀라운 안정성을 설명할 수 있었다.[22][23]
임팩트
페로센은 알려진 최초의 유기농 화합물이 아니었다. Zeise 소금 K[PtCl3(CH24)]·HO는2 1831년에 보고되었고,[24][25] 몬드의 니(4CO) 발견은 1888년에 일어났으며,[26] 유기석화합물은 1930년대에 개발되었다.[27] 그러나, 화학의 별도 영역으로서 유기농 화학에 착수한 것은 페로센의 발견이었다고 주장할 수 있다. 그것은 또한 탄화수소와 d-블록 금속의 화합물에 대한 관심 폭발로 이어졌다.
이번 발견은 윌킨슨과 피셔가 1973년 노벨 화학상을 "샌드위치 화합물이라 불리는 유기농 화학에 대해 독자적으로 수행된 그들의 선구적 업적으로" 공동 수상했다.[28]
구조 및 본딩
뫼스바우어 분광법은 페로센의 철 중심부에 +2 산화 상태를 할당해야 함을 나타낸다. 그런 다음 각 사이클로펜타디닐(Cp) 링에 음전하를 1회 할당해야 한다. 이리하여 페로센은 철로 설명할 수 있었다.II) bis(사이클로펜타디엔화), Fe2+[CH-55].2
각 고리에 붙어 있는 π전자의 수는 그 후 6명이므로 후켈의 규칙에 따라 방향성이 있다. 이 12개의 π 전자는 공밸런트 본딩을 통해 금속과 공유된다. Fe는2+ 6개의 d전자를 보유하고 있기 때문에 이 단지는 18전자의 구성을 갖추고 있어 안정성이 높다. 현대 표기법에서는 페로센 분자의 이 샌드위치 구조 모델을 Fe((-CH555)로 표기한다.2
각 5-membed 링 주위의 탄소-탄소 결합 거리는 모두 1.40 å이고 Fe-C 결합 거리는 모두 2.04 å이다. 상온에서 164K까지 내려가면 X선 결정학은 단핵 공간 그룹을 산출한다. 사이클로펜타디엔티나이드 링은 시차적으로 일치하므로 중심대칭 분자는 D를 갖는5d 것이다.[19] 그러나 110K 이하에서는 Perrocene이 Cp 링을 주문하고 에클립하여 분자가 대칭군 D를5h 갖도록 하는 Orthorhombic crystal lattice에서 결정화된다.[29] 가스 단계에서 전자 회절과[30] 계산 연구는[31] Cp 링이 에클립된 것을 보여준다.
Cp 링은 H 및 C 핵자기공명 분광법을 사용한 페로센 대체 파생 모델에 대한 측정에서 관찰한 바와 같이 Cp-Fe-Cp(centroid)(centroid) 축에 대한 낮은 장벽으로 회전한다. 예를 들어, 메틸페로센(CHCHFeCH35455)은 CH55 링을 위한 싱글릿을 보여준다.[32]
합성
산업합성
산업적으로 페로센은 철의 반응에 의해 합성된다.II) 사이클로펜타디엔을 포함한 이산화철, [33](II) 필요한 이산화질소는 무수 에탄올에서 금속 철의 전기화학적 산화에 의해 생성된다. 철의 반응 이후.II) 이산화물과 시클로펜타디엔은 부산물로 에탄올을 생산하며, 에탄올은 효과적으로 전체 반응의 촉매 역할을 하며, 순 반응은 Fe + 2CH56 → H2 + Fe(CH55)(2아래 참조)이다.
비아 그리그나드 시약
처음 보고된 페로센 합성은 거의 동시에 이루어졌다. 파우슨과 킬리는 염화 철(III)과 그리냐드 시약, 사이클로펜타디닐 마그네슘브로마그네슘을 사용하여 페로센을 합성한다. 염화 철(III)은 무수 디에틸에테르에 매달린 후 그리니드 시약에 첨가한다.[12] 리독스 반응이 일어나, 사이클로펜타디엔틸 래디컬과 철을 형성한다().II) 이온. 디하이드로풀발렌은 철이 있는 동안 급진-방사성 재조합에 의해 생성된다.II)는 그리그나드 시약과 반응하여 페로센을 형성한다. 킬리와 파우슨이 추구하는 결과물인 철(III)으로 디히드로풀발렌에서 풀발렌으로의 산화는 일어나지 않는다.[9]
기체-금속반응

페로센의 또 다른 초기 합성은 밀러 외 연구진에 의해 이루어졌다. [10]밀러 외 연구진은 금속 철을 높은 온도에서 기체 위상 사이클로펜타디엔과 직접 반응시켰다.[34] 철 펜타카르보닐을 이용한 접근법도 보고되었다.[35]
- Fe(CO)5 + 2 C5H6(g) → Fe(C5H5)2 + 5 CO(g) + H2(g)
알칼리 사이클로펜타디엔아이드 경유
보다 효율적인 준비 방법은 일반적으로 상용화된 시클로펜타디엔화[36] 나트륨 또는 새로 균열된 시클로펜타디엔을 수산화칼륨으로[37] 디프로토네이트하고 무수철로 반응하는 것을 사용한 원래의 전송순서의 수정이다(().II) ethereal 용제의 염화물.
파우손과 킬리의 원래 그리냐드 접근법의 현대적인 수정은 다음과 같이 알려져 있다.
- 사이클로펜타디엔화 나트륨 사용: 2 NaCH55 + FeCl2 → Fe(CH55)2 + 2 NaCl
- 새로 크래킹한 사이클로펜타디엔 사용: FeCl2/4HO2 + 2 CH56 + 2 KOH → Fe(CH55)2 + 2 KCl + 6 HO2
- 다리미 사용().II) Grignard 시약을 사용한 소금: 2 CHMgBr55 + FeCl2 → Fe(CH55)2 + 2 MgBrCl
일부 아민 염기(예: 디에틸아민)도 디프로토닌에 사용할 수 있지만, 강한 염기를 사용할 때보다 반응이 더 느리게 진행된다.[36]
- 2CH56 + 2(CHCH32)2NH + FeCl2 → Fe(CH55)2 + 2 (CHCH32)2NHCl2
직접 투과법은 만가노센과 같은 다른 야금류의 페로센을 준비하는데도 사용될 수 있다.[38]
- FeCl2 + Mn(CH55)2 → MnCl2 + Fe(CH55)2
특성.
페로센은 캠포르와 같은 냄새가 나는 공기안정성 오렌지 고형분이다. 대칭적이고 충전되지 않은 종에서 예상했듯이 페로센은 벤젠과 같은 일반적인 유기 용매에 용해되지만 물에서는 용해되지 않는다. 400 °C의 높은 온도에서도 안정적이다.[39]
페로센은 특히 진공 상태에서 가열할 때 쉽게 파괴된다. 증기압은 25℃에서 약 1Pa, 50℃에서 10Pa, 80℃에서 100Pa, 116℃에서 1000Pa, 162℃에서 약 10,000Pa(약 0.1atm)이다.[40][41]
반응
전기소자 포함
페로센은 방향성 화합물의 많은 반응을 일으켜 대체 유도체를 준비할 수 있다. 일반적인 학부 실험은 인산이 촉매로 존재하는 상태에서 페로센의 아세트산 무수화물(혹은 아세틸 염화물) 반응이다. 마니치 반응 조건 하에서 페로센은 N,N-디메틸아미노메틸프로세르로센을 투여한다.
페로센 양성화를 통해 [CpFeH2]PF를 분리할 수 있다.6[42]
염화알루미늄 염화물 MeNPCl과22 페로센이 반응하여 페로세닐 디클로로인산염을 생성하는 반면,[43] 유사한 조건에서 페닐디치클로인산염으로 처리하면 P,P-디퍼로세닐-P-페닐인산염이 형성된다.[44]
페로센은 PS와410 반응하여 이황화 디페로세닐-디티피아디페탄 이황화물을 형성한다.[45]
석회화
페로센은 부틸리튬과 반응하여 다용도 핵포함인 1,1′-딜리시오페로센을 준다. 테르트-부틸리튬은 모놀리스오페로센을 생산한다.[46] 딜리시오페로센은 S8, 클로로포인산염, 클로로실란스와 반응한다. 변형된 화합물은 고리 개방 중합 과정을 거친다.[47]
인광 리간드 1,1'-bis(디페닐인산소)페로센(dppf)은 딜리시오페로센으로부터 준비된다.
레독스 화학
페로센은 약 0.5V에서 포화칼로멜 전극(SCE) 대비 1전자의 산화를 겪으며 페로세늄이 된다. 이 가역성 산화는 표준 수소 전극 대비 Fc+/Fc = 0.40V로 전기화학에서 표준으로 사용되어 왔다.[48] 페로세늄 테트라플루오보오보트는 일반적인 시약이다.[49] 현저하게 가역성이 있는 산화 저감 작용은 전기화학 및[50][51] 광화학[52][53] 시스템에서 전자 전달 과정을 제어하는 데 광범위하게 사용되어 왔다.

사이클로펜타디엔틸 리간드의 대체물은 기대되는 방식으로 리독스 전위를 변화시킨다. 카복실산과 같은 전자 유출 그룹은 전위를 음극 방향으로 이동시킨다(즉, 더 양성화되었다). 메틸 그룹과 같은 전자 방출 그룹은 전위를 음극 방향으로 이동시킨다(더 부정적이다). 따라서 데카메틸페로센은 페로센보다 훨씬 쉽게 산화되며 심지어 해당 도화까지 산화될 수 있다.[54] 페로센은 비수성 전기화학에서 리독스 전위를 교정하기 위한 내부 표준으로 자주 사용된다.
대체페로센의 입체화학
불분명한 페로센은 1,2, 1,3 또는 1,1102-등분자로 존재할 수 있으며, 이 중 어느 것도 상호 변환이 불가능하다. 한 링에서 비대칭적으로 불분명한 페로센은 키랄이다. 예를 들어 [CpFe(EtCHMe53)] 이 평면적 운율성은 단 하나의 원자가 입체적인 중심이 아님에도 불구하고 발생한다. 오른쪽(4-(디메틸아미노)피리딘 유도체)에 표시된 대체 페로센은 경혈성 2차 알코올의 운동 분해능에 사용될 때 효과가 있는 것으로 나타났다.[55] 페로센을 비대칭적으로 기능하기 위해 몇 가지 접근법이 개발되었다.[56]
페로센과 그 파생상품의 응용
페로센과 그 수많은 파생상품은 대규모 용도가 없지만 특이한 구조(리건스캐슬, 제약 후보물질), 강건성(노크방지 제형, 재료의 전구체), 레독스(리전트 및 레독스 표준)를 활용하는 틈새 용도가 많다.
리간드 비계로서
치랄 페로세닐 인산염은 전이-금속 촉매 반응을 위한 리간드로 사용된다. 그들 중 일부는 의약품과 농화학물질의 합성에서 산업적 응용을 발견했다. 예를 들어, 디프인산염 1,1bis-bis(디페닐인산티노)페로센(dppf)은 팔라듐-커플링반응을 위한 값진 리간드로, 요시포스 리간드는 수소화촉매에 유용하다.[57] 그것들은 첫 번째 것을 만든 기술자인 조시 풀레오의 이름을 따서 지어졌다.[58][59]

연료첨가물
페로센과 그 파생상품은 가솔린 엔진의 연료에 사용되는 항익녹화제다. 그것들은 이전에 사용된 테트라에틸리드보다 안전하다.[60] 무연휘발유에 페로센을 함유한 가솔린 적층 솔루션을 추가하여 납으로 설계된 빈티지 자동차에 사용할 수 있게 할 수 있다.[61] 페로센으로 형성된 철 함유 침전물은 스파크 플러그 표면에 전도성 코팅을 형성할 수 있다. 페로센 유도체와 대체 다이드록시 알코올 사이에 폴리 응축 반응을 일으켜 준비된 페로센 폴리글리콜 복합체는 로켓 추진체의 구성 요소로서 유망하다. 이들 복합체는 로켓 추진체에 열 안정성을 제공하며, 추진체 바인더 역할을 하며 추진체 연소율을 제어한다.[62]
페로센은 석탄을 태울 때 발생하는 연기와 삼산화황의 감소에 효과가 있는 것으로 밝혀졌다. 석탄에 침전시키거나 페로센을 연소실에 첨가하는 어떤 실용적인 수단을 통해서라도, 비록 적은 양의 금속 사이클로펜타디엔닐 화합물이라도 이러한 바람직하지 않은 부산물의 양을 현저하게 줄일 수 있다.[63]
제약
페로센 유도체는 마약으로 조사되어 왔다.[64] 오직 한 가지 약품만이 항생제인 페로퀴인(7-클로로-N-) 메틸(dimethyl)페로세닐) 퀴놀린-4-아민(kinolin-4-amine) 임상시험에 들어갔다.[65][66] 페로센 함유 폴리머 기반 약물 전달 시스템이 조사되었다.[67]
페로센 유도체의 항암 활성은 아민이나 아미드 그룹이 있는 유도체를 림프구 백혈병에 대해 검사한 1970년대 후반에 처음 조사되었다.[68] 일부 페로세늄염은 항암작용을 보이나 병원 내에서는 아직 어떤 화합물도 평가되지 않았다.[69] 페로센 유도체는 인간 폐암 세포선 A549, 대장암 세포선 HCT116, 유방암 세포선 MCF-7에 대해 강한 억제 활성을 가진다.[70] 타목시펜의 페로케닐 버전인 실험 약물이 보고되었다.[71] 타목시펜이 에스트로겐 결합 부위와 결합하여 세포독성을 발생시킨다는 생각이다.[71][72]
페로시펜스는 Pr에 의해 설립된 프랑스의 생명공학인 페로스칸에 의해 암 응용에 이용된다. 제라드 자우엔
고체 로켓 추진제
페로센과 관련 유도체는 과염소산 암모늄 복합 추진체에서 강력한 연소율 촉매로 사용된다.[73]
파생상품 및 변동
페로센 아날로그는 사이클로펜타디엔틸의 변형으로 준비될 수 있다. 예를 들어, 비신데닐론과 비스플루오레니릴론이다.[59]
탄소 원자는 Fe(η-CMe555)(η-P55)와 Fe(η-CH555)( ("-CHN544)("azaferrocene")로 도해한 바와 같이 헤테로톰으로 대체될 수 있다. 아자페로센은 사이클로헥산(Cyclohexane)에서 Fe((-CH555)(CO)((-2pyrrole1)의 디카르보닐화에서 발생한다.[74] 벤젠의 역류 상태에서 끓일 때 이 화합물은 페로센으로 변환된다.[75]
대체의 용이성 때문에 구조적으로 특이한 페로센 파생상품이 많이 준비되었다. 예를 들어,[76] 펜타(페로세닐)사이클로펜타디엔틸 리간드는 5개의 페로센 대체물로 파생된 사이클로펜타디엔틸 아니온을 특징으로 한다.
헥사페로세닐벤젠, C6[((-CH554)Fe(η-CH555)]6에서 벤젠 분자의 모든 6개 위치에는 페로세닐 대체물(R)이 있다.[77] 이 화합물의 X선 회절 분석은 사이클로펜타디엔틸 리간드가 벤젠 코어와 공동 평면적이 아니라 +30°와 -80°의 다이오드 각도가 있음을 확인한다. 강낭콩의 혼잡으로 인해 강낭콩은 177° 각도로 약간 구부러지고 C-Fe 결합이 길다. 4분위 사이클로펜타디엔틸 탄소원자도 피라미드화된다. 또한 벤젠 코어는 14°의 강직 각도로 의자가 일치하며 142.7 - 141.1 사이의 결합 길이 교대 현상을 표시하며, 이는 대체물의 강직 혼잡의 두 가지 징후는 모두 142.7 - 141.1이다.
헥사페르로세닐벤젠 합성은 헥사오다이도벤젠과 디퍼로세닐진치의 네기시 결합을 사용하고, 트리스(디벤질리덴아세톤)디팔라듐(0)을 촉매로 사용하여 테트라하이드로푸란에서 보고되었다.[77]
수확량은 4%에 불과하며, 이는 아레네 핵 주변의 상당한 강직물 혼잡과 일치하는 추가 증거다.
재료 화학
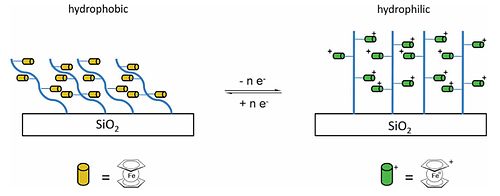
철 나노입자의 전구체인 페로센은 탄소 나노튜브 생산의 촉매제로 활용될 수 있다.[79] 빈혈로센은 알데히드, 인산염, 수산화나트륨의 위티그 반응에 의해 만들어질 수 있다.[80] 비닐 페로센은 폴리스티렌(Polyvinylferrocene, PVFc)의 페로세닐 버전인 폴리페르티렌(페닐 그룹은 페로세닐 그룹으로 대체됨)으로 변환할 수 있다. 형성될 수 있는 또 다른 폴리페로센은 폴리(2-(메타크릴로일록시) 에틸페로센카르복시산), PFCMA이다. 이러한 펜던트페로센 유닛은 유기 고분자 백본 사용 외에도 폴리실록산, 폴리인스포세네, 폴리인스포노보레인(-PH)과 같은 무기체 백본에 부착되어 있다.BH2–)n 및 결과 물질은 페로센/페로시늄 레독스 부부와 관련된 특이한 물리적 및 전자적 특성을 나타낸다.[78] PVFc와 PFcMA는 모두 실리카 웨이퍼와 폴리머 체인이 충전되지 않은 경우와 페로센 모이에티가 산화되어 양극으로 충전된 그룹을 만들 때 측정한 습도성에 연결되었다. PFcMA 코팅 웨이퍼의 물과의 접촉 각도는 산화 후 70° 더 작았고, PVFc의 경우 감소는 30°였으며 습식성의 전환은 되돌릴 수 있다. PFcMA의 경우 체인을 연장하여 더 많은 페로센 그룹을 도입하는 효과는 산화 시 접촉 각도가 현저히 감소한다.[78][81]
참고 항목
참조
- ^ International Union of Pure and Applied Chemistry (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. The Royal Society of Chemistry. p. 1041. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ^ "Ferrocene(102-54-5)". Retrieved 3 February 2010.
- ^ "FERROCENE_msds".
- ^ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. p. 3.258. ISBN 0-8493-0486-5.
- ^ Mohammadi, Narges; Ganesan, Aravindhan; Chantler, Christopher T.; Wang, Feng (2012). "Differentiation of ferrocene D5d and D5h conformers using IR spectroscopy". Journal of Organometallic Chemistry. 713: 51–59. doi:10.1016/j.jorganchem.2012.04.009.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. "#0205". National Institute for Occupational Safety and Health (NIOSH).
- ^ "Ferrocene MSDS". ScienceLab. Archived from the original on 2015-12-12. Retrieved 2015-11-25.
- ^ a b c d e Werner, H (2012). "At Least 60 Years of Ferrocene: The Discovery and Rediscovery of the Sandwich Complexes". Angew. Chem. Int. Ed. 51 (25): 6052–6058. doi:10.1002/anie.201201598. PMID 22573490.
- ^ a b c d Pauson, Peter L. (2001). "Ferrocene—how it all began". Journal of Organometallic Chemistry. 637–639: 3–6. doi:10.1016/S0022-328X(01)01126-3.
- ^ a b c Miller, S. A.; Tebboth, J. A.; Tremaine, J. F. (1952). "114. Dicyclopentadienyliron". J. Chem. Soc.: 632–635. doi:10.1039/JR9520000632.
- ^ a b c Laszlo, Pierre; Hoffmann, Roald (2000). "Ferrocene: Ironclad History or Rashomon Tale?" (PDF). Angewandte Chemie International Edition. 39 (1): 123–124. doi:10.1002/(SICI)1521-3773(20000103)39:1<123::AID-ANIE123>3.0.CO;2-Z. PMID 10649350.
- ^ a b c Kealy, T. J.; Pauson, P. L. (1951). "A New Type of Organo-Iron Compound". Nature. 168 (4285): 1039–1040. Bibcode:1951Natur.168.1039K. doi:10.1038/1681039b0. S2CID 4181383.
- ^ Federman Neto, Alberto; Pelegrino, Alessandra Caramori; Darin, Vitor André (2004). "Ferrocene: 50 Years of Transition Metal Organometallic Chemistry — From Organic and Inorganic to Supramolecular Chemistry (Abstract)". Trends in Organometallic Chemistry. Research Trends. 4: 147–169.
- ^ Werner, H. (2008). Landmarks in Organo-Transition Metal Chemistry: A Personal View. New York: Springer Science. pp. 161–63. ISBN 978-0-387-09847-0.
- ^ Wilkinson, G.; Rosenblum, M.; Whiting, M. C.; Woodward, R. B. (1952). "The structure of iron bis-cyclopentadienyl". J. Am. Chem. Soc. 74 (8): 2125–2126. doi:10.1021/ja01128a527.
- ^ Fischer, E. O.; Pfab, W. (1952). "Zur Kristallstruktur der Di-Cyclopentadienyl-Verbindungen des zweiwertigen Eisens, Kobalts und Nickels" [On the crystal structure of the bis-cyclopentadienyl compounds of divalent iron, cobalt and nickel]. Zeitschrift für Anorganische und Allgemeine Chemie (in German). 7 (6): 377–339. doi:10.1002/zaac.19532740603.
- ^ Fischer, E. O.; Pfab, W. (1952). "Zur Kristallstruktur der Di-Cyclopentadienyl-Verbindungen des zweiwertigen Eisens, Kobalts und Nickels" [On the crystal structure of the bis-cyclopentadienyl compounds of divalent iron, cobalt and nickel]. Zeitschrift für Naturforschung B. 7 (7): 377–379. doi:10.1515/znb-1952-0701.
- ^ Okuda, Jun (2016-12-28). "Ferrocene - 65 Years After". European Journal of Inorganic Chemistry. 2017 (2): 217–219. doi:10.1002/ejic.201601323. ISSN 1434-1948.
- ^ a b Eiland, Philip Frank; Pepinsky, Ray (1952). "X-ray Examination of Iron Biscyclopentadienyl". J. Am. Chem. Soc. 74 (19): 4971. doi:10.1021/ja01139a527.
- ^ Dunitz, J. D.; Orgel, L. E. (1953). "Bis-Cyclopentadienyl – A Molecular Sandwich". Nature. 171 (4342): 121–122. Bibcode:1953Natur.171..121D. doi:10.1038/171121a0. S2CID 4263761.
- ^ Dunitz, J.; Orgel, L.; Rich, A. (1956). "The crystal structure of ferrocene". Acta Crystallogr. 9 (4): 373–375. doi:10.1107/S0365110X56001091.
- ^ Mingos, D.M.P. (2001). "A Historical Perspective on Dewar's Landmark Contribution to Organometallic Chemistry". J. Organomet. Chem. 635 (1–2): 1–8. doi:10.1016/S0022-328X(01)01155-X.
- ^ Mehrotra, R.C.; Singh, A. (2007). Organometallic Chemistry: A Unified Approach (2nd ed.). New Delhi: New Age International. pp. 261–67. ISBN 978-81-224-1258-1.
- ^ Zeise, W.C. (1831). "Von der Wirkung zwischen Platinchlorid und Alkohol, und von den dabei entstehenden neuen Substanzen". Annalen der Physik (in German). 97 (4): 497–541. Bibcode:1831AnP....97..497Z. doi:10.1002/andp.18310970402.
- ^ Hunt, L.B. (1984). "The First Organometallic Compounds: William Christopher Zeise and his Platinum Complexes" (PDF). Platinum Metals Rev. 28 (2): 76–83.
- ^ Leigh, G.J.; Winterton, N., eds. (2002). Modern Coordination Chemistry: The Legacy of Joseph Chatt. Cambridge, UK: RSC Publishing. pp. 101–10. ISBN 978-0-85404-469-6.
- ^ Eisch, John J. (2002). "Henry Gilman: American Pioneer in the Rise of Organometallic Chemistry in Modern Science and Technology†". Organometallics. 21 (25): 5439–5463. doi:10.1021/om0109408. ISSN 0276-7333.
- ^ "The Nobel Prize in Chemistry 1973". Nobel Foundation. Retrieved 12 September 2010.
- ^ Seiler, P.; Dunitz, J. D. (1982). "Low-temperature crystallization of orthorhombic ferrocene: structure analysis at 98 K". Acta Crystallographica Section B. 38 (6): 1741–1745. doi:10.1107/s0567740882007080. ISSN 0567-7408.
- ^ Haaland, A.; Nilsson, J. E. (1968). "The Determination of Barriers to Internal Rotation by Means of Electron Diffraction. Ferrocene and Ruthenocene". Acta Chem. Scand. 22: 2653–2670. doi:10.3891/acta.chem.scand.22-2653.
- ^ Coriani, Sonia; Haaland, Arne; Helgaker, Trygve; Jørgensen, Poul (2006). "The Equilibrium Structure of Ferrocene". ChemPhysChem. 7 (1): 245–249. doi:10.1002/cphc.200500339. PMID 16404766.
- ^ Abel, E. W.; Long, N. J.; Orrell, K. G.; Osborne, A. G.; Sik, V. (1991). "Dynamic NMR studies of ring rotation in substituted ferrocenes and ruthenocenes". J. Org. Chem. 403 (1–2): 195–208. doi:10.1016/0022-328X(91)83100-I.
- ^ "Iron, bis(eta5-2,4-cyclopentadien-1-yl)-".
- ^ Wilkinson, G.; Pauson, P. L.; Cotton, F. A. (1954). "Bis-cyclopentadienyl Compounds of Nickel and Cobalt". J. Am. Chem. Soc. 76 (7): 1970. doi:10.1021/ja01636a080.
- ^ Wilkinson, G.; Cotton, F. A. (1959). "Cyclopentadienyl and Arene Metal Compounds". Progress in Inorganic Chemistry. 1. pp. 1–124. doi:10.1002/9780470166024.ch1. ISBN 978-0-470-16602-4.
- ^ a b Wilkinson, G. (1956). "Ferrocene". Organic Syntheses. 36: 31. doi:10.15227/orgsyn.036.0031.
- ^ Jolly, W. L. (1970). The Synthesis and Characterization of Inorganic Compounds. New Jersey: Prentice-Hall. ISBN 9780138799328.
- ^ Wilkinson, G.; Cotton, F. A.; Birmingham, J. M. (1956). "On manganese cyclopentadienide and some chemical reactions of neutral bis-cyclopentadienyl metal compounds". J. Inorg. Nucl. Chem. 2 (2): 95. doi:10.1016/0022-1902(56)80004-3.
- ^ Solomons, Graham; Fryhle, Craig (2006). Organic Chemistry (9th ed.). USA: John Wiley & Sons.
- ^ Monte, Manuel J. S.; Santos, Luís M. N. B. F.; Fulem, Michal; Fonseca, José M. S.; Sousa, Carlos A. D. (2006). "New Static Apparatus and Vapor Pressure of Reference Materials: Naphthalene, Benzoic Acid, Benzophenone, and Ferrocene". J. Chem. Eng. Data. 51 (2): 757. doi:10.1021/je050502y.
- ^ Fulem, Michal; Růžička, Květoslav; Červinka, Ctirad; Rocha, Marisa A. A.; Santos, Luís M. N. B. F.; Berg, Robert F. (2013). "Recommended vapor pressure and thermophysical data for ferrocene". Journal of Chemical Thermodynamics. 57: 530–540. doi:10.1016/j.jct.2012.07.023.
- ^ Malischewski, Moritz; Seppelt, Konrad; Sutter, Jörg; Heinemann, Frank W.; Dittrich, Birger; Meyer, Karsten (2017-09-19). "Protonation of Ferrocene: A Low-Temperature X-ray Diffraction Study of [Cp2FeH](PF6) Reveals an Iron-Bound Hydrido Ligand". Angewandte Chemie International Edition. 56 (43): 13372–13376. doi:10.1002/anie.201704854. PMID 28834022.
- ^ Knox, G. R.; Pauson, P. L.; Willison, D. (1992). "Ferrocene derivatives. 27. Ferrocenyldimethylphosphine". Organometallics. 11 (8): 2930–2933. doi:10.1021/om00044a038.
- ^ Sollott, G. P.; Mertwoy, H. E.; Portnoy, S.; Snead, J. L. (1963). "Unsymmetrical Tertiary Phosphines of Ferrocene by Friedel–Crafts Reactions. I. Ferrocenylphenylphosphines". J. Org. Chem. 28 (4): 1090–1092. doi:10.1021/jo01039a055.
- ^ Mark R. St. J. Foreman, Alexandra M. Z. Slawin, J. Derek Woollins (1996). "2,4-Diferrocenyl-1,3-dithiadiphosphetane 2,4-disulfide; structure and reactions with catechols and [PtCl2(PR3)2](R = Et or Bun)". J. Chem. Soc., Dalton Trans. (18): 3653–3657. doi:10.1039/DT9960003653.CS1 maint: 여러 이름: 작성자 목록(링크)
- ^ Rebiere, F.; Samuel, O.; Kagan, H. B. (1990). "A convenient method for the preparation of monolithioferrocene". Tetrahedron Lett. 31 (22): 3121–3124. doi:10.1016/S0040-4039(00)94710-5.
- ^ Herbert, David E.; Mayer, Ulrich F. J.; Manners, Ian (2007). "Strained Metallocenophanes and Related Organometallic Rings Containing pi-Hydrocarbon Ligands and Transition-Metal Centers". Angew. Chem. Int. Ed. 46 (27): 5060–5081. doi:10.1002/anie.200604409. PMID 17587203.
- ^ C. E. Housecroft & A. G. Sharpe, 무기 화학 4판, 2012, 페이지 925.
- ^ Connelly, N. G.; Geiger, W. E. (1996). "Chemical Redox Agents for Organometallic Chemistry". Chem. Rev. 96 (2): 877–910. doi:10.1021/cr940053x. PMID 11848774.
- ^ Sirbu, D.; Turta, C.; Gibson, E. A.; Benniston, A. C. (2015-08-11). "The ferrocene effect: enhanced electrocatalytic hydrogen production using meso-tetraferrocenyl porphyrin palladium(II) and copper(II) complexes". Dalton Transactions. 44 (33): 14646–14655. doi:10.1039/C5DT02191J. ISSN 1477-9234. PMID 26213204.
- ^ Lennox, Alastair J. J.; Nutting, Jordan E.; Stahl, Shannon S. (2018-01-03). "Selective electrochemical generation of benzylic radicals enabled by ferrocene-based electron-transfer mediators". Chemical Science. 9 (2): 356–361. doi:10.1039/C7SC04032F. ISSN 2041-6539. PMC 5909123. PMID 29732109.
- ^ Dannenberg, J. J.; Richards, J. H. (1965-04-01). "Photosensitization by Ferrocene. Photochemistry of Higher Electronic Excited States". Journal of the American Chemical Society. 87 (7): 1626–1627. doi:10.1021/ja01085a048. ISSN 0002-7863.
- ^ Sirbu, D.; Turta, C.; Benniston, A. C.; Abou-Chahine, F.; Lemmetyinen, H.; Tkachenko, N. V.; Wood, C.; Gibson, E. (2014-05-23). "Synthesis and properties of a meso- tris–ferrocene appended zinc(II) porphyrin and a critical evaluation of its dye sensitised solar cell (DSSC) performance". RSC Advances. 4 (43): 22733–22742. doi:10.1039/C4RA03105A. ISSN 2046-2069.
- ^ Malischewski, M.; Adelhardt, M.; Sutter, J.; Meyer, K.; Seppelt, K. (2016-08-12). "Isolation and structural and electronic characterization of salts of the decamethylferrocene dication". Science. 353 (6300): 678–682. Bibcode:2016Sci...353..678M. doi:10.1126/science.aaf6362. ISSN 0036-8075. PMID 27516596. S2CID 43385610.
- ^ Ruble, J. C.; Latham, H. A.; Fu, G. C. (1997). "Effective Kinetic Resolution of Secondary Alcohols with a Planar-Chiral Analogue of 4-(dimethylamino)pyridine. Use of the Fe(C5Ph5) Group in Asymmetric Catalysis". J. Am. Chem. Soc. 119 (6): 1492–1493. doi:10.1021/ja963835b.
- ^ Atkinson, Robert C. J.; Gibson, Vernon C.; Long, Nicholas J. (2004-06-08). "The syntheses and catalytic applications of unsymmetrical ferrocene ligands". Chemical Society Reviews. 33 (5): 313–328. doi:10.1039/B316819K. ISSN 1460-4744. PMID 15272371.
- ^ a b Blaser, Hans-Ulrich (2002). "Solvias Josiphos ligands: From discovery to technical applications". Topics in Catalysis. 19: 3–16. doi:10.1023/a:1013832630565. S2CID 95738043.
- ^ 제린주(2011년). 특권을 가진 치랄 리간즈와 촉매.
- ^ a b Stepnicka, Petr (2008). Ferrocenes: Ligands, Materials and Biomolecules. Hoboken, NJ: J. Wiley. ISBN 978-0-470-03585-6.
- ^ "Application of fuel additives" (PDF). Archived from the original (PDF) on 2006-05-05.
- ^ US 4104036, Chao, Tai S, "철 함유 모터 연료 구성 및 사용 방법" 1978-08-01을 발행했다.
- ^ 듀이, 프레드 M. 페로센 폴리글리콜스. 미국 특허 3,598,850, 1969년 6월 11일 출원, 1971년 8월 10일 발행. 사용 가능: https://patentimages.storage.googleapis.com/6f/2a/1c/dad6147ea46bcb/US3598850.pdf
- ^ 케리, 로버트 5세 석탄 연소 과정 및 구성. 1971년 11월 23일 미국 특허 3,927,992건이 출원되었고 1975년 12월 23일 발행되었다. 사용 가능: https://patentimages.storage.googleapis.com/0d/03/57/c94e635d15e1fb/US3927992.pdf
- ^ Van Staveren, Dave R.; Metzler-Nolte, Nils (2004). "Bioorganometallic Chemistry of Ferrocene". Chem. Rev. 104 (12): 5931–5986. doi:10.1021/cr0101510. PMID 15584693.
- ^ Biot, C.; Nosten, F.; Fraisse, L.; Ter-Minassian, D.; Khalife, J.; Dive, D. (2011). "The antimalarial ferroquine: from bench to clinic". Parasite. 18 (3): 207–214. doi:10.1051/parasite/2011183207. ISSN 1252-607X. PMC 3671469. PMID 21894260.

- ^ Roux, C.; Biot, C. (2012). "Ferrocene-based antimalarials". Future Med. Chem. 4 (6): 783–797. doi:10.4155/fmc.12.26. PMID 22530641.
- ^ Gu, Haibin; Mu, Shengdong; Qiu, Guirong; Liu, Xiong; Zhang, Li; Yuan, Yanfei; Astruc, Didier (June 2018). "Redox-stimuli-responsive drug delivery systems with supramolecular ferrocenyl-containing polymers for controlled release". Coordination Chemistry Reviews. 364: 51–85. doi:10.1016/j.ccr.2018.03.013. ISSN 0010-8545.
- ^ Ornelas, Catia (2011). "Application of ferrocene and its derivatives in cancer research". New Journal of Chemistry. 35 (10): 1973. doi:10.1039/c1nj20172g. S2CID 56521492.
- ^ Babin, V. N.; et al. (2014). "Ferrocenes as potential anticancer drugs. Facts and hypotheses". Russ. Chem. Bull. 63 (11): 2405–2422. doi:10.1007/s11172-014-0756-7. S2CID 94618726.
- ^ 용, 지안핑, 루, 칸중. 페로센 파생상품, 제조방법 및 사용법. 미국 특허권 9,738,673호는 2016년 11월 29일에 출원되어 2017년 8월 22일에 발행되었다. 사용 가능: https://patentimages.storage.googleapis.com/dd/6e/d6/9fd8e3c5c96b67/US9738673.pdf
- ^ a b Top, S.; Vessières, A.; Leclercq, G.; Quivy, J.; Tang, J.; Vaissermann, J.; Huché, M.; Jaouen, G. (2003). "Synthesis, Biochemical Properties and Molecular Modelling Studies of Organometallic Specific Estrogen Receptor Modulators (SERMs), the Ferrocifens and Hydroxyferrocifens: Evidence for an Antiproliferative Effect of Hydroxyferrocifens on both Hormone-Dependent and Hormone-Independent Breast Cancer Cell Lines". Chem. Eur. J. 9 (21): 5223–36. doi:10.1002/chem.200305024. PMID 14613131.
- ^ Ron Dagani (16 September 2002). "The Bio Side of Organometallics". Chemical and Engineering News. 80 (37): 23–29. doi:10.1021/cen-v080n037.p023.
- ^ "Ferrocene Burn Rate Catalyst". www.rocketmotorparts.com. Retrieved 2020-01-13.
- ^ Zakrzewski, J.; Giannotti, Charles (1990). "An improved photochemical synthesis of azaferrocene". J. Organomet. Chem. 388 (1–2): 175–179. doi:10.1016/0022-328X(90)85359-7.
- ^ Efraty, Avi; Jubran, Nusrallah; Goldman, Alexander (1982). "Chemistry of some η5-pyrrolyl- and η1-N-pyrrolyliron complexes". Inorg. Chem. 21 (3): 868. doi:10.1021/ic00133a006.
- ^ Yu, Y.; Bond, A. D.; Leonard, P. W.; Vollhardt, K. P. C.; Whitener, G. D. (2006). "Syntheses, Structures, and Reactivity of Radial Oligocyclopentadienyl Metal Complexes: Penta(ferrocenyl)cyclopentadienyl and Congeners". Angew. Chem. Int. Ed. 45 (11): 1794–1799. doi:10.1002/anie.200504047. PMID 16470902.
- ^ a b Yu, Yong; Bond, Andrew D.; Leonard, Philip W.; Lorenz, Ulrich J.; Timofeeva, Tatiana V.; Vollhardt, K. Peter C.; Whitener, Glenn D.; Yakovenko, Andrey A. (2006). "Hexaferrocenylbenzene". Chem. Commun. (24): 2572–2574. doi:10.1039/b604844g. PMID 16779481.
- ^ a b c Pietschnig, Rudolf (2016). "Polymers with pendant ferrocenes". Chem. Soc. Rev. 45 (19): 5216–5231. doi:10.1039/C6CS00196C. PMID 27156979.
- ^ Conroya, Devin; Moisalab, Anna; Cardosoa, Silvana; Windleb, Alan; Davidson, John (2010). "Carbon nanotube reactor: Ferrocene decomposition, iron particle growth, nanotube aggregation and scale-up". Chem. Eng. Sci. 65 (10): 2965–2977. doi:10.1016/j.ces.2010.01.019.
- ^ Liu, Wan-yi; Xu, Qi-hai; Ma, Yong-xiang; Liang, Yong-min; Dong, Ning-li; Guan, De-peng (2001). "Solvent-free synthesis of ferrocenylethene derivatives". J. Organomet. Chem. 625: 128–132. doi:10.1016/S0022-328X(00)00927-X.
- ^ Elbert, J.; Gallei, M.; Rüttiger, C.; Brunsen, A.; Didzoleit, H.; Stühn, B.; Rehahn, M. (2013). "Ferrocene Polymers for Switchable Surface Wettability". Organometallics. 32 (20): 5873–5878. doi:10.1021/om400468p.
외부 링크
| 위키미디어 커먼즈에는 페로센과 관련된 미디어가 있다. |