바륨 페레이트
Barium ferrate | |||
| | |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름 바륨 페레이트(VI) | |||
| 기타 이름 바륨 페레이트(2-) | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 켐스파이더 | |||
| |||
| |||
| 특성. | |||
| 바페오4 | |||
| 어금질량 | 257,1646 g/190 | ||
| 외관 | 검붉은 불투명한 결정체 | ||
| 불용성인 | |||
| 구조 | |||
| 정형외과적 | |||
| 팽마로62번길[1] | |||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
바륨 페레이트(Barium ferrate)는 공식 BaFeO의4 화학 화합물이다. 이것은 +6 산화 상태의 철을 함유한 희귀 화합물이다.[2] 페르레이트(VI) 이온은 두 개의 전자가 손상되지 않아 파라마그네틱이 된다.[3] BaSO와4 등구조적이며, 사면체[FeO4]2− 음이온이 포함되어 있다.[4]
구조
페르레이트(VI) 음이온은 두 개의 전자가 손상되지 않았기 때문에 파라마그네틱이며, 사면체 분자 기하학을 가지고 있다.[3]
X선 회절은 정형외과적 단위 세포 구조를 결정하는[1] 데 사용되어 왔다(격자 벡터 a ≠ b ≠ c, 축간각 α=β=====90°).[5] 나노크리스탈린 바FeO4 출신이다. Pnma 우주군(점 그룹: D2h)에서 격자 매개변수 a = 0.8880nm, b = 0.5512nm, c = 0.7214nm로 결정되었다.[1] X선 회절 데이터의 정확성은 고해상도 전송 전자 현미경(HRTEM)의 격자 프린지 간격과 SAED(선택 영역 회절)에서 계산한 셀 매개변수로 검증되었다.[1]

특성화
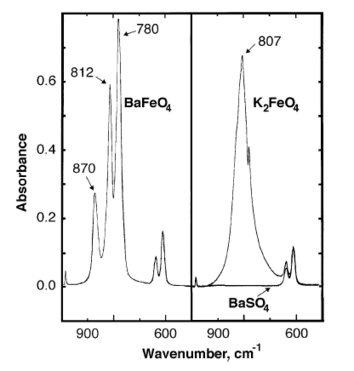
바륨 페레이트의 적외선 흡광도 피크는 870, 812, 780 cm에서−1 관측된다.[7]
BafeO는4 퀴리를 따른다.와이스 법칙과 자기 모멘트는 (2.92 ± 0.03) × 10−23 A2 m(3.45 ± 0.1 BM)이고 와이스 상수는 -89 K이다.[9]
준비와 화학
바륨 페레이트(VI)는 습식 및 건식 합성 방법으로 모두 준비할 수 있다. 건성합성은 보통 수산화바륨과 철을 가열하는 것과 같은 [7]열적 기법을 사용하여 수행된다(II) 산소가 있는 곳에서 약 800~900°C까지 수산화물.[10]
- Ba(OH)
2 + Fe(OH)
2 + O
2 → BaFeO
4 + 2 H
2O
습식 방법은 화학적, 전기적 화학적 기법을 모두 사용한다. 예를 들어 알칼리성 조건에 적합한 철소금을 놓고 차아염소산나트륨과 같은 강한 산화제가 첨가되면 페르레이트 음이온이 형성된다.[11]
- 2 Fe(OH)
3 + 3 OCl−
+ 4 OH−
→ 2 FeO2−
4 + 5 H
2O + 3 Cl−
바륨 페레이트(Barium ferrate)는 바륨 용액을 첨가하여 용액에서 침전된다(II) 소금.[11] 알칼리 금속 페르레이트 용액에 수용성 바륨 소금을 첨가하면 바륨 페르레이트(barium ferrate)의 마룬 침전물이 생성되는데, 이는 바륨 크롬산염과 구조가 같고 용해도가 거의 동일한 결정이다.[12] 바륨 페레이트 또한 차아염소산나트륨과 철 질산나트륨을 상온(또는 0°C)에서 혼합물에 첨가하여 준비되었다.[13] 이산화탄소가 없는 상태에서 저온에서 반응을 수행하고 침전물을 신속하게 여과 건조시켜 불순물로 바륨 수산화물 및 탄산바륨의 공동소화를 줄임으로써 제품의 순도를 향상시킬 수 있다.[12]
사용하다
바륨 페레이트는 산화제로 유기합성물에서 산화 시약으로 사용된다. 그것의 다른 응용 프로그램으로는 색 제거, 청산가리 제거, 박테리아 죽이기, 오염 및 폐수 처리 등이 있다.[7]
페레이트(VI)의 염분은 "초철" 배터리의 강력한 음극 물질이다. 페르레이트(VI) 화합물을 함유한 음극은 산화성이 높은 철 기초, 다중 전자 전달, 고 내인성 에너지 때문에 "초철" 음극이라고 불린다. 모든 페레이트(VI) 소금 중에서 바륨 페레이트(barium ferrate)는 비정상적으로 쉬운 전하 전달을 유지하는데, 이것은 알칼리성 배터리의 고출력 영역에 중요하다.[8]
반응
바륨 페레이트(Barium ferrate)는 페레이트(VI) 화합물 중 가장 안정적이다. 가장 순수한 상태로 준비할 수 있고 가장 확실한 구성을 가지고 있다. 바륨 페레이트는 탄산을 포함한 모든 가용성 산에 의해 쉽게 분해될 수 있다. 만약 이산화탄소가 하이드레이트 바륨 페레이트가 매달려 있는 물을 통과한다면 바륨 페레이트는 완전히 분해되어 바륨 탄산염, 철릭 수산화물, 산소 가스를 형성하게 된다. 알칼리성 황산염은 건조되지 않은 바륨 페레이트를 분해해 황산바륨, 철릭 수산화물, 산소 가스를 형성한다.
참고 항목
참조
- ^ a b c d Ni, Xiao-Min; Ji, Ming-Rong; Yang, Zhi-Ping; Zheng, Hua-Gui (2004). "Preparation and structure characterization of nanocrystalline BaFeO4". Journal of Crystal Growth. 261 (1): 82–86. doi:10.1016/j.jcrysgro.2003.09.024.
- ^ Briggs, J. G. R. (2005). Longman A-level course in chemistry (4th ed.). Pearson Education South Asia. p. 536. ISBN 978-981-4105-08-8.
- ^ a b Wiberg, Egon; Wiberg, Nils; Holleman, Arnold (2001). Inorganic chemistry. Academic Press. pp. 1457–1458. ISBN 978-0-12-352651-9.
- ^ Wells, A.F. (1986). Structural inorganic chemistry (5th ed.). Oxford [Oxfordshire]: Clarendon Press. ISBN 978-0-19-855370-0.
- ^ "IUCr". www.iucr.org. Retrieved 2016-04-29.
- ^ Ropp, Richard C. (2012). Encyclopedia of the Alkaline Earth Compounds. Newnes Press. ISBN 9780444595539.
- ^ a b c Henry-Chase, Adonica; Bhushan Tewari, Brij (2013). "Use to Ferrate (VI) A Green Chemical for the Environment Remediation" (PDF). Revista Boliviana de Química. 30 (1): 13–23. ISSN 0250-5460.
- ^ a b Licht, Stuart; Naschitz, Vera; Wang, Baohui (2002). "Rapid chemical synthesis of the barium ferrate super-iron Fe (VI) compound, BaFeO4". Journal of Power Sources. 109: 67–70. doi:10.1016/s0378-7753(02)00041-1.
- ^ Audette, R. J.; Quail, J. W. (1972). "Potassium, rubidium, cesium, and barium ferrates(VI). Preparations, infrared spectra, and magnetic susceptibilities". Inorganic Chemistry. 11 (8): 1904–1908. doi:10.1021/ic50114a034.
- ^ Sharma, R. K. (2007). "Stabilisation of Fe (VI)". Textbook of Coordination Chemistry. New Delhi: Discovery Publishing House. p. 124. ISBN 9788183562232.
- ^ a b Wulfsberg, Gary (1991). "pH and the stability of high oxidation states; Syntheses of oxo anions and their use as oxidizing agents". Principles of Descriptive Inorganic Chemistry. Sausalito, CA: University Science Books. pp. 142–143. ISBN 9780935702668.
- ^ a b Gump, J. R.; Wagner, W. F.; Schreyer, J. M. (1954). "Preparation and analysis of barium ferrate(VI)". Analytical Chemistry. 26 (12): 1957. doi:10.1021/ac60096a027. ISSN 0003-2700.
- ^ Herber, Rolfe H.; Johnson, David (1979). "Lattice dynamics and hyperfine interactions in M2FeO4 (M = K+, Rb+, Cs+) and M'FeO4 (M' = Sr2+, Ba2+)". Inorganic Chemistry. 18 (10): 2786–2790. doi:10.1021/ic50200a030.




