면역계
Immune system
면역 체계는 질병으로부터 유기체를 보호하는 생물학적 체계의 네트워크입니다.바이러스부터 기생벌레, 암세포, 나무조각 같은 물체까지 다양한 병원체를 감지하고 반응해 유기체 자체의 건강한 조직과 구분합니다.많은 종들은 면역체계의 두 가지 주요한 하위체계를 가지고 있습니다.선천적 면역체계는 광범위한 상황과 자극에 대해 미리 구성된 반응을 제공합니다.적응 면역 시스템은 이전에 만났던 분자를 인식하는 것을 학습함으로써 각각의 자극에 대한 맞춤형 반응을 제공합니다.둘 다 분자와 세포를 이용해 기능을 수행합니다.
거의 모든 생물들은 일종의 면역체계를 가지고 있습니다.박테리아는 바이러스 감염으로부터 보호하는 효소의 형태로 기본적인 면역 체계를 가지고 있습니다.다른 기본적인 면역 메커니즘은 고대 식물과 동물에서 진화했고 현대의 후손에 남아있습니다.이러한 메커니즘에는 식세포증, 데펜신이라고 불리는 항균 펩타이드, 그리고 보체 시스템이 포함됩니다.인간을 포함한 턱 척추동물들은 병원체를 더 효율적으로 인식하는 능력을 포함하여 훨씬 더 정교한 방어 메커니즘을 가지고 있습니다.적응적(또는 후천적) 면역은 면역학적 기억을 생성하여 동일한 병원체와의 후속 만남에 대한 반응을 향상시킵니다.이 후천적 면역의 과정이 백신 접종의 기본이 됩니다.
면역체계의 기능장애는 자가면역질환, 염증질환, 그리고 암을 유발할 수 있습니다.면역결핍은 면역체계가 정상보다 덜 활성화되어 반복적이고 생명을 위협하는 감염을 초래할 때 발생합니다.인간의 경우 면역결핍은 심각한 복합 면역결핍, HIV/AIDS와 같은 후천적 질환 또는 면역억제제 사용과 같은 유전적 질환의 결과일 수 있습니다.자가면역은 정상 조직을 마치 이물질인 것처럼 공격하는 과활성 면역체계에서 비롯됩니다.일반적인 자가면역질환으로는 하시모토 갑상샘염, 류마티스 관절염, 제1형 당뇨병, 전신홍반 루푸스 등이 있습니다.면역학은 면역체계의 모든 측면에 대한 연구를 다룹니다.
레이어드 디펜스
면역체계는 특이성이 증가하는 겹겹이 쌓인 방어로 숙주를 감염으로부터 보호합니다.물리적 장벽은 박테리아와 바이러스와 같은 병원균이 유기체 안으로 들어가는 것을 막습니다.[1]병원체가 이러한 장벽을 뚫으면 선천적 면역체계는 즉각적이지만 비특이적인 반응을 제공합니다.선천적인 면역체계는 모든 동물들에게서 발견됩니다.[2]병원균이 선천적인 반응을 성공적으로 회피하면 척추동물은 선천적인 반응에 의해 활성화되는 적응 면역체계라는 두 번째 보호층을 갖게 됩니다.[3]여기서 면역체계는 병원체에 대한 인식을 개선하기 위해 감염되는 동안의 반응을 조절합니다.이렇게 개선된 반응은 병원체가 제거된 후 면역학적 기억의 형태로 유지되며, 이 병원체가 마주칠 때마다 적응 면역 체계가 더 빠르고 강력한 공격을 할 수 있게 해줍니다.[4][5]
| 선천면역계 | 적응면역계 |
|---|---|
| 반응이 비특이적임 | 병원체 및 항원 특이반응 |
| 노출은 즉각적인 최대 응답으로 이어집니다. | 노출과 최대 응답 사이의 지연 시간 |
| 세포매개성 및 체액성 구성요소 | 세포매개성 및 체액성 구성요소 |
| 면역학적 기억이 없음 | 노출이 면역학적 기억을 유발합니다. |
| 거의 모든 형태의 생명체에서 발견됩니다. | 턱이 있는 척추동물에서만 발견됩니다. |
선천 면역과 적응 면역 모두 자가와 자가가 아닌 분자를 구별하는 면역 체계의 능력에 달려 있습니다.면역학에서 자가 분자는 면역 체계에 의해 이물질과 구별될 수 있는 유기체의 몸의 구성 요소입니다.[6]반대로 자기가 아닌 분자는 외부 분자로 인식되는 분자입니다.자가가 아닌 분자의 한 종류는 항원(원래 항체 생성기로 이름 붙여짐)이라고 불리며 특정 면역 수용체에 결합하고 면역 반응을 이끌어내는 물질로 정의됩니다.[7]
지표면 장벽
기계적, 화학적, 생물학적 장벽을 포함한 여러 장벽들이 생물체들을 감염으로부터 보호합니다.감염에 대한 첫 번째 방어선인 기계적 장벽으로는 대부분의 잎의 밀랍 모양의 큐티클, 곤충의 외골격, 외부에 퇴적된 알의 껍질과 막, 그리고 피부 등이 있습니다.[8]생물체는 환경으로부터 완전히 밀폐될 수 없기 때문에, 시스템은 폐, 장, 그리고 비뇨기과 같은 몸의 입구를 보호하는 역할을 합니다.폐에서 기침과 재채기는 호흡기에서 병원균과 다른 자극제를 기계적으로 배출합니다.눈물과 소변의 홍조작용도 기계적으로 병원균을 내보내는 반면 호흡기와 위장관에서 분비되는 점액은 미생물을 가두어 얽히게 하는 역할을 합니다.[9]
화학적 장벽은 또한 감염으로부터 보호합니다.피부와 호흡기는 β-디펜신과 같은 항균 펩타이드를 분비합니다.[10]타액, 눈물, 모유에 있는 라이소자임과 포스포리파아제 A2 같은 효소들도 항균 작용을 합니다.[11][12]질 분비물은 초경을 따라 화학적 장벽 역할을 하는데, 초경이 약간 산성화되면, 정액은 병원균을 죽이는 데 방어제와 아연을 함유하고 있습니다.[13][14]위에서 위산은 섭취된 병원균에 대한 화학적 방어 역할을 합니다.[15]
생식기와 위장관 내에서, 상식적인 식물군은 음식과 공간을 위해 병원성 박테리아와 경쟁하고, 어떤 경우에는 pH나 사용 가능한 철과 같은 환경의 조건을 변화시킴으로써 생물학적 장벽의 역할을 합니다.결과적으로, 병원균이 질병을 일으킬 수 있는 충분한 숫자에 도달할 가능성은 줄어듭니다.[16]
선천면역계
생물체에 성공적으로 들어온 미생물이나 독소는 선천적인 면역체계의 세포와 메커니즘을 만나게 됩니다.선천적인 반응은 보통 미생물이 다양한 미생물 그룹 사이에서 보존되는 구성 요소를 인식하는 패턴 인식 수용체에 의해 식별되거나 [17]손상을 입거나 부상을 입거나 스트레스를 받은 세포가 경보 신호를 보낼 때 유발됩니다. 이들 대부분은 병원체를 인식하는 수용체와 동일한 수용체에 의해 인식됩니다.[18]선천적 면역 방어는 비특이적이며, 이는 이러한 시스템이 일반적인 방식으로 병원균에 반응한다는 것을 의미합니다.[19]이 시스템은 병원체에 대한 장기간의 면역력을 부여하지 않습니다.선천적 면역체계는 대부분의 생물체에서 숙주 방어의 지배적인 체계이며 [2]식물에서는 유일합니다.[20]
면역감각
선천성 면역체계의 세포는 패턴 인식 수용체를 이용하여 병원체에 의해 생성되는 분자 구조를 인식합니다.[21]그것들은 주로 수지상 세포, 대식세포, 단핵구, 호중구 및 상피[19][22] 세포와 같은 선천적 면역계의 세포에 의해 발현되는 단백질로서 미생물 병원체와 관련된 병원체 관련 분자 패턴(PAMP) 및 손상 관련 분자 패턴(DAMP)의 두 부류를 식별합니다.세포 손상 또는 세포 사멸 시 방출되는 숙주 세포의 구성 요소와 관련이 있습니다.[23]
세포외 또는 내막성 PAMPs의 인식은 TLR(toll-like receptor)로 알려진 막간 단백질에 의해 매개됩니다.[24]TLR은 전형적인 구조적 모티프인 LRR(Leucine Rich Repeats)을 공유하며, 이는 곡선 모양을 제공합니다.[25]톨 유사 수용체는 드로소필라(Drosophila)에서 처음 발견되었으며 선천적 또는 적응적 면역 반응에 필요한 사이토카인의 합성 및 분비, 다른 숙주 방어 프로그램의 활성화를 유발합니다.인간에게는 10개의 톨 유사 수용체가 기술되어 있습니다.[26]
선천적 면역체계의 세포는 내부에 감염이나 세포 손상을 감지하는 패턴 인식 수용체를 가지고 있습니다.이러한 "사이토솔릭" 수용체의 세 가지 주요 부류는 NOD 유사 수용체, RIG(레티노산 유도 유전자) 유사 수용체, 그리고 세포질 DNA 센서입니다.[27]
선천면역세포

어떤 백혈구들은 독립적인 단세포 유기체처럼 행동하며 선천적인 면역 체계의 두 번째 팔입니다.선천적인 백혈구는 "전문적인" 식세포(대식세포, 호중구, 수지상세포)를 포함합니다.이 세포들은 접촉을 통해 더 큰 병원체를 공격하거나 미생물을 집어삼킨 후 죽여서 병원체를 확인하고 제거합니다.선천적인 반응에 관련된 다른 세포들은 선천적인 림프구 세포, 비만 세포, 호산구, 호산구, 그리고 자연 살해 세포를 포함합니다.[28]
식세포증은 병원체나 입자를 집어삼키는 식세포라고 불리는 세포에 의해 행해지는 세포 선천 면역의 중요한 특징입니다.식세포는 일반적으로 병원체를 찾기 위해 몸을 순찰하지만, 사이토카인에 의해 특정 장소로 호출될 수 있습니다.[29]일단 병원체가 파지세포에 의해 삼켜지면, 그것은 파지좀이라고 불리는 세포내 소포체에 갇히게 되고, 그 후 리소좀이라고 불리는 다른 소포체와 융합하여 파지좀을 형성합니다.병원체는 소화 효소의 활동에 의해 죽거나 활성산소를 파골리소좀으로 방출하는 호흡 폭발에 따라 죽습니다.[30][31]식세포증은 영양소를 얻는 수단으로 진화했지만, 이 역할은 식세포에서 확장되어 병원균을 방어 메커니즘으로 삼키는 것을 포함했습니다.[32]식세포가 척추동물과 무척추동물 모두에서 확인되었기 때문에 식세포증은 아마도 가장 오래된 숙주 방어의 형태를 나타낼 것입니다.[33]
호중구와 대식세포는 침입 병원체를 찾아 몸 전체를 돌아다니는 식세포입니다.[34]호중구는 일반적으로 혈류에서 발견되며, 전체 순환 백혈구의 50%에서 60%를 차지하는 가장 풍부한 유형의 식세포입니다.[35]염증의 급성기에 호중구는 화학작용(chemotaxis)이라 불리는 과정에서 염증 부위 쪽으로 이동하며, 대개 감염 부위에 가장 먼저 도착하는 세포입니다.대식세포는 조직 내에 존재하며 효소, 보체 단백질, 사이토카인을 포함한 일련의 화학물질을 생산하는 다용도의 세포입니다. 또한 그들은 신체의 닳은 세포와 다른 찌꺼기를 제거하는 청소기, 적응 면역 체계를 활성화하는 항원 제시 세포 (APC)로서 역할을 할 수 있습니다.[36]
수지상 세포는 외부 환경과 접촉하는 조직의 식세포이므로 주로 피부, 코, 폐, 위, 장에 위치합니다.[37]그들은 둘 다 척추와 같은 돌출부를 가지고 있기 때문에 신경 수지상돌기와 닮았다고 해서 이름 지어졌습니다.수지상 세포는 신체 조직과 선천성 및 적응성 면역 체계 사이의 연결 역할을 하는데, 이는 적응성 면역 체계의 주요 세포 유형 중 하나인 T 세포에 항원을 제시하기 때문입니다.[37]
과립구는 세포질에 과립을 가지고 있는 백혈구입니다.호중구, 비만세포, 호산구, 호산구가 이 범주에 속합니다.비만세포는 결합조직과 점막에 상주하며 염증반응을 조절합니다.[38]그것들은 가장 자주 알레르기와 아나필락시스와 관련이 있습니다.[35]호산구와 호산구는 호중구와 관련이 있습니다.그들은 기생충에 대한 방어에 관여하는 화학적 매개물질을 분비하고 천식과 같은 알레르기 반응에서 역할을 합니다.[39]
선천 림프 세포(ILCs)는 일반적인 림프 전구물질로부터 유래된 선천 면역 세포의 그룹이며 림프 계통에 속합니다.이 세포들은 재조합 활성화 유전자가 부족하기 때문에 항원 특이적 B 또는 T 세포 수용체(TCR)의 부재로 정의됩니다.ILC는 골수성 또는 수지상 세포 표지자를 표현하지 않습니다.[40]
자연살해세포(NK cells)는 림프구이며 침입하는 미생물을 직접적으로 공격하지 않는 선천적 면역체계의 구성요소입니다.[41]오히려, NK 세포는 종양 세포나 바이러스에 감염된 세포와 같은 손상된 숙주 세포를 파괴하고, 그러한 세포를 "실종된 자신"이라고 알려진 상태로 인식합니다.이 용어는 숙주 세포의 바이러스 감염에서 발생할 수 있는 상황인 MHCI(주요 조직 적합성 복합체)라고 불리는 세포 표면 마커의 수준이 낮은 세포를 설명합니다.[42]정상적인 체세포는 온전한 자기 MHC 항원을 발현하기 때문에 NK 세포에 의해 인식되고 공격받지 않습니다.그 MHC 항원들은 NK 세포에 근본적으로 제동을 거는 킬러 세포 면역글로불린 수용체에 의해 인식됩니다.[43]
염증
염증은 감염에 대한 면역체계의 첫 반응 중 하나입니다.[44]염증의 증상은 발적, 붓기, 열, 통증으로, 조직으로의 혈류 증가로 인해 발생합니다.염증은 에이코사노이드(eicosanoid)와 사이토카인(cytokine)에 의해 만들어지는데, 사이토카인은 상처를 입거나 감염된 세포에 의해 방출됩니다.에이코사노이드는 열을 내고 염증과 관련된 혈관의 확장을 일으키는 프로스타글란딘과 특정 백혈구를 끌어들이는 류코트리엔을 포함합니다.[45][46]일반적인 사이토카인으로는 백혈구 사이의 의사소통을 담당하는 인터류킨, 화학작용을 촉진하는 케모카인, 숙주세포에서 단백질 합성을 차단하는 등의 항바이러스 효과를 가진 인터페론 등이 있습니다.[47]성장인자와 세포독성인자도 방출될 수 있습니다.이러한 사이토카인과 다른 화학물질들은 감염 부위로 면역세포를 모집하고 병원체 제거 후 손상된 조직의 치유를 촉진합니다.[48]인플라즈마좀이라고 불리는 패턴 인식 수용체는 세포질 PAMP와 DAMP에 반응하여 형성되는 다중 단백질 복합체(NLR, 어댑터 단백질 ASC, 이펙터 분자 프로-카스파제-1로 구성됨)로, 염증성 사이토카인 IL-1β와 IL-18의 활성 형태를 생성하는 기능을 합니다.[49]
체액방어
보체계는 외부 세포의 표면을 공격하는 생화학적 캐스케이드입니다.그것은 20개 이상의 다른 단백질을 포함하고 있고 항체에 의한 병원균의 살상을 "보완"하는 능력 때문에 이름 지어졌습니다.보체는 선천적인 면역 반응의 주요한 체액적 구성 요소입니다.[50][51]식물, 어류, 일부 무척추동물과 같은 포유류가 아닌 동물을 포함하여 많은 종들이 보체계를 가지고 있습니다.[52]인간의 경우, 이러한 미생물에 부착된 항체에 대한 보체 결합 또는 미생물의 표면에 있는 탄수화물에 대한 보체 단백질의 결합에 의해 이러한 반응이 활성화됩니다.이 인식 신호는 빠른 킬링 응답을 유발합니다.[53]반응 속도는 단백질 분해효소인 보체 분자의 순차적인 단백질 분해 활성화 후에 발생하는 신호 증폭의 결과입니다.보체 단백질이 처음에 미생물에 결합한 후, 그들은 그들의 프로테아제 활성을 활성화하고, 다시 다른 보체 프로테아제를 활성화하는 등을 활성화합니다.이것은 조절된 양성 피드백에 의해 초기 신호를 증폭시키는 촉매 캐스케이드를 생성합니다.[54]캐스케이드는 면역세포를 유인하고 혈관 투과성을 증가시키며 병원체 표면을 옵소나이즈(oopsonization)하여 파괴를 표시하는 펩타이드를 생성합니다.보체의 이러한 침착은 막 공격 복합체의 형성을 통해 그들의 플라즈마 막을 파괴함으로써 세포를 직접 죽일 수도 있습니다.[50]
적응면역계

적응 면역 체계는 초기 척추동물에서 진화하였고, 각각의 병원체가 특징적인 항원에 의해 "기억"되는 면역학적 기억뿐만 아니라 더 강한 면역 반응을 가능하게 합니다.[55]적응 면역 반응은 항원 특이적이고 항원 제시라고 불리는 과정 동안 특정한 "자기가 아닌" 항원의 인식을 요구합니다.항원 특이성은 특정 병원체 또는 병원체에 감염된 세포에 맞춘 반응 생성을 가능하게 합니다.이러한 맞춤형 응답을 탑재하는 기능은 "메모리 셀"에 의해 체내에 유지됩니다.병원체가 몸에 두 번 이상 감염될 경우, 이러한 특정 기억 세포는 그것을 빠르게 제거하는 데 사용됩니다.[56]
항원인식
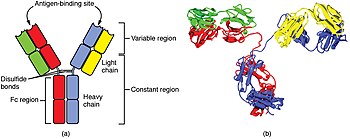
적응 면역체계의 세포들은 림프구라고 불리는 특별한 종류의 백혈구들입니다.B세포와 T세포는 림프구의 주요 유형이며 골수의 조혈모세포에서 유래합니다.[57]B 세포는 체액성 면역 반응에 관여하는 반면, T 세포는 세포 매개 면역 반응에 관여합니다.킬러 T 세포는 클래스 I MHC 분자에 결합된 항원만 인식하고, 헬퍼 T 세포와 조절 T 세포는 클래스 II MHC 분자에 결합된 항원만 인식합니다.이 두 가지 항원 제시 메커니즘은 두 가지 유형의 T 세포의 다른 역할을 반영합니다.세 번째, 작은 아형은 MHC 수용체에 결합되지 않은 온전한 항원을 인식하는 γδ T 세포입니다.이중 양성 T 세포는 흉선의 다양한 자가 항원에 노출되는데, 요오드는 흉선의 발달과 활동에 필요합니다.[59]반면, B 세포 항원 특이적 수용체는 B 세포 표면의 항체 분자로서 항원 처리의 필요성 없이 고유(미처리) 항원을 인식합니다.그러한 항원은 병원체의 표면에서 발견되는 큰 분자일 수도 있지만, 또한 운반체 분자에 붙어있는 작은 합텐(예: 페니실린)일 수도 있습니다.[60]B세포의 각 계통은 서로 다른 항체를 발현하기 때문에 B세포 항원 수용체의 완전한 집합은 신체가 생산할 수 있는 모든 항체를 나타냅니다.[57]B 세포나 T 세포가 그들의 관련 항원과 마주칠 때 그들은 증식하고 같은 항원을 표적으로 하는 세포의 많은 "클론"이 생성됩니다.이를 클론 선택이라고 합니다.[61]
T 림프구에 항원 제시
B세포와 T세포 모두 특정 표적을 인식하는 수용체 분자를 지니고 있습니다.T 세포는 주요 조직 적합성 복합체(MHC) 분자라고 불리는 "자체" 수용체와 결합하여 항원(병원체의 작은 조각)이 처리되고 제시된 후에야 병원체와 같은 "비자아" 표적을 인식합니다.[62]
세포매개면역
T 세포에는 크게 두 가지 아형이 있습니다: 킬러 T 세포와 헬퍼 T 세포.또한 면역 반응을 조절하는 역할을 하는 조절 T 세포가 있습니다.[63]
킬러 T세포
킬러 T 세포는 바이러스(및 다른 병원균)에 감염되거나 손상되거나 기능 장애가 있는 세포를 죽이는 T 세포의 하위 그룹입니다.[64]B세포와 마찬가지로 T세포의 각 유형은 서로 다른 항원을 인식합니다.킬러 T 세포는 T 세포 수용체가 다른 세포의 MHC Class I 수용체와 복합체에서 이 특정 항원에 결합할 때 활성화됩니다.이 MHC: 항원 복합체의 인식은 CD8이라고 불리는 T 세포의 공동 수용체에 의해 도움을 받습니다.그리고 나서 T 세포는 MHCI 수용체가 이 항원을 가지고 있는 세포를 찾기 위해 몸 전체를 돌아다닙니다.활성화된 T세포가 이러한 세포와 접촉하면 표적 세포의 혈장막에 기공을 형성하는 포레린과 같은 세포독소를 방출하여 이온, 물, 독소가 들어갈 수 있게 합니다.과립신(단백질가수분해효소)이라 불리는 또 다른 독소의 유입은 표적 세포가 세포자멸사를 겪도록 유도합니다.[65]숙주 세포의 세포 사멸은 바이러스의 복제를 막는 데 특히 중요합니다.T 세포 활성화는 엄격하게 제어되며 일반적으로 매우 강력한 MHC/항원 활성화 신호 또는 "도움을 주는" T 세포가 제공하는 추가 활성화 신호가 필요합니다(아래 참조).[65]
도우미 T세포
도우미 T 세포는 선천적인 면역 반응과 적응적인 면역 반응을 조절하고 신체가 특정 병원체에 어떤 면역 반응을 일으키는지 결정하는 것을 돕습니다.[66][67]이 세포들은 세포독성 활동이 없으며 감염된 세포를 직접 죽이거나 병원균을 제거하지 않습니다.그들은 대신 다른 세포들이 이러한 일을 수행하도록 지시함으로써 면역 반응을 조절합니다.[68]
도우미 T 세포는 Class II MHC 분자에 결합된 항원을 인식하는 T 세포 수용체를 발현합니다.MHC: 항원 복합체는 또한 조력자 세포의 CD4 공동 수용체에 의해 인식되며, 이는 T 세포의 활성화를 담당하는 분자(예를 들어 Lck)를 모집합니다.도우미 T 세포는 킬러 T 세포에서 관찰된 것보다 MHC: 항원 복합체와의 연관성이 약합니다. 즉, 도우미 T 세포의 많은 수용체(약 200–300)가 도우미 세포를 활성화하기 위해 MHC: 항원에 의해 결합되어야 하는 반면, 킬러 T 세포는 단일 MHC: 항원 분자의 결합으로 활성화될 수 있습니다.도우미 T 세포의 활성화는 또한 항원 제시 세포와의 더 긴 결합 기간을 요구합니다.[69]휴식 도우미 T 세포의 활성화는 많은 세포 유형의 활동에 영향을 미치는 사이토카인을 방출하게 합니다.도우미 T세포가 만들어내는 사이토카인 신호는 대식세포의 미세한 살인 기능과 살해 T세포의 활성을 강화합니다.[70]또한, 도우미 T 세포 활성화는 항체를 생성하는 B 세포를 활성화하는 데 일반적으로 필요한 추가 자극 신호를 제공하는 CD40 리간드(CD154라고도 함)와 같이 T 세포의 표면에 발현된 분자의 상향 조절을 야기합니다.[71]
감마델타T세포
감마 델타 T 세포(γδ T 세포)는 CD4+ 및 CD8+(αβ) T 세포와 달리 대체 T 세포 수용체(TCR)를 가지고 있으며 도우미 T 세포, 세포독성 T 세포 및 NK 세포의 특성을 공유합니다.T형 γδ 세포에서 반응이 일어나는 조건에 대해서는 아직 충분히 이해가 되지 않고 있습니다.CD1d 제한된 자연 살해자 T 세포와 같이 불변의 TCR을 갖는 다른 '전통적이지 않은' T 세포 하위 집합과 마찬가지로, γδ T 세포는 선천 면역과 적응 면역 사이의 경계에 걸쳐 있습니다.한편으로, γδ T 세포는 수용체 다양성을 생산하기 위해 TCR 유전자를 재배열하고 기억 표현형을 발달시킬 수 있기 때문에 적응 면역의 구성 요소입니다.다른 한편으로, 제한된 TCR 또는 NK 수용체가 패턴 인식 수용체로서 사용될 수 있기 때문에, 다양한 하위 집합은 또한 선천 면역계의 일부입니다.예를 들어, 많은 수의 인간 V γ9/V δ2 T 세포는 미생물에 의해 생성된 공통 분자에 수 시간 내에 반응하고, 상피세포에서 고도로 제한된 V δ1+ T 세포는 스트레스된 상피세포에 반응합니다.
체액성 면역 반응
B세포는 표면의 항체가 특정한 외래 항원과 결합할 때 병원체를 확인합니다.[74]이 항원/항체 복합체는 B 세포에 의해 흡수되고 단백질 분해에 의해 펩타이드로 처리됩니다.그 다음 B 세포는 MHC 클래스 II 분자 표면에 이러한 항원 펩티드를 표시합니다.이 MHC와 항원의 조합은 일치하는 조력자 T 세포를 끌어당기는데, 이것은 임포카인을 방출하고 B 세포를 활성화시킵니다.[75]그리고 나서 활성화된 B 세포가 분열하기 시작하면서, 그것의 자손(플라즈마 세포)은 이 항원을 인식하는 항체의 수백만 카피를 분비합니다.이 항체들은 혈장과 림프에서 순환하며, 항원을 발현하는 병원체에 결합하고 보체 활성화에 의한 파괴 또는 식세포에 의한 흡수와 파괴를 표시합니다.항체는 또한 박테리아 독소에 결합하거나 바이러스와 박테리아가 세포를 감염시키기 위해 사용하는 수용체를 방해함으로써 도전을 직접적으로 무력화시킬 수 있습니다.[76]
신생아는 미생물에 대한 사전 노출이 없으며 특히 감염에 취약합니다.여러 층의 수동 보호 기능은 모체에 의해 제공됩니다.임신 중에, IgG라고 불리는 특정한 종류의 항체는 태반을 통해 엄마에서 아기로 직접 운반되기 때문에, 인간 아기들은 심지어 태어날 때에도 그들의 엄마와 같은 범위의 항원 특이성을 가진 높은 수준의 항체를 가지고 있습니다.[77]모유나 초유는 또한 신생아가 자신의 항체를 합성할 수 있을 때까지 아기의 내장으로 옮겨져 박테리아 감염으로부터 보호하는 항체를 포함하고 있습니다.[78]이것은 태아가 실제로 어떤 기억 세포나 항체도 만들지 않고 단지 그것들을 빌려오기 때문에 수동 면역입니다.이 수동 면역은 보통 며칠에서 몇 달까지 단기간 지속됩니다.의학에서, 보호 수동 면역은 한 개인에서 다른 개인으로 인위적으로 옮겨질 수도 있습니다.[79]
면역학적 기억
B 세포와 T 세포가 활성화되고 복제되기 시작하면, 그들의 자손 중 일부는 장수하는 기억 세포가 됩니다.이러한 기억 세포는 동물의 일생 동안 마주친 각각의 특정 병원체를 기억하고 병원체가 다시 감지되면 강력한 반응을 일으킬 수 있습니다.이것은 그 병원체에 대한 감염에 대한 적응으로서 개인의 일생 동안 발생하고 미래의 도전에 대한 면역 체계를 준비시키기 때문에 "적응적"입니다.면역학적 기억은 수동적 단기 기억 또는 능동적 장기 기억의 형태일 수 있습니다.[80]
생리학적 조절

면역 체계는 신체의 생리학적 조절의 많은 부분에 관여합니다.면역 체계는 내분비계와[81][82] 신경계와[83][84][85] 같은 다른 체계와 밀접하게 상호작용합니다.면역 체계는 또한 조직의 수리와 재생뿐만 아니라 배아 발생(배아의 발달)에 중요한 역할을 합니다.[86]
호르몬
호르몬은 면역 조절제 역할을 하여 면역 체계의 민감성을 바꿀 수 있습니다.예를 들어, 여성 성호르몬은 적응적[87] 면역반응과 선천적 면역반응의 면역자극제로 알려져 있습니다.[88]루푸스 홍반성 루푸스와 같은 일부 자가면역 질환은 여성에게 우선적으로 타격을 주며, 그들의 발병은 종종 사춘기와 일치합니다.대조적으로, 테스토스테론과 같은 남성 성 호르몬은 면역 억제제인 것 같습니다.[89]다른 호르몬들도 면역체계를 조절하는 것으로 보이는데, 특히 프롤락틴, 성장호르몬 그리고 비타민 D가 대표적입니다.[90][91]
비타민 D
비록 세포 연구들이 비타민 D가 면역 체계에서 수용체와 가능한 기능을 가지고 있다고 나타내지만, 비타민 D 결핍이 면역 질환의 위험을 증가시키거나 비타민 D 보충이 면역 질환의 위험을 낮춘다는 것을 증명할 임상적인 증거는 없습니다.[92]2011년 미국 의학연구소 보고서는 "면역 기능과 자가 면역 장애, 그리고 감염과 관련된 결과는 칼슘이나 비타민 D 섭취와 확실하게 연관될 수 없으며 종종 상충되는 것"이라고 말했습니다.[93]: 5
수면과 휴식
면역체계는 수면과 휴식에 영향을 받고, 수면부족은 면역기능에 해롭습니다.[94]감염에 반응하여 생성되는 인터루킨-1 및 종양 괴사인자-α와 같은 사이토카인을 포함하는 복잡한 피드백 루프는 또한 비-급속 안구 운동(REM) 수면의 조절에 역할을 하는 것으로 보입니다.[95]따라서 감염에 대한 면역 반응은 REM 수면에 비해 느린파 수면의 증가를 포함한 수면 주기의 변화를 초래할 수 있습니다.[96]
수면부족이 있는 사람들에게, 적극적인 면역은 효과가 감소할 수 있고, 잘 쉬었던 사람보다 항체 생산이 감소하고 면역반응이 저하될 수 있습니다.[97]또한, NFIL3와 같은 단백질은 T 세포 분화 및 생체 리듬과 밀접하게 연관되어 있는 것으로 밝혀졌으며, 수면 부족의 경우를 통해 자연광의 교란 및 암흑 주기를 통해 영향을 받을 수 있습니다.이러한 장애는 심장병, 만성 통증, 천식과 같은 만성 질환의 증가로 이어질 수 있습니다.[98]
수면 부족의 부정적인 결과 외에도, 수면과 밀접한 생체 시스템은 선천 면역과 적응 면역 모두에 영향을 미치는 면역학적 기능에 강력한 조절 효과를 가지고 있는 것으로 나타났습니다.먼저, 초기의 느린 파도 수면 단계에서, 코르티솔, 에피네프린, 노르에피네프린의 혈중 농도의 급격한 감소는 렙틴, 뇌하수체 성장 호르몬, 프로락틴 호르몬의 혈중 농도를 증가시킵니다.이러한 신호는 염증성 사이토카인 인터류킨-1, 인터류킨-12, TNF-알파 및 IFN-감마의 생성을 통해 염증성 상태를 유도합니다.그리고 나서 이 사이토카인들은 면역세포의 활성화, 증식, 그리고 분화와 같은 면역 기능을 자극합니다.서서히 진화하는 적응 면역 반응의 이 시기 동안, 순진한 ï브 및 중심 기억 T 세포와 같이 분화되지 않은 또는 덜 분화된 세포에서 정점이 있습니다.이러한 효과 외에도, 이때 생성되는 호르몬(렙틴, 뇌하수체 성장 호르몬, 프로락틴)의 환경은 APC와 T세포 사이의 상호작용, T1/T2 사이토카인 균형이 T1을 지원하는 것으로의 이동, 전반적인 T세포 증식의 증가, 림프절로의 na ïVE T세포 이동을 지원합니다.이것은 또한 Th1 면역 반응의 개시를 통해 오래 지속되는 면역 기억의 형성을 지원하는 것으로 생각됩니다.[99]
깨어있는 기간 동안, 세포독성 자연 살해 세포 및 세포독성 T 림프구와 같은 분화된 이펙터 세포는 침입 병원체에 대한 효과적인 반응을 이끌어내기 위해 절정에 이릅니다.코티솔과 카테콜아민과 같은 항염증성 분자도 깨어있는 활동 시간 동안 절정에 이릅니다.만약 깨어있는 시간에 염증이 발생한다면 심각한 인지 및 신체적 장애를 일으킬 것이고, 멜라토닌의 존재로 인해 수면 시간에 염증이 발생할 수도 있습니다.염증은 많은 산화 스트레스를 유발하고 수면 시간 동안 멜라토닌의 존재는 이 시간 동안 자유 라디칼 생성을 적극적으로 억제할 수 있습니다.[99][100]
운동
신체적 운동은 면역체계에 긍정적인 영향을 미치며 빈도와 강도에 따라 세균과 바이러스에 의한 질병의 병원성 효과가 조절됩니다.[101]격렬한 운동을 한 직후에는 순환하는 림프구의 수가 감소하고 항체 생성이 감소하는 일시적인 면역 저하가 발생합니다.이것은 잠재적인 바이러스 감염의 감염과 재활성화를 위한 기회의 창을 야기할 수 있지만,[102] 그 증거는 확정적이지 않습니다.[103][104]
세포 수준에서의 변화

운동 중에는 모든 종류의 순환 백혈구가 증가합니다.이것은 내피 세포 표면에 흐르는 혈액의 마찰력과 카테콜아민이 β-아드레날린 수용체(βARs)에 영향을 미치기 때문에 발생합니다.[102]혈액 속의 호중구의 수는 증가하고 6시간까지 유지되며 미성숙한 형태가 나타납니다.비록 호중구의 증가가 박테리아 감염 동안에 보이는 것과 비슷하지만, 운동 후에 세포 인구는 약 24시간 정도에 정상으로 돌아옵니다.[102]
순환림프구(주로 자연살해세포)의 수는 격렬한 운동을 하는 동안 감소하지만 4~6시간 후에는 정상으로 돌아옵니다.사망하는 세포의 최대 2%가 혈액에서 대부분의 조직, 주로 병원균과 마주칠 가능성이 가장 높은 장과 폐로 이동합니다.[102]
일부 단핵구는 혈액 순환을 떠나 근육으로 이동하여 분화하여 대식세포가 됩니다.[102]이 세포들은 두 가지 유형으로 분화됩니다: 증식성 대식세포는 줄기세포의 수를 증가시키는 역할을 하고 근육세포로 성숙하는 것과 관련된 회복성 대식세포입니다.[105]
수리재생
면역체계, 특히 선천적인 요소는 모욕 후 조직을 고치는 데 결정적인 역할을 합니다.주요 행위자는 대식세포와 호중구를 포함하지만, γδT 세포, 선천 림프세포(ILCs), 조절 T 세포(Tregs)를 포함한 다른 세포적 행위자도 중요합니다.면역세포의 가소성과 소염증 신호와 소염증 신호 사이의 균형은 효율적인 조직 복구의 중요한 측면입니다.면역 성분과 경로는 예를 들어 축척지 재생과 같은 양서류에서도 재생과 관련이 있습니다.한 가설에 따르면, 재생이 가능한 유기체는 재생이 불가능한 유기체보다 면역 능력이 떨어질 수 있습니다.[106]
인간 면역 장애
호스트 방어 실패는 면역결핍,[107] 자가면역,[108] 초민감성의 세 가지 광범위한 범주로 나뉩니다.[109]
면역결핍
면역결핍은 면역체계의 구성요소 중 하나 이상이 비활성일 때 발생합니다.면역노화로 인해 50세 전후부터 면역반응이 저하되기 시작하는 등 젊은 층과 노년층 모두에서 병원균에 대한 면역체계의 반응 능력이 떨어집니다.[110][111]선진국에서는 비만, 알코올 중독, 약물 복용이 면역 기능 저하의 흔한 원인인 반면, 개발도상국에서는 영양실조가 면역결핍의 가장 흔한 원인입니다.[111]충분한 단백질이 부족한 식단은 손상된 세포 매개 면역, 보체 활성, 식세포 기능, IgA 항체 농도 및 사이토카인 생성과 관련이 있습니다.또한, 유전적 변이나 수술적 제거를 통해 어린 나이에 흉선이 소실되면 심각한 면역결핍과 감염에 대한 높은 취약성을 초래합니다.[112]면역결핍은 유전되거나 '획득'될 수도 있습니다.[113]중증복합면역결핍증은 수많은 유전자 변이로 인해 기능성 T세포와 B세포의 발달이 방해받는 것을 특징으로 하는 희귀 유전질환입니다.[114]식세포가 병원체를 파괴하는 능력이 감소하는 만성 육아종성 질환은 유전적 또는 선천적 면역결핍의 한 예입니다.에이즈와 몇몇 종류의 암은 후천적 면역결핍을 일으킵니다.[115][116]
자가면역

과도한 면역 반응은 면역 기능 장애의 다른 끝을 형성하는데, 특히 자가 면역 질환이 그렇습니다.여기서 면역체계는 자아와 비자아를 제대로 구분하지 못하고 신체의 일부를 공격합니다.정상적인 상황에서, 많은 T 세포와 항체는 "자기" 펩타이드와 반응합니다.[117](흉선과 골수에 위치한) 특수화된 세포의 기능 중 하나는 몸 전체에서 생성된 자가 항원을 어린 림프구에 제시하고 자가 항원을 인식하는 세포를 제거하여 자가 면역을 예방하는 것입니다.[74]일반적인 자가면역질환으로는 하시모토 갑상샘염,[118] 류마티스 관절염,[119] 제1형 당뇨병,[120] 전신홍반 루푸스 등이 있습니다.[121]
과민증
과민증은 신체 조직에 손상을 주는 면역 반응입니다.관련 메커니즘과 과민 반응의 시간 과정에 따라 4가지 클래스(유형 I – IV)로 나뉩니다.I형 과민증은 즉각적이거나 과민성 반응이며, 종종 알레르기와 관련이 있습니다.증상은 가벼운 불편함에서부터 사망에 이르기까지 다양합니다.I형 과민성은 IgE에 의해 매개되며, 항원에 의해 가교될 때 비만세포와 호염구의 탈과립을 유발합니다.[122]II형 과민증은 항체가 개인의 세포에 있는 항원에 결합하여 파괴를 표시할 때 발생합니다.이것은 항체 의존성(또는 세포독성) 과민성이라고도 불리며, IgG 및 IgM 항체에 의해 매개됩니다.[122]다양한 조직에 침착된 면역 복합체(항원, 보체 단백질, IgG 및 IgM 항체의 응집)는 타입 III 과민 반응을 유발합니다.[122]IV형 과민증(세포 매개형 또는 지연형 과민증으로도 알려져 있음)은 보통 발병하는데 2일에서 3일 정도 걸립니다.IV형 반응은 많은 자가면역 및 감염성 질환에 관련되어 있지만 접촉성 피부염을 포함할 수도 있습니다.이러한 반응은 T세포, 단세포, 대식세포에 의해 매개됩니다.[122]
특발성 염증
염증은 감염에 대한 면역체계의 첫 반응 중 하나이지만,[44] 알려진 원인 없이 나타날 수 있습니다.
염증은 에이코사노이드(eicosanoid)와 사이토카인(cytokine)에 의해 만들어지는데, 사이토카인은 상처를 입거나 감염된 세포에 의해 방출됩니다.에이코사노이드는 열을 내고 염증과 관련된 혈관의 확장을 일으키는 프로스타글란딘과 특정 백혈구를 끌어들이는 류코트리엔을 포함합니다.[45][46]일반적인 사이토카인으로는 백혈구 사이의 의사소통을 담당하는 인터류킨, 화학작용을 촉진하는 케모카인, 숙주세포에서 단백질 합성을 차단하는 등의 항바이러스 효과를 가진 인터페론 등이 있습니다.[47]성장인자와 세포독성인자도 방출될 수 있습니다.이러한 사이토카인과 다른 화학물질들은 감염 부위로 면역세포를 모집하고 병원체 제거 후 손상된 조직의 치유를 촉진합니다.[48]
의약품 조작

면역 반응은 자가 면역, 알레르기, 이식 거부로 인한 원치 않는 반응을 억제하고 면역 체계 또는 암을 크게 회피하는 병원균에 대한 보호 반응을 자극하기 위해 조작될 수 있습니다.[123]
면역억제
면역억제제는 과도한 조직 손상이 발생했을 때 자가면역장애나 염증을 조절하고 장기이식 후 거부반응을 막기 위해 사용됩니다.[124][125]
염증의 영향을 조절하기 위해 항염증제가 자주 사용됩니다.글루코코르티코이드는 이러한 약물 중 가장 강력하고 중추 비만, 고혈당, 골다공증과 같은 많은 바람직하지 않은 부작용을 가질 수 있습니다.[126]그들의 사용은 엄격하게 통제됩니다.저용량의 항염증제는 종종 메토트렉세이트나 아자티오프린과 같은 세포독성 또는 면역억제제와 함께 사용됩니다.
세포독성 약물은 활성화된 T 세포와 같은 분열 세포를 죽여서 면역 반응을 억제합니다.이 살처분은 무차별적이고 끊임없이 분열하는 다른 세포들과 그들의 장기들이 영향을 받아 독성 부작용을 일으킵니다.[125]사이클로스포린과 같은 면역억제제는 신호전달 경로를 억제함으로써 T세포가 신호에 정확하게 반응하는 것을 막습니다.[127]
면역 자극
다양한 제품과 척추 지압사, 동종 요법사, 침술사와 같은 대체 건강 제공자들의 마케팅 담당자들이 면역 체계를 자극하거나 "향상"시킬 수 있다고 주장하는 것은 일반적으로 의미 있는 설명과 효과에 대한 증거가 부족합니다.[128]
예방접종

B 및 T 세포의 활성화에 의한 감염 후 장기 활성기억이 획득됩니다.적극적 면역은 백신 접종을 통해 인위적으로 발생할 수도 있습니다.백신 접종 뒤의 원리(면역이라고도 함)는 병원체로부터 항원을 도입하여 면역 체계를 자극하고 해당 유기체와 관련된 질병을 일으키지 않고 특정 병원체에 대한 특정 면역을 발달시키는 것입니다.[129]면역 반응의 이러한 의도적인 유도는 면역 체계의 유도성뿐만 아니라 자연적인 특수성을 이용하기 때문에 성공적입니다.전염병이 인류의 주요 사망 원인 중 하나로 남아있는 가운데, 백신 접종은 인류가 발전시킨 면역 체계 중 가장 효과적인 조작을 나타냅니다.[57][130]
많은 백신들은 무해한 독소 성분을 포함한 미생물의 세포 성분을 기반으로 합니다.[129]세포 백신에서 유래한 많은 항원들은 적응 반응을 강하게 유도하지 않기 때문에, 대부분의 세균 백신은 선천 면역계의 항원 제시 세포를 활성화시키고 면역원성을 극대화하는 부가적인 보조제를 제공합니다.[131]
종양면역학
면역체계의 또 다른 중요한 역할은 종양을 확인하고 제거하는 것입니다.이것은 면역 감시라고 불립니다.종양의 형질전환된 세포는 정상 세포에는 없는 항원을 발현합니다.면역체계에 있어서, 이 항원들은 이질적으로 보이고, 그것들의 존재는 면역세포가 변형된 종양세포를 공격하게 합니다.종양에 의해 발현되는 항원들은 여러 출처를 가지고 있는데,[132] 일부는 자궁경부,[133] 외음부, 질, 음경, 항문, 입, 목구멍의 암을 유발하는 인유두종 바이러스와 같은 종양성 바이러스로부터 유래된 것이고, 다른 [134]것들은 정상 세포에서는 낮은 수준으로 발생하지만 종양 세포에서는 높은 수준에 도달하는 유기체 자체의 단백질입니다.한 가지 예는 높은 수준으로 발현될 때 특정 피부 세포(예를 들어, 멜라닌 세포)를 멜라닌종이라고 불리는 종양으로 변환시키는 tyrosinase라고 불리는 효소입니다.[135][136]종양 항원의 세 번째 가능한 원천은 보통 세포의 성장과 생존을 조절하는데 중요한 단백질로, 흔히 종양 유전자라고 불리는 암을 유도하는 분자로 돌연변이를 일으킵니다.[132][137][138]

종양에 대한 면역체계의 주된 반응은 살인자 T 세포를 이용하여 비정상적인 세포를 파괴하는 것이고, 때로는 조력자 T 세포의 도움을 받아 파괴하는 것입니다.[136][140]종양 항원은 바이러스 항원과 유사한 방식으로 MHC 클래스 I 분자에 제시됩니다.이것은 살인자 T 세포가 종양 세포를 비정상적인 것으로 인식할 수 있게 해줍니다.[141]NK 세포는 또한 종양 세포를 비슷한 방식으로 죽입니다, 특히 종양 세포가 그들의 표면에 정상보다 더 적은 MHC 클래스 I 분자를 가지고 있다면, 이것은 종양의 일반적인 현상입니다.[142]때때로 항체는 보체계에 의한 파괴를 가능하게 하는 종양세포에 대항하여 생성됩니다.[137]
일부 종양들은 면역체계를 회피하고 암으로 발전합니다.[143][144]종양 세포는 종종 그들의 표면에 감소된 MHC 클래스 I 분자의 수를 가지고 있어서 킬러 T 세포에 의한 감지를 피합니다.[141][143]일부 종양 세포는 또한 면역 반응을 억제하는 제품을 내놓습니다. 예를 들어 대식세포와 림프구의 활동을 억제하는 사이토카인 TGF-β를 분비함으로써 말입니다.[143][145]게다가, 면역학적 내성이 종양 항원에 대해 발달할 수도 있기 때문에, 면역 체계는 더 이상 종양 세포를 공격하지 않습니다.[143][144]
역설적으로, 대식세포는 종양세포가 대식세포를 유인하는 사이토카인을 내보내면 종양의[146] 성장을 촉진시킬 수 있고, 이 사이토카인과 종양의 발달을 촉진하거나 줄기세포와 같은 가소성을 촉진하는 종양괴사인자 알파와 같은 성장인자를 생성합니다.[143]게다가, 종양 내의 저산소증과 대식세포에 의해 생성되는 사이토카인의 조합은 종양 세포가 전이를 차단하는 단백질의 생성을 감소시키도록 유도하여 암세포의 확산을 돕습니다.[143]항종양 M1 대식세포는 종양 발생 초기에 모집되지만 면역억제기 스위치인 프로종양 효과를 가진 M2로 점진적으로 분화됩니다.저산소증은 항종양 반응을 위한 사이토카인 생성을 감소시키고, 대식세포는 IL-4 및 IL-10을 포함하는 종양 미세 환경에 의해 유도되는 프로-종양 M2 기능을 점진적으로 획득합니다.[147]암 면역 요법은 암 종양을 공격하기 위해 면역 체계를 자극하는 의학적인 방법을 다룹니다.[148]
면역원성 예측
일부 약물은 중화 면역 반응을 일으킬 수 있는데, 이는 면역 체계가 약물의 작용에 대항하는 중화 항체를 생성한다는 것을 의미하며, 특히 약물이 반복적으로 또는 더 많은 용량으로 투여될 경우 더욱 그렇습니다.이것은 더 큰 펩티드 및 단백질(일반적으로 6000 Da보다 큰)에 기초한 약물의 효과를 제한합니다.[149]경우에 따라서는 약물 자체가 면역원성이 아니라 Taxol의 경우처럼 면역원성 화합물과 병용 투여될 수도 있습니다.펩티드와 단백질의 면역원성을 예측하기 위한 계산 방법이 개발되었으며, 이는 치료 항체 설계, 바이러스 코팅 입자의 돌연변이의 가능한 독성 평가 및 제안된 펩티드 기반 약물 치료의 검증에 특히 유용합니다.초기 기술은 소수성 아미노산보다 친수성 아미노산이 에피토프 영역에서 과하게 표현된다는 관찰에 주로 의존했습니다.[150] 그러나 최근의 개발은 훈련 세트로 일반적으로 잘 연구된 바이러스 단백질에 대한 기존 알려진 에피토프의 데이터베이스를 사용하는 기계 학습 기술에 의존합니다.[151]B 세포가 인식할 수 있는 것으로 알려진 병원체의 에피토프 목록화를 위해 공개적으로 접근 가능한 데이터베이스가 확립되었습니다.[152]면역원성에 대한 생물정보학 기반 연구의 새로운 분야는 면역정보학이라고 불립니다.[153]면역단백체학은 면역 반응에 관련된 많은 단백질 집합을 연구하는 학문입니다.[154]
진화 및 기타 메커니즘
면역체계의 진화
무척추동물은 림프구나 항체에 기초한 체성 반응을 일으키지 않기 때문에, 첫 번째 척추동물과 함께 다중 구성요소인 적응 면역체계가 생겨났을 가능성이 있습니다.[155]그러나 많은 종들은 척추동물 면역의 이러한 측면들의 전조로 보이는 메커니즘을 사용합니다.면역체계는 박테리아가 박테리오파지라고 불리는 바이러스 병원체로부터 그들 자신을 보호하기 위해 제한 수정 체계라고 불리는 독특한 방어 체계를 사용하는, 구조적으로 가장 단순한 형태의 생명체에서도 나타납니다.[156]원핵생물(박테리아와 원핵생물)은 과거에 접촉했던 파지 유전체의 단편들을 보유하기 위해 CRISPR 서열을 사용하는 시스템을 통해 후천적인 면역력도 보유하고 있는데, 이 시스템은 RNA 간섭의 형태를 통해 바이러스 복제를 차단할 수 있습니다.[157][158]원핵생물은 또한 다른 방어 메커니즘을 가지고 있습니다.[159][160]면역체계의 공격적인 요소들은 단세포 진핵생물에도 존재하지만, 방어에 있어서 그들의 역할에 대한 연구는 거의 없습니다.[161]
패턴 인식 수용체는 병원체와 관련된 분자를 식별하기 위해 거의 모든 유기체에 의해 사용되는 단백질입니다.데펜신이라고 불리는 항균 펩타이드는 모든 동물과 식물에서 발견되는 선천적 면역 반응의 진화적으로 보존된 구성 요소이며, 무척추동물 전신 면역의 주요 형태를 나타냅니다.[155]보체계와 식세포는 또한 대부분의 무척추동물 생명체에 의해 사용됩니다.리보뉴클레아제와 RNA 간섭 경로는 모든 진핵생물에 걸쳐 보존되고 바이러스에 대한 면역 반응에 역할을 하는 것으로 생각됩니다.[162]
동물과 달리, 식물은 식세포가 부족하지만, 많은 식물 면역 반응은 식물을 통해 전달되는 전신적인 화학적 신호를 포함합니다.[163]개별 식물 세포는 병원체 관련 분자 패턴 또는 PAMP로 알려진 병원체와 관련된 분자에 반응합니다.[164]식물의 한 부분이 감염되면, 그 식물은 국소적인 과민 반응을 일으켜서, 감염 부위에 있는 세포들이 병이 식물의 다른 부분으로 퍼지는 것을 막기 위해 빠른 세포 자멸을 겪습니다.전신 획득 저항성은 식물 전체가 특정한 감염원에 저항성을 갖게 하는 식물이 사용하는 방어 반응의 한 유형입니다.[163]RNA 침묵 메커니즘은 바이러스 복제를 차단할 수 있기 때문에 이러한 전신 반응에서 특히 중요합니다.[165]
대체 적응 면역 체계
적응 면역체계의 진화는 턱이 있는 척추동물의 조상에서 일어났습니다.적응 면역체계의 고전적인 분자들 중 많은 것들(예를 들어 면역글로불린과 T-세포 수용체)은 턱이 있는 척추동물에만 존재합니다.람프리나 먹장어와 같은 원시적인 턱이 없는 척추동물에서 뚜렷한 림프구 유래 분자가 발견되었습니다.이 동물들은 턱이 있는 척추동물의 항원 수용체처럼 소수의 유전자로부터만 생성되는 가변 림프구 수용체(VLR)라고 불리는 많은 수의 분자를 가지고 있습니다.이 분자들은 항체와 유사한 방식으로 병원성 항원을 결합시키는 것으로 여겨지고, 같은 정도의 특이성을 가지고 있습니다.[166]
병원체에 의한 조작
모든 병원체의 성공은 숙주 면역 반응을 회피하는 능력에 달려 있습니다.따라서, 병원균은 면역체계에 의한 감지나 파괴를 피하면서 숙주를 성공적으로 감염시킬 수 있는 여러 가지 방법들을 진화시켰습니다.[167]박테리아는 종종 예를 들어 II형 분비 시스템을 사용함으로써 장벽을 소화시키는 효소를 분비함으로써 물리적 장벽을 극복합니다.[168]또는, 유형 III 분비 시스템을 사용하여, 그들은 중공 튜브를 숙주 세포에 삽입하여, 단백질이 병원체로부터 숙주로 이동하는 직접적인 경로를 제공할 수 있습니다.이 단백질들은 종종 숙주 방어를 차단하는데 사용됩니다.[169]
선천적 면역체계를 피하기 위해 여러 병원체들이 사용하는 회피 전략은 숙주의 세포 안에 숨는 것입니다.여기서, 병원균은 대부분의 생애 주기를 숙주 세포 안에서 보내는데, 여기서 그것은 면역 세포, 항체 그리고 보체와의 직접적인 접촉으로부터 보호됩니다.세포내 병원균의 예로는 바이러스, 식중독균인 살모넬라균, 말라리아(Plasmodium spp.)와 리슈마니아(Leishmania spp.)를 유발하는 진핵 기생충 등이 있습니다.결핵균과 같은 다른 박테리아는 보체에 의한 용해를 막는 보호 캡슐 안에 삽니다.[170]많은 병원균들은 숙주의 면역 반응을 약화시키거나 잘못 지시하는 화합물을 분비합니다.[167]일부 박테리아는 면역체계의 세포와 단백질로부터 자신을 보호하기 위해 생물막을 형성합니다.그러한 바이오필름은 낭포성 섬유증의 특징인 만성 녹농균 및 부르크홀더리아 세뇨세파시아 감염과 같은 많은 성공적인 감염에 존재합니다.[171]다른 박테리아는 항체에 결합하는 표면 단백질을 생성하여 항체를 무력하게 만듭니다. 예를 들어 스트렙토코커스(단백질 G), 황색포도상구균(단백질 A), 펩토스트렙토코커스 마그누스(단백질 L) 등이 있습니다.[172]
적응 면역 체계를 피하기 위해 사용되는 메커니즘은 더 복잡합니다.가장 간단한 방법은 필수 에피토프를 숨긴 채 병원체 표면의 비필수 에피토프(아미노산 및/또는 당)를 신속하게 변경하는 것입니다.이것을 항원 변이라고 합니다.한 예로 HIV가 있는데, HIV는 빠르게 변이하기 때문에 숙주 표적 세포로 들어가는 데 필수적인 바이러스 외피에 있는 단백질들이 끊임없이 변화합니다.항원의 이러한 빈번한 변화는 이 바이러스를 겨냥한 백신의 실패를 설명할 수 있습니다.[173]기생충 트리파노소마 브루세이는 비슷한 전략을 사용하는데, 한 종류의 표면 단백질을 다른 종류의 표면 단백질로 끊임없이 바꾸어 항체 반응보다 한 단계 앞서도록 합니다.[174]숙주 분자로 항원을 가리는 것은 면역체계에 의한 감지를 피하기 위한 또 다른 일반적인 전략입니다.HIV에서 비리온을 덮는 외피는 숙주 세포의 가장 바깥쪽 막으로부터 형성됩니다. 이러한 "자기 망토" 바이러스는 면역 체계가 그것들을 "자기 자신이 아닌" 구조로 식별하는 것을 어렵게 만듭니다.[175]
면역학의 역사

면역학은 면역체계의 구조와 기능을 조사하는 과학입니다.질병에 대한 면역력의 원인에 대한 의학과 초기 연구에서 비롯되었습니다.면역에 대한 최초의 언급은 기원전 430년 아테네의 페스트 때였습니다.투키디데스는 이전의 한 차례 질병에서 회복된 사람들은 두 번째 질병에 걸리지 않고 환자들을 간호할 수 있다고 언급했습니다.[177]18세기에, Pierre-Louis Moreau de Maupertuis는 전갈의 독을 실험했고 어떤 개들과 쥐들이 이 독에 면역성이 있다는 것을 관찰했습니다.[178]10세기에 페르시아의 의사 알 라지 (라제스라고도 알려짐)는 천연두에 대한 논쟁이 생존자들을 미래의 감염으로부터 보호한다고 언급하면서 [179][180]후천 면역에 대한 최초의 기록된 이론을 썼습니다.비록 그는 면역력을 혈액에서 "과다한 수분"이 배출되는 것으로 설명했고, 따라서 질병의 두 번째 발생을 막았지만, 이 이론은 이 시기에 알려진 천연두에 대한 많은 관측들을 설명했습니다.[181]
후천적 면역에 대한 이것들과 다른 관찰들은 후에 루이스 파스퇴르에 의해 그의 백신 접종과 그가 제안한 질병에 대한 세균 이론의 발전에 이용되었습니다.[182]파스퇴르의 이론은 미아즈마 이론과 같은 현대의 질병 이론에 직접적으로 반대되는 것이었습니다.로버트 코흐가 1891년에 증명한 것, 1905년에 노벨상을 수상한 것, 미생물이 감염병의 원인으로 확인된 것은 그가 1891년에 이르러서였습니다.[183]바이러스는 1901년 월터 리드에 의해 황열병 바이러스가 발견되면서 인간 병원체로 확인되었습니다.[184]
면역학은 체액성 면역학과 세포성 면역학의 연구에서 급속한 발전을 통하여 19세기 말에 큰 발전을 이루었습니다.[185]특히 중요한 것은 항원-항체 반응의 특이성을 설명하기 위해 측쇄 이론을 제안한 폴 에를리히의 연구였습니다. 체액 면역학의 이해에 대한 그의 공헌은 세포 면역학의 창시자인 엘리 메치니코프와 함께 1908년 공동 노벨상을 수상함으로써 인정받았습니다.[176]1974년에 닐스 카예르네는 면역 네트워크 이론을 발전시켰고, 그는 면역 시스템과 관련된 이론으로 1984년에 조르주 J. F. 쾰러, 세자르 밀스타인과 함께 노벨상을 수상했습니다.[186][187]
참고 항목
- Fc수용체
- 면역 자극기
- 성인 인체의 구별되는 세포 유형 목록
- 신경면역계
- 원래 항원성 죄 – 면역체계가 약간 다른 병원체를 만났을 때 면역학적 기억을 사용하는 경우
- 식물병 저항성
- 다클론 반응
- 종양항원
참고문헌
인용문
- ^ 솜페이락 2019, 페이지 1.
- ^ a b Litman GW, Cannon JP, Dishaw LJ (November 2005). "Reconstructing immune phylogeny: new perspectives". Nature Reviews. Immunology. 5 (11): 866–79. doi:10.1038/nri1712. PMC 3683834. PMID 16261174.
- ^ 솜페이락 2019, 페이지 4.
- ^ Restifo NP, Gattinoni L (October 2013). "Lineage relationship of effector and memory T cells". Current Opinion in Immunology. 25 (5): 556–63. doi:10.1016/j.coi.2013.09.003. PMC 3858177. PMID 24148236.
- ^ Kurosaki T, Kometani K, Ise W (March 2015). "Memory B cells". Nature Reviews. Immunology. 15 (3): 149–59. doi:10.1038/nri3802. PMID 25677494. S2CID 20825732.
- ^ 솜페이락 2019, 11쪽.
- ^ 솜페이락 2019, 페이지 146.
- ^ Alberts et al. 2002, sec. "병원균은 숙주를 식민지화하기 위해 보호 장벽을 넘습니다.
- ^ Boyton RJ, Openshaw PJ (2002). "Pulmonary defences to acute respiratory infection". British Medical Bulletin. 61 (1): 1–12. doi:10.1093/bmb/61.1.1. PMID 11997295.
- ^ Agerberth B, Gudmundsson GH (2006). "Host antimicrobial defence peptides in human disease". Current Topics in Microbiology and Immunology. 306: 67–90. doi:10.1007/3-540-29916-5_3. ISBN 978-3-540-29915-8. PMID 16909918.
- ^ Moreau JM, Girgis DO, Hume EB, Dajcs JJ, Austin MS, O'Callaghan RJ (September 2001). "Phospholipase A(2) in rabbit tears: a host defense against Staphylococcus aureus". Investigative Ophthalmology & Visual Science. 42 (10): 2347–54. PMID 11527949.
- ^ Hankiewicz J, Swierczek E (December 1974). "Lysozyme in human body fluids". Clinica Chimica Acta; International Journal of Clinical Chemistry. 57 (3): 205–09. doi:10.1016/0009-8981(74)90398-2. PMID 4434640.
- ^ Fair WR, Couch J, Wehner N (February 1976). "Prostatic antibacterial factor. Identity and significance". Urology. 7 (2): 169–77. doi:10.1016/0090-4295(76)90305-8. PMID 54972.
- ^ Yenugu S, Hamil KG, Birse CE, Ruben SM, French FS, Hall SH (June 2003). "Antibacterial properties of the sperm-binding proteins and peptides of human epididymis 2 (HE2) family; salt sensitivity, structural dependence and their interaction with outer and cytoplasmic membranes of Escherichia coli". The Biochemical Journal. 372 (Pt 2): 473–83. doi:10.1042/BJ20030225. PMC 1223422. PMID 12628001.
- ^ Smith JL (2003). "The role of gastric acid in preventing foodborne disease and how bacteria overcome acid conditions". J Food Prot. 66 (7): 1292–1303. doi:10.4315/0362-028X-66.7.1292. PMID 12870767.
- ^ Gorbach SL (February 1990). "Lactic acid bacteria and human health". Annals of Medicine. 22 (1): 37–41. doi:10.3109/07853899009147239. PMID 2109988.
- ^ Medzhitov R (October 2007). "Recognition of microorganisms and activation of the immune response". Nature. 449 (7164): 819–26. Bibcode:2007Natur.449..819M. doi:10.1038/nature06246. PMID 17943118. S2CID 4392839.
- ^ Matzinger P (April 2002). "The danger model: a renewed sense of self" (PDF). Science. 296 (5566): 301–05. Bibcode:2002Sci...296..301M. doi:10.1126/science.1071059. PMID 11951032. S2CID 13615808.
- ^ a b Alberts et al. 2002, Chapter: "천부적 면역"
- ^ 이리티 2019, p.xi.
- ^ Kumar H, Kawai T, Akira S (February 2011). "Pathogen recognition by the innate immune system". International Reviews of Immunology. 30 (1): 16–34. doi:10.3109/08830185.2010.529976. PMID 21235323. S2CID 42000671.
- ^ Schroder K, Tschopp J (March 2010). "The inflammasomes". Cell. 140 (6): 821–32. doi:10.1016/j.cell.2010.01.040. PMID 20303873. S2CID 16916572.
- ^ 솜페이락 2019, 페이지 20.
- ^ Beutler B, Jiang Z, Georgel P, Crozat K, Croker B, Rutschmann S, Du X, Hoebe K (2006). "Genetic analysis of host resistance: Toll-like receptor signaling and immunity at large". Annual Review of Immunology. 24: 353–89. doi:10.1146/annurev.immunol.24.021605.090552. PMID 16551253. S2CID 20991617.
- ^ Botos I, Segal DM, Davies DR (April 2011). "The structural biology of Toll-like receptors". Structure. 19 (4): 447–59. doi:10.1016/j.str.2011.02.004. PMC 3075535. PMID 21481769.
- ^ Vijay K (June 2018). "Toll-like receptors in immunity and inflammatory diseases: Past, present, and future". Int Immunopharmacol. 59: 391–412. doi:10.1016/j.intimp.2018.03.002. PMC 7106078. PMID 29730580.
- ^ Thompson MR, Kaminski JJ, Kurt-Jones EA, Fitzgerald KA (June 2011). "Pattern recognition receptors and the innate immune response to viral infection". Viruses. 3 (6): 920–40. doi:10.3390/v3060920. PMC 3186011. PMID 21994762.
- ^ 솜페이락 2019, 1-4쪽.
- ^ Alberts et al. 2002, sec. "식세포는 병원체를 찾고, 집어삼키고, 파괴한다.
- ^ Ryter A (1985). "Relationship between ultrastructure and specific functions of macrophages". Comparative Immunology, Microbiology and Infectious Diseases. 8 (2): 119–33. doi:10.1016/0147-9571(85)90039-6. PMID 3910340.
- ^ Langermans JA, Hazenbos WL, van Furth R (September 1994). "Antimicrobial functions of mononuclear phagocytes". Journal of Immunological Methods. 174 (1–2): 185–94. doi:10.1016/0022-1759(94)90021-3. PMID 8083520.
- ^ May RC, Machesky LM (March 2001). "Phagocytosis and the actin cytoskeleton". Journal of Cell Science. 114 (Pt 6): 1061–77. doi:10.1242/jcs.114.6.1061. PMID 11228151. Archived from the original on 31 March 2020. Retrieved 6 November 2009.
- ^ Salzet M, Tasiemski A, Cooper E (2006). "Innate immunity in lophotrochozoans: the annelids" (PDF). Current Pharmaceutical Design. 12 (24): 3043–50. doi:10.2174/138161206777947551. PMID 16918433. S2CID 28520695. Archived from the original (PDF) on 31 March 2020.
- ^ Zen K, Parkos CA (October 2003). "Leukocyte-epithelial interactions". Current Opinion in Cell Biology. 15 (5): 557–64. doi:10.1016/S0955-0674(03)00103-0. PMID 14519390.
- ^ a b Stvrtinová, Jakubovsk ý & Hulín 1995 장:염증과 발열.
- ^ Rua R, McGavern DB (September 2015). "Elucidation of monocyte/macrophage dynamics and function by intravital imaging". Journal of Leukocyte Biology. 98 (3): 319–32. doi:10.1189/jlb.4RI0115-006RR. PMC 4763596. PMID 26162402.
- ^ a b Guermonprez P, Valladeau J, Zitvogel L, Théry C, Amigorena S (2002). "Antigen presentation and T cell stimulation by dendritic cells". Annual Review of Immunology. 20 (1): 621–67. doi:10.1146/annurev.immunol.20.100301.064828. PMID 11861614.
- ^ 크리슈나스와미, 아지타위 & Chi 2006, pp. 13-34
- ^ Kariyawasam HH, Robinson DS (April 2006). "The eosinophil: the cell and its weapons, the cytokines, its locations". Seminars in Respiratory and Critical Care Medicine. 27 (2): 117–27. doi:10.1055/s-2006-939514. PMID 16612762. S2CID 260317790.
- ^ Spits H, Cupedo T (2012). "Innate lymphoid cells: emerging insights in development, lineage relationships, and function". Annual Review of Immunology. 30: 647–75. doi:10.1146/annurev-immunol-020711-075053. PMID 22224763.
- ^ Gabrielli S, Ortolani C, Del Zotto G, Luchetti F, Canonico B, Buccella F, Artico M, Papa S, Zamai L (2016). "The Memories of NK Cells: Innate-Adaptive Immune Intrinsic Crosstalk". Journal of Immunology Research. 2016: 1376595. doi:10.1155/2016/1376595. PMC 5204097. PMID 28078307.
- ^ Bertok & Chow 2005, p. 17.
- ^ 라잘링암 2012, 장:킬러 세포 면역글로불린 유사 수용체 시스템의 개요
- ^ a b Kawai T, Akira S (February 2006). "Innate immune recognition of viral infection". Nature Immunology. 7 (2): 131–37. doi:10.1038/ni1303. PMID 16424890. S2CID 9567407.
- ^ a b Miller SB (August 2006). "Prostaglandins in health and disease: an overview". Seminars in Arthritis and Rheumatism. 36 (1): 37–49. doi:10.1016/j.semarthrit.2006.03.005. PMID 16887467.
- ^ a b Ogawa Y, Calhoun WJ (October 2006). "The role of leukotrienes in airway inflammation". The Journal of Allergy and Clinical Immunology. 118 (4): 789–98, quiz 799–800. doi:10.1016/j.jaci.2006.08.009. PMID 17030228.
- ^ a b Le Y, Zhou Y, Iribarren P, Wang J (April 2004). "Chemokines and chemokine receptors: their manifold roles in homeostasis and disease" (PDF). Cellular & Molecular Immunology. 1 (2): 95–104. PMID 16212895.
- ^ a b Martin P, Leibovich SJ (November 2005). "Inflammatory cells during wound repair: the good, the bad and the ugly". Trends in Cell Biology. 15 (11): 599–607. doi:10.1016/j.tcb.2005.09.002. PMID 16202600.
- ^ Platnich JM, Muruve DA (February 2019). "NOD-like receptors and inflammasomes: A review of their canonical and non-canonical signaling pathways". Archives of Biochemistry and Biophysics. 670: 4–14. doi:10.1016/j.abb.2019.02.008. PMID 30772258. S2CID 73464235.
- ^ a b Rus H, Cudrici C, Niculescu F (2005). "The role of the complement system in innate immunity". Immunologic Research. 33 (2): 103–12. doi:10.1385/IR:33:2:103. PMID 16234578. S2CID 46096567.
- ^ Degn SE, Thiel S (August 2013). "Humoral pattern recognition and the complement system". Scandinavian Journal of Immunology. 78 (2): 181–93. doi:10.1111/sji.12070. PMID 23672641.
- ^ Bertok & Chow 2005, 페이지 112-113.
- ^ Liszewski MK, Farries TC, Lublin DM, Rooney IA, Atkinson JP (1996). Control of the complement system. Advances in Immunology. Vol. 61. pp. 201–283. doi:10.1016/S0065-2776(08)60868-8. ISBN 978-0-12-022461-6. PMID 8834497.
- ^ Sim RB, Tsiftsoglou SA (February 2004). "Proteases of the complement system" (PDF). Biochemical Society Transactions. 32 (Pt 1): 21–27. doi:10.1042/BST0320021. PMID 14748705. S2CID 24505041. Archived from the original (PDF) on 2 March 2019.
- ^ Pancer Z, Cooper MD (2006). "The evolution of adaptive immunity". Annual Review of Immunology. 24 (1): 497–518. doi:10.1146/annurev.immunol.24.021605.090542. PMID 16551257.
- ^ 솜페이락 2019, 38쪽.
- ^ a b c 제인웨이 2005.
- ^ a b Holtmeier W, Kabelitz D (2005). "gammadelta T cells link innate and adaptive immune responses". Chemical Immunology and Allergy. 86: 151–83. doi:10.1159/000086659. ISBN 3-8055-7862-8. PMID 15976493.
- ^ Venturi S, Venturi M (September 2009). "Iodine, thymus, and immunity". Nutrition. 25 (9): 977–79. doi:10.1016/j.nut.2009.06.002. PMID 19647627.
- ^ 제인웨이, 트래버스 & 월포트 2001, sec. 12-10.
- ^ 솜페이락 2019, 페이지 5-6.
- ^ 솜페이락 2019, 51-53쪽.
- ^ 솜페이락 2019, 페이지 7-8.
- ^ Harty JT, Tvinnereim AR, White DW (2000). "CD8+ T cell effector mechanisms in resistance to infection". Annual Review of Immunology. 18 (1): 275–308. doi:10.1146/annurev.immunol.18.1.275. PMID 10837060.
- ^ a b Radoja S, Frey AB, Vukmanovic S (2006). "T-cell receptor signaling events triggering granule exocytosis". Critical Reviews in Immunology. 26 (3): 265–90. doi:10.1615/CritRevImmunol.v26.i3.40. PMID 16928189.
- ^ Abbas AK, Murphy KM, Sher A (October 1996). "Functional diversity of helper T lymphocytes". Nature. 383 (6603): 787–93. Bibcode:1996Natur.383..787A. doi:10.1038/383787a0. PMID 8893001. S2CID 4319699.
- ^ McHeyzer-Williams LJ, Malherbe LP, McHeyzer-Williams MG (2006). "Helper T cell-regulated B cell immunity". Current Topics in Microbiology and Immunology. 311: 59–83. doi:10.1007/3-540-32636-7_3. ISBN 978-3-540-32635-9. PMID 17048705.
- ^ 솜페이락 2019, 페이지 8.
- ^ Kovacs B, Maus MV, Riley JL, Derimanov GS, Koretzky GA, June CH, Finkel TH (November 2002). "Human CD8+ T cells do not require the polarization of lipid rafts for activation and proliferation". Proceedings of the National Academy of Sciences of the United States of America. 99 (23): 15006–11. Bibcode:2002PNAS...9915006K. doi:10.1073/pnas.232058599. PMC 137535. PMID 12419850.
- ^ Alberts et al. 2002, Chapter."T 세포와 림프구 활성화를 돕습니다."
- ^ Grewal IS, Flavell RA (1998). "CD40 and CD154 in cell-mediated immunity". Annual Review of Immunology. 16 (1): 111–35. doi:10.1146/annurev.immunol.16.1.111. PMID 9597126.
- ^ Girardi M (January 2006). "Immunosurveillance and immunoregulation by gammadelta T cells". The Journal of Investigative Dermatology. 126 (1): 25–31. doi:10.1038/sj.jid.5700003. PMID 16417214.
- ^ "Understanding the Immune System: How it Works" (PDF). National Institute of Allergy and Infectious Diseases (NIAID). Archived from the original (PDF) on 3 January 2007. Retrieved 1 January 2007.
- ^ a b Sproul TW, Cheng PC, Dykstra ML, Pierce SK (2000). "A role for MHC class II antigen processing in B cell development". International Reviews of Immunology. 19 (2–3): 139–55. doi:10.3109/08830180009088502. PMID 10763706. S2CID 6550357.
- ^ Parker DC (1993). "T cell-dependent B cell activation". Annual Review of Immunology. 11: 331–60. doi:10.1146/annurev.iy.11.040193.001555. PMID 8476565.
- ^ 머피 & 위버 2016, 10장:체액성 면역 반응.
- ^ Saji F, Samejima Y, Kamiura S, Koyama M (May 1999). "Dynamics of immunoglobulins at the feto-maternal interface" (PDF). Reviews of Reproduction. 4 (2): 81–89. doi:10.1530/ror.0.0040081. PMID 10357095. S2CID 31099552. Archived from the original (PDF) on 30 January 2021.
- ^ Van de Perre P (July 2003). "Transfer of antibody via mother's milk". Vaccine. 21 (24): 3374–76. doi:10.1016/S0264-410X(03)00336-0. PMID 12850343.
- ^ Keller MA, Stiehm ER (October 2000). "Passive immunity in prevention and treatment of infectious diseases". Clinical Microbiology Reviews. 13 (4): 602–14. doi:10.1128/CMR.13.4.602-614.2000. PMC 88952. PMID 11023960.
- ^ 솜페이락 2019, 페이지 98.
- ^ Wick G, Hu Y, Schwarz S, Kroemer G (October 1993). "Immunoendocrine communication via the hypothalamo-pituitary-adrenal axis in autoimmune diseases". Endocrine Reviews. 14 (5): 539–63. doi:10.1210/edrv-14-5-539. PMID 8262005.
- ^ Kroemer G, Brezinschek HP, Faessler R, Schauenstein K, Wick G (June 1988). "Physiology and pathology of an immunoendocrine feedback loop". Immunology Today. 9 (6): 163–5. doi:10.1016/0167-5699(88)91289-3. PMID 3256322.
- ^ Trakhtenberg EF, Goldberg JL (October 2011). "Immunology. Neuroimmune communication". Science. 334 (6052): 47–8. Bibcode:2011Sci...334...47T. doi:10.1126/science.1213099. PMID 21980100. S2CID 36504684.
- ^ Veiga-Fernandes H, Mucida D (May 2016). "Neuro-Immune Interactions at Barrier Surfaces". Cell. 165 (4): 801–11. doi:10.1016/j.cell.2016.04.041. PMC 4871617. PMID 27153494.
- ^ "Neuroimmune communication". Nature Neuroscience. 20 (2): 127. February 2017. doi:10.1038/nn.4496. PMID 28092662.
- ^ Wilcox SM, Arora H, Munro L, Xin J, Fenninger F, Johnson LA, Pfeifer CG, Choi KB, Hou J, Hoodless PA, Jefferies WA (2017). "The role of the innate immune response regulatory gene ABCF1 in mammalian embryogenesis and development". PLOS ONE. 12 (5): e0175918. Bibcode:2017PLoSO..1275918W. doi:10.1371/journal.pone.0175918. PMC 5438103. PMID 28542262.
- ^ Wira, Crane-Godreau & Grant 2004, Chapter: 여성 생식기의 점막 면역계의 내분비 조절
- ^ Lang TJ (December 2004). "Estrogen as an immunomodulator". Clinical Immunology. 113 (3): 224–30. doi:10.1016/j.clim.2004.05.011. PMID 15507385.
Moriyama A, Shimoya K, Ogata I, Kimura T, Nakamura T, Wada H, Ohashi K, Azuma C, Saji F, Murata Y (July 1999). "Secretory leukocyte protease inhibitor (SLPI) concentrations in cervical mucus of women with normal menstrual cycle". Molecular Human Reproduction. 5 (7): 656–61. doi:10.1093/molehr/5.7.656. PMID 10381821.
Cutolo M, Sulli A, Capellino S, Villaggio B, Montagna P, Seriolo B, Straub RH (2004). "Sex hormones influence on the immune system: basic and clinical aspects in autoimmunity". Lupus. 13 (9): 635–38. doi:10.1191/0961203304lu1094oa. PMID 15485092. S2CID 23941507.
King AE, Critchley HO, Kelly RW (February 2000). "Presence of secretory leukocyte protease inhibitor in human endometrium and first trimester decidua suggests an antibacterial protective role". Molecular Human Reproduction. 6 (2): 191–96. doi:10.1093/molehr/6.2.191. PMID 10655462. - ^ Fimmel S, Zouboulis CC (2005). "Influence of physiological androgen levels on wound healing and immune status in men". The Aging Male. 8 (3–4): 166–74. doi:10.1080/13685530500233847. PMID 16390741. S2CID 1021367.
- ^ Dorshkind K, Horseman ND (June 2000). "The roles of prolactin, growth hormone, insulin-like growth factor-I, and thyroid hormones in lymphocyte development and function: insights from genetic models of hormone and hormone receptor deficiency". Endocrine Reviews. 21 (3): 292–312. doi:10.1210/edrv.21.3.0397. PMID 10857555.
- ^ Nagpal S, Na S, Rathnachalam R (August 2005). "Noncalcemic actions of vitamin D receptor ligands". Endocrine Reviews. 26 (5): 662–87. doi:10.1210/er.2004-0002. PMID 15798098.
- ^ "Vitamin D - Fact Sheet for Health Professionals". Office of Dietary Supplements, US National Institutes of Health. 17 August 2021. Retrieved 31 March 2022.
- ^ Institute of Medicine (2011). "8, Implications and Special Concerns". In Ross AC, Taylor CL, Yaktine AL, Del Valle HB (eds.). Dietary Reference Intakes for Calcium and Vitamin D. The National Academies Collection: Reports funded by the National Institutes of Health. National Academies Press. doi:10.17226/13050. ISBN 978-0-309-16394-1. PMID 21796828. S2CID 58721779.
- ^ Bryant PA, Trinder J, Curtis N (June 2004). "Sick and tired: Does sleep have a vital role in the immune system?". Nature Reviews. Immunology. 4 (6): 457–67. doi:10.1038/nri1369. PMID 15173834. S2CID 29318345.
- ^ Krueger JM, Majde JA (May 2003). "Humoral links between sleep and the immune system: research issues". Annals of the New York Academy of Sciences. 992 (1): 9–20. Bibcode:2003NYASA.992....9K. doi:10.1111/j.1749-6632.2003.tb03133.x. PMID 12794042. S2CID 24508121.
- ^ Majde JA, Krueger JM (December 2005). "Links between the innate immune system and sleep". The Journal of Allergy and Clinical Immunology. 116 (6): 1188–98. doi:10.1016/j.jaci.2005.08.005. PMID 16337444.
- ^ Taylor DJ, Kelly K, Kohut ML, Song KS (2017). "Is Insomnia a Risk Factor for Decreased Influenza Vaccine Response?". Behavioral Sleep Medicine. 15 (4): 270–287. doi:10.1080/15402002.2015.1126596. PMC 5554442. PMID 27077395.
- ^ Krueger JM (2008). "The role of cytokines in sleep regulation". Current Pharmaceutical Design. 14 (32): 3408–16. doi:10.2174/138161208786549281. PMC 2692603. PMID 19075717.
- ^ a b Besedovsky L, Lange T, Born J (January 2012). "Sleep and immune function". Pflügers Archiv. 463 (1): 121–37. doi:10.1007/s00424-011-1044-0. PMC 3256323. PMID 22071480.
- ^ "Can Better Sleep Mean Catching fewer Colds?". Archived from the original on 9 May 2014. Retrieved 28 April 2014.
- ^ da Silveira MP, da Silva Fagundes KK, Bizuti MR, Starck É, Rossi RC, de Resende E, Silva DT (February 2021). "Physical exercise as a tool to help the immune system against COVID-19: an integrative review of the current literature". Clinical and Experimental Medicine. 21 (1): 15–28. doi:10.1007/s10238-020-00650-3. PMC 7387807. PMID 32728975.
- ^ a b c d e Peake JM, Neubauer O, Walsh NP, Simpson RJ (May 2017). "Recovery of the immune system after exercise" (PDF). Journal of Applied Physiology. 122 (5): 1077–1087. doi:10.1152/japplphysiol.00622.2016. PMID 27909225. S2CID 3521624.
- ^ Campbell JP, Turner JE (2018). "Debunking the Myth of Exercise-Induced Immune Suppression: Redefining the Impact of Exercise on Immunological Health Across the Lifespan". Frontiers in Immunology. 9: 648. doi:10.3389/fimmu.2018.00648. PMC 5911985. PMID 29713319.
- ^ Simpson RJ, Campbell JP, Gleeson M, Krüger K, Nieman DC, Pyne DB, Turner JE, Walsh NP (2020). "Can exercise affect immune function to increase susceptibility to infection?". Exercise Immunology Review. 26: 8–22. PMID 32139352.
- ^ Minari AL, Thomatieli-Santos RV (January 2022). "From skeletal muscle damage and regeneration to the hypertrophy induced by exercise: what is the role of different macrophage subsets?". American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 322 (1): R41–R54. doi:10.1152/ajpregu.00038.2021. PMID 34786967. S2CID 244369441.
- ^ Godwin JW, Pinto AR, Rosenthal NA (January 2017). "Chasing the recipe for a pro-regenerative immune system". Seminars in Cell & Developmental Biology. Innate immune pathways in wound healing/Peromyscus as a model system. 61: 71–79. doi:10.1016/j.semcdb.2016.08.008. PMC 5338634. PMID 27521522.
- ^ 솜페이락 2019, 페이지 120-24.
- ^ 솜페이락 2019, 페이지 114-18
- ^ 솜페이락 2019, 페이지 111-14
- ^ Aw D, Silva AB, Palmer DB (April 2007). "Immunosenescence: emerging challenges for an ageing population". Immunology. 120 (4): 435–46. doi:10.1111/j.1365-2567.2007.02555.x. PMC 2265901. PMID 17313487.
- ^ a b Chandra RK (August 1997). "Nutrition and the immune system: an introduction". The American Journal of Clinical Nutrition. 66 (2): 460S–63S. doi:10.1093/ajcn/66.2.460S. PMID 9250133.
- ^ Miller JF (July 2002). "The discovery of thymus function and of thymus-derived lymphocytes". Immunological Reviews. 185 (1): 7–14. doi:10.1034/j.1600-065X.2002.18502.x. PMID 12190917. S2CID 12108587.
- ^ 리스 2011, 페이지 967.
- ^ Burg M, Gennery AR (2011). "Educational paper: The expanding clinical and immunological spectrum of severe combined immunodeficiency". Eur J Pediatr. 170 (5): 561–571. doi:10.1007/s00431-011-1452-3. PMC 3078321. PMID 21479529.
- ^ Joos L, Tamm M (2005). "Breakdown of pulmonary host defense in the immunocompromised host: cancer chemotherapy". Proceedings of the American Thoracic Society. 2 (5): 445–48. doi:10.1513/pats.200508-097JS. PMID 16322598.
- ^ Copeland KF, Heeney JL (December 1996). "T helper cell activation and human retroviral pathogenesis". Microbiological Reviews. 60 (4): 722–42. doi:10.1128/MMBR.60.4.722-742.1996. PMC 239461. PMID 8987361.
- ^ Miller JF (1993). "Self-nonself discrimination and tolerance in T and B lymphocytes". Immunologic Research. 12 (2): 115–30. doi:10.1007/BF02918299. PMID 8254222. S2CID 32476323.
- ^
 이 문서는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다.
이 문서는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다. - ^ Smolen JS, Aletaha D, McInnes IB (October 2016). "Rheumatoid arthritis" (PDF). Lancet. 388 (10055): 2023–2038. doi:10.1016/S0140-6736(16)30173-8. PMID 27156434. S2CID 37973054.
- ^ Farhy LS, McCall AL (July 2015). "Glucagon - the new 'insulin' in the pathophysiology of diabetes". Current Opinion in Clinical Nutrition and Metabolic Care. 18 (4): 407–14. doi:10.1097/mco.0000000000000192. PMID 26049639. S2CID 19872862.
- ^ "Handout on Health: Systemic Lupus Erythematosus". www.niams.nih.gov. February 2015. Archived from the original on 17 June 2016. Retrieved 12 June 2016.
- ^ a b c d Ghaffar A (2006). "Immunology – Chapter Seventeen: Hypersensitivity States". Microbiology and Immunology On-line. University of South Carolina School of Medicine. Retrieved 29 May 2016.
- ^ 솜페이락 2019, 페이지 83–85.
- ^ 시콘 2015, 37장.
- ^ a b Taylor AL, Watson CJ, Bradley JA (October 2005). "Immunosuppressive agents in solid organ transplantation: Mechanisms of action and therapeutic efficacy". Critical Reviews in Oncology/Hematology. 56 (1): 23–46. doi:10.1016/j.critrevonc.2005.03.012. PMID 16039869.
- ^ Barnes PJ (March 2006). "Corticosteroids: the drugs to beat". European Journal of Pharmacology. 533 (1–3): 2–14. doi:10.1016/j.ejphar.2005.12.052. PMID 16436275.
- ^ Masri MA (July 2003). "The mosaic of immunosuppressive drugs". Molecular Immunology. 39 (17–18): 1073–77. doi:10.1016/S0161-5890(03)00075-0. PMID 12835079.
- ^ Hall H (July–August 2020). "How You Can Really Boost Your Immune System". Skeptical Inquirer. Amherst, New York: Center for Inquiry. Archived from the original on 21 January 2021. Retrieved 21 January 2021.
- ^ a b 리스 2011, 페이지 965.
- ^ 2002년 WHO 회원국의 원인별 사망 및 DALY 추정치.2008년 10월 21일 Wayback Machine World Health Organization에서 보관.2007년 1월 1일 회수.
- ^ Singh M, O'Hagan D (November 1999). "Advances in vaccine adjuvants". Nature Biotechnology. 17 (11): 1075–81. doi:10.1038/15058. PMID 10545912. S2CID 21346647.
- ^ a b Andersen MH, Schrama D, Thor Straten P, Becker JC (January 2006). "Cytotoxic T cells". The Journal of Investigative Dermatology. 126 (1): 32–41. doi:10.1038/sj.jid.5700001. PMID 16417215.
- ^ Boon T, van der Bruggen P (March 1996). "Human tumor antigens recognized by T lymphocytes". The Journal of Experimental Medicine. 183 (3): 725–29. doi:10.1084/jem.183.3.725. PMC 2192342. PMID 8642276.
- ^ Ljubojevic S, Skerlev M (2014). "HPV-associated diseases". Clinics in Dermatology. 32 (2): 227–34. doi:10.1016/j.clindermatol.2013.08.007. PMID 24559558.
- ^ Castelli C, Rivoltini L, Andreola G, Carrabba M, Renkvist N, Parmiani G (March 2000). "T-cell recognition of melanoma-associated antigens". Journal of Cellular Physiology. 182 (3): 323–31. doi:10.1002/(SICI)1097-4652(200003)182:3<323::AID-JCP2>3.0.CO;2-#. PMID 10653598. S2CID 196590144.
- ^ a b Romero P, Cerottini JC, Speiser DE (2006). The human T cell response to melanoma antigens. Advances in Immunology. Vol. 92. pp. 187–224. doi:10.1016/S0065-2776(06)92005-7. ISBN 978-0-12-373636-9. PMID 17145305.
- ^ a b Guevara-Patiño JA, Turk MJ, Wolchok JD, Houghton AN (2003). "Immunity to cancer through immune recognition of altered self: studies with melanoma". Advances in Cancer Research. 90: 157–77. doi:10.1016/S0065-230X(03)90005-4. ISBN 978-0-12-006690-2. PMID 14710950.
- ^ Renkvist N, Castelli C, Robbins PF, Parmiani G (March 2001). "A listing of human tumor antigens recognized by T cells". Cancer Immunology, Immunotherapy. 50 (1): 3–15. doi:10.1007/s002620000169. PMID 11315507. S2CID 42681479.
- ^ Morgan RA, Dudley ME, Wunderlich JR, et al. (October 2006). "Cancer Regression in Patients After Transfer of Genetically Engineered Lymphocytes". Science. 314 (5796): 126–29. Bibcode:2006Sci...314..126M. doi:10.1126/science.1129003. PMC 2267026. PMID 16946036.
- ^ Gerloni M, Zanetti M (June 2005). "CD4 T cells in tumor immunity". Springer Seminars in Immunopathology. 27 (1): 37–48. doi:10.1007/s00281-004-0193-z. PMID 15965712. S2CID 25182066.
- ^ a b Seliger B, Ritz U, Ferrone S (January 2006). "Molecular mechanisms of HLA class I antigen abnormalities following viral infection and transformation". International Journal of Cancer. 118 (1): 129–38. doi:10.1002/ijc.21312. PMID 16003759. S2CID 5655726.
- ^ Hayakawa Y, Smyth MJ (2006). "Innate immune recognition and suppression of tumors". Advances in Cancer Research. 95: 293–322. doi:10.1016/S0065-230X(06)95008-8. ISBN 978-0-12-006695-7. PMID 16860661.
- ^ a b c d e f Syn NL, Teng MW, Mok TS, Soo RA (December 2017). "De-novo and acquired resistance to immune checkpoint targeting". The Lancet. Oncology. 18 (12): e731–e741. doi:10.1016/s1470-2045(17)30607-1. PMID 29208439.
- ^ a b Seliger B (2005). "Strategies of tumor immune evasion". BioDrugs. 19 (6): 347–54. doi:10.2165/00063030-200519060-00002. PMID 16392887. S2CID 1838144.
- ^ Frumento G, Piazza T, Di Carlo E, Ferrini S (September 2006). "Targeting tumor-related immunosuppression for cancer immunotherapy". Endocrine, Metabolic & Immune Disorders Drug Targets. 6 (3): 233–7. doi:10.2174/187153006778250019. PMID 17017974.
- ^ Stix G (July 2007). "A malignant flame. Understanding chronic inflammation, which contributes to heart disease, Alzheimer's and a variety of other ailments, may be a key to unlocking the mysteries of cancer" (PDF). Scientific American. 297 (1): 60–67. Bibcode:2007SciAm.297a..60S. doi:10.1038/scientificamerican0707-60. PMID 17695843. Archived from the original (PDF) on 16 July 2011.
- ^ Cervantes-Villagrana RD, Albores-García D, Cervantes-Villagrana AR, García-Acevez SJ (18 June 2020). "Tumor-induced Neurogenesis and Immune Evasion as Targets of Innovative Anti-Cancer Therapies". Signal Transduct Target Ther. 5 (1): 99. doi:10.1038/s41392-020-0205-z. PMC 7303203. PMID 32555170.
- ^ Yang Y (September 2015). "Cancer immunotherapy: harnessing the immune system to battle cancer". The Journal of Clinical Investigation. 125 (9): 3335–7. doi:10.1172/JCI83871. PMC 4588312. PMID 26325031.
- ^ Baker MP, Reynolds HM, Lumicisi B, Bryson CJ (October 2010). "Immunogenicity of protein therapeutics: The key causes, consequences and challenges". Self/Nonself. 1 (4): 314–322. doi:10.4161/self.1.4.13904. PMC 3062386. PMID 21487506.
- ^ Welling GW, Weijer WJ, van der Zee R, Welling-Wester S (September 1985). "Prediction of sequential antigenic regions in proteins". FEBS Letters. 188 (2): 215–18. doi:10.1016/0014-5793(85)80374-4. PMID 2411595.
- ^ Söllner J, Mayer B (2006). "Machine learning approaches for prediction of linear B-cell epitopes on proteins". Journal of Molecular Recognition. 19 (3): 200–08. doi:10.1002/jmr.771. PMID 16598694. S2CID 18197810.
- ^ Saha S, Bhasin M, Raghava GP (2005). "Bcipep: a database of B-cell epitopes". BMC Genomics. 6: 79. doi:10.1186/1471-2164-6-79. PMC 1173103. PMID 15921533.
- ^ Flower DR, Doytchinova IA (2002). "Immunoinformatics and the prediction of immunogenicity". Applied Bioinformatics. 1 (4): 167–76. PMID 15130835.
- ^ Kanduc D (September 2019). "From hepatitis C virus immunoproteomics to rheumatology via cross-reactivity in one table". Current Opinion in Rheumatology. 31 (5): 488–492. doi:10.1097/BOR.0000000000000606. PMID 31356379. S2CID 198982175.
- ^ a b Flajnik MF, Kasahara M (January 2010). "Origin and evolution of the adaptive immune system: genetic events and selective pressures". Nature Reviews. Genetics. 11 (1): 47–59. doi:10.1038/nrg2703. PMC 3805090. PMID 19997068.
- ^ Bickle TA, Krüger DH (June 1993). "Biology of DNA restriction". Microbiological Reviews. 57 (2): 434–50. doi:10.1128/MMBR.57.2.434-450.1993. PMC 372918. PMID 8336674.
- ^ Barrangou R, Fremaux C, Deveau H, Richards M, Boyaval P, Moineau S, Romero DA, Horvath P (March 2007). "CRISPR provides acquired resistance against viruses in prokaryotes". Science. 315 (5819): 1709–12. Bibcode:2007Sci...315.1709B. doi:10.1126/science.1138140. hdl:20.500.11794/38902. PMID 17379808. S2CID 3888761.
- ^ Brouns SJ, Jore MM, Lundgren M, Westra ER, Slijkhuis RJ, Snijders AP, Dickman MJ, Makarova KS, Koonin EV, van der Oost J (August 2008). "Small CRISPR RNAs guide antiviral defense in prokaryotes". Science. 321 (5891): 960–64. Bibcode:2008Sci...321..960B. doi:10.1126/science.1159689. PMC 5898235. PMID 18703739.
- ^ Hille F, Charpentier E (November 2016). "CRISPR-Cas: biology, mechanisms and relevance". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 371 (1707): 20150496. doi:10.1098/rstb.2015.0496. PMC 5052741. PMID 27672148.
- ^ Koonin EV (February 2017). "Evolution of RNA- and DNA-guided antivirus defense systems in prokaryotes and eukaryotes: common ancestry vs convergence". Biology Direct. 12 (1): 5. doi:10.1186/s13062-017-0177-2. PMC 5303251. PMID 28187792.
- ^ Bayne CJ (2003). "Origins and evolutionary relationships between the innate and adaptive arms of immune systems". Integr. Comp. Biol. 43 (2): 293–99. doi:10.1093/icb/43.2.293. PMID 21680436.
- ^ Stram Y, Kuzntzova L (June 2006). "Inhibition of viruses by RNA interference". Virus Genes. 32 (3): 299–306. doi:10.1007/s11262-005-6914-0. PMC 7088519. PMID 16732482.
- ^ a b Schneider D. "Innate Immunity – Lecture 4: Plant immune responses" (PDF). Stanford University Department of Microbiology and Immunology. Retrieved 1 January 2007.
- ^ Jones JD, Dangl JL (November 2006). "The plant immune system". Nature. 444 (7117): 323–29. Bibcode:2006Natur.444..323J. doi:10.1038/nature05286. PMID 17108957.
- ^ Baulcombe D (September 2004). "RNA silencing in plants". Nature. 431 (7006): 356–63. Bibcode:2004Natur.431..356B. doi:10.1038/nature02874. PMID 15372043. S2CID 4421274.
- ^ Alder MN, Rogozin IB, Iyer LM, Glazko GV, Cooper MD, Pancer Z (December 2005). "Diversity and function of adaptive immune receptors in a jawless vertebrate". Science. 310 (5756): 1970–73. Bibcode:2005Sci...310.1970A. doi:10.1126/science.1119420. PMID 16373579.
- ^ a b Finlay BB, McFadden G (February 2006). "Anti-immunology: evasion of the host immune system by bacterial and viral pathogens". Cell. 124 (4): 767–82. doi:10.1016/j.cell.2006.01.034. PMID 16497587. S2CID 15418509.
- ^ Cianciotto NP (December 2005). "Type II secretion: a protein secretion system for all seasons". Trends in Microbiology. 13 (12): 581–88. doi:10.1016/j.tim.2005.09.005. PMID 16216510.
- ^ Winstanley C, Hart CA (February 2001). "Type III secretion systems and pathogenicity islands". Journal of Medical Microbiology. 50 (2): 116–26. doi:10.1099/0022-1317-50-2-116. PMID 11211218.
- ^ Finlay BB, Falkow S (June 1997). "Common themes in microbial pathogenicity revisited". Microbiology and Molecular Biology Reviews. 61 (2): 136–69. doi:10.1128/mmbr.61.2.136-169.1997. PMC 232605. PMID 9184008.
- ^ Kobayashi H (2005). "Airway biofilms: implications for pathogenesis and therapy of respiratory tract infections". Treatments in Respiratory Medicine. 4 (4): 241–53. doi:10.2165/00151829-200504040-00003. PMID 16086598. S2CID 31788349.
- ^ Housden NG, Harrison S, Roberts SE, Beckingham JA, Graille M, Stura E, Gore MG (June 2003). "Immunoglobulin-binding domains: Protein L from Peptostreptococcus magnus" (PDF). Biochemical Society Transactions. 31 (Pt 3): 716–18. doi:10.1042/BST0310716. PMID 12773190. S2CID 10322322. Archived from the original (PDF) on 2 March 2019.
- ^ Burton DR, Stanfield RL, Wilson IA (October 2005). "Antibody vs. HIV in a clash of evolutionary titans". Proceedings of the National Academy of Sciences of the United States of America. 102 (42): 14943–48. Bibcode:2005PNAS..10214943B. doi:10.1073/pnas.0505126102. PMC 1257708. PMID 16219699.
- ^ Taylor JE, Rudenko G (November 2006). "Switching trypanosome coats: what's in the wardrobe?". Trends in Genetics. 22 (11): 614–20. doi:10.1016/j.tig.2006.08.003. PMID 16908087.
- ^ Cantin R, Méthot S, Tremblay MJ (June 2005). "Plunder and stowaways: incorporation of cellular proteins by enveloped viruses". Journal of Virology. 79 (11): 6577–87. doi:10.1128/JVI.79.11.6577-6587.2005. PMC 1112128. PMID 15890896.
- ^ a b "The Nobel Prize in Physiology or Medicine 1908". The Nobel Prize. Retrieved 8 January 2007.
- ^ Retief FP, Cilliers L (January 1998). "The epidemic of Athens, 430–426 BC". South African Medical Journal = Suid-Afrikaanse Tydskrif vir Geneeskunde. 88 (1): 50–53. PMID 9539938.
- ^ Ostoya P (1954). "Maupertuis et la biologie". Revue d'histoire des sciences et de leurs applications. 7 (1): 60–78. doi:10.3406/rhs.1954.3379.
- ^ Doherty M, Robertson MJ (December 2004). "Some early Trends in Immunology". Trends in Immunology. 25 (12): 623–31. doi:10.1016/j.it.2004.10.008. PMID 15530829.
- ^ Silverstein 1989, p. 6.
- ^ Silverstein 1989, p. 7.
- ^ Plotkin SA (April 2005). "Vaccines: past, present and future". Nature Medicine. 11 (4 Suppl): S5–11. doi:10.1038/nm1209. PMC 7095920. PMID 15812490.
- ^ 1905년 노벨 생리학·의학상은 2006년 12월 10일 웨이백 머신에서 보관됨 Nobelprize.org 2009년 1월 8일 회수.
- ^ 월터 리드 소령, 미군 월터 리드 육군 의료 센터의 의무대입니다.2007년 1월 8일 회수.
- ^ Metchnikoff E (1905). Immunity in Infective Diseases (Full Text Version: Internet Archive). Translated by Binnie FG. Cambridge University Press. LCCN 68025143.
history of humoral immunity.
- ^ "Niels K. Jerne". The Nobel Prize. Retrieved 27 November 2020.
- ^ Yewdell J (4 October 2003). "He put the Id in Idiotype". EMBO Reports (Book review). 4 (10): 931. doi:10.1038/sj.embor.embor951. PMC 1326409.
일반참고문헌
- Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walters P (2002). Molecular Biology of the Cell (Fourth ed.). New York and London: Garland Science. ISBN 978-0-8153-3218-3.
- Bertok L, Chow D (2005). Bertok L, Chow D (eds.). Natural Immunity. Vol. 5 (1st ed.). Elsevier Science. ISBN 978-0-44451-755-5.
- Iriti M (2019). Plant Innate Immunity 2.0. Basel: MDPI. doi:10.3390/books978-3-03897-581-6. ISBN 978-3-03897-580-9. OCLC 1105775088.
- Ciccone CD (2015). Pharmacology in Rehabilitation (Contemporary Perspectives in Rehabilitation) (5th ed.). F.A. Davis Company. ISBN 978-0-80364-029-0.
- Janeway CA, Travers P, Walport M (2001). Immunobiology (5th ed.). Garland Science.
- Janeway CA (2005). Immunobiology (6th ed.). Garland Science. ISBN 0-443-07310-4.
- Krishnaswamy G, Ajitawi O, Chi DS (2006). "The human mast cell: an overview". Mast Cells. Methods in Molecular Biology. Vol. 315. pp. 13–34. doi:10.1385/1-59259-967-2:013. ISBN 1-59259-967-2. PMID 16110146.
- Murphy K, Weaver C (2016). Immunobiology (9 ed.). Garland Science. ISBN 978-0-8153-4505-3.
- Rajalingam R (2012). "Overview of the Killer Cell Immunoglobulin-Like Receptor System". Immunogenetics. Methods in Molecular Biology. Vol. 882. pp. 391–414. doi:10.1007/978-1-61779-842-9_23. ISBN 978-1-61779-841-2. PMID 22665247.
- Reece J (2011). Campbell biology. Frenchs Forest, N.S.W: Pearson Australia. ISBN 978-1-4425-3176-5. OCLC 712136178.
- Silverstein AM (1989). A History of Immunology. Academic Press. ISBN 978-0-08-092583-7.
- Sompayrac L (2019). How the immune system works. Hoboken, NJ: Wiley-Blackwell. ISBN 978-1-119-54212-4. OCLC 1083261548.
- Stvrtinová V, Jakubovský J, Hulín I (1995). Pathophysiology: Principles of Disease. Computing Centre, Slovak Academy of Sciences: Academic Electronic Press.
- Wira CR, Crane-Godreau M, Grant K (2004). Ogra PL, Mestecky J, Lamm ME, Strober W, McGhee JR, Bienenstock J (eds.). Mucosal Immunology. San Francisco: Elsevier. ISBN 0-12-491543-4.
추가열람
| 라이브러리 리소스정보 면역계 |
- Dettmer P (2021). Immune: A Journey into the Mysterious System that Keeps You Alive. Philip Laibacher (illustrations). New York: Random House. ISBN 9780593241318. OCLC 1263845194. Archived from the original on 24 November 2021. Retrieved 4 January 2022. (책의 출처는 온라인으로만 나와 있습니다.)면역체계에 대한 대중적인 과학적 설명.
외부 링크
- 미생물학 및 면역학 온라인 교재 – South Carolina University of Medicine (학사 수준)


