데펜신
Defensin| 데펜신 | |
|---|---|
 | |
| 식별자 | |
| 기호. | 데펜신 |
| 빠맘 클랜 | CL0075 |
| OPM 슈퍼 패밀리 | 54 |
| OPM단백질 | 6cs9 |
데펜신은 척추동물과 무척추동물의[2] 동물,[3][4] 식물,[5] 곰팡이를 포함한[1] 세포에 걸쳐 있는 작은 시스테인이 풍부한 양이온 단백질입니다.그것들은 숙주 방어 펩타이드이며, 구성원은 직접 항균 활성, 면역 신호 전달 활성 또는 둘 다 나타낸다.그들은 박테리아, 곰팡이, 그리고 많은 포장과 비포장 바이러스에 대해 다양하게 활동합니다.그것들은 전형적으로 길이가 18-45개의 아미노산이고, 보존성이 높은 3-4개의 디황화 결합을 가지고 있다.
동물에서 그것들은 선천적인 면역 체계와 상피 세포에 의해 생성되는 반면, 식물과 곰팡이에서는 다양한 조직에 의해 생성된다.유기체는 보통 많은 다른 디펜신을 생산하는데, 그 중 일부는 세포 내부에 저장되고, 다른 것들은 세포외 매체로 분비된다.미생물을 직접 죽이는 사람들에게, 그들의 작용 메커니즘은 미생물 세포막의 파괴에서 신진대사 파괴까지 다양합니다.
품종
'defensin'이라는 이름은 1980년대 중반에 만들어졌지만, 단백질은 '카티온성 항균 단백질', '중성 펩타이드',[6] '감마티오닌' 등으로 다양하게 불렸다.
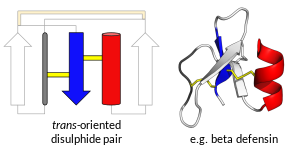
'디펜신'이라고 불리는 단백질들이 모두 진화적으로 서로 [7]관련이 있는 것은 아니다.대신 두 개의 넓은 슈퍼 패밀리로 나뉘는데, 각각은 여러 개의 [7][8]패밀리를 포함합니다.슈퍼과 중 하나인 트랜스-디펜신은 인간과 다른[9][10] 척추동물,[11][12] 그리고 일부 무척추동물에서 발견되는 디펜신을 포함하고 있다.다른 슈퍼 패밀리인 시스-데펜신은 무척추동물, 식물, [13][14][15]곰팡이에서 발견되는 디펜신을 포함하고 있다.슈퍼패밀리와 패밀리는 전체적인 3차 구조로 결정되며 각 패밀리는 보통 보존된 이황화 결합 패턴을 [9][16]가지고 있다.모든 디펜신은 작고 컴팩트하게 접힌 구조를 형성하며, 일반적으로 다중 이황화 결합으로 인해 매우 안정적인 높은 양의 전하를 가집니다.모든 가족에서, 디펜신 생산을 담당하는 기초 유전자는 매우 다형성이다.
트랜스 디펜신
척추동물 디펜신은 주로 α-디펜신과 β-디펜신이다.일부 영장류는 훨씬 더 작은 γ-defensins를 추가로 가지고 있다.일반적으로 α-디펜신 및 β-디펜신 모두 2엑손 유전자에 의해 부호화되며, 여기서 제1엑손은 소수성 리더 배열(번역 후 제거됨) 및 시스테인이 풍부한 배열(성숙한 펩타이드)을 부호화한다.시스테인에 의해 형성된 디술피드 결합은 포유류의 선천적 면역과 관련된 활동에 필수적인 것으로 제안되었지만 항균 활동에 [17][18]반드시 필요한 것은 아니다.세타 디펜신은 단일 베타 헤어핀 구조를 형성하며, 따라서 다른 그룹을 나타내기도 합니다.사람에서는 알파와 베타 디펜신만 [19]발현된다.
| 유형 | 유전자 기호 | 유전자명 | 단백질명 | 묘사 |
|---|---|---|---|---|
| α-디펜신 | DEFA1 | 데펜신, 알파 1 | 호중구 디펜신 1 | 주로 호중구뿐만 아니라 NK 세포와 특정 T림프구 서브셋에서 발현된다.DEFA5와 DEFA6는 소장의 파네스 세포에서 발현되며, 장내강에서 미생물 균형을 조절하고 유지할 수 있습니다. |
| DEFA1B | 데펜신, 알파 1B | 데펜신, 알파 1 | ||
| DEFA3 | 데펜신, 알파3, 호중구 특이적 | 호중구 디펜신 3 | ||
| DEFA4 | 데펜신, 알파4, 코르티코스타틴 | 호중구 디펜신 4 | ||
| 데파5 | 데펜신, 알파 5, 파네스 세포 특이적 | 디펜신-5 | ||
| DEFA6 | 데펜신, 알파 6, 파네스 세포 특이적 | 디펜신-6 | ||
| β-디펜신 | DEFB1 | Defensin, 베타 1 | 베타 디펜신 1 | 백혈구와 다양한 종류의 상피세포에 의해 분비되는 가장 널리 분포되어 있다.예를 들어, 그것들은 혀, 피부, 각막, 침샘, 신장, 식도, 그리고 호흡기에서 발견될 수 있습니다.낭포성 섬유증의 병리 중 일부는 높은 염분 함량으로 인해 폐와 기관의 상피 표면에서 β-데펜신 활성의 억제에서 발생한다는 것이 제안되었다(그러나 도전). |
| DEFB2 | Defensin, 베타 2 | 베타-디펜신 2 | ||
| DEFB3 | Defensin, 베타 3 | 베타디펜신3 | ||
| DEFB103A | 데펜신, 베타 103B | 베타-디펜신 103 | ||
| ... | ... | ... | ||
| DEFB106A | 데펜신, 베타 106A | 베타-디펜신 106A | ||
| DEFB106B | 데펜신, 베타 106B | 베타-디펜신 106B | ||
| DEFB107B | 데펜신, 베타 107A | 베타-디펜신 107 | ||
| DEFB110 | 데펜신, 베타 110 | 베타-디펜신 110 | ||
| ... | ... | ... | ||
| DEFB136 | 데펜신, 베타 136 | 베타-디펜신 136 | ||
| γ-defensins | DEFT1P | 디펜신, 세타1 유사유전자 | 인간으로 표현되지 않다 | 희귀하고 지금까지 붉은털원숭이와[20] 올리브개코원숭이 파피오 아누비스의 백혈구에서만 발견되었으며, 이를 코드하는 유전자는 인간과 다른 [21][22]영장류에서 손상되었다. |
비록 가장 잘 연구된 디펜신은 척추동물에서 나온 것이지만, 트랜스 디펜신 과는 ''라고 불립니다.대형 디펜신'은 연체동물, 절지동물, [7][8]랜슬릿에서 발견된다.
시스 디펜신
절지동물 디펜신은 무척추동물(특히 [23]곤충의 디펜신)에서 가장 잘 특징지어지는 디펜신이다.이 단백질 슈퍼패밀리로부터 디펜신을 생산하는 것으로 알려진 다른 무척추동물로는 연체동물, 환형동물 및 크니다리아가 [24]있다.
식물성 디펜신은 1990년에 발견되었고 항진균과 항균의 [25]예와 함께 항균 작용을 하는 대부분의 식물 조직에서 발견되었다.그것들은 모든 주요 혈관 식물 그룹에서 확인되었지만, 양치식물, 이끼 또는 [25]조류에서는 확인되지 않았다.
곰팡이 방어제는 2005년에 처음 [26]확인되었다.연구된 예들은 주로 항균 활동을 하고 있으며, Zygomycota와 Glomeromycota의 보다 기초적인 그룹뿐만 아니라 곰팡이의 주요 부분(Ascomycota와 Basidiomycota)[27]에서 발견되었다.
박테리아 디펜신 또한 확인되었지만, 단연코 가장 연구가 덜 되어있다.그들은 오직 4개의 시스테인을 가진 변종들을 포함하고 있는 반면, 진핵생물의 디펜신들은 거의 모두 6개나 [28]8개를 가지고 있다.
관련 데펜신유사단백질
숙주 방어에 관여하는 디펜신 외에도 다른 활성을 가지도록 진화한 다수의 관련 디펜신-라이크 펩타이드(DLP)가 있다.
독소
동물의 [29]정맥에 사용되는 독소 단백질로 여러 번 진화한 것으로 보인다; 그들은 이온 채널에 직접 결합하는 것부터 신경 신호를 방해하는 것까지 그들의 항균 친척에 대해 완전히 다른 메커니즘을 통해 작용한다.예를 들면, 뱀 [30]독의 크로타민 독소, 많은 전갈 [31]독소, 말미잘 [10]독소, 그리고 오리너구리 [29]독의 독소 중 하나를 포함합니다.실제로 곤충 디펜신은 이온 [32]채널과의 상호작용을 입체적으로 방해하는 작은 루프를 제거함으로써 실험적으로 독소로 전환되었다.
시그널링
척추동물에서 일부 α 및 β-디펜신은 선천 면역계와 적응 면역계 [33][34]사이의 신호 전달에 관여한다.플랜트에서는 자가 수분 발생 여부를 검출하고 자가 비호환성을 유도하여 근친 [35]교배를 방지하는 시그널링에 전문화된 DLP 패밀리가 관여하고 있습니다.
효소억제제
일부 항균성 방어제는 효소 억제 활성을 가지며, 일부 DLP는 주로 효소 억제제로 기능하여 해열제(동물이 [36][37][38]그것들을 먹는 것을 막는다)로 작용한다.
기능.
미성숙한 유대류 동물에서, 그들의 면역 체계는 태어날 때 충분히 발달하지 않았기 때문에,[citation needed] 디펜신은 병원균에 대한 방어에 중요한 역할을 한다.그것들은 어미의 젖과 문제의 어린 유대류 동물에 의해 생산된다.
인간의 모유에서 디펜신은 신생아 [39]면역에 중추적인 역할을 한다.
인간 게놈에는 세타 디펜신 유전자가 들어있지만 조기 정지 코돈이 있어 발현을 방해한다.인공 인간 세타 디펜신인 [40]레트로사이클린은 유사 유전자를 '고정'하여 만들어졌으며, HIV와 단순 헤르페스 바이러스 및 인플루엔자 A를 포함한 다른 바이러스에 효과가[41] 있는 것으로 나타났다.그들은 주로 이러한 바이러스가 그들의 표적 세포에 들어가는 것을 막음으로써 작용한다.
탄저균(바실러스 안트라시스)에 의해 생성되는 엑소톡신에 대한 알파-디펜신의 영향도 흥미롭다.천 김 외는 MAPKK를 목표로 하는 금속단백질치사인자(LF) 단백질을 생성하는 탄저균이 인간 호중구 단백질-1(HNP-1)에 얼마나 취약한지를 보여주었다.이 그룹은 HNP-1이 [42]LF의 가역적 비경쟁적 억제제 역할을 하는 것을 보여주었다.
이들은 일반적으로 점막 건강에 기여하는 것으로 간주되어 왔다. 그러나 이러한 펩타이드는 인간의 모유에 존재하는 생물 활성 화합물에 의해 상향 조절될 수 있는 생물학적 요인으로 간주될 수 있다.이러한 의미에서 우유로부터 삼엽에 의한 hBD2 및 hBD4로서의 항균 펩타이드의 장내 생산은 신생아의 식민지화에 중요한 역할을 할 수 있으며,[39][43] 이에 따라 신생아가 접촉할 수 있는 병원체에 대한 면역 반응을 향상시킬 수 있다.
병리학
알파 디펜신은 대장암을 [44]포함한 몇몇 암에서 증가한다.
피부에 있는 디펜신의 불균형은 [45]여드름의 원인이 될 수 있다.
회장 디펜신의 감소는 크론병에 [46][47]걸리기 쉽다.
한 소규모 연구에서, 정신분열증 환자의 T 세포 용해액에서 알파 디펜신 수치가 유의하게 증가하였다. 불협화음 쌍둥이 쌍에서, 영향을 받지 않은 쌍둥이도 그들의 아픈 형제자매만큼 높지는 않았지만 증가하였다.저자들은 알파-디펜신 수치가 정신분열증 [48]위험에 대한 유용한 지표가 될 수 있다고 제안했다.
디펜신은 건선과[49] 같은 염증 조건과 상처 치유 중에 인간의 피부에서 발견됩니다.
적용들
데펜신스
현재 항생제 내성이 널리 퍼지면서 새로운 항균제의 개발과 개발이 필요하다.이러한 관점에서 디펜신(및 일반적으로 항균성 펩타이드)은 매우 흥미롭다.디펜신은 광범위한 [50]병원균에 대해 항균 활성을 보이는 것으로 나타났다.게다가, 디펜신은 기존의 항생제의 [50]효과를 높일 수 있다.
디펜신-미메트릭스
숙주 방어 펩타이드(HDP) 미메틱스라고도 불리는 [51]데펜신 미메틱스는 구조와 활동에서 데펜신을 모방하는 완전히 합성된, 비펩타이드, 작은 분자 구조입니다.브릴라시딘과 같은 유사한 분자는 항생제,[52] 구강 점막염의 [53][54]항염증제, 그리고 특히 칸디다증 [55][56][57]등의 항진균제로 개발되고 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ Hazlett L, Wu M (January 2011). "Defensins in innate immunity". Cell and Tissue Research. 343 (1): 175–88. doi:10.1007/s00441-010-1022-4. PMID 20730446. S2CID 2234617.
- ^ Tassanakajon A, Somboonwiwat K, Amparyup P (February 2015). "Sequence diversity and evolution of antimicrobial peptides in invertebrates". Developmental and Comparative Immunology. Specific immunity in invertebrates. 48 (2): 324–41. doi:10.1016/j.dci.2014.05.020. PMID 24950415.
- ^ Thomma BP, Cammue BP, Thevissen K (December 2002). "Plant defensins". Planta. 216 (2): 193–202. doi:10.1007/s00425-002-0902-6. PMID 12447532. S2CID 19356421.
- ^ Sathoff AE, Samac DA (May 2019). "Antibacterial Activity of Plant Defensins". Molecular Plant-Microbe Interactions. 32 (5): 507–514. doi:10.1094/mpmi-08-18-0229-cr. PMID 30501455.
- ^ Wu J, Gao B, Zhu S (August 2014). "The fungal defensin family enlarged". Pharmaceuticals. 7 (8): 866–80. doi:10.3390/ph7080866. PMC 4165938. PMID 25230677.
- ^ Lehrer RI (September 2004). "Primate defensins". Nature Reviews. Microbiology. 2 (9): 727–38. doi:10.1038/nrmicro976. PMID 15372083. S2CID 8774156.
- ^ a b c Shafee TM, Lay FT, Hulett MD, Anderson MA (September 2016). "The Defensins Consist of Two Independent, Convergent Protein Superfamilies". Molecular Biology and Evolution. 33 (9): 2345–56. doi:10.1093/molbev/msw106. PMID 27297472.
- ^ a b Shafee TM, Lay FT, Phan TK, Anderson MA, Hulett MD (February 2017). "Convergent evolution of defensin sequence, structure and function". Cellular and Molecular Life Sciences. 74 (4): 663–682. doi:10.1007/s00018-016-2344-5. PMID 27557668. S2CID 24741736.
- ^ a b Hollox EJ, Abujaber R (2017). "Evolution and Diversity of Defensins in Vertebrates". In Pontarotti P (ed.). Evolutionary Biology: Self/Nonself Evolution, Species and Complex Traits Evolution, Methods and Concepts. Springer International Publishing. pp. 27–50. doi:10.1007/978-3-319-61569-1_2. ISBN 978-3-319-61569-1.
- ^ a b Mitchell ML, Shafee T, Papenfuss AT, Norton RS (July 2019). "Evolution of cnidarian trans-defensins: Sequence, structure and exploration of chemical space". Proteins. 87 (7): 551–560. doi:10.1002/prot.25679. PMID 30811678. S2CID 73469576.
- ^ Zhu S, Gao B (2013). "Evolutionary origin of β-defensins". Developmental and Comparative Immunology. 39 (1–2): 79–84. doi:10.1016/j.dci.2012.02.011. PMID 22369779.
- ^ Montero-Alejo V, Corzo G, Porro-Suardíaz J, Pardo-Ruiz Z, Perera E, Rodríguez-Viera L, et al. (February 2017). "Panusin represents a new family of β-defensin-like peptides in invertebrates". Developmental and Comparative Immunology. 67: 310–321. doi:10.1016/j.dci.2016.09.002. PMID 27616720. S2CID 19734223.
- ^ Dias RD, Franco OL (October 2015). "Cysteine-stabilized αβ defensins: From a common fold to antibacterial activity". Peptides. Festschrift to highlight the career of Abba J. Kastin as a founding editor, researcher, and educator in the peptide field. 72: 64–72. doi:10.1016/j.peptides.2015.04.017. PMID 25929172. S2CID 17846143.
- ^ Shafee T, Anderson MA (March 2019). "A quantitative map of protein sequence space for the cis-defensin superfamily". Bioinformatics. 35 (5): 743–752. doi:10.1093/bioinformatics/bty697. PMID 30102339. S2CID 51968286.
- ^ Zhu S (February 2008). "Discovery of six families of fungal defensin-like peptides provides insights into origin and evolution of the CSalphabeta defensins". Molecular Immunology. 45 (3): 828–38. doi:10.1016/j.molimm.2007.06.354. PMID 17675235.
- ^ Wang YP, Lai R (February 2010). "[Insect antimicrobial peptides: structures, properties and gene regulation]". Dong Wu Xue Yan Jiu = Zoological Research. 31 (1): 27–34. doi:10.3724/sp.j.1141.2010.01027. PMID 20446450.
- ^ Varkey J, Singh S, Nagaraj R (November 2006). "Antibacterial activity of linear peptides spanning the carboxy-terminal beta-sheet domain of arthropod defensins". Peptides. 27 (11): 2614–23. doi:10.1016/j.peptides.2006.06.010. PMID 16914230. S2CID 21104756.
- ^ Varkey J, Nagaraj R (November 2005). "Antibacterial activity of human neutrophil defensin HNP-1 analogs without cysteines". Antimicrobial Agents and Chemotherapy. 49 (11): 4561–6. doi:10.1128/AAC.49.11.4561-4566.2005. PMC 1280114. PMID 16251296.
- ^ Dhople V, Krukemeyer A, Ramamoorthy A (September 2006). "The human beta-defensin-3, an antibacterial peptide with multiple biological functions". Biochimica et Biophysica Acta (BBA) - Biomembranes. 1758 (9): 1499–512. doi:10.1016/j.bbamem.2006.07.007. PMID 16978580.
- ^ Tran D, Tran P, Roberts K, Osapay G, Schaal J, Ouellette A, Selsted ME (March 2008). "Microbicidal properties and cytocidal selectivity of rhesus macaque theta defensins". Antimicrobial Agents and Chemotherapy. 52 (3): 944–53. doi:10.1128/AAC.01090-07. PMC 2258523. PMID 18160518.
- ^ Garcia AE, Selsted M (March 2008). "Olive baboon θ-defensins". The FASEB Journal. 22 (1 Suppl): 673.11. doi:10.1096/fasebj.22.1_supplement.673.11.
- ^ Garcia AE, Osapay G, Tran PA, Yuan J, Selsted ME (December 2008). "Isolation, synthesis, and antimicrobial activities of naturally occurring theta-defensin isoforms from baboon leukocytes". Infection and Immunity. 76 (12): 5883–91. doi:10.1128/IAI.01100-08. PMC 2583559. PMID 18852242.
- ^ Koehbach J (2017). "Structure-Activity Relationships of Insect Defensins". Frontiers in Chemistry. 5: 45. Bibcode:2017FrCh....5...45K. doi:10.3389/fchem.2017.00045. PMC 5506212. PMID 28748179.
- ^ Greco S, Gerdol M, Edomi P, Pallavicini A (January 2020). "Molecular Diversity of Mytilin-Like Defense Peptides in Mytilidae (Mollusca, Bivalvia)". Antibiotics. 9 (1): 37. doi:10.3390/antibiotics9010037. PMC 7168163. PMID 31963793.
- ^ a b Parisi K, Shafee TM, Quimbar P, van der Weerden NL, Bleackley MR, Anderson MA (April 2019). "The evolution, function and mechanisms of action for plant defensins". Seminars in Cell & Developmental Biology. 88: 107–118. doi:10.1016/j.semcdb.2018.02.004. PMID 29432955. S2CID 3543741.
- ^ Mygind PH, Fischer RL, Schnorr KM, Hansen MT, Sönksen CP, Ludvigsen S, et al. (October 2005). "Plectasin is a peptide antibiotic with therapeutic potential from a saprophytic fungus". Nature. 437 (7061): 975–80. Bibcode:2005Natur.437..975M. doi:10.1038/nature04051. PMID 16222292. S2CID 4423851.
- ^ Wu J, Gao B, Zhu S (August 2014). "The fungal defensin family enlarged". Pharmaceuticals. 7 (8): 866–80. doi:10.3390/ph7080866. PMC 4165938. PMID 25230677.
- ^ Dash TS, Shafee T, Harvey PJ, Zhang C, Peigneur S, Deuis JR, et al. (February 2019). "A Centipede Toxin Family Defines an Ancient Class of CSαβ Defensins". Structure. 27 (2): 315–326.e7. doi:10.1016/j.str.2018.10.022. PMID 30554841.
- ^ a b Whittington CM, Papenfuss AT, Bansal P, Torres AM, Wong ES, Deakin JE, et al. (June 2008). "Defensins and the convergent evolution of platypus and reptile venom genes". Genome Research. 18 (6): 986–94. doi:10.1101/gr.7149808. PMC 2413166. PMID 18463304.
- ^ Batista da Cunha D, Pupo Silvestrini AV, Gomes da Silva AC, Maria de Paula Estevam D, Pollettini FL, de Oliveira Navarro J, et al. (May 2018). "Mechanistic insights into functional characteristics of native crotamine". Toxicon. 146: 1–12. doi:10.1016/j.toxicon.2018.03.007. hdl:11449/170828. PMID 29574214. S2CID 205440053.
- ^ Possani LD, Becerril B, Delepierre M, Tytgat J (September 1999). "Scorpion toxins specific for Na+-channels". European Journal of Biochemistry. 264 (2): 287–300. doi:10.1046/j.1432-1327.1999.00625.x. PMID 10491073.
- ^ Zhu S, Peigneur S, Gao B, Umetsu Y, Ohki S, Tytgat J (March 2014). "Experimental conversion of a defensin into a neurotoxin: implications for origin of toxic function". Molecular Biology and Evolution. 31 (3): 546–59. doi:10.1093/molbev/msu038. PMID 24425781.
- ^ Petrov V, Funderburg N, Weinberg A, Sieg S (December 2013). "Human β defensin-3 induces chemokines from monocytes and macrophages: diminished activity in cells from HIV-infected persons". Immunology. 140 (4): 413–20. doi:10.1111/imm.12148. PMC 3839645. PMID 23829433.
- ^ Semple F, Dorin JR (2012). "β-Defensins: multifunctional modulators of infection, inflammation and more?". Journal of Innate Immunity. 4 (4): 337–48. doi:10.1159/000336619. PMC 6784047. PMID 22441423.
- ^ Fobis-Loisy I, Ivanov R, Gaude T (2012). "The S-LOCUS CYSTEINE-RICH PROTEIN (SCR): A Small Peptide with A High Impact on the Evolution of Flowering Plants". Plant Signaling Peptides. Signaling and Communication in Plants. Vol. 16. Springer Berlin Heidelberg. pp. 77–92. doi:10.1007/978-3-642-27603-3_5. ISBN 978-3-642-27602-6.
- ^ Williams LK, Brayer GD (2015-11-25). "Porcine pancreatic alpha-amylase in complex with helianthamide, a novel proteinaceous inhibitor". doi:10.2210/pdb4x0n/pdb.
- ^ Zhao Q, Chae YK, Markley JL (2003-01-07). "Minimized NMR structure of ATT, an Arabidopsis trypsin/chymotrypsin inhibitor". doi:10.2210/pdb1jxc/pdb.
- ^ Pelegrini PB, Lay FT, Murad AM, Anderson MA, Franco OL (November 2008). "Novel insights on the mechanism of action of alpha-amylase inhibitors from the plant defensin family". Proteins. 73 (3): 719–29. doi:10.1002/prot.22086. PMID 18498107. S2CID 28378146.
- ^ a b Barrera GJ, Sanchez G, Gonzalez JE (November 2012). "Trefoil factor 3 isolated from human breast milk downregulates cytokines (IL8 and IL6) and promotes human beta defensin (hBD2 and hBD4) expression in intestinal epithelial cells HT-29". Bosnian Journal of Basic Medical Sciences. 12 (4): 256–64. doi:10.17305/bjbms.2012.2448. PMC 4362502. PMID 23198942.
- ^ 미국 국립 의학 도서관 의학 과목 표제(MeSH)의 레트로사이클린
- ^ Münk C, Wei G, Yang OO, Waring AJ, Wang W, Hong T, et al. (October 2003). "The theta-defensin, retrocyclin, inhibits HIV-1 entry". AIDS Research and Human Retroviruses. 19 (10): 875–81. doi:10.1089/088922203322493049. PMID 14585219.
- ^ Kim C, Gajendran N, Mittrücker HW, Weiwad M, Song YH, Hurwitz R, et al. (March 2005). "Human alpha-defensins neutralize anthrax lethal toxin and protect against its fatal consequences". Proceedings of the National Academy of Sciences of the United States of America. 102 (13): 4830–5. Bibcode:2005PNAS..102.4830K. doi:10.1073/pnas.0500508102. PMC 555714. PMID 15772169.
- ^ Barrera GJ, Tortolero GS (2016). "Trefoil factor 3 (TFF3) from human breast milk activates PAR-2 receptors, of the intestinal epithelial cells HT-29, regulating cytokines and defensins". Bratislavske Lekarske Listy. 117 (6): 332–9. doi:10.4149/bll_2016_066. PMID 27546365.
- ^ Albrethsen J, Bøgebo R, Gammeltoft S, Olsen J, Winther B, Raskov H (January 2005). "Upregulated expression of human neutrophil peptides 1, 2 and 3 (HNP 1-3) in colon cancer serum and tumours: a biomarker study". BMC Cancer. 5: 8. doi:10.1186/1471-2407-5-8. PMC 548152. PMID 15656915.
- ^ Philpott MP (November 2003). "Defensins and acne". Molecular Immunology. 40 (7): 457–62. doi:10.1016/S0161-5890(03)00154-8. PMID 14568392.
- ^ "Researchers discover a possible cause of chronic inflammations of Crohn Disease". Genomics & Genetics Weekly: 72. August 11, 2006.
- ^ Wehkamp J, Salzman NH, Porter E, Nuding S, Weichenthal M, Petras RE, et al. (December 2005). "Reduced Paneth cell alpha-defensins in ileal Crohn's disease". Proceedings of the National Academy of Sciences of the United States of America. 102 (50): 18129–34. Bibcode:2005PNAS..10218129W. doi:10.1073/pnas.0505256102. PMC 1306791. PMID 16330776.
- ^ Craddock RM, Huang JT, Jackson E, Harris N, Torrey EF, Herberth M, Bahn S (July 2008). "Increased alpha-defensins as a blood marker for schizophrenia susceptibility". Molecular & Cellular Proteomics. 7 (7): 1204–13. doi:10.1074/mcp.M700459-MCP200. PMID 18349140. S2CID 35381828.
- ^ Harder J, Bartels J, Christophers E, Schroder JM (February 2001). "Isolation and characterization of human beta -defensin-3, a novel human inducible peptide antibiotic". The Journal of Biological Chemistry. 276 (8): 5707–13. doi:10.1074/jbc.M008557200. PMID 11085990. S2CID 9516726.
- ^ a b Bolatchiev A (2020-11-25). "Antibacterial activity of human defensins against Staphylococcus aureus and Escherichia coli". PeerJ. 8: e10455. doi:10.7717/peerj.10455. PMC 7698690. PMID 33304659.
- ^ "Press release: PolyMedix". 2008-05-09. 업무용 회선
- ^ "PMX-30063 The First And Only Defensin Mimetic Systemic Antibiotic Drug In Human Clinical Trials". 2008.
- ^ 임상시험번호 NCT02324335 - "두경부암(Brilacidin) 환자의 브릴라시딘 경구 린스의 안전성 및 효과 평가를 위한 2단계 연구" (ClinicalTrials.gov )
- ^ "Brilacidin-OM page". Cellceutix. Archived from the original on 2015-02-07. Retrieved 2015-03-02.
- ^ "Candidiasis". Cellceutix. Archived from the original on 2015-02-07. Retrieved 2015-03-02.
- ^ Diamond G, Scott R. "A Novel Therapeutic For Invasive Candiasis". Grantome. Fox Chase Chemical Diversity Center.
- ^ Ryan LK, Freeman KB, Masso-Silva JA, Falkovsky K, Aloyouny A, Markowitz K, et al. (July 2014). "Activity of potent and selective host defense peptide mimetics in mouse models of oral candidiasis". Antimicrobial Agents and Chemotherapy. 58 (7): 3820–7. doi:10.1128/AAC.02649-13. PMC 4068575. PMID 24752272.
외부 링크
- Defensins 데이터베이스(싱가포르)
- Western Kentucky University 선천적(비특이적) 면역
- 막족/슈퍼패밀리-56에서 단백질의 UMich 배향 - 척추동물 디펜신 및 관련 말미잘 나트륨 채널 독소
- 막과/슈퍼패밀리-61에서 단백질의 UMich 배향 - 곤충, 식물 및 전갈 독소로부터의 방어
- 미국 국립 의학 도서관 의학 주제 제목(MeSH)의 Defensins