항원 변이
Antigenic variation항원변형 또는 항원변형은 원생동물, 세균, 바이러스 등의 감염물질이 표면의 단백질이나 탄수화물을 변화시켜 숙주 면역반응을 회피하는 메커니즘을 말하며 항원탈출 메커니즘 중 하나이다.위상 변동과 관련이 있습니다.항원 변이는 병원체가 현재 숙주의 면역 반응을 피할 수 있게 할 뿐만 아니라 이전에 감염된 숙주의 재감염도 가능하게 한다.재감염에 대한 면역은 병원체가 운반하는 항원의 인식에 기초하며, 이 항원은 후천적인 면역 반응에 의해 "기억"된다.만약 병원체의 지배적인 항원이 바뀔 수 있다면, 그 병원체는 숙주의 후천적인 면역 체계를 피할 수 있다.항원성 변이는 단백질과 탄수화물을 포함한 다양한 표면 분자를 변화시킴으로써 발생할 수 있다.항원 변이는 유전자 변환,[1] 부위 특이적 DNA 반전,[2] 과변성 [3]또는 배열 [4]카세트의 재조합에서 발생할 수 있습니다.그 결과 병원균의 클론 집단조차도 이종 표현형을 [5]발현한다.항원이나 상변화를 보이는 것으로 알려진 단백질의 대부분은 [6]독성과 관련이 있다.
세균내
박테리아의 항원성 변이는 Neisseria(Neisseria meningitidis와 Neisseria gonorhoae, 임균)의 종, Streptoccus와 Mycoplasma에 의해 가장 잘 나타난다.Neisseria 종은 그들의 pili (박테리아 접착에 중요한 역할을 하고, 활발한 숙주 면역 반응을 자극하는 pilin이라고 불리는 소단위들로 이루어진 단백질 중합체)와 Streptocci는 그들의 M-단백질을 다양화합니다.
라임병의 원인균인 Borrelia burgdorferi는 표면지단백질 VlsE가 재조합되어 항원다양성을 얻을 수 있다.이 박테리아는 15개의 사일런트 vls 카세트와 1개의 vlsE 기능 복사본을 포함하는 플라스미드를 운반합니다.사일런트 카세트의 세그먼트는 vlsE 유전자와 재결합하여 표면 리포단백질 [7]항원의 변형을 생성합니다.
원생동물에서
항원성 변이는 많은 다른 원생동물 기생충에 의해 사용된다.Trypanosoma brucei와 Plasmodium falciparum은 가장 잘 연구된 예들 중 하나이다.
트리파노소마 브루시
트리파노소마 브루시, 수면병을 일으키는 유기체,
감염된 포유류의 혈류에서 세포외로 복제되며 보체 시스템, 선천적 및 적응적 면역 시스템을 포함한 수많은 숙주 방어 메커니즘의 영향을 받습니다.스스로를 보호하기 위해, 기생충은 변종 표면 당단백질(VSG)의 밀도가 높은 균질한 외피(~10^7 분자)로 자신을 장식합니다.
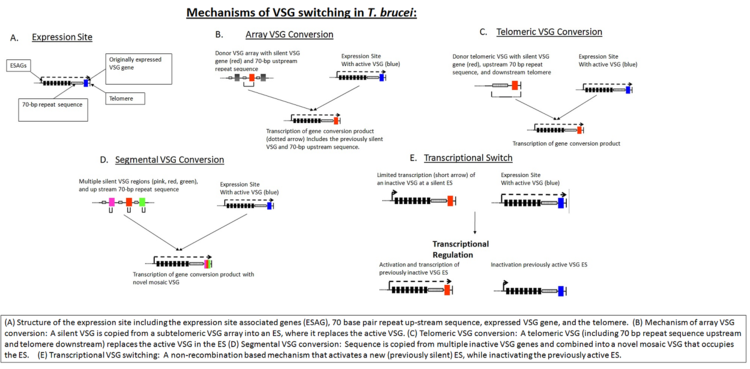
침입 초기에 VSG 코트는 면역 검출로부터 기생충을 보호하기에 충분하다.숙주는 결국 VSG를 외부 항원으로 식별하고 미생물에 대한 공격을 시작합니다.하지만, 이 기생충의 게놈은 다른 종류의 VSG 단백질을 코드하는 1,000개 이상의 유전자를 가지고 있으며, 이는 큰 염색체의 소구체 부분이나 중간 염색체에 위치하고 있다.이러한 VSG 유전자는 유전자 변환에 의해 계층적인 순서로 활성화된다: 텔로머 VSG가 먼저 활성화되고, 그 다음에 어레이 VSG가 활성화되고, 마지막으로 의사 유전자 [8]VSG가 활성화된다.동시에 표현되는 VSG는 1개뿐입니다.각각의 새로운 유전자는 차례로 VSG 발현 부위(ES)[9]로 전환된다.이 과정은 부분적으로 RAD51과 T. brucei BRCA2 유전자의 상호작용에 의해 매개되는 DNA의 상동 재조합에 의존한다(그러나 BRCA2 변이체들이 여전히 VSG 전환을 [9]보이기 때문에 이것은 유일한 가능한 메커니즘은 아니다).
T. brucei는 복수의 잠재적 발현 부위가 있기 때문에 상동 재조합과 더불어 전사 조절도 항원 전환에서 중요하다.새로운 VSG는 이전에 사일런트 ES의 전사 활성화 또는 VSG 시퀀스를 액티브 ES로 재결합하여 선택할 수 있습니다(그림 "T. brucei에서의 VSG 전환 메커니즘"[8] 참조).VSG 전환을 초래하는 생물학적 트리거는 완전히 알려져 있지 않지만, 수학적 모델링에 따르면 서로 다른 VSG 변이체의 질서 있는 출현은 기생충에서 파생된 최소 두 가지 주요 요소, 즉 기생충 VSG의 차등 활성화 속도와 밀도에 의존하는 기생충 [10][11]분화에 의해 제어된다.
플라즈모듐팔시파룸
인간 말라리아의 주요 원인 물질인 플라스모디움 팔시파룸은 인간과 모기 모두에게 발생하는 매우 복잡한 수명 주기를 가지고 있다.인간 숙주에 있는 동안, 기생충은 간세포와 적혈구 안에서 대부분의 수명 주기를 보낸다. (세포 밖으로 남아 있는 T. brucei와 대조적으로).주로 세포 내 틈새로 인해 기생충 단백질을 나타내는 기생 숙주 세포는 숙주 면역 방어에 의한 파괴를 방지하기 위해 수정되어야 한다.플라스모듐의 경우, 이는 이중목적 플라스모듐 팔시파룸 적혈구막 단백질 1(PfEMP1)을 통해 달성된다.PfEMp1은 다양한 유전자 패밀리로 알려진 유전자 패밀리에 의해 암호화된다(전체 약 60개의 유전자).유전자 패밀리의 다양성은 텔로미어 궤적에서의 유전자 정보 교환 및 감수성 재조합을 포함한 많은 다른 메커니즘을 통해 더욱 증가한다.PfEMp1 단백질은 내피와의 유착을 통해 비장 파괴로부터 감염된 적혈구를 격리하는 역할을 한다.또한 PfEMp1 [12]단백질의 코드화에 사용되는 바알레알레알레알레알레알레알레알레알레알레알레알레알레알레알레알레알레알레알레알레알레알레알레알레알티브루스처럼, 각각의 기생충은 하나의 동일한 단백질의 여러 복사본을 표현합니다.그러나 T. brucei와 달리 P. falciparum에서 var switching이 발생하는 메커니즘은 순수하게 전사된 [13]것으로 생각된다.P. falciparum [14]기생충의 적혈구 침입 직후 var 전환이 일어나는 것으로 나타났습니다.형광성 현장 교배 분석 결과 var alle의 활성화는 유전 물질의 뚜렷한 "전사적으로 허용되는"[15] 영역으로의 위치 변경과 관련이 있는 것으로 나타났습니다.
바이러스 내
다른 바이러스 패밀리는 그들의 게놈을 바꾸고 면역체계가 인식하지 못하도록 속이는 다른 수준의 능력을 가지고 있다.어떤 바이러스는 파라믹소바이러스와 같은 비교적 변하지 않는 게놈을 가지고 있는 반면, 인플루엔자와 같은 다른 바이러스들은 질병에 대한 오래 지속되는 백신을 만드는 우리의 능력을 억제하는 빠르게 변화하는 게놈을 가지고 있다.일반적으로 바이러스는 인간이나 박테리아 세포보다 게놈의 돌연변이 속도가 훨씬 빠르다.일반적으로 게놈이 짧은 바이러스는 [16]복제 속도가 빠르기 때문에 긴 게놈보다 돌연변이 속도가 빠르다.RNA 중합효소는 번역 오류를 확인하는 메커니즘이 부족하기 때문에 RNA 게놈을 가진 바이러스는 항상 DNA 게놈을 가진 바이러스보다 항원 변화율이 빠르다고 생각되었지만, Duffy 등의 최근 연구는 일부 DNA 바이러스가 그들의 RNA 대조군과 같은 높은 항원 변화율을 가지고 있음을 보여준다.ts.[16] 바이러스 내 항원 변이는 항원 드리프트, 시프트, 리프트, 리프트, 시프터, 선물이라고 하는 6개의 카테고리로 분류할 수 있다.
항원성 표류: 바이러스 게놈의 불완전한 복제를 통해 발생하는 점 돌연변이.모든 바이러스는 시간이 지남에 따라 유전적 표류를 보이지만, 그들이 그들의 적합성에 부정적인 영향을 미치지 않고 표류할 수 있는 양은 가족마다 다르다.
항원 이동: 단일 숙주 세포가 두 개의 고유한 바이러스 입자와 함께 감염되었을 때 발생하는 바이러스 게놈의 재조합.바이러스가 복제됨에 따라, 그들은 재조합을 하고 새로운 싹이 트는 바이러스로 포장되면 두 종의 유전자가 뒤섞인다.인플루엔자의 경우, 이 과정은 바이러스의 256가지 새로운 변형을 발생시킬 수 있으며, 의미 있는 항원 이동 사건은 20년마다 발생하는 경향이 있다.
항원균열: 바이러스 유전자의 재조합.이것은 같은 숙주 세포를 감염시키는 두 개의 바이러스 세포가 다시 있을 때 발생합니다.이 경우 바이러스는 단순히 유전자를 바꾸는 대신 새로운 유전자를 만드는 각 유전자의 조각들과 재결합한다.H5N1의 유전자가 시간이 [17]지남에 따라 어떻게 변화했는지에 대해 조류 인플루엔자 변종에서 재조합이 광범위하게 연구되어 왔다.
항원시프: 바이러스의 주노틱 변종과 함께 직접 전염된다.이것은 스필오버 이벤트 중에 사람이 감염되었을 때 발생합니다.
항원 리프트: 숙주 유래 유전자의 바이러스 전달.어떤 바이러스들은 숙주의 유전자를 훔쳐서 그들의 바이러스 게놈에 통합시키고, 때때로 그들에게 독성을 증가시키는 유전자를 암호화한다.이것의 한 예는 인간 성장 인자와 매우 유사하고 [18]인간 게놈에서 도용되었다고 생각되는 바이러스 성장 인자를 코드한 수두 바이러스 백시니아이다.
항원성 선물: 인간이 실험 환경에서나 바이오 무기를 만들기 위해 의도적으로 바이러스의 게놈을 수정할 때 발생합니다.
인플루엔자바이러스
인플루엔자 바이러스의 항원 특성은 헤마글루티닌과 뉴라미니다아제 둘 다에 의해 결정된다.특정 숙주 단백질 분해 효소는 단일 펩타이드 HA를 두 개의 소단위 HA1과 HA2로 분해한다.분열 부위의 아미노산이 친유성이면 바이러스는 매우 치명적이 된다.환경에서의 선택압력은 적응진화가 진행 중인 장소와 치환이 진행 중인 항원위치를 포함하는 HA의 항원결정인자의 항원변화를 위해 선택되며, 이는 궁극적으로 바이러스의 항원변화를 초래한다.HA의 글리코실화는 항원성이나 [19]선택압과는 관련이 없다.항원변이는 두 가지 유형으로 분류될 수 있다. 즉, 소수의 아미노산 변화에 기인하는 항원 드리프트와 새로운 구조단백질 획득의 결과인 항원 이동이다.인플루엔자 바이러스는 항원 표류 능력을 가지고 있기 때문에 매년 새로운 백신이 필요하다.항원성 변화는 구조 단백질의 유전자가 다른 동물 숙주로부터 획득되어 바이러스 게놈의 급격한 변화를 야기할 때 주기적으로 발생한다.조류 및 인간 인플루엔자 바이러스 세그먼트의 헤마글루티닌과 뉴라미니다아제를 코드하는 세그먼트 간의 재결합은 유라시아 조류 바이러스로부터 3개의 유전자를 획득하여 순환하는 인간 스트라의 5개의 유전자 세그먼트로 재보증을 받은 1957년의 아시아 독감처럼 세계적인 유행병이라는 유행병을 낳았다.또 다른 예는 유라시아 조류 바이러스로부터 6개의 유전자 세그먼트를 순환하는 인간의 변종에서 재치환하여 2개의 유전자를 얻은 1968년 홍콩 독감이다.
인플루엔자 예방 접종
예방접종 후 IgG+항체분비형 플라즈마세포(ASC)가 급격히 증가하여 7일차에 최대치에 도달한 후 14일차에 최소치로 복귀한다.인플루엔자 특이 기억 B세포는 14~21일에 최대치에 도달한다.분비되는 항체는 백신 바이러스에 특유하다.또한 분리된 모노클로널 항체의 대부분은 HA에 대한 결합 친화력을 가지며, 나머지는 NA, 핵단백질(NP) 및 기타 항원에 대한 친화력을 나타낸다.이러한 고친화성 인간 모노클로널 항체는 백신 접종 후 한 달 이내에 생성될 수 있으며, 인간 기원으로 인해 인체에서 항체 관련 부작용은 거의 없을 것이다.그것들은 잠재적으로 인플루엔자 바이러스 전염에 대한 수동 항체 치료법을 개발하기 위해 사용될 수 있다.
항원 진화 매핑
항바이러스 항체의 혈응집 억제 능력을 측정하여 항원 진화를 시각화할 수 있도록 항원 지도법이라고 불리는 과정을 사용하여 2차원 지도를 생성하는데 사용할 수 있다.이 지도들은 아미노산의 변화가 바이러스 입자에 대한 항체의 결합을 어떻게 바꿀 수 있는지 보여줄 수 있고 유전자 및 항원 진화의 패턴을 분석하는데 도움을 줄 수 있다.최근의 연구결과는 H1 emaglutinin Sa 부위의 한 영역에서 항체 구동 항원 변이의 결과로, NA의 보상적 돌연변이가 NA 항원 변이를 초래할 수 있음을 보여준다.그 결과 약물 내성이 NA 억제제로 발전한다.NA 억제제에 대한 저항은 항체 주도형 HA [20]탈출에 기인할 수 있기 때문에 이러한 현상은 자연에서 NA 진화의 진화를 가릴 수 있다.
HIV-1
장기적으로 HIV-1 감염을 통제하기 위한 주요 과제는 면역 탈출이다.특정 HLA 대립 유전자에 의해 에피토프가 표적이 되는 정도와 빈도는 사람마다 다르다.게다가 면역 우성의 결과로서 개인의 CTL 응답은 6개의 HLA 클래스 1 대립 유전자가 발현되어 있어도 특정 HLA 대립 유전자의 소수의 에피토프로 한정된다.급성상에서의 CTL 응답은 제한된 수의 에피토프에 대해 지향되지만, 에피토픽 레퍼토리는 바이러스 유출로 인해 시간이 지남에 따라 증가한다.추가적으로 아미노산 공진화는 다루어져야 할 도전적인 문제이다.예를 들어 특정 부위의 치환에 의해 다른 부위의 2차적 또는 보상적 돌연변이가 발생한다.매우 귀중한 발견은 선택적 압력이 가해졌을 때 HIV-1의 진화 패턴을 예측할 수 있다는 것이다.보호 HLA B*27 대립 유전자를 발현하는 개체에서 Gag 에피토프 KK10에서 발생하는 첫 번째 돌연변이는 L에서 M으로 위치 6에 있으며, 몇 년 후 위치 2가 R에서 K로 변화한다.따라서 탈출 경로의 예측 가능성에 대한 지식은 면역물질을 [21]설계하는 데 이용될 수 있다.1차 수용체인 CD4와 접촉하는 HIV-1 Env의 영역 gp120은 기능적으로 보존되어 모노클로널 항체 b12와 같은 중화 항체에 취약하다.최근의 연구결과에 따르면 b12에 의한 중화 저항은 CD4 접촉 표면에 가까운 영역에 존재하는 치환의 결과였다.이렇게 함으로써 바이러스는 CD4와의 [22]결합에 영향을 주지 않고 b12에 의해 중화되는 것을 회피한다.
플라비바이러스
플라비바이러스과(Flaviviridae)는 웨스트 나일 바이러스, 뎅기 바이러스 등 잘 알려진 바이러스를 포함하는 바이러스 과이다.플라비바이러스속은 표면에 바이러스 중화 항체의 표적 역할을 하는 원형 외피단백질(E-단백질)을 가지고 있다.E단백질은 수용체에 결합하는 역할을 하며 숙주 면역체계를 회피하는 역할을 할 수 있다.그것은 세 가지 주요 항원 도메인, 즉 A, B, C를 가지며, 세 가지 구조 도메인 II, III, I에 해당한다.구조 도메인 III는 추정 수용체 결합 도메인이며 이에 대한 항체는 플라비 바이러스의 감염성을 중화시킨다.항원 차이를 초래하는 돌연변이는 도메인 III에서의 돌연변이의 위치뿐만 아니라 아미노산 치환의 생화학적 특성으로 추적될 수 있다.예를 들어, 다른 아미노산에서의 치환은 항체에 의한 다양한 중화 수준을 초래한다.만약 중요한 아미노산의 돌연변이가 항체에 의한 중성화를 극적으로 바꿀 수 있다면 WNV 백신과 진단 분석은 의존하기 어려워진다.뎅기열, 루핑병 및 황열을 일으키는 다른 플라비바이러스는 E [23][24]단백질의 도메인 III의 돌연변이를 통해 항체 중화로부터 탈출한다.
레퍼런스
- ^ Pays, Etienne; et al. (1983). "Gene conversion as a mechanism for antigenic variation in Trypanosomes". Cell. 34 (2): 371–381. doi:10.1016/0092-8674(83)90371-9. PMID 6616615. S2CID 688880.
- ^ Lysnyansky, I.; Ron, Y.; Yogev, D. (2001). "Juxtaposition of an Active Promoter to vsp Genes via Site-Specific DNA Inversions Generates Antigenic Variation in Mycoplasma bovis". Journal of Bacteriology. 183 (19): 5698–5708. doi:10.1128/JB.183.19.5698-5708.2001. PMC 95462. PMID 11544233.
- ^ Brunham, Robert C.; et al. (1993). "Bacterial Antigenic Variation, Host Immune Response, and Pathogen-Host Coevolution". Infection and Immunity. 61 (6): 2273–2276. doi:10.1128/IAI.61.6.2273-2276.1993. PMC 280844. PMID 8500868.
- ^ Zhang, Jing-Ren; et al. (1997). "Antigenic Variation in Lyme Disease Borreliae by Promiscuous Recombination of VMP-like Sequence Cassettes". Cell. 89 (2): 275–285. doi:10.1016/S0092-8674(00)80206-8. PMID 9108482.
- ^ Avery, S. V. (2006). "Microbial cell individuality and the underlying sources of heterogeneity". Nat Rev Microbiol. 4 (8): 577–87. doi:10.1038/nrmicro1460. PMID 16845428. S2CID 27337497.
- ^ van der Woude, Marjan W.; et al. (2004). "Phase and Antigenic Variation in Bacteria". American Society for Microbiology. 17 (3): 581–611. doi:10.1128/CMR.17.3.581-611.2004. PMC 452554. PMID 15258095.
- ^ Wisniewski-Dyé F; Vial L (2008). "Phase and antigenic variation mediated by genome modifications". Antonie van Leeuwenhoek. 94 (4): 493–515. doi:10.1007/s10482-008-9267-6. PMID 18663597. S2CID 25378695.
- ^ a b Stockdale C; Swiderski MR; Barry JD; McCulloch R (2008). "Antigenic variation in Trypanosoma brucei: joining the DOTs". PLOS Biol. 6 (7): e185. doi:10.1371/journal.pbio.0060185. PMC 2486309. PMID 18666832.
- ^ a b Hartley CL; McCulloch R (2008). "Trypanosoma brucei BRCA2 acts in antigenic variation and has undergone a recent expansion in BRC repeat number that is important during homologous recombination". Mol Microbiol. 68 (5): 1237–51. doi:10.1111/j.1365-2958.2008.06230.x. PMC 2408642. PMID 18430140.
- ^ Lythgoe KA, Morrison LJ, Read AF, Barry JD (2007). "Parasite-intrinsic factors can explain ordered progression of trypanosome antigenic variation". Proceedings of the National Academy of Sciences. 104 (19): 8095–100. doi:10.1073/pnas.0606206104. PMC 1876577. PMID 17463092.
- ^ Mideo, Nicole; Acosta-Serrano, Alvaro; Aebischer, Toni; Brown, Mark J.F.; Fenton, Andy; Friman, Ville-Petri; Restif, Olivier; Reece, Sarah E.; Webster, Joanne P.; Brown, Sam P. (2013). "Life in cells, hosts, and vectors: Parasite evolution across scales". Infection, Genetics and Evolution. Elsevier. 13: 344–347. doi:10.1016/j.meegid.2012.03.016. ISSN 1567-1348. PMID 22465537. S2CID 206881591.
- ^ Kyes SA, Kraemer SM, Smith JD (2007). "Antigenic variation in Plasmodium falciparum: gene organization and regulation of the var multigene family". Eukaryot Cell. 6 (9): 1511–20. doi:10.1128/EC.00173-07. PMC 2043368. PMID 17644655.
- ^ Scherf A, Hernandez-Rivas R, Buffet P, Bottius E, Benatar C, Pouvelle B, Gysin J, Lanzer M (1998). "Antigenic variation in malaria: in situ switching, relaxed and mutually exclusive transcription of var genes during intra-erythrocytic development in Plasmodium falciparum". EMBO J. 17 (18): 5418–26. doi:10.1093/emboj/17.18.5418. PMC 1170867. PMID 9736619.
- ^ Kyes S, Christodoulou Z, Pinches R, Kriek N, Horrocks P, Newbold C (2007). "Plasmodium falciparum var gene expression is developmentally controlled at the level of RNA polymerase II-mediated transcription initiation". Mol Microbiol. 63 (4): 1237–47. doi:10.1111/j.1365-2958.2007.05587.x. PMID 17257309.
- ^ Ralph SA, Scheidig-Benatar C, Scherf A (2005). "Antigenic variation in Plasmodium falciparum is associated with movement of var loci between subnuclear locations". Proc Natl Acad Sci U S A. 102 (15): 5414–9. doi:10.1073/pnas.0408883102. PMC 556247. PMID 15797990.
- ^ a b Dufy, Siobain (March 4, 2008). "Rates of evolutionary change in viruses: patterns and determinants". Nature. 9 (4): 267–276. doi:10.1038/nrg2323. PMID 18319742. S2CID 10305325.
- ^ Bean, William (3 December 1979). "Recombination of human influenza A viruses in nature". Nature. 284 (5757): 638–40. doi:10.1038/284638a0. PMID 7366737. S2CID 4368679.
- ^ Lyttle, D J (Jan 1994). "Homologs of vascular endothelial growth factor are encoded by the poxvirus orf virus". Journal of Virology. 68 (1): 84–92. doi:10.1128/JVI.68.1.84-92.1994. PMC 236267. PMID 8254780.
- ^ Chen, Jiezhong; Deng, Yi-Mo (2009). "Influenza virus antigenic variation, host antibody production and new approach to control epidemics". Virology Journal. 6: 30. doi:10.1186/1743-422X-6-30. PMC 2666653. PMID 19284639.
- ^ Hensley, Scott E.; Das, Suman R.; Gibbs, James S.; Bailey, Adam L.; Schmidt, Loren M.; Bennink, Jack R.; Yewdell, Jonathan W. (2011). De La Torre, Juan C. (ed.). "Influenza A Virus Hemagglutinin Antibody Escape Promotes Neuraminidase Antigenic Variation and Drug Resistance". PLOS ONE. 6 (2): e15190. doi:10.1371/journal.pone.0015190. PMC 3043005. PMID 21364978.
- ^ Carlson, JM; Brumme, ZL (2008). "HIV evolution in response to HLA-restricted CTL selection pressures: a population-based perspective". Microbes and Infection / Institut Pasteur. 10 (5): 455–61. doi:10.1016/j.micinf.2008.01.013. PMID 18407775.
- ^ Li, H; Xu, CF; Blais, S; Wan, Q; Zhang, HT; Landry, SJ; Hioe, CE (2009). "Proximal glycans outside of the epitopes regulate the presentation of HIV-1 envelope gp120 helper epitopes". Journal of Immunology. 182 (10): 6369–78. doi:10.4049/jimmunol.0804287. PMC 2808118. PMID 19414790.
- ^ Diamond, MS (2003). "Evasion of innate and adaptive immunity by flaviviruses". Immunology and Cell Biology. 81 (3): 196–206. doi:10.1046/j.1440-1711.2003.01157.x. PMID 12752684. S2CID 37056432.
- ^ Li, Li; Barrett, Alan D.T.; Beasley, David W.C. (2005). "Differential expression of domain III neutralizing epitopes on the envelope proteins of West Nile virus strains". Virology. 335 (1): 99–105. doi:10.1016/j.virol.2005.02.011. PMID 15823609.