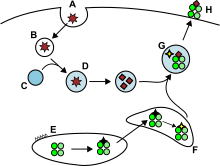
항원 제시
Antigen presentation항원제시는 T세포 면역반응 트리거링에 필수적인 중요한 면역과정이다.T세포는 세포 표면에 표시된 단편화된 항원만을 인식하기 때문에, 현재 주요 조직적합성 복합체(MHC)에 결합되어 있는 항원 조각이 T세포 수용체에 의해 인식될 수 있는 것으로 알려진 과정인 세포 표면으로 전송되기 전에 항원 처리가 일어나야 한다.만약 바이러스나 박테리아에 감염된 적이 있다면, 세포는 MHC 분자에 의해 항원으로부터 유래된 내인성 또는 외인성 펩타이드 단편을 제시할 것이다.항원의 작용이 다른 MHC 분자에는 두 가지 유형이 있다. 즉, MHC 클래스 I 분자(MHC-I)는 세포 세포에서 펩타이드를 결합하는 반면, 내부화 후 세포 내 소포에서 생성된 펩타이드는 MHC 클래스 II(MHC-II)[1]와 결합한다.세포막은 세포내 환경과 세포외 환경 두 가지를 분리한다.각 T 세포는 동일한 세포에 제시된 수천 개의 다른 펩타이드 중에서 단 하나의 펩타이드 배열의 고유한 수십 개에서 수백 개의 복사본만 인식할 수 있다. 왜냐하면 한 세포의 MHC 분자는 꽤 넓은 범위의 [2][3]펩타이드와 결합할 수 있기 때문이다.어떤 항원이 특정 MHC/HLA 유형에 의해 면역계에 나타날지 예측하는 것은 어렵지만 관련된 기술은 [4]발전하고 있다.
세포내 항원의 제시: 클래스 I
세포독성 T세포(T, 킬러 T세포 또는 세포독성 T림프구(CTL)라고도c 함)는 CD8 공동수용체를 발현하며 다른 세포의 프로그래밍된 세포사를 유도하는 데 특화된 T세포 집단이다.세포독성 T세포는 생체 항상성을 유지하기 위해 정기적으로 모든 신체 세포를 순회한다.예를 들어 바이러스나 세포내 박테리아 또는 변형된 종양세포의 존재로 인해 발생하는 질병의 징후를 만날 때마다, 그들은 잠재적으로 [1]해로운 세포를 파괴하는 과정을 시작합니다.혈소판과 함께 체내의 모든 핵세포는 클래스 I 주요 조직적합성 복합체(MHC-I 분자)를 나타낸다.이들 세포에서 내생적으로 생성된 항원은 MHC-I 분자에 결합되어 세포 표면에 나타난다.이 항원 제시 경로는 면역 시스템이 변형된 자기(변이된) 또는 [5][6]외래 단백질로부터 펩타이드를 나타내는 변형 또는 감염된 세포를 검출할 수 있게 한다.
제시 과정에서 이들 단백질은 주로 프로테아솜 내의 세포소성 단백질 분해효소(cytosol protease)에 의해 작은 펩타이드로 분해되지만 다른 세포질 단백질 분해 경로도 존재한다.다음으로 펩타이드는 열충격단백질 및 ATP의존성 수송기구의 ER 내강에 세포성 펩타이드를 전위시키는 항원처리(TAP)와 관련된 트랜스포터의 작용을 통해 소포체(ER)로 분배된다.MHC-I 조립에는 칼넥신, 칼레티쿨린, Erp57, 단백질 이황화물 이성질화효소(PDI),[7] 타파신 등 여러 ER 샤페론이 관여한다.구체적으로는 TAP, Tapasin, MHS Class 1, ERP57 및 칼레티쿨린의 복합체를 PLC([8]펩타이드 부하 복합체)라고 한다.펩타이드는 MHC 클래스 I 분자의 α1 및 α2 도메인 하단에 있는 2개의 알파 헬리클 사이의 MHC-I 펩타이드 결합홈에 부하된다.타파신에서 방출된 후 펩타이드-MHC-I 착체(pMHC-I)는 ER에서 나와 세포외 소포를 [9][10]통해 세포표면으로 운반된다.
Nave 항바이러스 T세포(CD8+)는 변환되거나 감염된 세포를 직접 제거할 수 없다.항원 제시 세포(APC)의 pMHC-I 복합체에 의해 활성화되어야 한다.여기서 항원은 바이러스 감염 [11]세포와 비감염 세포에서 직접(상기와 같이) 또는 간접(교차 제시)될 수 있다.pMHC-I와 TCR의 상호작용 후 공동자극신호 및/또는 사이토카인의 존재 하에서 T세포를 활성화하고 말초조직으로 이동하여 세포독성을 [citation needed]유도하여 표적세포(감염 또는 손상세포)를 죽인다.
교차 표시는 MHC-I 분자가 세포외 항원을 나타낼 수 있는 특별한 경우이며, 보통 MHC-II 분자에 의해서만 나타난다.이 능력은 주로 CD8+ T 세포를 직접 자극하는 조직의 플라스마사이토이드 수지상 세포인 여러 APC에서 나타난다.이 과정은 APC가 직접 감염되지 않은 경우 필수적이며, 국소 림프절에서 [6]APC를 밀매하지 않고 국소 항바이러스 및 항종양 면역 반응을 즉시 유발합니다.
세포외 항원의 제시: Class II
세포외 공간으로부터의 항원 및 때로는 내생적인 [12]항원은 내구성 소포에 봉입되어 MHC-II 분자에 의해 세포표면에 CD4 분자를 발현하는 도우미 T세포에 제시된다.수지상 세포, B 세포 또는 대식세포와 같은 APC만이 상당한 양의 MHC-II 분자를 표면에 발현시키기 때문에 MHC-I [citation needed]분자의 발현은 MHC-I보다 세포 특이적이다.
APC는 보통 내구증뿐만 아니라 피노사이트증, 매크로오토파지증, 내염색체 미세오토파지증 또는 샤페론 매개 오토파지에 의해 외인성 항원을 내면화한다.[12]첫 번째 경우, 내부화 후, 항원은 엔도솜이라고 불리는 소포에 싸여 있다.이 항원 제시 경로에는 초기 엔도솜, 후기 엔도솜 또는 엔도리솜 및 리소솜의 세 가지 구획이 관여하며, 여기서 항원은 리소좀 관련 효소(산 의존성 가수분해효소, 글리코시다아제, 단백질분해효소, 리파아제)에 의해 가수분해된다.이 과정은 pH의 점진적인 감소에 의해 선호된다.엔도솜의 주요 단백질 분해효소는 카테신이며 그 결과 항원이 올리고펩티드로 [citation needed]분해된다.
MHC-II 분자는 단백질 불변사슬(Ii, CD74)과 함께 ER에서 MHC 클래스 II 로딩 컴파트먼트로 운반된다.비고전적 MHC-II 분자(HLA-DO 및 HLA-DM)는 CD74(CLIP 펩타이드)의 일부와 펩타이드 항원의 교환을 촉매한다.펩타이드-MHC-II 복합체(pMHC-II)가 혈장막으로 운반되어 처리된 항원이 림프절의 [9]도우미 T세포에 제시된다.
APC는 화학적인 신호를 통해 림프조직으로 이동하는 동안 성숙 과정을 거치며, 식세포 능력을 상실하고 항원 [13]제시를 통해 T세포와 소통하는 능력을 높인다.CD8+ 세포독성 T세포와 마찬가지로 APC는 순진한 T도우미 세포를 완전히 활성화하기 위해 pMHC-II와 추가 비용 자극 신호가 필요합니다.
MHC-II 분자에 대한 내인성 항원 처리 및 제시의 대체 경로는 자가파지 과정을 통해 수질 흉선상피세포(mTEC)에 존재한다.특히 자기반응성 클론의 음성선택에 대한 T세포의 중심 내성이 중요한 과정이다.AIRE의 작용과 MHC-I 및 MHC-II 분자에 나타나는 발현 분자의 자기소화를 통해 게놈 전체의 무작위 유전자 발현을 달성한다.
B세포에 대한 토종 온전한 항원 제시
B세포 표면에 있는 B세포 수용체는 작은 조각으로 소화되어 MHC 분자에 의해 나타나는 펩타이드의 선형 배열보다는 구조적인 성질의 손상되지 않은 천연 및 소화되지 않은 항원에 결합한다.온전한 항원의 큰 복합체는 면역 복합체의 형태로 모낭 수지상 세포에 의해 B 세포에 대한 림프절에서 나타난다.상대적으로 낮은 수준의 리소좀 효소를 발현하는 일부 APC는 따라서 B [14][15]세포에 제시하기 전에 포착한 항원을 소화시킬 가능성이 낮다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b Janeway Jr CA, Travers P, Walport M, Shlomchik MJ (2001-01-01). "Chapter 5 Antigen Presentation to T Lymphocytes". Immunobiology: The Immune System in Health and Disease. 5th edition.
- ^ Purcell AW, Croft NP, Tscharke DC (June 2016). "Immunology by numbers: quantitation of antigen presentation completes the quantitative milieu of systems immunology!". Current Opinion in Immunology. 40: 88–95. doi:10.1016/j.coi.2016.03.007. PMID 27060633.
- ^ Janeway Jr CA, Travers P, Walport M, Shlomchik MJ (2001-01-01). "The major histocompatibility complex and its functions". Immunobiology: The Immune System in Health and Disease (5th ed.).
- ^ Bouzid R, de Beijer MT, Luijten RJ, Bezstarosti K, Kessler AL, Bruno MJ, Peppelenbosch MP, Demmers JA, Buschow SI (May 2021). "Empirical Evaluation of the Use of Computational HLA Binding as an Early Filter to the Mass Spectrometry-Based Epitope Discovery Workflow". Cancers. 13 (10): 2307. doi:10.3390/cancers13102307. PMC 8150281. PMID 34065814.
- ^ Hewitt EW (October 2003). "The MHC class I antigen presentation pathway: strategies for viral immune evasion". Immunology. 110 (2): 163–9. doi:10.1046/j.1365-2567.2003.01738.x. PMC 1783040. PMID 14511229.
- ^ a b Joffre OP, Segura E, Savina A, Amigorena S (July 2012). "Cross-presentation by dendritic cells". Nature Reviews. Immunology. 12 (8): 557–69. doi:10.1038/nri3254. PMID 22790179. S2CID 460907.
- ^ "Antigen Processing and Presentation British Society for Immunology". www.immunology.org. Retrieved 2021-11-27.
- ^ Thomas, Christoph; Tampé, Robert (2017). "Proofreading of Peptide—MHC Complexes through Dynamic Multivalent Interactions". Frontiers in Immunology. 8: 65. doi:10.3389/fimmu.2017.00065. ISSN 1664-3224. PMC 5296336. PMID 28228754.
- ^ a b Sinha JK, Bhattacharya S. A Text Book of Immunology. Academic Publishers. ISBN 9788189781095.
- ^ Nesmiyanov, Pavel P. (2020), "Antigen Presentation and Major Histocompatibility Complex", Reference Module in Biomedical Sciences, Elsevier, pp. B978012818731900029X, doi:10.1016/b978-0-12-818731-9.00029-x, ISBN 978-0-12-801238-3, S2CID 234948691, retrieved 2021-12-02
- ^ Sei JJ, Haskett S, Kaminsky LW, Lin E, Truckenmiller ME, Bellone CJ, et al. (June 2015). "Peptide-MHC-I from Endogenous Antigen Outnumber Those from Exogenous Antigen, Irrespective of APC Phenotype or Activation". PLOS Pathogens. 11 (6): e1004941. doi:10.1371/journal.ppat.1004941. PMC 4479883. PMID 26107264.
- ^ a b Stern LJ, Santambrogio L (June 2016). "The melting pot of the MHC II peptidome". Current Opinion in Immunology. 40: 70–7. doi:10.1016/j.coi.2016.03.004. PMC 4884503. PMID 27018930.
- ^ Flores-Romo L (March 2001). "In vivo maturation and migration of dendritic cells". Immunology. 102 (3): 255–62. doi:10.1046/j.1365-2567.2001.01204.x. PMC 1783189. PMID 11298823.
- ^ Batista FD, Harwood NE (January 2009). "The who, how and where of antigen presentation to B cells". Nature Reviews. Immunology. 9 (1): 15–27. doi:10.1038/nri2454. PMID 19079135. S2CID 2413048.
- ^ Harwood NE, Batista FD (December 2010). "Antigen presentation to B cells". F1000 Biology Reports. 2: 87. doi:10.3410/B2-87. PMC 3026618. PMID 21283653.
외부 링크
- ImmPort - 항원 처리 및 제시와 관련된 유전자에 대한 유전자 요약, 온톨로지, 경로, 단백질/단백질 상호작용 등
- 미국 국립 의학 도서관 의학 주제 제목(MeSH)에서의 항원+프레젠테이션